動(dòng)物園禽源奇異變形桿菌對(duì)第三代頭孢菌素的耐藥分子機(jī)制


摘 要 為研究觀賞禽類中分離的奇異變形桿菌(Proteus mirabilis)對(duì)第三代頭孢菌素的耐藥機(jī)制,于2019年從河南省某動(dòng)物園禽類養(yǎng)殖區(qū)綠孔雀(Pavo muticus)、紅綠金剛鸚鵡(Ara chloroptera)、火雞(Meleagris gallopavo)、帽子雞(polish chicken)和非洲鴕鳥(niǎo)(Struthio camelus)5 種觀賞禽類中分離17 株奇異變形桿菌,經(jīng)藥物敏感性試驗(yàn)、blaCTX-M基因檢測(cè)、全基因組測(cè)序、PFGE和RT-qPCR等探明受試菌對(duì)第三代頭孢菌素的耐藥機(jī)制。結(jié)果發(fā)現(xiàn):共有6株受試菌對(duì)第三代頭孢菌素耐藥,除1株(6D)攜帶超廣譜β-內(nèi)酰胺酶blaCTX-M-14和1株(106A)攜帶AmpC酶blaACT-16外,其余4株經(jīng)PFGE檢測(cè)證實(shí)為同一克隆型,且細(xì)菌體內(nèi)雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)CpxAR、BaeSR和EnvZ/OmpR的表達(dá)量顯著高于敏感菌,主要通過(guò)抑制耐藥菌細(xì)胞膜上OmpC和OmpF的表達(dá)減少藥物吸收,同時(shí)促進(jìn)OmpW表達(dá)加速藥物外排,從而減少菌體內(nèi)藥物濃度,進(jìn)而導(dǎo)致其對(duì)第三代頭孢菌素類耐藥。研究表明,動(dòng)物園禽類養(yǎng)殖區(qū)的奇異變形桿菌對(duì)第三代頭孢菌素的耐藥機(jī)制復(fù)雜多樣,散播機(jī)制主要為染色體介導(dǎo)的克隆傳播,應(yīng)引起重視。
關(guān)鍵詞:禽源奇異變形桿菌;頭孢菌素類;耐藥基因;膜孔蛋白;雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)
中圖分類號(hào):S852. 61
文獻(xiàn)標(biāo)志碼:A
文章編號(hào):2310 - 1490(2024)- 04 - 0811 - 08
DOI:10.12375/ysdwxb.20240414
變形桿菌屬(Proteus)細(xì)菌在自然界中廣泛存在,在人體內(nèi)生存和繁殖的能力較強(qiáng),臨床上可引起腹瀉、膿毒癥、呼吸系統(tǒng)問(wèn)題和尿路感染等疾病;奇異變形桿菌(P. mirabilis,PM)是公認(rèn)的導(dǎo)致人類和動(dòng)物感染的主要病原體之一[1]。近年來(lái),人源和動(dòng)物源奇異變形桿菌的臨床分離率日趨增多,且臨床分離菌株多呈現(xiàn)明顯耐藥[2]。β-內(nèi)酰胺類為人醫(yī)和獸醫(yī)臨床常用抗生素,但是,隨著近年來(lái)第三代頭孢菌素類藥物在臨床中的廣泛應(yīng)用,耐藥菌也逐漸增多,尤其是質(zhì)粒介導(dǎo)的超廣譜β-內(nèi)酰胺酶(extendedspectrum β-lactamases,ESBLs)和AmpC酶的出現(xiàn)[3],給臨床有效防控耐藥菌感染造成極大困難。細(xì)菌中的雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)(two-component signal trans?duction system,TCS)可調(diào)控多種基因(如細(xì)菌細(xì)胞膜上的膜孔蛋白或外排泵相關(guān)基因)的表達(dá),從而參與細(xì)菌耐藥性的形成[4]。
隨著“One Health”理念的推廣及普及,耐藥菌在人與動(dòng)物間的水平傳播越來(lái)越受到人們的關(guān)注和重視。動(dòng)物園是人與動(dòng)物密切接觸和互動(dòng)的一個(gè)重要場(chǎng)所。游客與動(dòng)物互動(dòng)(如接觸或喂食)在教育和娛樂(lè)方面有一定價(jià)值,同時(shí)也可能增加病原菌或耐藥菌的散播,但是,截至目前相關(guān)研究較少。課題組曾在某動(dòng)物園禽類散養(yǎng)場(chǎng)分離獲得1株染色體介導(dǎo)的替加環(huán)素耐藥不動(dòng)桿菌(Acinetobacter indicus),其可通過(guò)同源重組的方式進(jìn)行水平散播[5]。本研究從河南省某動(dòng)物園禽類養(yǎng)殖區(qū)分離獲得17株禽源奇異變形桿菌,經(jīng)藥物敏感性試驗(yàn)、耐藥基因檢測(cè)、全基因組測(cè)序、PFGE和RT-qPCR,研究受試菌對(duì)第三代頭孢菌素的耐藥機(jī)制和散播機(jī)制,為臨床控制第三代頭孢菌素耐藥菌的傳播提供參考依據(jù),并為評(píng)估動(dòng)物園禽類散養(yǎng)場(chǎng)中人獸共患耐藥菌在人與動(dòng)物間的水平傳播風(fēng)險(xiǎn)提供理論支撐。
1 材料與方法
1. 1 菌株來(lái)源
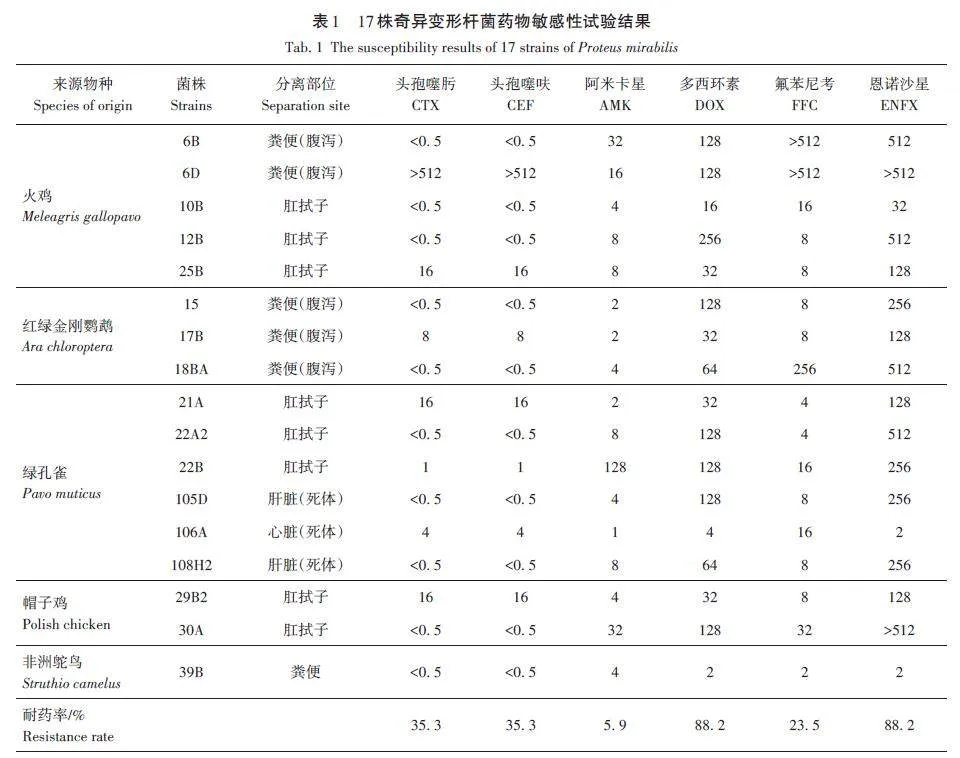
2019年7月,在河南省某動(dòng)物園禽類養(yǎng)殖區(qū),采集綠孔雀(Pavo muticus)、紅綠金剛鸚鵡(Ara chlorop?tera)、火雞(Meleagris gallopavo)、帽子雞(polishchicken)和非洲鴕鳥(niǎo)(Struthio camelus)5種觀賞禽類糞便或肛拭子樣品,對(duì)于死體采集其肝臟或心臟組織樣本,一只動(dòng)物僅收集保存1份有效樣品。細(xì)菌經(jīng)常規(guī)分離、純化及全自動(dòng)細(xì)菌鑒定儀鑒定,共獲得17株禽源奇異變形桿菌,詳細(xì)分離動(dòng)物及菌株命名見(jiàn)表1。
1. 2 主要藥品
除頭孢噻肟和頭孢噻呋購(gòu)自上海源葉生物科技有限公司外,其他藥物,包括阿米卡星、多西環(huán)素、氟苯尼考和恩諾沙星,均購(gòu)自河南牧翔動(dòng)物藥業(yè)有限公司。藥品使用時(shí)均在有效期內(nèi)。
1. 3 藥物敏感性試驗(yàn)
采用微量肉湯稀釋法檢測(cè)頭孢噻肟、頭孢噻呋、阿米卡星、多西環(huán)素、氟苯尼考和恩諾沙星對(duì)17株禽源奇異變形桿菌的最小抑菌濃度(minimum inhibi?tory concentration,MIC),藥敏結(jié)果按照美國(guó)臨床試驗(yàn)室標(biāo)準(zhǔn)化協(xié)會(huì)(CLSI)判讀[6]。試驗(yàn)重復(fù)3 次,以Escherichia coli ATCC? 25922為質(zhì)控菌。
1. 4 blaCTX-M基因的檢測(cè)
根據(jù)藥敏結(jié)果,對(duì)頭孢噻肟耐藥卻不攜帶耐藥基因的臨床菌株用煮沸法提取DNA,由北京擎科生物科技有限公司合成blaCTX-MU、blaCTX-M-1 和blaCTX-M-9 的引物序列[7],PCR 檢測(cè)blaCTX-M 相關(guān)基因。PCR 產(chǎn)物送至北京擎科生物技術(shù)有限公司測(cè)序,結(jié)果經(jīng)NCBI數(shù)據(jù)庫(kù)序列比對(duì)后確定基因亞型。
1. 5 PFGE 檢測(cè)
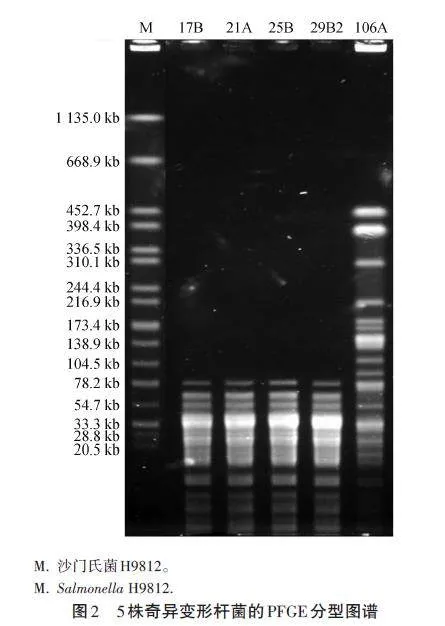
根據(jù)前期試驗(yàn)結(jié)果,參照PFGE 標(biāo)準(zhǔn)程序說(shuō)明書(shū)對(duì)耐頭孢噻肟但不攜帶blaCTX-M基因的奇異變形桿菌進(jìn)行PFGE分型。用DNA限制性內(nèi)切酶XbaⅠ對(duì)受試菌進(jìn)行酶切,沙門(mén)氏菌H9812作為參考菌株。
1. 6 全基因組測(cè)序
根據(jù)PFGE 分型結(jié)果,利用天根(TIANGEN)細(xì)菌全基因組提取試劑盒提取代表性受試菌的總基因組DNA(gDNA)。通過(guò)Illumina 高通量測(cè)序儀進(jìn)行測(cè)序,將獲得的序列數(shù)據(jù)經(jīng)SOAP、SPAdes和ABySS進(jìn)行序列拼接、組裝和比對(duì)。使用CISA軟件整合拼接結(jié)果,并對(duì)整合后的結(jié)果進(jìn)行最終的優(yōu)化處理,確保基因組序列的質(zhì)量和準(zhǔn)確性。使用ResFinder 4. 1在線分析工具(https://www. genomicepidemiology.org/services/)對(duì)得到的基因組序列進(jìn)行耐藥基因的查找。
1. 7 RT-qPCR 檢測(cè)
為進(jìn)一步確認(rèn)耐頭孢噻肟卻不攜帶耐藥基因的奇異變形桿菌耐藥機(jī)制,以敏感菌株作為對(duì)照菌,RT-qPCR檢測(cè)耐藥菌株的膜孔蛋白及相關(guān)調(diào)控蛋白的相對(duì)表達(dá)量。使用異硫氰酸胍-酚法抽提待測(cè)菌株的總RNA,測(cè)定其濃度及純度后,按照HiScript?Ⅲ RT SuperMix for qPCR(+gDNA wiper)反轉(zhuǎn)錄試劑盒(諾唯贊,中國(guó))的說(shuō)明進(jìn)行反轉(zhuǎn)錄合成cDNA。以cDNA為模板,16S rRNA為內(nèi)參基因,通過(guò)RT-qPCR對(duì)樣品中待測(cè)基因的mRNA相對(duì)表達(dá)水平進(jìn)行定量檢測(cè),反應(yīng)條件為:95 ℃,30 s;(95 ℃,10 s;60 ℃,30 s)40個(gè)循環(huán);95 ℃,15 s;60 ℃,60 s;95 ℃,15 s。結(jié)果采用2?ΔΔCt法計(jì)算,每個(gè)樣品重復(fù)3次。
1. 8 數(shù)據(jù)分析
利用GraphPad Prisim 8. 0軟件對(duì)試驗(yàn)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)和顯著性分析,組內(nèi)采用t 檢驗(yàn),*為P lt; 0. 05為有統(tǒng)計(jì)學(xué)差異;**為P lt; 0. 01為差異顯著;***和****分別為P lt; 0. 001和P lt; 0. 000 1,均為差異極顯著。
2 結(jié)果與分析
2. 1 藥敏試驗(yàn)結(jié)果
17株奇異變形桿菌對(duì)5種受試抗菌藥的敏感性結(jié)果見(jiàn)表1。由表1可知,受試菌對(duì)多西環(huán)素和恩諾沙星的耐藥率高達(dá)88. 2%(15/17),僅有2株菌(39B和106A)對(duì)其敏感;對(duì)頭孢噻肟和頭孢噻呋的耐藥率為35. 3%(6/17)、對(duì)氟苯尼考的耐藥率為23. 5%(4/17);對(duì)阿米卡星耐藥率較低,僅1株(22B)呈現(xiàn)耐藥。有9株菌為多重耐藥菌株,占52. 9%,其中菌株6D除對(duì)阿米卡星敏感外,對(duì)頭孢噻肟、頭孢噻呋、多西環(huán)素、氟苯尼考和恩諾沙星均高度耐藥。同時(shí),發(fā)現(xiàn)9株多重耐藥菌均分離自健康禽類,說(shuō)明游客在動(dòng)物園與健康動(dòng)物間的互動(dòng)也存在耐藥菌的水平散播風(fēng)險(xiǎn)。
2. 2 blaCTX-M基因檢測(cè)結(jié)果
用PCR檢測(cè)6株對(duì)第三代頭孢菌素耐藥的禽源奇異變形桿菌是否攜帶blaCTX-M基因(圖1),經(jīng)測(cè)序和序列比對(duì)發(fā)現(xiàn),6 株耐藥菌株中僅有1 株(6D)為blaCTX-M陽(yáng)性,其亞型為blaCTX-M-14,說(shuō)明該動(dòng)物園禽類散養(yǎng)場(chǎng)中禽源奇異變形桿菌對(duì)第三代頭孢菌素耐藥的原因復(fù)雜多樣,需進(jìn)一步研究。
2. 3 PFGE 結(jié)果
根據(jù)前期試驗(yàn)結(jié)果,對(duì)5株耐第三代頭孢菌素但不攜帶blaCTX-M 基因的禽源奇異變形桿菌進(jìn)行PFGE 分型。如圖2 所示,菌株17B、21A、25B 和29B2具有完全相同的譜型,表明為同一克隆型,且這4株菌分別來(lái)自不同禽類樣本,說(shuō)明該動(dòng)物園禽類散養(yǎng)場(chǎng)內(nèi)對(duì)第三代頭孢菌素耐藥的禽源奇異變形桿菌存在明顯的克隆散播。
2. 4 全基因組測(cè)序結(jié)果
為進(jìn)一步研究不攜帶blaCTX-M但對(duì)第三代頭孢菌素耐藥的禽源奇異變形桿菌的耐藥機(jī)制,選取17B和106A進(jìn)行全基因組測(cè)序,將獲得的序列數(shù)據(jù)經(jīng)拼接、組裝和比對(duì)后發(fā)現(xiàn)耐藥菌106A除攜帶β-內(nèi)酰胺類耐藥基因blaACT-16外,還同時(shí)攜帶多個(gè)耐藥基因,包括sul1、dfrA14、dfrA27、aph(3')-Ia、aph(6)-Id、aph(3″)-Ib、aac(3)-IId、aadA16、mph(A)、qnrB6、qnrB91、aac(6')-Ib-cr、tet(J)、tet(A)、cat 和floR,其中,blaACT-16屬于AmpC酶。AmpC酶能水解除第四代頭孢菌素和碳青霉烯類之外的多數(shù)β-內(nèi)酰胺類藥物的β-內(nèi)酰胺環(huán)而導(dǎo)致菌株耐藥[8],說(shuō)明菌株106A對(duì)第三代頭孢菌素耐藥的原因是其產(chǎn)生了AmpC型blaACT-16 酶。耐藥菌株17B雖然對(duì)頭孢噻肟耐藥,但未檢測(cè)到對(duì)第三代頭孢菌素耐藥的相關(guān)已知基因,暗示其可能通過(guò)其他機(jī)制,如外排泵、膜通透性改變等對(duì)第三代頭孢菌素耐藥,其耐藥機(jī)制仍需進(jìn)一步研究。
2. 5 RT-qPCR 結(jié)果
2. 5. 1 膜孔蛋白相關(guān)基因的mRNA相對(duì)表達(dá)量
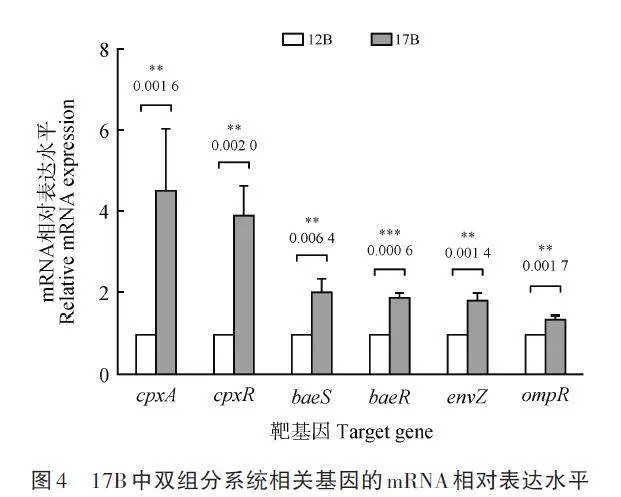
任選1株對(duì)頭孢噻肟敏感的禽源奇異變形桿菌12B 作為對(duì)照株,采用RT-qPCR 檢測(cè)耐藥菌株17B的染色體編碼膜孔蛋白相關(guān)基因的表達(dá)量,引物見(jiàn)表2,通過(guò)2-ΔΔCt法計(jì)算其膜孔蛋白基因ompA、ompC、ompF 和ompW 的相對(duì)表達(dá)水平。結(jié)果顯示,菌株17B 的ompC 和ompF 的相對(duì)表達(dá)量極顯著降低,其中ompC 的相對(duì)表達(dá)量較對(duì)照菌12B 下降了約93. 4%;而ompA 和ompW 的相對(duì)表達(dá)量極顯著升高(圖3)。
2. 5. 2 雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)相關(guān)基因的mRNA相對(duì)表達(dá)量
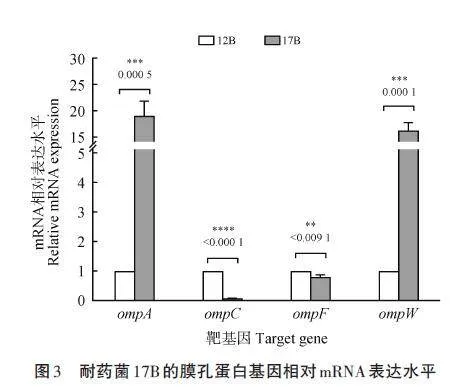
為探究引起外膜蛋白表達(dá)量變化的原因,以敏感菌株12B為對(duì)照菌,采用RT-qPCR檢測(cè)耐藥菌株17B 的相關(guān)雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)相關(guān)基因(cpxA、cpxR、baeS、baeR、envZ 和ompR)的相對(duì)表達(dá)水平。圖4結(jié)果顯示,與對(duì)照菌12B相比,耐藥菌17B的cpxA和cpxR 的相對(duì)表達(dá)量分別增加5倍和4倍,而baeS、baeR 和envZ、ompR 的相對(duì)表達(dá)量均增加2倍左右。有文獻(xiàn)[9]證明,CpxAR雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)對(duì)ompF和ompC 的表達(dá)具有負(fù)向調(diào)節(jié)作用,BaeSR雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)對(duì)ompW 為正調(diào)控、對(duì)ompC 和ompF 均為負(fù)調(diào)控,而EnvZ/OmpR雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)對(duì)ompC正調(diào)控作用。本試驗(yàn)結(jié)果表明,耐藥菌17B的雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)CpxAR、BaeSR 和EnvZ/OmpR 的表達(dá)量顯著高于敏感對(duì)照菌,其抑制OmpC和OmpF表達(dá)而減少藥物吸收,促進(jìn)OmpW表達(dá)而加速藥物外排,減少耐藥菌體內(nèi)的藥物濃度,進(jìn)而對(duì)第三代頭孢菌素類藥物產(chǎn)生耐藥。
3 討論
目前國(guó)內(nèi)的一些動(dòng)物園為吸引游客,會(huì)增設(shè)觸摸或者喂食等游客與動(dòng)物互動(dòng)的活動(dòng)。雖然這些活動(dòng)在教育和娛樂(lè)方面具有一定的價(jià)值,但這些行為也增加了人獸共患病病原體的傳播風(fēng)險(xiǎn),具有嚴(yán)重的公共衛(wèi)生安全隱患[10?11]。本研究結(jié)果表明,河南省某動(dòng)物園禽源奇異變形桿菌對(duì)頭孢噻肟和頭孢噻呋的耐藥率均為35. 3%(6/17),其中2株分離自腹瀉禽類糞便樣品,1株分離自死亡禽類的新鮮組織樣品,其余均來(lái)自于健康禽類肛門(mén)拭子。由此可見(jiàn),除患病禽類外,健康禽類機(jī)體也會(huì)攜帶耐藥菌,這給臨床治療帶來(lái)了困難,需要引起重視。因此,動(dòng)物園應(yīng)加強(qiáng)動(dòng)物的管理和監(jiān)測(cè),以保障人類和動(dòng)物健康。其次,游客也應(yīng)提高自我防護(hù)意識(shí),在動(dòng)物園與動(dòng)物直接或間接接觸后需做好消毒措施,以減少病原微生物的感染概率。此外,政府和相關(guān)部門(mén)也應(yīng)該加強(qiáng)對(duì)動(dòng)物園的監(jiān)管和管理,確保其嚴(yán)格遵守公共衛(wèi)生標(biāo)準(zhǔn)。
奇異變形桿菌是臨床感染中常見(jiàn)的陰性菌,其耐藥性近年來(lái)隨著廣譜抗生素的廣泛應(yīng)用逐漸升高,甚至出現(xiàn)多重耐藥現(xiàn)象[12]。頭孢噻肟屬于第三代頭孢菌素類藥物,是至關(guān)重要的人獸共用抗菌藥物。然而,blaCTX-M基因的出現(xiàn)導(dǎo)致奇異變形桿菌對(duì)第三代頭孢菌素產(chǎn)生耐藥性[13]。早在2013年潘玉善等[14]已發(fā)現(xiàn)禽源奇異變形桿菌中存在blaCTX-M-65基因,且CTX-M型超廣譜β-內(nèi)酰胺酶基因在禽源奇異變形桿菌中的存在已經(jīng)比較普遍。AmpC酶是β-內(nèi)酰胺酶的一個(gè)重要分支,由染色體或質(zhì)粒介導(dǎo),呈現(xiàn)出多樣化的基因型趨勢(shì)[15]。AmpC酶的產(chǎn)生使細(xì)菌能夠水解頭孢菌素類藥物,進(jìn)而失去抗菌活性,也是奇異變形桿菌對(duì)第三代頭孢耐藥的重要原因之一[12]。葛強(qiáng)等[16]對(duì)分離得到的21株豬源奇異變形桿菌進(jìn)行耐藥基因擴(kuò)增發(fā)現(xiàn),豬源奇異變形桿菌中攜帶ESBLs或AmpC的菌株比例較高,分別為57. 1%和14. 3%,同時(shí)攜帶ESBLs 和AmpC 的菌株占14. 3%,其中ESBLs菌株為blaTEM型、blaCTX-M型或blaTEM型和blaCTX-M 型。本研究測(cè)序結(jié)果顯示,1株(6D)攜帶耐藥基因blaCTX-M-14,1 株(106A)攜帶耐藥基因blaACT-16,與耐藥表型一致。
本研究中4 株同一克隆型頭孢噻肟耐藥菌(17B、21A、25B 和29B2)RT-qPCR 結(jié)果表明,3個(gè)雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)共同調(diào)節(jié)膜孔蛋白基因(ompA、ompC、ompF 和ompW)的表達(dá),結(jié)果導(dǎo)致禽源奇異變形桿菌對(duì)頭孢噻肟的抗性。OmpC和OmpF為革蘭陰性菌細(xì)胞膜上的主要孔道蛋白,在抗菌藥透過(guò)細(xì)胞膜進(jìn)入菌體的過(guò)程中發(fā)揮重要作用[17],其表達(dá)量下降時(shí)會(huì)導(dǎo)致抗菌藥的吸收減少,從而降低菌體內(nèi)藥物濃度而導(dǎo)致耐藥。OmpA常與β-內(nèi)酰胺酶或多藥外排泵一起作為非特異性慢孔外排蛋白而促進(jìn)菌體內(nèi)藥物的外排,Tsai et al.[18]證明ompA 缺失株使厄他培南、亞胺培南、美羅培南、多尼培南、萘啶酸、阿米卡星和黏菌素的敏感性增加2 ~ 3倍。OmpW 屬于小的外膜孔蛋白家族,可作為一種動(dòng)態(tài)變化的孔通道參與某些外排蛋白的外排功能,如與小多重耐藥蛋白EmrE 共同作用促進(jìn)特異性底物的泵出[9]。雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)是菌體內(nèi)常見(jiàn)的調(diào)控元件,通過(guò)調(diào)控膜孔蛋白的表達(dá)來(lái)影響藥物的流入與排出,進(jìn)而產(chǎn)生耐藥[4,9]。Masi et al.[19]研究表明,CpxA分別調(diào)節(jié)OmpF孔蛋白和AcrD外排泵的表達(dá),以CpxR依賴性方式賦予菌株對(duì)β-內(nèi)酰胺類和氨基糖苷類藥物的抗性,證明CpxAR雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)對(duì)ompF的負(fù)向調(diào)節(jié)作用。Hu et al.[20]通過(guò)回補(bǔ)baeR 基因發(fā)現(xiàn)OmpW在抗性菌株R200中的表達(dá)恢復(fù)正常水平,并且還完全恢復(fù)了對(duì)頭孢曲松的耐藥性,證明BaeSR雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)正向調(diào)控OmpW表達(dá)。Adler et al. [21]發(fā)現(xiàn)envZ 突變降低OmpF 的豐度,但OmpC 的表達(dá)水平增加,證明EnvZ/OmpR 雙組分信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)能負(fù)調(diào)控ompC 的表達(dá)。
ESBLs的表達(dá)是導(dǎo)致第三代頭孢菌素耐藥的主要機(jī)制,在ESBLs中,CTX-M酶因其廣泛流行和高效耐藥特性而備受關(guān)注,其既可通過(guò)接合型質(zhì)粒、插入序列、轉(zhuǎn)座子等進(jìn)行水平散播,也可以通過(guò)克隆進(jìn)行垂直傳播[22],其中ST131型大腸桿菌攜帶blaCTX-M-15在全球不同國(guó)家和地區(qū)的克隆傳播和大流行,對(duì)公共衛(wèi)生構(gòu)成了嚴(yán)重威脅[23]。本研究發(fā)現(xiàn),分離自不同品種禽類樣本的第三代頭孢菌素耐藥菌(17B、21A、25B和29B2)具有相同的譜型,表明該動(dòng)物園禽類散養(yǎng)場(chǎng)對(duì)第三代頭孢菌素耐藥的奇異變形桿菌存在著克隆傳播,為控制該克隆傳播,禽類散養(yǎng)場(chǎng)應(yīng)在加強(qiáng)飼養(yǎng)管理的同時(shí),嚴(yán)格消毒。盡管本研究檢出的克隆傳播菌株未攜帶CTX-M酶,但其仍對(duì)第三代頭孢菌素耐藥,如不能嚴(yán)格消毒,阻斷耐藥菌的克隆傳播,不僅會(huì)造成在禽類散養(yǎng)場(chǎng)區(qū)域內(nèi)流行散播,而且可能通過(guò)與游客的互動(dòng)等直接或間接的接觸造成更大范圍的流行散播,故應(yīng)引起人們的足夠重視。
參考文獻(xiàn):
[1] 陳赫威, 馬玲, 秦樹(shù)英, 等. 產(chǎn)AmpC酶的豬源奇異變形桿菌分離鑒定及生物學(xué)特性分析[J]. 畜牧與獸醫(yī), 2023, 55(7):46-52.
CHEN H W, MA L, QIN S Y, et al. Isolation, identification andbiological characteristics of swine-sourced Proteus mirabilis pro?ducing AmpC enzyme[J]. Animal Husbandry amp; Veterinary Medi?cine, 2023, 55(7): 46-52.
[2] 劉根, 李世宗, 信愛(ài)國(guó), 等. 一株野生馬來(lái)穿山甲源奇異變形桿菌的分離鑒定及生物學(xué)特性分析[J]. 野生動(dòng)物學(xué)報(bào),2023, 44(3): 657-668.
LIU G, LI S Z, XIN A G, et al. Isolation, identification and bio?logical characteristics analysis of one Proteus mirabilis strain fromwild Manis javanica[J]. Chinese Journal of Wildlife, 2023, 44(3): 657-668.
[3] 蔣增海, 姚璐璐, 張超君, 等. 河南省豬產(chǎn)業(yè)鏈中耐頭孢菌素沙門(mén)菌對(duì)β-內(nèi)酰胺類和喹諾酮類藥物的耐藥機(jī)制分析[J]. 中國(guó)獸醫(yī)學(xué)報(bào), 2023, 43(11): 2274-2280.
JIANG Z H, YAO L L, ZHANG C J, et al. Analysis of mecha?nisms of resistance to β-lactams and quinolones for cephalosporinresistantSalmonella isolates from pig-borne food chain of HenanProvince[J]. Chinese Journal of Veterinary Science, 2023, 43(11): 2274-2280.
[4] DE GAETANO G V, LENTINI G, FAMà A, et al. Antimicrobialresistance: two-component regulatory systems and multidrug ef?flux pumps[J]. Antibiotics, 2023, 12(6): 965.
[5] 李垠樹(shù), 趙冰, 孫華潤(rùn), 等. 1株同時(shí)攜帶tet(X6)和tet(X3)的禽源印地不動(dòng)桿菌比較基因組學(xué)分析[J]. 中國(guó)獸醫(yī)學(xué)報(bào),2022, 42(8): 1620-1625.
LI Y S, ZHAO B, SUN H R, et al. Comparative genomics analy?sis of an avian Acinetobacter indicus carrying both tet(X6) and tet(X3)[J]. Chinese Journal of Veterinary Science, 2022, 42(8):1620-1625.
[6] CLSI. Performance standards for antimicrobial susceptibility test?ing[M]. 30th ed. CLSI supplement M100. Wayne: Clinical andLaboratory Standards Institute, 2020.
[7] PAGANI L, DELL’AMICO E, MIGLIAVACCA R, et al. Mul?tiple CTX-M-type extended-spectrum β -lactamases in nosocomialisolates of Enterobacteriaceae from a hospital in northern Italy[J].Journal of Clinical Microbiology, 2003, 41(9): 4264-4269.
[8] MUSILA L, KYANY’A C, MAYBANK R, et al. Detection of di?verse carbapenem and multidrug resistance genes and high-riskstrain types among carbapenem non-susceptible clinical isolates oftarget gram-negative bacteria in Kenya[J]. PLoS One, 2021, 16(2): e0246937.
[9] ZHOU G, WANG Q, WANG Y S, et al. Outer membrane porinscontribute to antimicrobial resistance in gram-negative bacteria[J]. Microorganisms, 2023, 11(7): 1690.
[10] KANG Q, WANG X, ZHAO J N, et al. Multidrug-resistant Pro?teus mirabilis isolates carrying blaOXA-1 and blaNDM-1 from wildlifein China: increasing public health risk[J]. Integrative Zoology,2021, 16(6): 798-809.
[11] 黃長(zhǎng)羚. 動(dòng)物園中需注意的人畜共患病種類及防控建議[J].福建畜牧獸醫(yī), 2023, 45(4): 62-63.
HUANG C L. Species of zoonoses diseases in zoos and sugges?tions for prevention and control suggestions in zoos[J]. FujianJournal of Animal Husbandry and Veterinary Medicine, 2023,45(4): 62-63.
[12] 石翯, 樓正青. 奇異變形桿菌的臨床分布以及耐藥性分析[J]. 中國(guó)衛(wèi)生檢驗(yàn)雜志, 2023, 33(6): 692-694.
SHI H, LOU Z Q. Clinical distribution of Proteus mirabilis andanalysis of its drug resistance[J]. Chinese Journal of HealthLaboratory Technology, 2023, 33(6): 692-694.
[13] CHALMERS G, ANDERSON R E V, MURRAY R, et al. Char?acterization of Proteus mirabilis and associated plasmids isolatedfrom anaerobic dairy cattle manure digesters[J]. PLoS One,2023, 18(8): e0289703.
[14] 潘玉善, 苑麗, 吳華, 等. 禽源奇異變形桿菌超廣譜β-內(nèi)酰胺酶基因的分子特征[J]. 中國(guó)農(nóng)業(yè)科學(xué), 2013, 46(7):1463-1469.
PAN Y S, YUAN L, WU H, et al. Molecular characteristics ofextended-spectrum β-lactamases in clinical isolates of Proteus mi?rabilis form poultry[J]. Scientia Agricultura Sinica, 2013, 46(7): 1463-1469.
[15] 肖園園, 譚彩霞, 李春輝, 等. 美國(guó)感染病學(xué)會(huì)關(guān)于產(chǎn)超廣譜β-內(nèi)酰胺酶腸桿菌目細(xì)菌(ESBL-E)、耐碳青霉烯類腸桿菌目細(xì)菌(CRE)、難治性耐藥銅綠假單胞菌(DTR-PA)、產(chǎn)AmpC β-內(nèi)酰胺酶腸桿菌目細(xì)菌(AmpC-E)、耐碳青霉烯類鮑曼不動(dòng)桿菌(CRAB)和嗜麥芽窄食單胞菌的抗感染治療指引(2022 版)摘要[J]. 中國(guó)感染控制雜志, 2022, 21(12):1267-1276.
XIAO Y Y, TAN C X, LI C H, et al. Summary of infectious dis?eases society of America guidance on the treatment of extendedspectrumβ -lactamase-producing Enterobacterales, carbapenemresistantEnterobacterales, Pseudomonas aeruginosa with difficult-to-treat resistance, AmpC β-lactamase-producing Enterobac?terales, carbapenem-resistant Acinetobacter baumannii, and Ste?notrophomonas maltophilia infections (2022 edition)[J]. Chi?nese Journal of Infection Control, 2022, 21(12): 1267-1276.
[16] 葛強(qiáng), 馬東鑫, 周雨晴, 等. 豬源奇異變形桿菌的分離鑒定及特征分析[J]. 中國(guó)畜牧獸醫(yī), 2021, 48(5): 1804-1815.
GE Q, MA D X, ZHOU Y Q, et al. Isolation, identification andbiological characteristics of Proteus mirabilis of swine[J]. ChinaAnimal Husbandry amp; Veterinary Medicine, 2021, 48(5):1804-1815.
[17] MASI M, VERGALLI J, GHAI I, et al. Cephalosporin translo?cation across enterobacterial OmpF and OmpC channels, a filteracross the outer membrane[J]. Communications Biology, 2022,5: 1059.
[18] TSAI Y K, LIOU C H, LIN J C, et al. Effects of different resis?tance mechanisms on antimicrobial resistance in Acinetobacterbaumannii: a strategic system for screening and activity testingof new antibiotics[J]. International Journal of AntimicrobialAgents, 2020, 55(4): 105918.
[19] MASI M, PINET E, PAGèS J M. Complex response of theCpxAR two-component system to β -lactams on antibiotic resis?tance and envelope homeostasis in Enterobacteriaceae[J]. Anti?microbial Agents and Chemotherapy, 2020, 64(6): e00291-20.
[20] HU W S, LI P C, CHENG C Y. Correlation between ceftriaxoneresistance of Salmonella enterica serovar Typhimurium and ex?pression of outer membrane proteins OmpW and Ail/OmpX-likeprotein, which are regulated by BaeR of a two-component system[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(9):3955-3958.
[21] ADLER M, ANJUM M, ANDERSSON D I, et al. Combinationsof mutations in envZ, ftsI, mrdA, acrB and acrR can cause highlevelcarbapenem resistance in Escherichia coli[J]. Journal ofAntimicrobial Chemotherapy, 2016, 71(5): 1188-1198.
[22] BUSH K, BRADFORD P A. Epidemiology of β -lactamaseproducingpathogens[J]. Clinical Microbiology Reviews, 2020,33(2): e00047-19.
[23] KO K S. Antibiotic-resistant clones in Gram-negative pathogens:presence of global clones in Korea[J]. Journal of Microbiology,2019, 57(3): 195-202.
基金項(xiàng)目:河南省高校科技創(chuàng)新團(tuán)隊(duì)支持計(jì)劃項(xiàng)目(23IRTSTHN021);河南省自然科學(xué)基金重點(diǎn)項(xiàng)目(232300421111)

