高考中化學反應機理的命題趨勢分析
隨著教育改革的不斷推進和高考命題思路的不斷更新,高考化學試題在化學反應機理方面的命題趨勢愈發明顯.這一趨勢不僅要求學生掌握化學反應的基本原理和核心概念,還要求學生能夠深入理解反應機理,注重實際應用,追求創新思維.本文將探討這一命題趨勢的特點,以期幫助學生更好地進行備考.
1 強調基礎知識和核心概念
高考化學作為一門考查學生化學知識綜合運用能力的考試,始終將基礎知識和核心概念作為命題的核心.特別是在化學反應機理的考查中,這種趨勢尤為明顯.這不僅體現在對基礎反應機理的深入探究,還體現在將反應機理與實際應用相結合,考查學生的綜合分析能力.
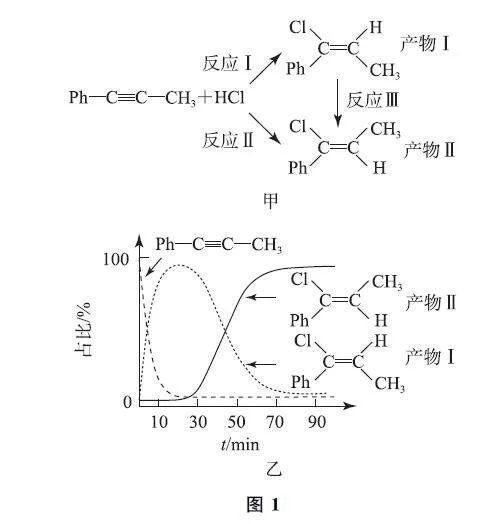
例1 (2023年6月浙江卷)一定條件下,1G苯基丙炔(Ph—C≡C—CH3)可與HCl發生催化加成,反應如圖1G甲所示:
反應過程中該炔烴及反應產物的占比隨時間的變化如圖1G乙所示(已知:反應Ⅰ、Ⅲ為放熱反應),下列說法不正確的是( ).
A.反應焓變:反應Ⅰ>反應Ⅱ
B.反應活化能:反應Ⅰ<反應Ⅱ
C.增加HCl濃度可增加平衡時產物Ⅱ和產物Ⅰ的比例
D.選擇相對較短的反應時間,及時分離可獲得高產率的產物Ⅰ
解析 由圖1G甲可知,反應Ⅱ=反應Ⅰ+反應Ⅲ,反應Ⅰ、反應Ⅲ都是放熱反應,所以反應Ⅱ也是放熱反應,且反應Ⅱ的反應熱比反應Ⅰ小,即存在反應焓變:反應Ⅰ>反應Ⅱ,選項A 說法正確.反應所需的活化能越小,反應速率越快,相同時間內所占比例越大,由圖可知,短時間內,產物Ⅰ的占比遠遠大于產物Ⅱ,說明反應Ⅰ的速率遠遠大于反應Ⅱ,則所需活化能:反應Ⅰ<反應Ⅱ,選項B說法正確.由于存在產物Ⅰ與產物Ⅱ之間的可逆反應,K 與氯化氫含量無關,因此比值不會隨著HCl含量的改變而改變,選項C說法錯誤.由圖可知,相對較短的反應時間內產物Ⅰ的占比較大,所以選擇相對較短的反應時間,及時分離可獲得高產率的產物Ⅰ,選項D說法正確.
答案 C.
2 注重實際應用
在近年高考中,實際應用類試題在化學反應機理的考查中愈發受到重視.這一轉變不僅體現了化學學科與實際生活的緊密聯系,更突顯了高考對學生綜合應用能力的全面要求.化學反應機理,作為化學學科的核心內容,其實際應用不僅關乎學生對理論知識的理解和掌握,更在于培養學生解決實際問題的能力.
例2 (2023年北京卷,節選)尿素[CO(NH2)2]合成的發展體現了化學科學與技術的不斷進步.
(1)19世紀初,用氰酸銀(AgOCN)與NH4Cl在一定條件下反應制得CO(NH2)2,實現了由無機物到有機物的合成.該反應的化學方程式是________.
(2)20世紀初,工業上以CO2 和NH3 為原料在一定溫度和壓強下合成尿素.反應分兩步:
ⅰ.CO2 和NH3 生成NH2COONH4;
ⅱ.NH2COONH4 分解生成尿素.
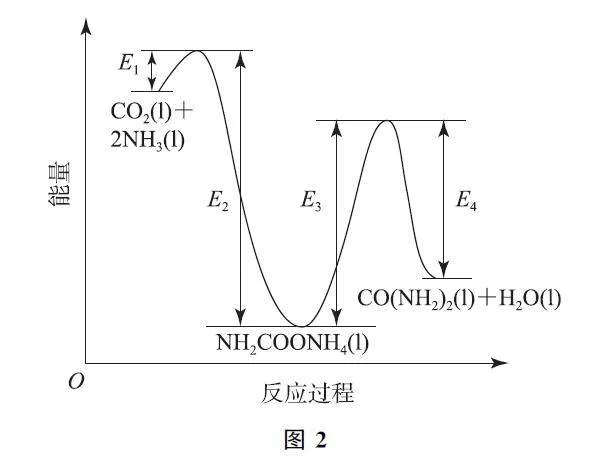
結合反應過程中能量變化示意圖(如圖2),下列說法正確的是________(填序號).
a.活化能:反應ⅰ<反應ⅱ
b.ⅰ為放熱反應,ⅱ為吸熱反應
c.CO2(l)+2NH3(l)=CO(NH2)2(l)+H2O(l)ΔH =E1-E4
解析 (1)AgOCN 與NH4Cl在一定條件下反應制得CO(NH2)2 和AgCl,根據原子守恒,該反應化學方程式為AgOCN+NH4Cl=CO(NH2)2+AgCl.
(2)由圖可知,反應ⅰ的活化能是E1,反應ⅱ的活化能是E3,E1<E3,故a正確.從圖中反應物和生成物能量的相對大小可看出ⅰ為放熱反應,ⅱ為吸熱反應,故b正確.總反應的ΔH =E1-E2+E3-E4,即CO2(l)+2NH3(l)=CO(NH2)2(l)+H2O(l)的ΔH =E1-E2+E3-E4,故c錯誤.答案為a、b.
3 強調實驗探究
高考試題對于化學反應機理的考查逐漸轉向與實驗探究相結合,這一轉變不僅凸顯了化學作為一門實驗科學的本質,更強調了實驗在理解和分析化學反應機理中的核心地位.考生不僅需要掌握理論知識,更需要通過實驗來驗證、探究和應用這些理論知識.
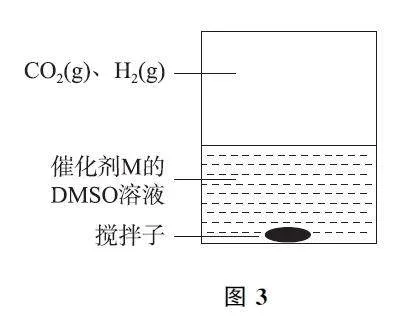
例3 (2024年1月浙江卷,節選)通過電化學、熱化學等方法,將CO2 轉化為HCOOH 等化學品,是實現“雙碳”目標的途徑之一.
為提高效率,該研究小組參考文獻優化熱化學方法,在圖3 所示密閉裝置中充分攪拌催化劑M 的DMSO(有機溶劑)溶液,CO2 和H2 在溶液中反應制備HCOOH,反應過程中保持CO2(g)和H2(g)的壓強不變,總反應CO2+H2?HCOOH 的反應速率為v,反應機理如下列3個基元反應,各反應的活化能E2<E1?E3(不考慮催化劑活性降低或喪失).
Ⅳ:M+CO2?Q E1.
Ⅴ:Q+H2?L E2.
Ⅵ:L?M+HCOOH E3.
(1)催化劑M 足量條件下,下列說法正確的是________(填序號).
A.v 與CO2(g)的壓強無關
B.v 與溶液中溶解H2 的濃度無關
C.溫度升高,v 不一定增大
D.在溶液中加入N(CH2CH3)3,可提高CO2 轉化率
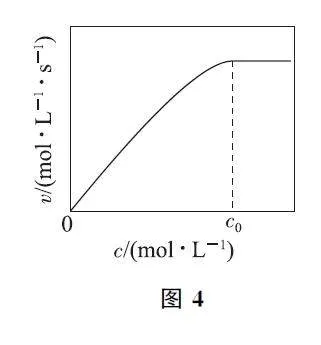
(2)實驗測得:298K,p(CO2)=p(H2)=2MPa下,v 隨催化劑M 濃度c 變化如圖4所示.c≤c0 時,v隨c 增大而增大;c>c0 時,v 不再顯著增大.請解釋原因: ________.
解析 (1)v 與CO2(g)的壓強有關,壓強越大,溶液中CO2 的濃度越大,v 越大,選項A 錯誤.v與溶液中溶解H2 的濃度有關,H2 的濃度越大,速率越快,選項B錯誤.溫度升高,v 不一定增大,反應Ⅳ和Ⅴ是快反應,而Ⅵ是慢反應(決速步驟),若Ⅳ和Ⅴ是放熱反應且可以快速建立平衡狀態,則隨著溫度升高L的濃度減小,若L的濃度減小對反應速率的影響大于溫度升高對總反應速率的影響,則總反應速率減小,總反應的速率不一定增大,選項C正確.在溶液中加入的N(CH2CH3)3 會與HCOOH 反應,使得3個平衡正向移動,可提高CO2 轉化率,選項D正確.
(2)因各反應的活化能E2<E1?E3,反應Ⅵ為決速步驟,但L的濃度取決于反應Ⅴ和Ⅳ,故v 與催化劑M 的濃度、反應物CO2 和H2 的濃度有關.當c≤c0時,催化劑M 活性位點數量不夠,v 取決于催化劑M的濃度;當c>c0 時,催化劑M 活性位點數量足夠,v取決于反應物CO2 和H2 的濃度.
總之,學生需要全面掌握理論知識,加強實驗探究和實踐應用,并提高分析和解決問題的能力.
(完)

