環尾狐猴弓形蟲感染診治
摘要:四川某飼養單位于2022年7月起陸續發現環尾狐猴開始出現精神萎靡、不好動、食欲廢絕等癥狀,且病程短、死亡率較高。通過實驗室檢測診斷為弓形蟲感染,選擇林可霉素、螺旋霉素、磺胺類等藥物進行防治,取得了一定的治療效果。
關鍵詞:環尾狐猴;弓形蟲;檢測;診斷;治療
環尾狐猴(Lemur catta)屬于原始靈長類,分布于非洲馬達加斯加島南部和西部的干燥森林中,生活在疏林裸巖地帶。環尾狐猴被列入《瀕危野生動植物種國際貿易公約》CITES附錄Ⅰ中。其性情溫和,身體背部的毛呈淺灰褐色,腹部為灰白色,額部、耳背和頰部為白色,與黑色的吻部和眼圈構成了鮮明的對比色彩,十分有趣。很多動物園和萌寵樂園都飼養有環尾狐猴。四川某飼養單位于2022年7月陸續發現環尾狐猴開始發病,多數出現精神萎靡、不好動、食欲廢絕、體溫升高或體溫變化不明顯,有些病程很短就死亡,取死亡動物組織實驗室檢測診斷為弓形蟲感染,經治療和預防投藥,取得一定效果。
1 發病情況
2022年7月5,飼養人員發現一亞成體環尾狐猴出現精神萎靡、不好動、食欲廢絕、體溫升高,血液常規和生化無明顯異常,經治療無效死亡,取該動物血液及死亡后心、肝、脾、肺、腎做弓形體抗原核酸檢測弓形蟲陽性。7月21日、7月27日相繼又有環尾狐猴發病,根據實驗室檢測結果,結合臨床特征,按照弓形蟲感染進行治療,7月21日發病的環尾狐猴,經過長達20 d的治療,動物逐漸康復,7月27日發病個體治療無效死亡。
2 材料與方法
2.1 樣品采集及處理
血液樣本采集自發病環尾狐猴個體。在麻醉的情況下,使用含有EDTA的采血管從待測動物后肢靜脈中采集全血樣本,分裝后至4 ℃保存至血漿分離及DNA提取。收集死亡動物剖檢后心、肝、脾、肺、腎等組織樣本進行組織病理切片及DNA提取。血液樣本DNA提取試劑盒采用QIAGEN的QIAamp DNA Blood Mini Kit;組織樣本DNA提取試劑盒采用QIAGEN的Blood & Tissue Kit;PCR預混液(包括DNA聚合酶,10×Buffer,dNTP等)購自賽默飛世爾科技公司,DL2000 DNA Marker購自Biosharp公司。
2.2 血清抗體檢測
使用酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)和改良凝集試驗(modified agglutination test,MAT)對血漿樣本中弓形蟲抗體IgG進行檢測。ELISA試劑盒購自北京天之泰生物科技有限公司,MAT試劑盒購自美國田納西大學研究基金會,實驗使用96孔U型板進行,血漿樣本按1∶25~1∶200連續稀釋。具體實驗步驟及結果判定參照商用試劑盒說明書進行。當MAT和ELISA結果均為陽性時,判斷檢測結果為陽性,反之則為陰性;當MAT與ELISA結果不同時,重復實驗,若結果仍不相同,則判斷結果為疑似陽性。
2.3 抗原核酸檢測
參照Homan等[1]報道的弓形蟲529 bp重復序列(AF146527.1),對提取的環尾狐猴組織及血液DNA進行弓形蟲PCR檢測,使用引物對:上游引物529ToxoF(5'-CTGCAGGGAGGAAGACGAAAGTTG-3')和下游引物529ToxoR(5'-CTGCAGACACAGTGCATCTGGATT-3'),引物由生工生物工程(上海)股份有限公司合成。PCR反應體系為25 ?滋L,其中包括12.5 ?滋L的PCR預混液(Dream Taq Green MM),8.5 ?滋L的雙蒸水,50 ?滋mol/L上下游引物各1 ?滋L,DNA模板2 ?滋L。PCR反應程序為:預變性94 ℃ 5 min,變性94 ℃ 1 min,退火65 ℃ 1 min,延伸72 ℃ 1 min,循環30次,最后72 ℃ 10 min。PCR產物用1.5%瓊脂糖凝膠電泳分析(120 V,35 min)。
3 結果與診斷
3.1 剖檢與病理組織切片分析
死亡動物剖檢主要病變是肺充血、出血,胸腔積液增多,多數發病急的動物組織器官剖檢無明顯肉眼所見病變。死亡動物組織切片主要表現為肺組織出血、淤血、充血,肝細胞水腫、變性、多灶性壞死、肝細胞膽汁淤積,心臟灶區心肌纖維波浪樣變,腸系膜淋巴結凝固性壞死,其他組織病理變化不明顯。不同死亡個體組織病變也不完全相同,多數死亡動物均有肺組織病變。
3.2 血清學檢查結果
對采集到的環尾狐猴血液樣本使用MAT和ELISA進行弓形蟲IgG抗體檢測。結果顯示,采集環尾狐猴血液樣本為弓形蟲IgG抗體陽性,其中MAT結果效價為1∶50。
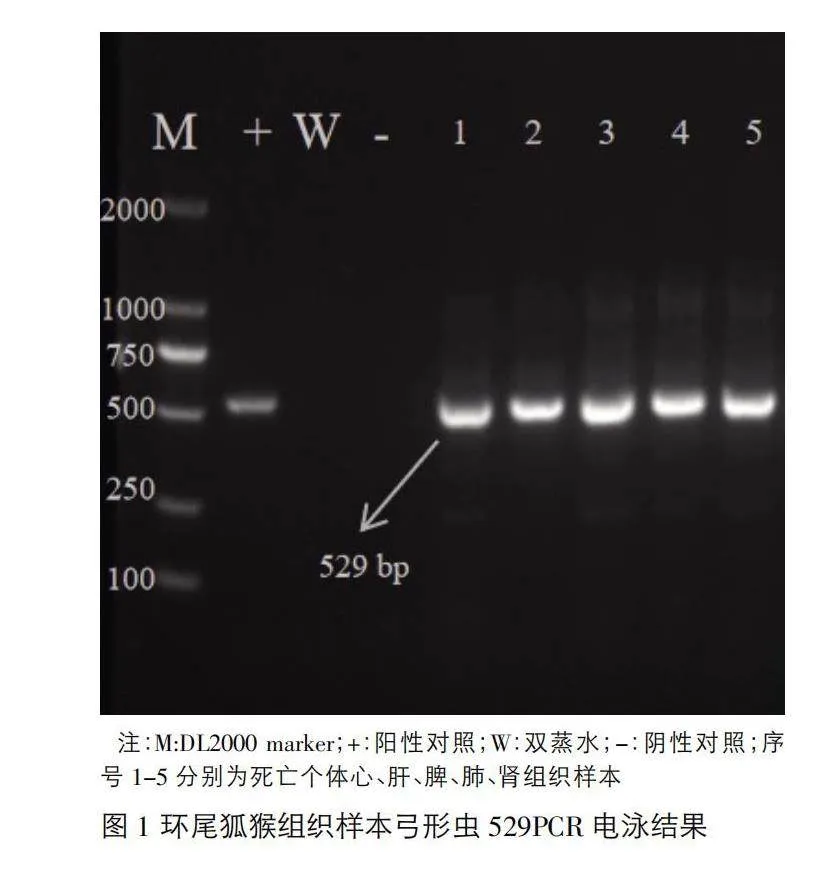
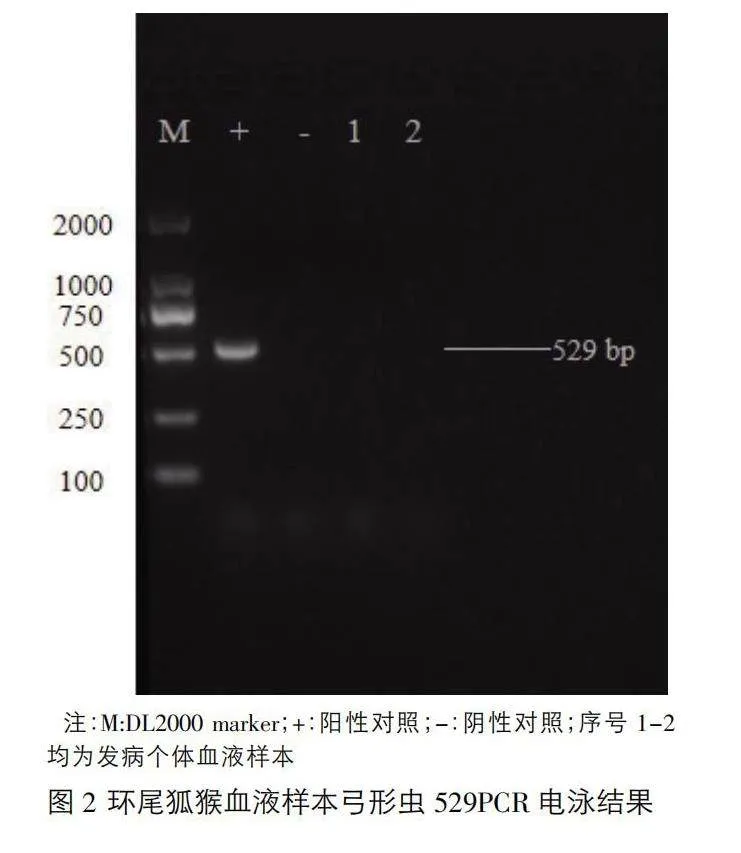
3.3 PCR檢測及陽性結果測序
對提取的組織樣本DNA及血液樣本DNA進行弓形蟲529序列進行PCR檢測。檢測結果顯示,環尾狐猴內臟組織樣本均為弓形蟲PCR陽性(圖1),血液樣本弓形蟲PCR檢測結果為陰性(圖2)。將陽性樣本送至生工生物工程(上海)股份有限公司測序,并將獲得的序列進行Blast分析,結果顯示擴增片段為弓形蟲的529 bp重復序列。
3.4 診斷結果
根據病史、臨床癥狀、剖檢、病理組織切片和實驗室檢查結果,確診環尾狐猴死亡個體患有弓形蟲病。
4 治療和預防
動物發病后,通過靜脈及時補充電解質和能量,早期選用磺胺類和林可霉素聯合進行治療,病情緩解后,再用磺胺類藥物進行鞏固治療。其中,7月21日發病的環尾狐猴完全康復,但也有動物發病急,治療效果不明顯。發病高峰期,對其他猴群交替投喂磺胺類和螺旋霉素,加強環境衛生消毒,加強滅鼠,制止流浪貓進入動物獸舍,整體情況得到控制,但動物體內弓形蟲包囊殺滅和清除,存在反復感染的情況。
5 轉歸與預后
目前治療弓形蟲的藥物有限,大多藥物具有毒副作用強的特點,用藥時間過長,動物機體會受到的影響比較大,需要很長時間才能消除藥物副作用帶來的影響。發病急或發現比較晚的病例治療效果很不理想。
6 討論
該養殖單位環尾狐猴感染弓形蟲的情況與國內外資料報道的情況相似或相同,無論是臨床癥狀還是病理變化都基本吻合,且發病率和死亡率均很高[2-4]。充分說明,環尾狐猴對弓形蟲高度易感,該病對環尾狐猴種群影響非常大,提醒各動物園、萌寵樂園或其他環尾狐猴飼養單位,做好弓形蟲的防控任務十分緊迫。
按照當前動物疾病治療水平,可選擇的藥物大多為磺胺類、乙胺嘧啶、螺旋霉素、林可霉素、阿奇霉素等,藥物的副作用都比較大,再加上動物體內的弓形蟲包囊難以殺滅及清除和/或疾病分期的問題,其治療效果受限[5-6] 。今后在弓形蟲敏感低毒藥物的篩選、弓形蟲在環尾狐猴致病機理、治療方式方法、早期診斷和預防等方面加大研究力度,方可進行有效防控。
弓形蟲病(toxoplasmosis)是剛地弓形蟲寄生于多種動物和人的有核細胞內引起的一種重要的人與動物共患病。弓形蟲宿主種類廣泛,幾乎所有的溫血動物都可能成為感染弓形蟲的來源[7]。弓形蟲可寄生在除紅細胞外的幾乎所有有核細胞內,蟲體整個生活史分為五個階段,分別是滋養期、包囊期、裂殖期、配子體和卵囊期。由于弓形蟲病的臨床癥狀無明顯特異性,且多呈現隱性感染,故依據臨床癥狀和流行病學難以作出診斷。目前弓形蟲病主要依據實驗室診斷,主要方法有病原學檢查、免疫學檢測和分子生物學技術[8]。
病原學檢查以從病料中直接查到速殖子或卵囊為確診標準。采用直接涂片或者組織切片、動物接種和卵囊等檢查法,該檢查結果準確,但由于檢出率低、耗時長,不適用于大熊貓弓形蟲病的快速檢測和流行情況調查;免疫學檢測是從血清或腦脊液內檢測到特異性抗體是診斷弓形蟲病應用廣泛的重要輔助手段。主要方法包括染色試驗(sabin-Feldman dye test,DT)、間接血凝試驗(indirect hemagglutination test,IHA)、乳膠凝集試驗(latrx agglutination test,LAT)、間接免疫熒光試驗(indirect immunofluorescent assay,IFA)、酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)等[9]。其中IHA特異性高、假陽性率低、診斷價值高和操作簡便;ELISA具有敏感性高、特異性強、檢測速度快、受檢樣本多等特點,有很好的推廣應用價值。分子生物學技術已應用于弓形蟲病的檢測,國內外已經建立了多種弓形蟲病基因診斷方法,主要有LAMP、DNA探針和PCR技術等。目前用于弓形蟲檢測的探針多為特異性DNA克隆片段或人工合成的寡核苷酸探針,但其制備需要一定條件,且費用較高,不易推廣。PCR技術自建立以來,以其靈敏、特異、高效而成為一項目前廣為應用的診斷技術。為提高試驗的敏感性和特異性,在PCR基礎上,又發展了巢式PCR(nested PCR)、PCR-ELISA和RT-PCR技術,并在弓形蟲病診斷中得以應用[10]。
目前關于圈養非人靈長類動物感染弓形蟲的研究仍然知之甚少,已證實首要風險因素是攜帶弓形蟲卵囊的貓科動物,而動物種屬、館舍開放程度和飼養管理等因素在不同地區的非人靈長類感染中的權重也有所差異[11]。現有研究表明新世界靈長類對弓形蟲具有較高的易感性,且急性弓形蟲病易導致其死亡[12]。獲得性弓形蟲的常見傳播方式是經口感染其組織包囊或卵囊,導致動物發病和傳播,因此,加大滅鼠工作力度,加強流浪貓的管控,是控制或防止弓形蟲病發生的重要手段。■
參考文獻:
[1] Homan W L,Vercammen M , Braekeleer J D,et al.Identification of a 200- to 300-fold repetitive 529 bp DNA fragment in Toxoplasma gondii, and its use for diagnostic and quantitative PCR.[J].International Journal for Parasitology, 2000, 30(1):69-75.
[2] SUREAU P, RAYNAUD JP, LAPEIRE C, et al. Preimer isolement de Toxoplasma gondii a Madagascar toxoplasmose spontanée et expérimentale du Lemur catta[J]. Bull Soc Pathol Exot,1962, 55:357-362.
[3] SPENCER J A, JOINER K S, HILTON C D, et al. Disseminated toxoplasmosis in a captive ring-tailed lemur (Lemur catta) [J]. Journal of Parasitology, 2004, 90(4): 904-906.
[4] 單芬,李康信,徐春忠,等.環尾狐猴源弓形蟲的檢測與鑒定[J].野生動物學報, 2016, 37(2):118-125.
[5] 孫曉敬,張磊,田甜,等.弓形蟲病治療:從傳統藥物到納米藥物[J].畜牧獸醫學報, 2023, 54(5):1834-1844.
[6] ZHANG Y, ZHANG Q, LI H, et al. In vitro and in vivo anti-Toxoplasma activities of HDAC inhibitor Panobinostat on experimental acute ocular toxoplasmosis[J].Frontiers in Cellular and Infection Microbiology,2022,12:1002817.
[7] MONTOYA J G, LIESENFELD O. Toxoplasmosis. [J]. Lancet, 2004, 363:1965-1976.
[8] 高正琴.弓形蟲快速鑒定及國內實驗動物感染調查[J].實驗動物科學,2018,35(05):40-45.
[9] 沈繼龍,余莉.我國弓形蟲病我國弓形蟲病流行概況及防治基礎研究進展[J].中國血吸蟲病防治雜志,2019,31(1):71-76.
[10] 王萌,王艷華,蔡志杰,張德林.弓形蟲病的分子診斷技術研究進展[J].中國人獸共患病學報,2010,26(12):1160-1162.
[11] 張述義.非人靈長類動物弓形蟲病的研究概況[J].中國動物傳染病學報, 1998(1):57-59.
[12] EPIPHANIO S, SINHORINI I L, CAT?魨O-DIAS J L. Pathology of toxoplasmosis in captive new world primates [J]. Journal of Comparative Pathology, 2003, 129(2-3): 238-246.

