例析初中化學歸因分析類題型的解題策略

摘要:“歸因”是指歸納原因.初中化學中的歸因題型是指已知結果、尋找原因的題目.在江蘇新課程改革的背景下,歸因分析類題型在中考中出現的頻次較高,逐漸成為學生高分路上的“攔路虎”.即便是身為老師,也可能在分析時發生不夠精確或者完整的狀況.基于此,本文以近幾年江蘇省中考真題為例,分析了初中化學歸因分析類題型的常見解題策略和思路,希望能給一線教師教學帶來啟示.
關鍵詞:歸因分析;解題技巧;初中化學
中圖分類號:G632文獻標識碼:A文章編號:1008-0333(2024)26-0106-03
歸因分析類題目針對學生的能力提出嚴格的要求,重點考查學生的邏輯推理與模型認知能力,以此評估學生的核心素養.基于江蘇省某些城市近兩年的中考試卷答題情況,發現大多數考生在這類題目上的表現并不理想,常見的問題包括信息提取不當、邏輯推理不嚴謹、知識儲備不足、答題語言不規范等,這些因素導致了錯誤的答案和分數的丟失[1].所以,研究初中化學歸因分析題型的有效解題策略仍然是化學備考的關鍵.
1對物質性質的考查
在近年的中考中,物質性質類的歸因分析題目已成為必考的組成部分.這類題目要求學生能夠利用常見物質的特性來分析和闡釋化學現象及實際情況,并且能夠針對真實的化學問題進行初步的分析和解決[2].
例1(2023年揚州市中考真題·節選)CO2可以用于滅火.
(3)研究CO2和KHCO3聯合使用時的滅火效果.
①KHCO3滅火的原因較復雜.KHCO3受熱分解時會吸收能量,化學方程式為:2KHCO3△K2CO3+CO2↑+H2O↑.以初中所學燃燒和滅火的原理分析,KHCO3可以用于滅火的原因有.
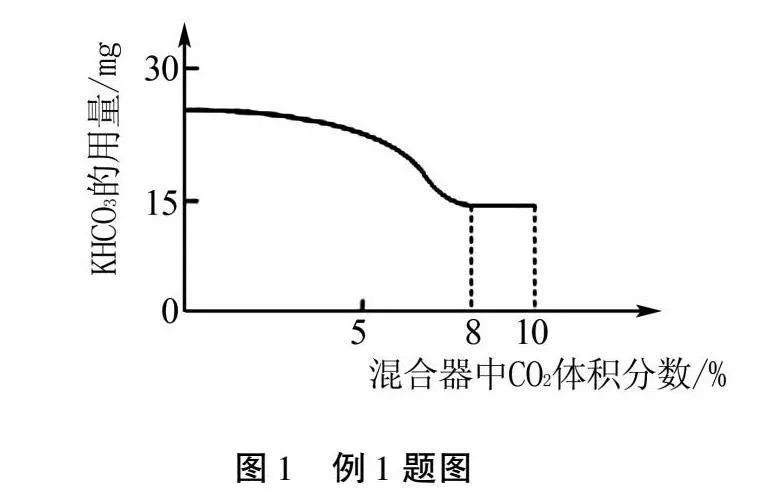
②向燃燒器內通入CH4和空氣,點燃,待火焰穩定后,從進口A通入CO2,進口B加入KHCO3粉末,控制其他條件不變,測得火焰剛好熄滅時,KHCO3的用量與混合器中通入的CO2體積分數如圖1所示.CO2的體積分數在8%~10%內,隨CO2體積分數的增加,使火焰熄滅所需的KHCO3用量不再減少,且燃燒器內殘留的KHCO3增多,原因是.
解析①燃燒的三要素為:有可燃物、可燃物與O2接觸、可燃物溫度達到著火點;三者必須同時滿足才能起火.反之,我們在滅火時也可以從以上三點入手.KHCO3受熱可以分解產生K2CO3、H2O與CO2,則KHCO3滅火的原理為:分解時吸熱降低反應物的溫度,分解產生H2O蒸發吸熱,產生的CO2覆蓋在可燃物表面隔絕O2;故答案為:分解時吸熱降低反應物溫度,分解產生H2O蒸發吸熱,產生的CO2蓋在可燃物表面隔絕O2;
②KHCO3受熱分解產生CO2,當CO2含量在8%時,KHCO3分解產生的CO2與通入的CO2足以達到滅火的效果,再增加KHCO3已經不參加反應;故答案為:CO2含量在8%時,KHCO3分解產生的CO2與通入的CO2足以達到滅火的效果.
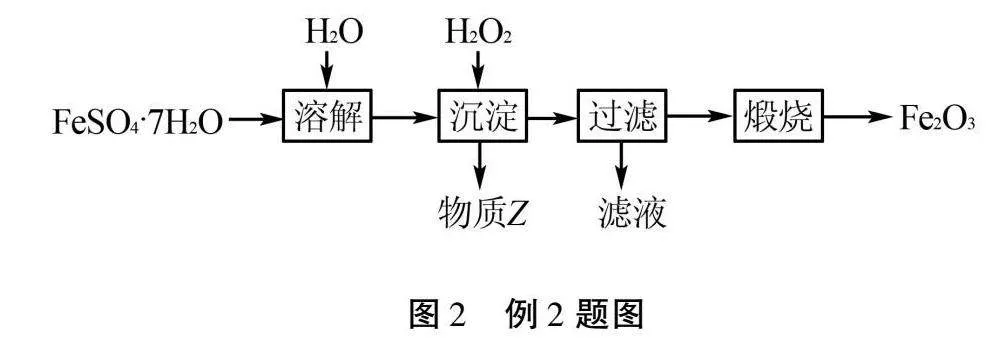
例2(2020年揚州市中考真題·節選)以FeSO4·7H2O為原料制備鐵紅(Fe2O3)的一種方法如圖2:
已知“沉淀”時的主要反應為:2FeSO4+H2O2+2H2O2FeO(OH)↓+2H2SO4;
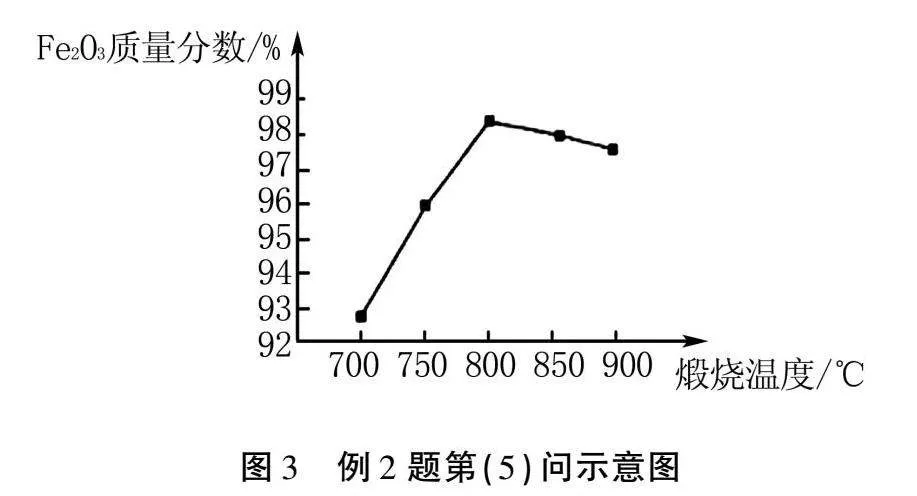
(5)圖3為其他條件相同時不同煅燒溫度對產品中Fe2O3質量分數的影響.煅燒溫度低時,產品中Fe2O3的質量分數較低,其原因是.當煅燒溫度達到800 ℃時,繼續升高溫度,產品中Fe2O3質量分數降低,且鐵元素質量分數升高,所得產品發黑,其可能原因是.
解析圖3為不同煅燒溫度對產品中Fe2O3質量分數的影響.分析圖中曲線可知,當煅燒溫度較低時,產品中Fe2O3質量分數較低,其原因是煅燒溫度較低時,除生成Fe2O3外,還生成其他固體物質,低溫條件下FeO(OH)不易分解;當煅燒溫度達800 ℃時,繼續升高溫度,產品中Fe2O3質量分數降低,且鐵元素質量分數升高,所得產品發黑,其可能原因是煅燒溫度高于800 ℃時,除生成Fe2O3外,還生成了Fe3O4.故填:煅燒溫度較低時,除生成Fe2O3外,還生成其他固體物質,低溫條件下FeO(OH)不易分解;煅燒溫度高于800 ℃時,除生成Fe2O3外,還生成了Fe3O4.
總結本題主要考查有關Fe及其化合物的性質,結合以Fe2O3為原料制備鐵紅的工業流程為背景,考查了學生對有關鐵的化學反應的掌握情況.在解答這個問題時,需要考生結合題目中給出的已知信息,結合鐵及其化合物的化學性質分析現象產生的原因,具備一定難度和綜合性.
2對證據推理能力的考查
考查證據推理的歸因分析類題型是近兩年中考化學中常見的出題形式,它對學生的邏輯分析能力和知識點的掌握情況要求都較高,需要學生在知識點的學習過程中,具備一定的化學學科思維,能夠根據實驗現象進行合理推斷和模型建構[3].難度較高,教師要在備考階段引起重視.
例3(2021年蘇州中考題·節選)水是生命之源,是人類寶貴的資源和財富.
(1)水體富營養化是廢水排放中氨氮(基于NH3形式存在)含量過高的直接后果.次氯酸(HClO)能夠有效去除廢水中的NH3,其反應過程:2NH3+3HClO=X+3HCl+3H2O,那么X的化學方程式是.當廢水的堿性過強(PH>10),NH3的去除效率將明顯下降,原因是.
解析在化學反應前后,原子的種類與數目不變.已知反應前有2個N原子、9個H原子、3個NH+原子、3個O原子;反應后有9個H原子、3個NH+原子、3個O原子,所以2個N原子在X中,則X的化學式為N2.若廢水堿性過強PH>10,NH3的去除率會顯著降低,這說明反應速率下降.分析反應物HClO呈酸性,可知NH3的去除率會顯著降低的原因是溶液的堿性過強,消耗了HClO,使HClO濃度降低.故橫線處應填:N2;過強的堿性會導致消耗增加HClO,使HClO的濃度降減少,這種變化會引起NH3去除率的下降.
總結本題以水為背景,考查了有關廢水的處理知識,旨在檢驗考生對質量守恒定律和歸因分析的掌握情況.在解答時,考生要結合題設中給出的化學方程式,準確識別和判斷影響化學反應因素.以本題為例,根據化學方程式,影響化學反應速率的反應物為NH3和HClO,溶液堿性增強,NH3不變但化學反應速率下降,這就說明另一反應物HClO的濃度隨著溶液堿性的增強降低了.通常,如果化學反應被各種因素干擾,必須評估這些影響因素之間是存在同一性或者對立性.假如這些因素之間是對立的關系,則對化學反應的影響需要根據實際情況判斷,和化學結果相符合的因素即為最主要的影響因素.如果各因素呈現同一性,不論它們的種類如何不同,對化學反應所造成的影響是趨向一致的,則需要分點作答,或者直接選擇影響最大的因素回答即可.
例4(2023年蘇州市中考題·節選)CH4與CO2在催化劑影響下能夠生成合成氣(CO和H2),在反應進行時,催化劑表面也會發生碳的沉積與消除反應,這一過程的具體機理如圖4所示.
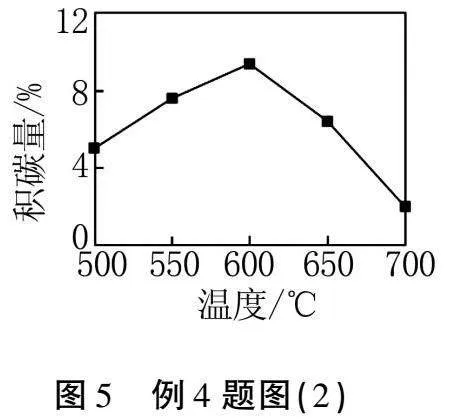
③在保持其他實驗條件恒定的情況下,催化劑表面積累的碳量將隨著溫度的升高而發生變化,具體如圖5所示.當溫度超過600 ℃,催化劑表面積碳量降低的現象,這可能是因為.
解析CH4和CO2通過催化劑的作用,可以生成合成氣CO和H2,在這一過程中,催化劑表面會同時發生碳的沉積和清除反應,兩反應對于催化劑表面的積碳量變化存在競爭關系.在保持其他條件不變的情況下,催化劑表面的碳積累量會隨著溫度的變化而變化,具體變化趨勢如圖5所示.從圖表中能夠觀察到,當溫度超過600 ℃時,催化劑表面的碳積累量有所下降,說明此時在積碳反應和消碳反應的競爭中,消碳反應為主導反應.結合化學反應的原理,出現這一現象的因素可能是隨著溫度的增加,碳清除反應消耗的碳量超過了碳沉積反應產生的碳量.
總結本題為證據推理的歸因分析類題型.需要學生從題干中獲取有用信息,并結合已有的知識儲備綜合求解.在解答歸因分析類問題時,學生一定要把握住題干中的每一句有用信息.結合實驗設計的原理分析實驗,做好歸因分析.
3結束語
通過總結和分析近幾年江蘇省中考化學的真題,尤其是2023年蘇州市中考化學歸因分析類題目發現,考生要想在此類題型上獲得高分,一定要把握好題干中的關鍵信息.收集已知信息,并構建起已知信息與未知信息之間的橋梁.另外,基于獲得的信息和證據開展合理的邏輯推理也是解題的關鍵.根據筆者經驗,考生在實際解題過程中可以按這樣的解題思路:首先找準事實結果和現象,判斷分析題干或圖片中和實驗現象有關系的信息;再進一步分析可能影響現象和事實結果的眾多因素,厘清各個因素之間的關系,協同抑或競爭,確定導致事件產生的根本原因;最后再將其用規范專業的語言表達出來。
初中階段涉及反映現象或事實結果的影響因素包括反應物與生成物、反應條件、有無副反應、反應溫度和濃度、催化劑和接觸面積等.考生要理清各個因素之間的邏輯關系,保證自己在考場上能夠不遺漏關鍵信息.當然,在日常的解題訓練和備考階段,教師也要著重幫助學生總結歸納相關知識點,豐富學生的知識儲備量,拓展學生的“武器庫”,保證學生在實際解題過程中能做到不疾不徐、精準突破.
參考文獻:[1] 張棱.淺談中考歸因題型的解題策略[J].中學化學, 2023(10):32-34.
[2] 丁艷.物質結構與性質視角下歸因分析的試題研究[J].中學化學, 2023(5):50-52.
[3] 高麗.有序思維在新高考新題型中的應用[J].高中數理化, 2023(8):68-69.
[責任編輯:季春陽]

