促紅細胞生成素對牦牛腎間質成纖維細胞凋亡因子表達的影響

摘 要: 旨在探討促紅細胞生成素(EPO)對牦牛腎間質成纖維細胞(RIFs)中凋亡因子的影響。本研究首先分別采集3頭4歲齡的健康牦牛和黃牛的腎臟組織,采用免疫組織化學方法和Western blot檢測牦牛和黃牛腎臟中EPO的準確分布及其表達量。同時對牦牛RIFs進行原代培養鑒定,并對其進行不同藥物處理來調控RIFs中EPO表達水平,檢測EPO對凋亡相關基因Bax,Bcl-2,PCNA在mRNA和蛋白表達水平的影響。免疫組化學檢測結果顯示,EPO在牦牛和黃牛腎臟中集合管上皮細胞、腎小管上皮細胞和小管周間質成纖維樣細胞中均呈陽性表達。qRT-PCR和Western blot結果顯示,EPO在牦牛腎臟中的表達量顯著高于黃牛(Plt;0.001)。隨后對生成EPO的RIFs進行原代培養并調控EPO的表達,結果表明:激活組顯著升高RIFs中Bcl-2和PCNA的表達,降低Bax的表達(Plt;0.001)。EPO抑制組顯著降低RIFs中Bcl-2、PCNA的表達,上調Bax的表達(Plt;0.001)。綜上表明,EPO在牦牛和黃牛腎臟中集合管上皮細胞、腎小管上皮細胞和小管周間質成纖維樣細胞中均呈陽性表達,牦牛腎臟中的EPO高表達能夠促進RIFs中Bcl-2和PCNA的表達,并降低Bax的表達,說明EPO可以在牦牛腎臟中起到抗凋亡的作用。
關鍵詞: 牦牛;促紅細胞生成素(EPO);腎間質成纖維細胞(RIFs);凋亡
中圖分類號:S823.85
文獻標志碼:A
文章編號:0366-6964(2024)08-3460-12
收稿日期:2024-01-09
基金項目:國家自然科學基金(32372974)
作者簡介:盧增華(1997-),男,甘肅民勤人,碩士生,主要從事動物組織學與胚胎學研究,E-mail:1763689878@qq.com
通信作者:崔 燕,主要從事動物比較組織學研究,E-mail:cuiyan369@sina.com
Effect of Erythropoietin on the Expression of Apoptotic Factor in Yak Renal Interstitial
Fibroblasts
LU" Zenghua1, CUI" Yan1,2*, YU" Sijiu1,2, BAI" Xuefeng1, LU" Hongqin1, HE" Junfeng1, LU" Kai1,
ZHAI" Guoliang1, QI" Zhengman1
(1.College of Veterinary Medicine, Gansu Agricultural University, Lanzhou 730070," China;
2.
Gansu Province Livestock Embryo Engineering Research Center, Lanzhou 730070, China)
Abstract:" The purpose of this study was to investigate the effect of erythropoietin (EPO) on apoptosis factors in yak renal interstitial fibroblasts (RIFs). Firstly, the kidney tissues of three3 healthy yaks and cattle aged 4 years were collected respectively, immunohistochemistry and Western blot were used to detect the exact distribution of EPO and its expression in the kidneys of yaks and calves. Meanwhile, the yak RIFs were identified by primary culture, and different drug treatments were applied to regulate the EPO expression level in the RIFs, and the effects of EPO on the apoptosis-related genes Bax, Bcl-2, and PCNA at mRNA and protein expression levels were detected. Immunohistochemical results showed that EPO was positively expressed in collecting duct epithelial cells, renal tubular epithelial cells, and peritubular mesenchymal fibroblast-like cells in the kidneys of both yaks and calves. qRT-PCR and Western blot results showed that the expression of EPO in the kidneys of yaks was significantly higher than that in the calves (Plt;0.001). Subsequently, the EPO-generating RIFs were cultured in primary culture and the expression of EPO was regulated, and the results showed that the activation group significantly elevated the expression of Bcl-2 and PCNA and decreased the expression of Bax in the RIFs (Plt;0.001).The EPO-inhibition group significantly decreased the expression of Bcl-2,PCNA and up-regulated the expression of Bax in the RIFs (Plt;0.001). In conclusion, it was showed that EPO was positively expressed in collecting duct epithelial cells, renal tubular epithelial cells and peritubular mesenchymal fibroblast-like cells in the kidney of yak and calf, and the high expression of EPO in the kidney of yak was able to promote the expression of Bcl-2 and PCNA and decrease the expression of Bax in the RIFs, which indicated that EPO could play an anti-apoptotic role in the kidney of yak.
Key words: yak; erythropoietin (EPO); renal interstitial fibroblasts (RIFs); apoptosis
*Corresponding author:CUI Yan, E-mail: cuiyan369@sina.com
EPO是一種糖蛋白激素,具有促進紅細胞生成的作用,是紅細胞生成過程及維持機體穩態的關鍵因子[1]。哺乳動物從胚胎發育到出生,EPO的分泌組織和器官不斷發生著變化,在胚胎中期時,EPO由神經組織分泌,在胚胎后期,EPO以旁分泌的方式由肝細胞開始分泌,刺激紅細胞的生成,出生后基本轉為腎臟[2]。具有EPO生成能力的細胞是腎間質成纖維細胞(renal interstitial fibroblast-like cells,RIFs)[3]。EPO在由腎臟分泌后進入血液,通過體循環系統到達骨髓,進而調控紅細胞的生成。EPO除了能夠刺激紅細胞的生成,也具有抗凋亡,抗氧化的作用。在臨床研究中發現,EPO不僅能通過抗凋亡作用保護組織免受缺血和再灌注損傷,還能拮抗促炎因子的活性,改善、促進損傷后的愈合和再生[4-6]。在另一項研究中也發現,EPO對由脂多糖誘導的內皮細胞凋亡具有較強的抑制作用[7]。有研究表明,長期的低氧環境可以引起腎功能嚴重受損,從而導致慢性腎炎、慢性間質性腎炎、腎病綜合征、無癥狀性蛋白尿等慢性疾病,而這都與細胞凋亡有著密切的關系[8-11]。然而,牦牛長期生活在高海拔低氧環境并未引起腎臟相關疾病,這是否與EPO對凋亡因子的調控有關,尚未有研究報道。
Bax和Bcl-2這兩對基因是細胞凋亡的一對相互調控的基因,Bcl-2蛋白主要通過凋亡途徑的阻斷抑制細胞凋亡的信號傳導,從而使細胞存活時間增長。而Bax可拮抗Bcl-2的影響,是促凋亡基因中的一種。其中細胞凋亡的關鍵調控因子Bcl-2及其相關蛋白是通過抑制Caspases蛋白酶的活性而抑制凋亡[12]。Bcl-2與Bax蛋白存在形成異源或同源二聚體的能力,發揮細胞凋亡作用是由Bcl-2/Bax蛋白的比例決定的[13]。增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)屬于細胞增殖相關的抗原,是真核生物DNA合成所必須的核蛋白,為DNA聚合酶的推動因子,與細胞的生長增殖密切相關[14]。
EPO參與了多種信號通路,發揮抗凋亡的作用。本研究試驗以牦牛和黃牛腎臟為研究對象,采用RT-qPCR、Western blot和免疫組織化學技術(IHC)證明了EPO在牦牛腎臟中的表達量顯著高于黃牛腎臟,并通過調控EPO的表達,明確了其對凋亡及增殖相關因子Bax、Bcl-2和PCNA的表達調控,進一步證明了EPO不僅可以調控凋亡分子機制,還可以抑制細胞凋亡的發生。揭示了牦牛在長期低氧環境下沒有發生凋亡引起的相關疾病的原因,也為凋亡類疾病的治療提供了重要的理論依據。
1 材料與方法
1.1 試驗樣品
在甘肅省甘南藏族自治州分別選取3頭4歲齡的健康牦牛和黃牛,進行屠宰,采集其腎臟組織樣品,放置于多聚甲醛和冰盒中帶回實驗室。
1.2 主要試劑和儀器
DMEM/Highg lucose購自Gibco公司;胰蛋白酶購自Sigma公司;胎牛血清購于Hyclone公司;CCK8試劑盒、兔抗CK18購自Bisso;EPO、Bax、Bcl-2和PCNA多克隆抗體和二抗均購自Affinity公司。鼠抗β-actin抗體購自于全式金;DMOG和IOX3均購自于MCE公司。
1.3 免疫組織化學檢測
牦牛和黃牛腎臟組織經4%多聚甲醛固定后,切成1 cm3的組織塊,制成4 μm厚度石蠟切片,用于免疫組織化學染色。石蠟切片經二甲苯和梯度酒精脫蠟水化,修復抗原,冷卻至室溫后,滴加內源性過氧化物阻斷劑,于37 ℃孵育15 min;隨后滴加血清封閉液,室溫孵育15 min;滴加一抗(EPO:1∶800,陰性對照用PBS代替),4 ℃孵育過夜;次日滴加生物素標記山羊抗兔IgG,37 ℃孵育15 min;滴加辣根酶標記鏈霉卵白素工作液于37 ℃溫箱孵育15 min;使用增強型二氨基聯苯胺(diaminobenzidine,DAB)顯色,自來水中終止顯色,依次進行蘇木精染色、分化、返藍、脫水、透明、封片和鏡檢。
1.4 牦牛RIFs的分離培養和活性檢測
將牦牛完整腎臟浸泡于含有青鏈霉素混合液的生理鹽水中,由屠宰場運輸至實驗室。剖開腎臟被膜后,分離出腎臟皮質并剪成約1 mm3小塊。每瓶12塊組織均勻鋪于細胞瓶底部,將細胞瓶背面朝上并在每瓶中加入2 mL的DMEM/HIGHGLUCOSE培養基。在37 ℃培養箱中靜置12 h,待組織塊貼壁后翻轉細胞瓶使組織塊浸入培養液后繼續培養。細胞從組織塊分裂出待貼壁融合率達到約90%后,用PBS洗去組織塊后按照1∶3比例傳代或凍存。
選取第三代RIFs進行細胞活性測定,以每孔5×103個的數量各接種于96孔板內,使用CCK-8檢測試劑對其進行染色,每隔24 h使用酶標儀進行OD值測定,共計測量7 d,每組設置3個重復。
1.5 細胞免疫熒光鑒定
用4%多聚甲醛對貼壁細胞固定30 min,0.5%的TritonX-100通透30 min,使用免疫熒光封閉液(BSA)室溫封閉3 h。分別滴加anti-CK18(1∶400),anti-Vimentin(1∶400)和anti-CD31(1∶400)后4 ℃孵育過夜。清洗后加山羊抗兔的熒光二抗(1∶250),37 ℃孵育1 h。滴加DAPI染液,室溫染色3 min。取出蓋玻片,封片,倒置顯微鏡下觀察結果。
1.6 藥物處理RIFs
用二甲基亞砜(dimethylsulfoxide, DMSO)溶解二甲基草酰甘氨酸IOX3和LW6;參考相關文獻及藥物說明書的IC50值,將藥物IOX3設置為25 μmol·mL-1、50 μmol·mL-1、75 μmol·mL-1和100 μmol·mL-1四個濃度梯度;LW6為5 μmol·mL-1、10 μmol·mL-1和20 μmol·mL-1三個濃度梯度。在對照組中,使用PBS替代藥物,其他操作與試驗組同步。
1.6.1 流式細胞
收集RIFs并用70%乙醇在4 ℃下固定過夜。將細胞懸浮在緩沖液中,濃度調整為3×105個·mL-1。細胞懸液和FITC標記AnnexinV混合,室溫孵育10 min后離心,PBS洗滌細胞,使用緩沖液重懸細胞,PI染色細胞5 min,流式細胞儀分析。
1.6.2 EdU染色
將配置好的EdU溶液加入細胞培養液中孵育2 h,之后對細胞進行固定,通透液通透10 min,PBS洗滌。進行Apollo染色,PBS洗滌之后,細胞核染色使用Hoechst染料。倒置熒光顯微鏡下觀察。
1.7 實時熒光定量PCR
將樣品置于冰盒上,使用細胞裂解液Trizol提取總RNA,按照反轉錄試劑盒說明書的步驟將其反轉成cDNA后進行實時熒光定量PCR(引物序列見表1)。反應體系為20 μL:10 μL SYBR Green Mix,8 μL ddH2O,1 μL cDNA,上、下游引物各0.5 μL。反應條件:95 ℃ 4 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 10 s,72 ℃ 5 min,40個循環。每個基因設置3個重復孔。用2-ΔΔCT法計算基因的mRNA相對表達量。
1.8 Western blot檢測
將樣品置于冰袋上進行蛋白裂解(1mL RIPA+10 μL RMSF),所提取的蛋白與4×蛋白buffer混合(3∶1),蛋白變性。8 μL蛋白樣品進行SDS-PAGE凝膠電泳,濕轉法將其蛋白轉移至PVDF膜上,5%脫脂牛奶室溫封閉3 h,將anti-EPO(1∶800)、anti-Bax(1∶800)、anti-Bcl-2(1∶1 000)、anti-PCNA(1∶1 000)與PVDF膜共同孵育,4 ℃過夜。二抗(1∶2 500)室溫孵育1 h,使用ECL化學發光試劑盒顯影。每組重復測定3次,ImageJ軟件對Western blot條帶進行分析。
1.9 數據統計分析
所有測定數據以“平均值±標準誤(SEM)”表示,SPSS 20.0用于分析數據是否符合正態分布和方差齊性,使用單因素(ANOVA)Duncan法進行比較分析,統計顯著性以 * 表示,*表示Plt;0.05;**表示Plt;0.01;***表示Plt;0.001;ns表示不具有統計學意義。
2 結 果
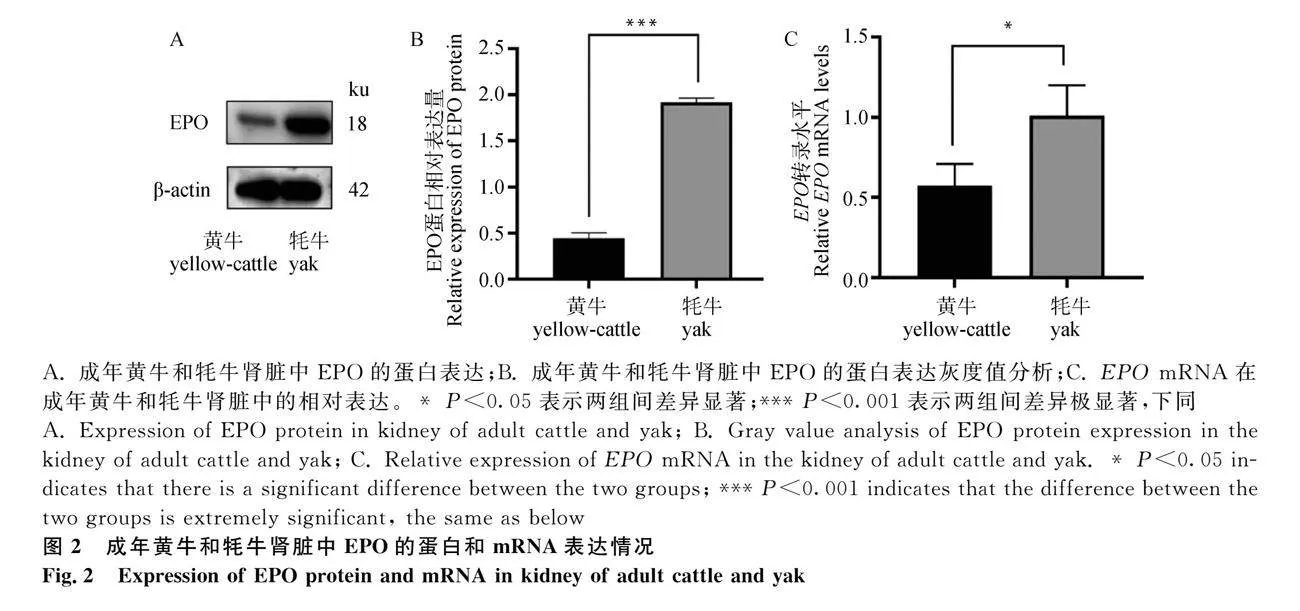
2.1 EPO在成年黃牛和牦牛腎臟中的定位及表達
2.1.1 免疫組織檢測
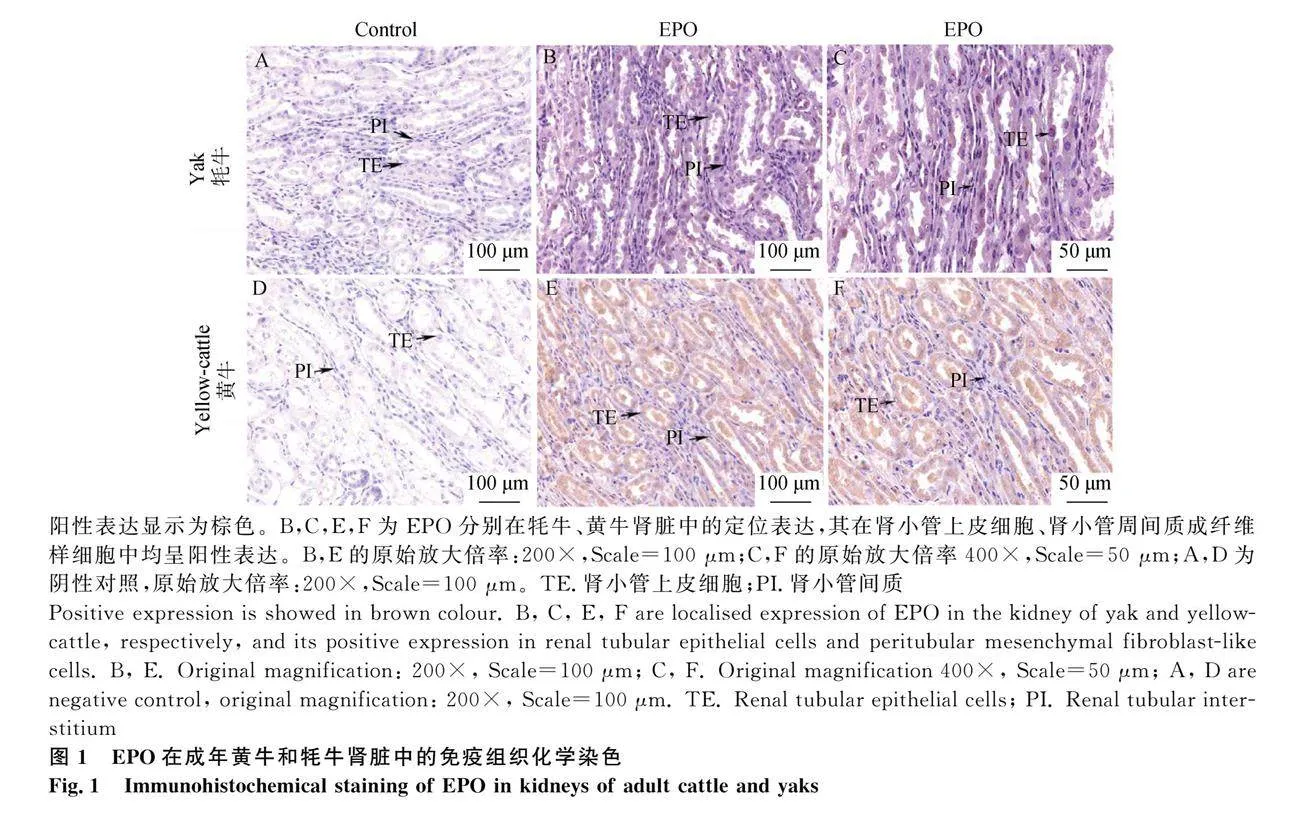
選取健康的腎臟組織用于免疫組織化學檢測。結果顯示(圖1),EPO在成年牦牛和黃牛腎臟中均呈陽性表達,主要表達于腎小管上皮細胞、集合管上皮細胞、腎小管周間質成纖維樣細胞。
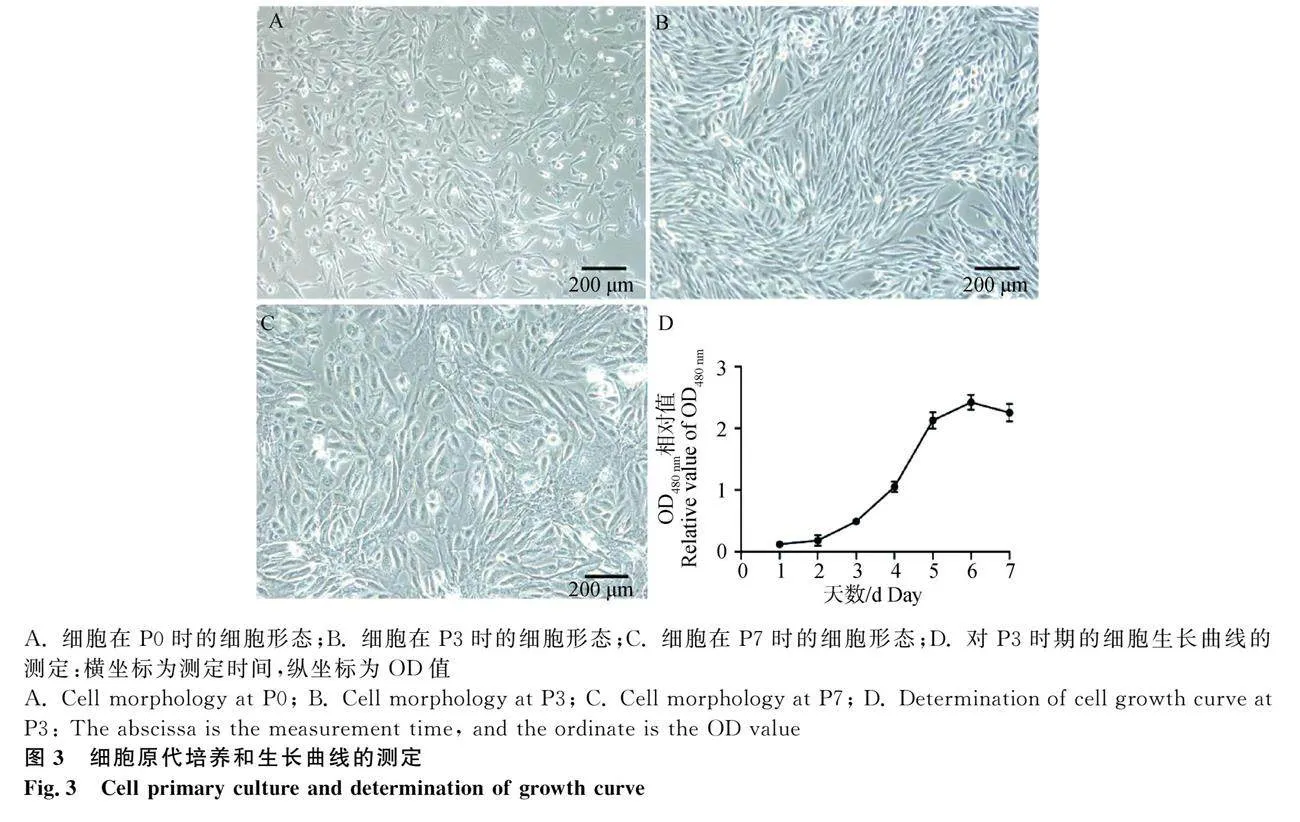
2.2 腎間質成纖維細胞的原代培養和活性檢測
對腎間質成纖維細胞進行原代培養。培養的細胞形似紡錘狀或不規則的三角形(圖3A)。在傳至第三代時,細胞狀態最為良好,細胞呈克隆樣集落生長,增殖速度較快(圖3B)。但在培養至第七代時,細胞形態發生變化,其細胞核增大,部分細胞出現空泡,且增殖速度較慢,這表明細胞開始老化,不再適合用作試驗材料(圖3C)。
選用狀態良好的第三代細胞進行活性檢測,使用Cell Counting Kit-8(CCK-8)試劑盒進行細胞生長曲線測定(圖3D)。原代細胞在培養1~2天時,增殖速度較為緩慢,在第3天時,細胞呈指數生長,直到第5天,細胞進入平臺期,增殖速度下降,且在第7天時,由于細胞鋪滿皿底,融合率達到95%以上,開始出現接觸抑制,部分細胞死亡,出現細胞數量下降的情況。
2.3 腎間質成纖維細胞的鑒定
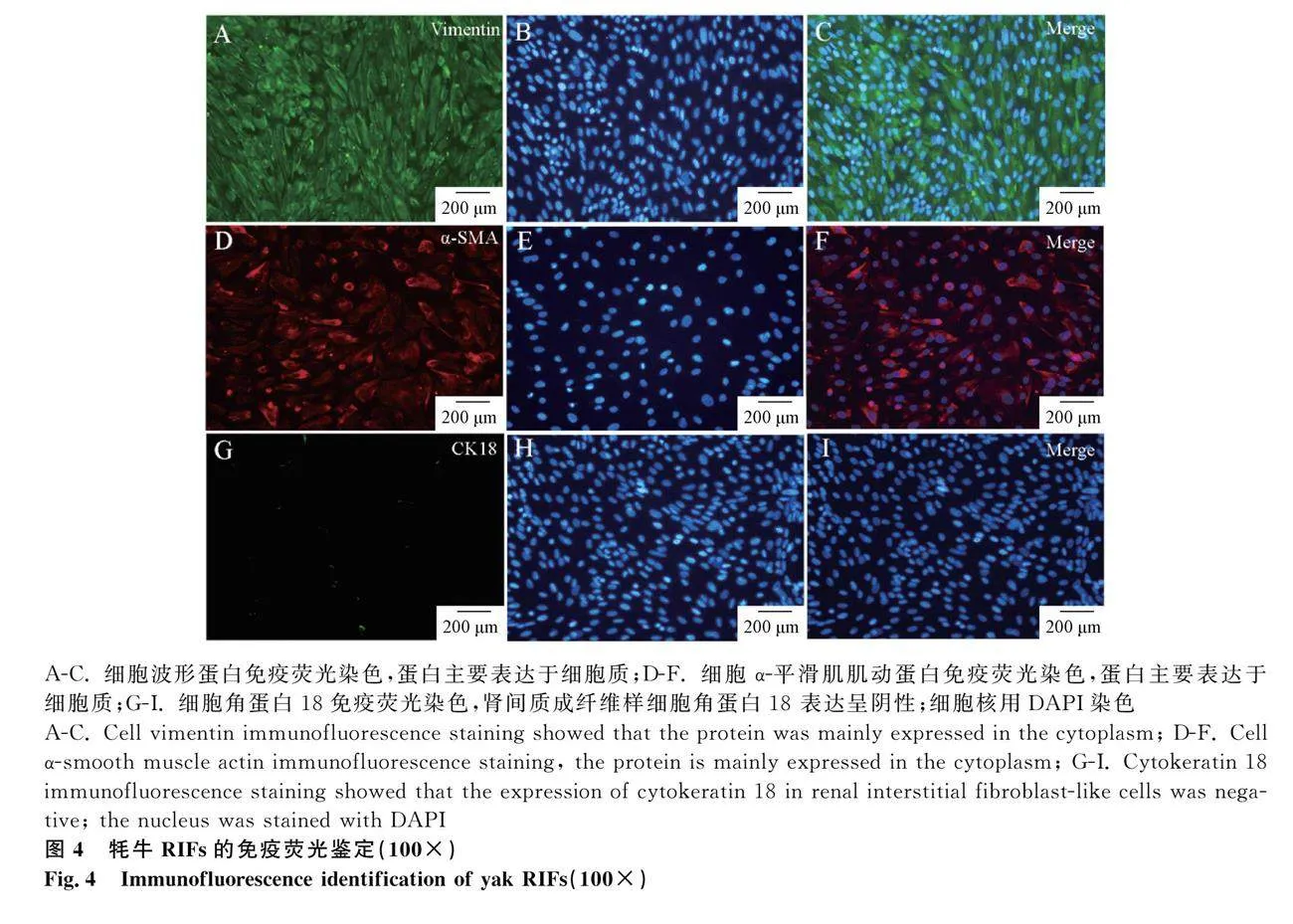
對所培養的細胞進行細胞免疫熒光檢測,為鑒定所培養的是否存在和腎小管上皮細胞雜糅的情況。選取上皮細胞的特異性標志蛋白CK18為對照組,成纖維細胞的特異性蛋白Vimentin和α-SMA為試驗組。Vimentin和α-SMA在所培養的細胞骨架上呈陽性表達且熒光信號較強(圖4C、F),CK18呈陰性表達(圖4I)。試驗結果表明,通過原代培養與純化,獲得了純度較高的牦牛RIFs,可用于后續試驗。
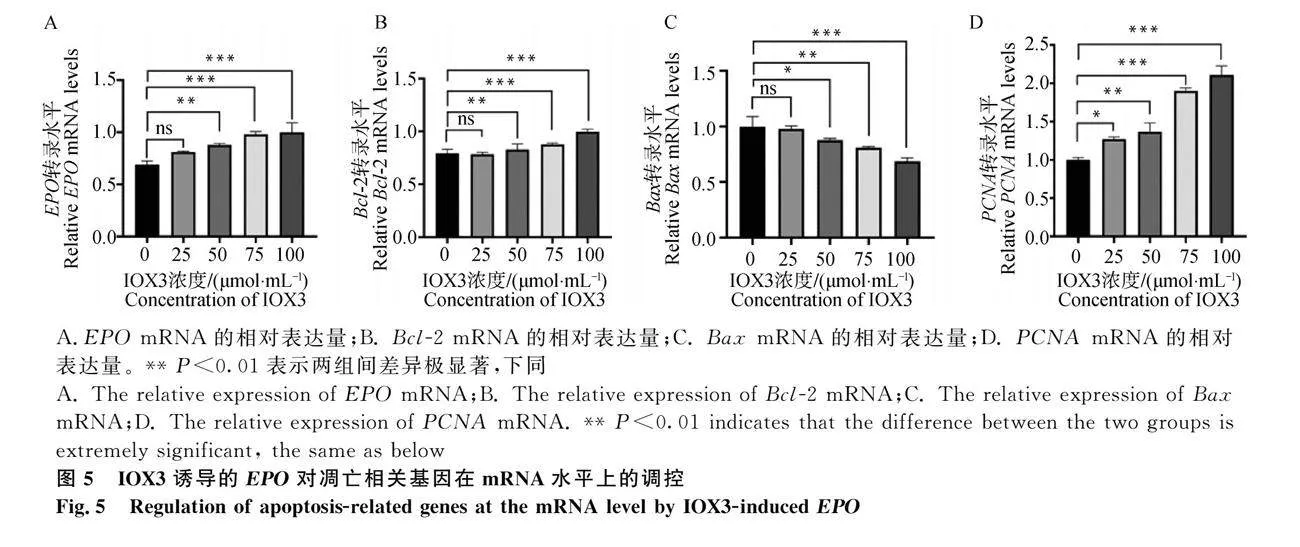
2.4 IOX3誘導的EPO對凋亡相關基因及蛋白的影響
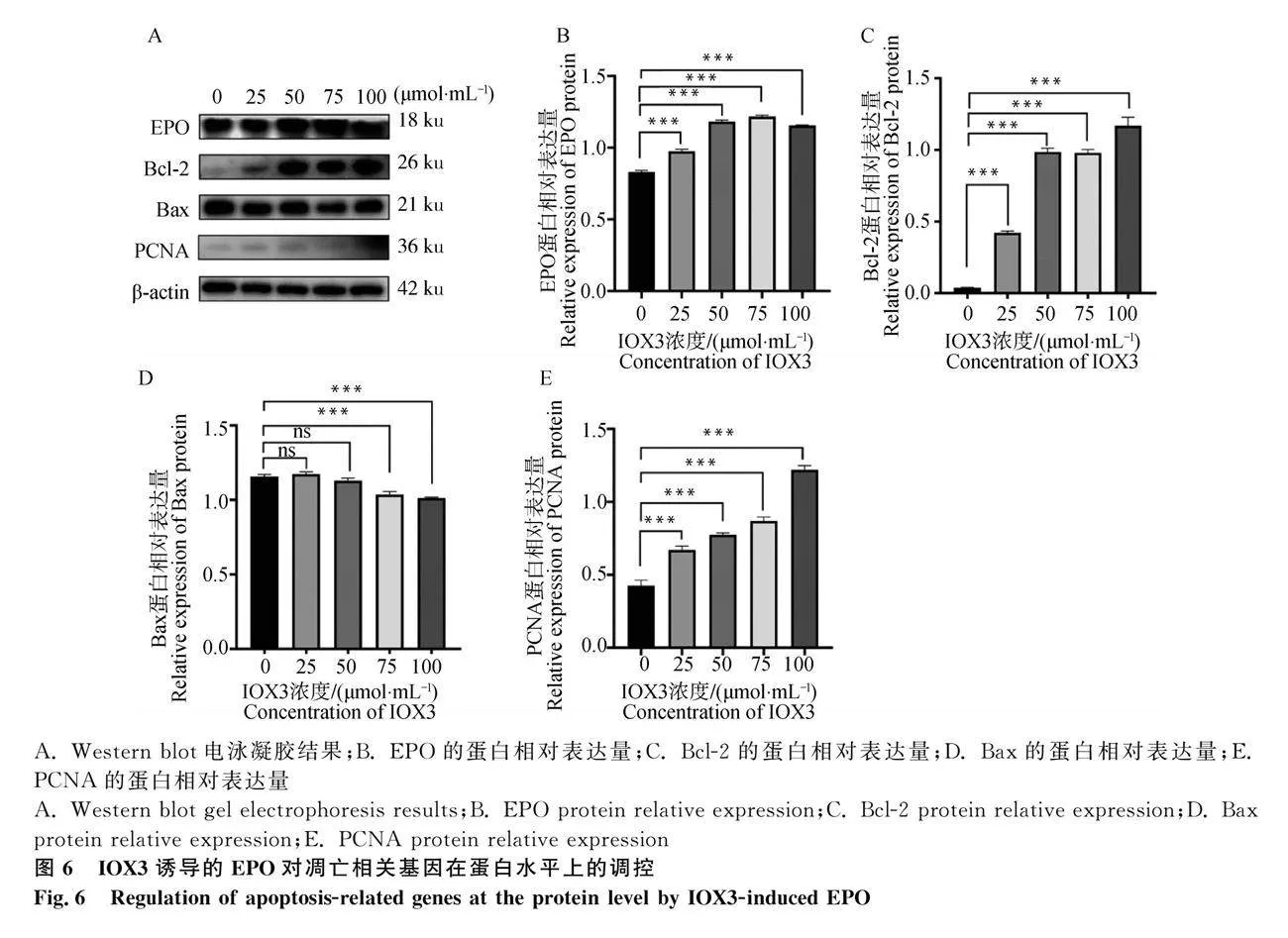
本研究選用IOX3為EPO的激活劑,它可以促進EPO生成和胎兒血紅蛋白的表達。藥物濃度的選用根據說明書推薦范圍設置成4個濃度(25μmol·mL-1、50μmol·mL-1,、75μmol·mL-1和100μmol·mL-1),并對EPO和凋亡相關基因進行mRNA和蛋白水平的檢測。mRNA表達水平如圖5所示,與對照組相比,隨著藥物誘導濃度的增加,EPO的mRNA表達水平逐漸升高,且呈劑量依賴性,在100μmol·mL-1時達到最大值(Plt;0.001)。Bcl-2和PCNA的mRNA表達水平也隨著藥物濃度的升高而上調,而Bax的mRNA表達水平在試驗組的表達水平極顯著地低于對照組(Plt;0.0001)。試驗結果表明:IOX3成功誘導了EPO在mRNA水平上的高表達,且EPO的表達上調對Bcl-2和PCNA在mRNA水平的表達有促進作用,對Bax在mRNA水平的表達有抑制作用。
為進一步驗證EPO過表達后對Bax、Bcl-2和PCNA在蛋白水平上的調控作用,采用Western blot技術檢測相關蛋白表達情況。由圖6可知,EPO、Bcl-2和PCNA在試驗組的蛋白表達量極顯著高于對照組(Plt;0.001)。而Bax在試驗組的蛋白表達量極顯著低于對照組(Plt;0.001)。試驗結果表明:IOX3成功誘導了EPO在蛋白水平的高表達,且EPO的表達上調對Bcl-2和PCNA蛋白的表達有促進作用,對Bax蛋白的表達有抑制作用。
2.5 LW6抑制EPO在RIFs中對凋亡相關基因及蛋白的影響
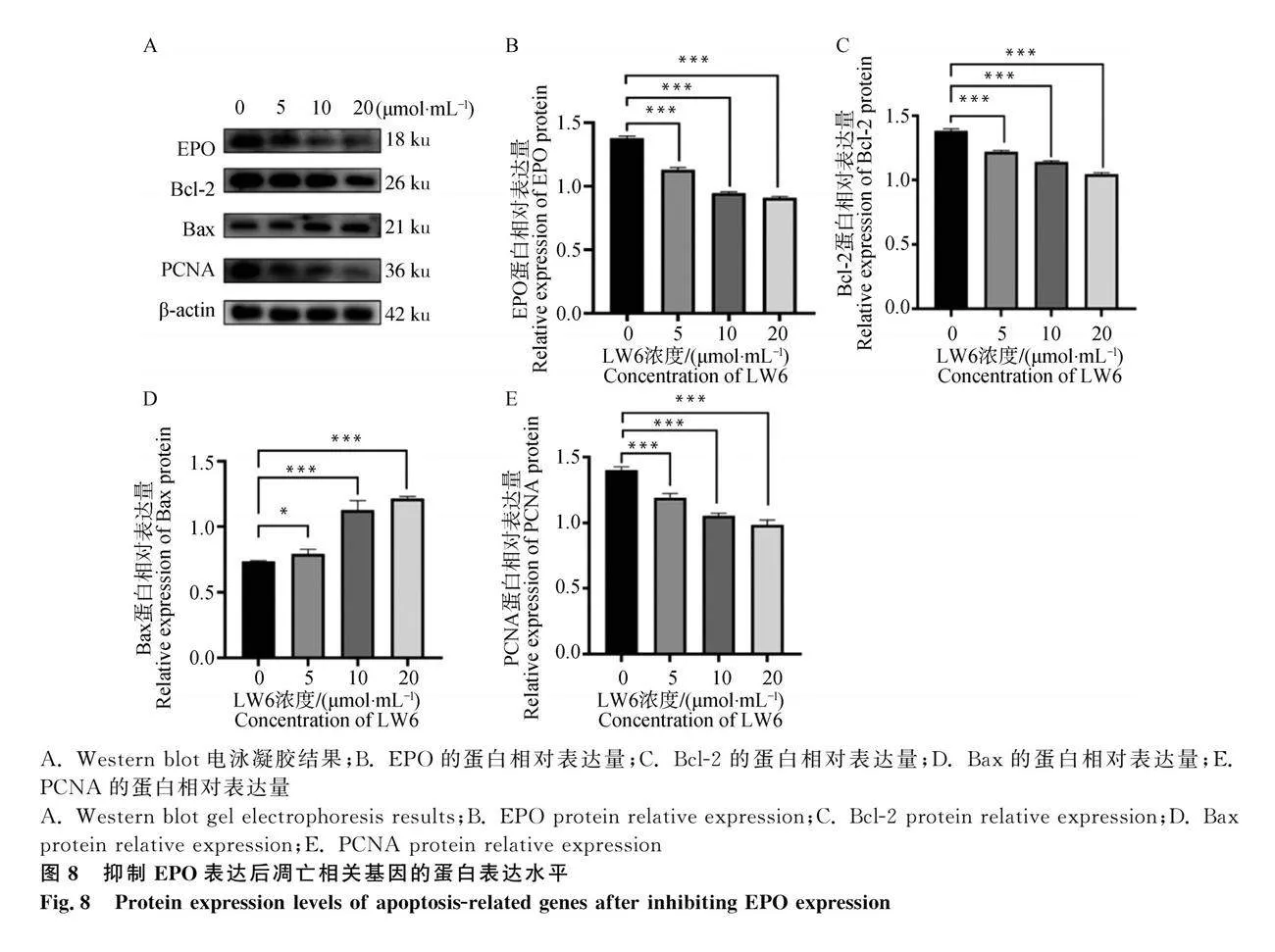
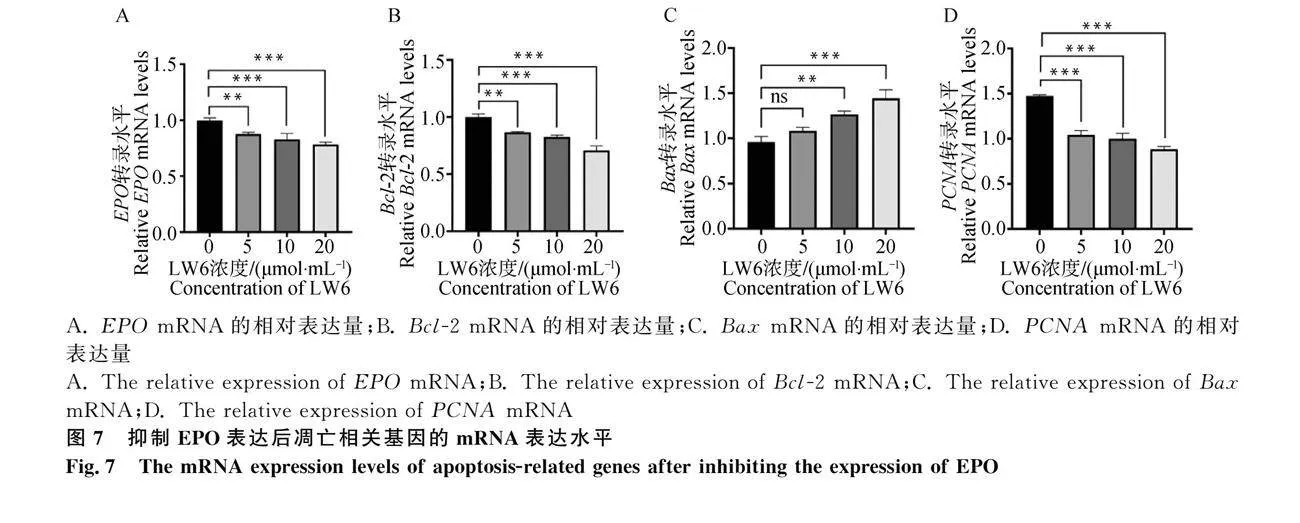
上述結果證明了IOX3誘導的EPO發揮抗凋亡作用。為保證試驗結果的準確性,我們使用EPO的抑制劑LW6處理RIFs。藥物濃度設定根據所推薦的濃度設置為3個藥物梯度,分別為5μmol·mL-1,、10μmol·mL-1和20μmol·mL-1 。藥物處理結果如圖7所示,與對照組相比隨著LW6濃度的增加,EPO、Bcl-2和PCNA的mRNA水平在試驗組的表達極顯著低于對照組(Plt;0.001),而Bax的mRNA水平在試驗組的表達極顯著高于對照組(Plt;0.001)。
隨后我們又檢測了EPO、Bcl-2、Bax和PCNA蛋白的相對表達水平。由圖8可知,EPO、Bcl-2和PCNA在試驗組的蛋白表達量極顯著低于對照組(Plt;0.001)。而Bax在試驗組的蛋白表達量極顯著高于對照組(Plt;0.001)。試驗結果表明:LW6也抑制了EPO在蛋白水平的表達,且EPO的表達下調對Bcl-2和PCNA蛋白的表達有抑制作用,對Bax蛋白的表達有促進作用。試驗結果表明:LW6成功的抑制了EPO在mRNA和蛋白水平上的表達,且EPO的表達下調對Bcl-2和PCNA的表達有抑制作用,對Bax的表達有促進作用。
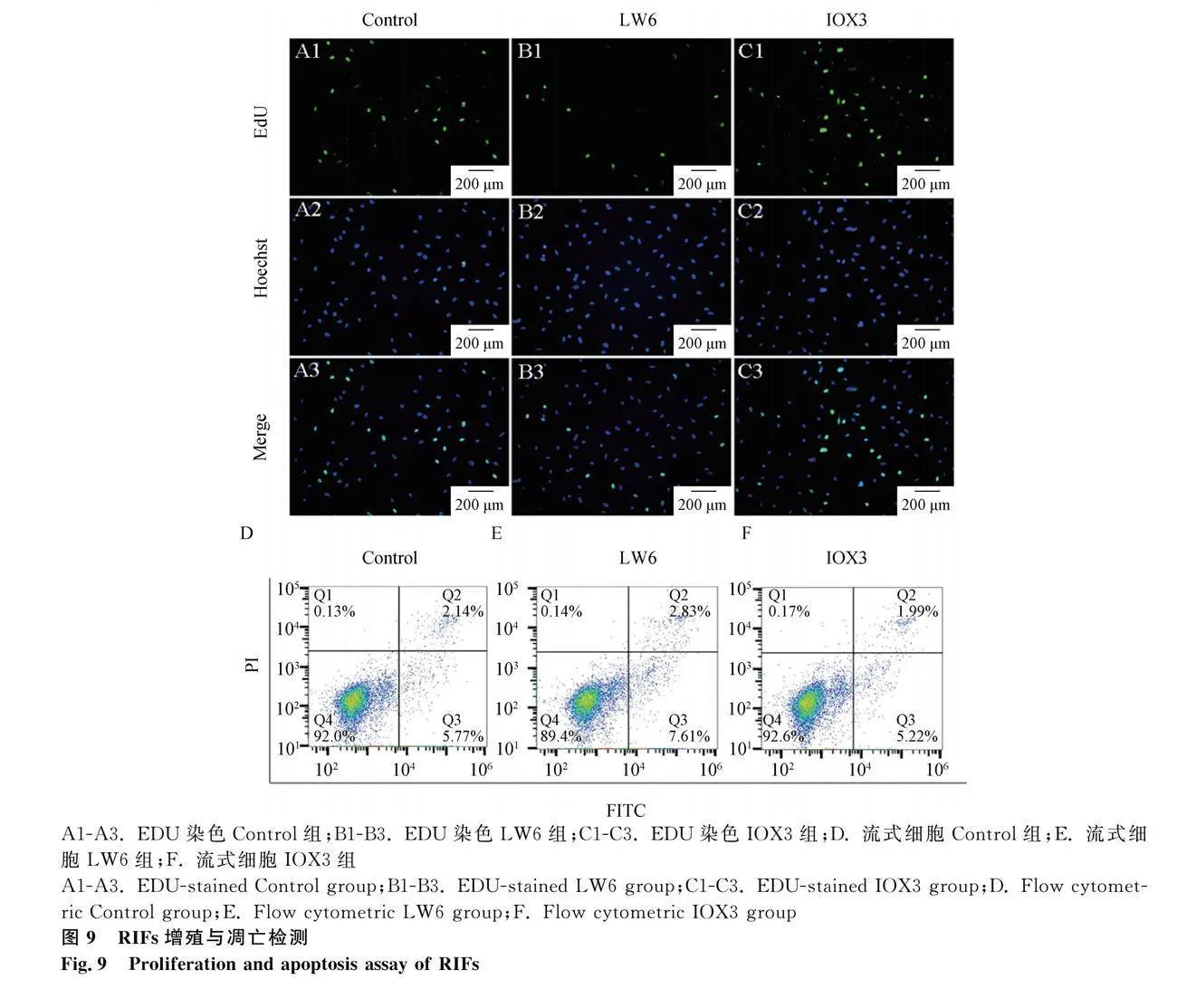
2.6 EPO對牦牛RIFs凋亡和增殖的影響
上述結果表明藥物IOX3、LW6可以激活或抑制EPO的表達。我們用不同濃度的IOX3(100 μmol·mL-1)和LW6(20 μmol·mL-1)分別處理RIFs,檢測其凋亡和增殖的發生情況。EdU染色表明,Control組細胞沒有發生明顯的增殖,IOX3組細胞增殖相對對照組增加,而LW6組的細胞增殖降低(圖9A1-C3)。通過流式細胞術進一步檢測IOX3和LW6對腎間質成纖維細胞凋亡的影響,結果顯示,Control組的凋亡率為7.91%;IOX3組的凋亡率為7.21%;LW6組的凋亡率為10.44%(圖9D、E、F)。這與蛋白和基因表達數據結果相一致,說明EPO在牦牛RIFs中起到抗凋亡的作用。
3 討 論
腎臟作為動物泌尿系統重要的組成部分之一,在高原動物低氧適應性中發揮著重要的作用。研究表明,在貧血或缺氧等應激條件下,機體需要適應低氧的條件,以維持各機能的正常運行,紅細胞數量相應增多[15-16]。EPO作為調控紅細胞生成的核心因子,對于高原動物在低氧環境中的適應性至關重要,表達失調通常會導致各種病理結果[17-18]。對于身處低氧環境中的牦牛而言,紅細胞數量的增多是其適應不利環境重要方式之一。由于體內的紅細胞數量增多不僅要保障正常的供氧量,還要避免出現紅細胞過度增多引起的臨床癥狀。因此,EPO對紅細胞生成的調控必須十分精確。除此之外,EPO還具有抗凋亡功能。相關研究表明,它是一種具有抗凋亡活性的細胞因子,可有效緩解由缺血缺氧導致的腎損傷等疾病[19-20]。然而,牦牛長期生活在高海拔低氧環境下卻未發現相關腎臟疾病。因此,我們推測EPO可能在牦牛腎臟中的抗凋亡功能是一重要因素。本研究通過對牦牛和黃牛的對比,發現EPO在腎內的集合管上皮細胞、腎小管上皮細胞和腎間質成纖維細胞中均有陽性表達,這一結果與EPO在其他哺乳動物腎臟中表達分布結果一致[21-22]。但在表達水平上,我們發現,牦牛腎內EPO的表達量顯著高于黃牛。其機制可能是在低氧條件下促進了缺氧誘導因子的表達上調,從而導致了腎臟中EPO的產生增加[23]。有研究表明,一定濃度的重組人促紅細胞生成素對內皮細胞凋亡具有較大的抑制作用,其體現為對腎臟一種保護性的效果[24-25]。
細胞凋亡是細胞在一定的生理或病理條件下主動的、程序化的死亡過程,受多種基因精確調控,是機體重要的自穩調節機制[26]。通過大量學者研究表明,線粒體通路在細胞凋亡機制中起著至關重要的作用,其中Bcl-2等抗凋亡因子及Bax、Cyto-C等促凋亡因子在細胞凋亡線粒體途徑中起著關鍵作用。研究發現,通常情況下Bcl-2和Bax兩種蛋白的表達量相對穩定,而當Bax在細胞內高表達時,Bax/Bax同源二聚體的數量大量上升,細胞產生死亡信號,啟動凋亡;而當Bcl-2高表達時,則Bax/Bax二聚體大量解離,發揮抗凋亡的作用,使細胞存活期延長[27-28]。PCNA是真核細胞合成所必需的一種核蛋白,研究表明,PCNA的表達及合成與細胞增生周期有關。G1期PCNA表達逐漸升高,在S期達到頂峰。因此,PCNA表達高低能準確地反映細胞的生長狀態,其表達上調促進細胞的增殖[29]。
EPO不僅作為一種促紅細胞生成因子,還可以抑制腫瘤細胞凋亡并促進其生長[30]。既往的研究表明,EPO通過與其受體(EPOR)結合,抑制了PI3K/Akt信號通路的激活,從而抑制細胞凋亡,從而發揮糾正貧血的作用[31]。有研究表明,促紅細胞生成素可以抑制人腎小球系膜細胞的凋亡,而該抑制作用與其濃度水平相關[32]。有研究證明,EPO顯著抑制脂多糖誘導的內皮細胞單層凋亡,其作用機制是上調了Bcl-2的表達,同時下調了Bax的表達[33]。在大鼠腦出血病理模型中,注射外源EPO后,檢測到正常大鼠海馬組織中Bcl-2的表達量明顯低于腦出血組,TUNEL法檢測發現,注射組中凋亡細胞數量明顯低于腦出血組,結果證實了rhEPO具有抗凋亡作用[34]。此外,在糖尿病小鼠模型中,EPO在胰島內也能夠發揮抗凋亡、促增殖的作用,從而對胰島細胞產生保護作用[35]。此外,在癲癇大鼠的病理模型中,EPO對癲癇大鼠神經細胞凋亡的抑制作用可以通過激活TGF-β/Smad信號通路來實現,從而緩解神經元凋亡,改善癲癇癥狀,結果證實了EPO具有抗凋亡作用[36]。本試驗中,藥物IOX3能夠激活牦牛RIFs中EPO的高表達,且隨著IOX3濃度的增加,EPO的表達水平逐漸升高,且呈劑量依賴性;藥物LW6能夠抑制牦牛RIFs中EPO的表達,與對照組相比隨著LW6濃度的增加,EPO的表達水平顯著低于對照組。EPO高表達組能夠顯著地促進RIFs中Bcl-2和PCNA的表達,降低Bax的表達;細胞凋亡率下降,細胞增殖率增加。EPO抑制組能夠顯著地抑制RIFs中Bcl-2和PCNA的表達并促進Bax的表達。還有研究發現,在不同濃度時,EPO以劑量依賴性的方式促進牙髓細胞增殖[37]。以上研究結果表明,EPO在不同物種和病理模型中都具有抗凋亡和促增殖的作用,但是其具體的信號傳導通路與作用途徑,仍需進一步的試驗研究來論證。本研究選用IOX3和LW6藥物處理牦牛RIFs,從而導致EPO的激活和抑制。研究結果表明,當EPO的表達量出現變化時,細胞凋亡率也隨之變化,并調控Bcl-2、PCNA和Bax的表達水平。這表明EPO可以在牦牛腎臟中起到抗凋亡的作用。
4 結 論
本研究結果表明,EPO主要分布于牦牛和黃牛腎臟中的腎小管上皮細胞和小管周間質成纖維樣細胞中,且EPO在牦牛腎內的表達顯著高于黃牛。EPO激活組能夠顯著地促進RIFs中Bcl-2和PCNA的表達,降低Bax的表達;細胞凋亡率下降,細胞增殖增加。EPO抑制組能夠顯著地抑制RIFs中Bcl-2和PCNA的表達并促進Bax的表達。細胞凋亡率上升,細胞增殖下降。這表明EPO在牦牛RIFs中起到抗凋亡的作用。
參考文獻(References):
[1] JELKMANN W.Physiology and pharmacology of erythropoietin[J].Transfus Med Hemother,2013,40(5):302-309.
[2] 李 慧.低氧條件下成年牦牛腎間質成纖維樣細胞中EPO的適應性調控研究[D].蘭州:甘肅農業大學,2020.
LI H.Adaptive regulation of EPO in adult yak renal interstitial fibroblasts-like cells under hypoxia[D].Lanzhou:Gansu Agricultural University,2020.(in Chinese)
[3] SUZUKI N.Erythropoietin gene expression:developmental-stage specificity,cell-type specificity,and hypoxia inducibility[J]. Tohoku J Exp Med,2015,235(3):233-240.
[4] REN C C,ZHU W,WANG Q W,et al.The renal protect function of erythropoietin after release of bilateral ureteral obstruction in a rat model[J].Clin Sci (Lond),2018,132(18):2071-2085.
[5] HAN X P,ZHANG F Q,TAN X S,et al.EPO modified MSCs can inhibit asthmatic airway remodeling in an animal model[J].J Cell Biochem,2018,119(1):1008-1016.
[6] 朱國萍,婁 陽,徐 沖.Bcl-2蛋白家族與細胞凋亡[J].細胞生物學雜志,2001,23(1):20-23.
ZHU G P,LOU Y,XU C.Bcl-2 protein family and apoptosis[J].Journal of Cell Biology,2001,23(1):20-23.(in Chinese)
[7] 龐 睿.重組人促紅細胞生成素抑制內皮細胞凋亡的實驗研究[J].科學技術創新,2019,17(10):66-67.
PANG R.Experimental study on the inhibition of endothelial cell apoptosis by recombinant human erythropoietin[J].Scientific and Technological Innovation,2019,17(10):66-67.(in Chinese)
[8] NEKOUI A,DEL CARMEN ESCALANTE TRESIERRA V,ABDOLMOHAMMADI S,et al.Neuroprotective effect of erythropoietin in postoperation cervical spinal cord injury:case report and review[J].Anesthesiol Pain Med,2015,5(6):e28849.
[9] SINGH A K,KOLLIGUNDLA L P,FRANCIS J,et al.Detrimental effects of hypoxia on glomerular podocytes[J].J Physiol Biochem,2021,77(2):193-203.
[10] CIANCI R,SIMEONI M,CIANCI E,et al.Stem cells in kidney ischemia:from inflammation and fibrosis to renal tissue regeneration[J].Int J Mol Sci,2023,24(5):4631.
[11] NASU K,KAWAKAMI T,SHINOHARA A,et al.Munc18-1-interacting protein 3 mitigates renal fibrosis through protection of tubular epithelial cells from apoptosis[J].Nephrol Dial Transplant,2020,35(4):576-586.
[12] ADAMS J M,CORY S.The Bcl-2 protein family:arbiters of cell survival[J].Science,1998,281(5381):1322-1326.
[13] 羅文捷,張啟芳,孟云超,等.骨髓間充質干細胞對潰瘍性結腸炎小鼠受損腸黏膜修復作用的探究[J].安徽醫科大學學報,2019,54(12):1882-1887.
LUO W J,ZHANG Q F,MENG Y C,et al.Effect of bone marrow mesenchymal stem cells on the repair of damaged intestinal mucosa in mice with ulcerative colitis[J].Acta Universitatis Medicinalis Anhui,2019,54(12):1882-1887.(in Chinese)
[14] 宋楠萌,桑建利,徐 恒.增殖細胞核抗原(PCNA)的分子結構及其生物學功能研究進展[J].自然科學進展,2006,16(10):1201-1209.
SONG N M,SANG J L,XU H.Advances in molecular structure and biologicalfunction of proliferating cell nuclear antigen (PCNA)[J].Progress in Natural Science,2006,16(10):1201-1209.(in Chinese)
[15] PALIEGE A,ROSENBERGER C,BONDKE A,et al.Hypoxia-inducible factor-2α-expressing interstitial fibroblasts are the only renal cells that express erythropoietin under hypoxia-inducible factor stabilization[J].Kidney Int,2010,77(4):312-318.
[16] 錢慶元,潘錦超,楊 軍,等.不同缺氧干預對低壓低氧模型鼠血氣及紅細胞相關指標的影響[J].浙江大學學報(醫學版),2023,52(6):777-784.
QIAN Q Y,PAN J C,YANG J,et al.Effect of different hypoxic and hypobaric interventions on blood gas and erythrocyte-related indicators in rats[J].Journal of Zhejiang University (Medical Sciences),2023,52(6):777-784.(in Chinese)
[17] HAASE V H.HIF-prolyl hydroxylases as therapeutic targets in erythropoiesis and iron metabolism[J].Hemodial Int,2017, 21(S1):S110-S124.
[18] SUZUKI N,YAMAMOTO M.Roles of renal erythropoietin-producing (REP) cells in the maintenance of systemic oxygen homeostasis[J].Pflugers Arch Eur J Physiol,2016,468(1):3-12.
[19] SANKARAN V G,WEISS M J.Anemia:progress in molecular mechanisms and therapies[J].Nat Med,2015,21(3):221-230.
[20] VICTOR S,ROCHA-FERREIRA E,RAHIM A,et al.New possibilities for neuroprotection in neonatal hypoxic-ischemic encephalopathy[J].Eur J Pediatr,2022,181(3):875-887.
[21] SEMENZA G L.Involvement of oxygen-sensing pathways in physiologic and pathologic erythropoiesis[J].Blood, 2009, 114(10):2015-2019.
[22] 楊 歡,石玉紅,冉海鳳,等.促紅細胞生成素的生理功能及生成來源[J].中國臨床藥理學與治療學,2021,26(4):434-443.
YANG H,SHI Y H,RAN H F,et al.Erythropoietin′s biological function and source [J].Chinese Journal of Clinical Pharmacology and Therapeutics,2021,26(4):434-443.(in Chinese)
[23] 姚一凡,張伊陽,董仕慧,等.低氧下牦牛、黑白花牛腎間質成纖維細胞PDK1、Smad2、Caspase3等因子表達差異研究[J].核農學報,2023,37(7):1335-1343.
YAO Y F,ZHANG Y Y,DONG S H,et al.Differential expression of PDK1,Smad2 and Caspase3 in renal interstitial fibroblasts of Yak and Holstein under hypoxia[J].Journal of Nuclear Agricultural Sciences,2023,37(7):1335-1343.(in Chinese)
[24] 張 晶,張承英.抗EPO抗體特性、分類及其相關純紅細胞再生障礙性貧血的發病機制及診治進展[J].武警醫學,2018,29(12):1169-1172.
ZHANG J,ZHANG C Y.Latest diagnosis of pure red cell aplastic anemia related to anti-EPO antibodies[J].Medical Journal of the Chinese Peoples Armed Police Forces,2018,29(12):1169-1172.(in Chinese)
[25] 李晶晶,伍 超,柯 慧,等.腎虛免疫低下大鼠EPO的變化及右歸飲與外源性EPO的逆轉作用[J].中國中藥雜志,2019,44(6):1246-1257.
LI J J,WU C,KE H,et al.Changes of EPO in rats with chronic renal failure and low immunity and reversal effects of Yougui Yin and exogenous EPO[J].China Journal of Chinese Materia Medica,2019,44(6):1246-1257.(in Chinese)
[26] 董雅潔,高維娟.bcl-2、bax、caspase-3在細胞凋亡中的作用及其關系[J].中國老年學雜志,2012,32(21):4828-4830.
DONG Y J,GAO W J.The role of bcl-2,bax,caspase-3 in apoptosis and their relationship[J].Chinese Journal of Gerontology,2012,32(21):4828-4830.(in Chinese)
[27] TSUKAHARA S,YAMAMOTO S,TIN-TIN-WIN-SHWE,et al.Inhalation of low-level formaldehyde increases the Bcl-2/Bax expression ratio in the hippocampus of immunologically sensitized mice[J].Neuroimmunomodulation,2006,13(2):63-68.
[28] 劉大銳,李報春,李懷東.細胞凋亡核心基因Caspase家族的研究進展[J].中國醫藥導刊,2020,22(11):800-805.
LIU D R,LI B C,LI H D.Research progress in Caspase family of apoptosis core gene[J].Chinese Journal of Medicinal Guide,2020,22(11):800-805.(in Chinese)
[29] AYMONNIER K,BOSETTA E,LEBORGNE N G F,et al.G-CSF reshapes the cytosolic PCNA scaffold and modulates glycolysis in neutrophils[J].J""" Leukocyte Biol,2024,115(2):205-221.
[30] VTSVEEN T K,SPONAAS A M,TIAN E M,et al.Erythropoietin (EPO)-receptor signaling induces cell death of primary myeloma cells in vitro[J].J Hematol Oncol,2016,9(1):75.
[31] 牟云鴻.促紅細胞生成素對高糖環境下系膜細胞凋亡的影響及其可能機制[D].南昌:南昌大學,2019.
MOU Y H.Effect of EPO on high glucose-cultured apoptosis of human glomerular mesangial cells and its possible mechanisms[D].Nanchang:Nanchang University,2019.(in Chinese)
[32] YI X Y,YAN W H,GUO T L,et al.Erythropoietin mitigates diabetic nephropathy by restoring PINK1/Parkin-mediated Mitophagy[J].Front Pharmacol,2022,13:883057.
[33] WARREN J S,ZHAO Y,YUNG R,et al.Recombinant human erythropoietin suppresses endothelial cell apoptosis and reduces the ratio of Bax to Bcl-2 proteins in the aortas of apolipoprotein E-deficient mice[J].J Cardiovasc Pharmacol,2011,57(4): 424-433.
[34] 潘廣艷.重組人促紅細胞生成素對腦出血大鼠認知功能及海馬組織凋亡相關因子Bcl-2、Bax表達的影響[D].遵義:遵義醫科大學,2020.
PAN G Y.Effects of recombinant human erythropoietin on cognitive function and expression of apoptosis-related factors Bcl-2 and Bax in hippocampus of rats with intracerebral hemorrhage[D].Zunyi:Zunyi Medical University,2020.(in Chinese)
[35] CHOI D,SCHROER S A,LU S Y,et al.Erythropoietin protects against diabetes through direct effects on pancreatic β cells[J].J Exp Med,2010,207(13):2831-2842.
[36] PAN X X,GONG X Q,PAN L L,et al.Erythropoietin relieves neuronal apoptosis in epilepsy rats via TGF-β/Smad signaling pathway[J].Cell Mol Biol (Noisy-le-grand),2023,69(10):239-243.
[37] 殷亮亮,李春年.EPO對低氧狀態下牙髓細胞增殖和保護的實驗研究[J].河北醫科大學學報,2021,42(7):765-769.
YIN L L,LI C N.Experimental study of EPO on proliferation and protection of dental pulp cells under hypoxia[J].Journal of Hebei Medical University,2021,42(7):765-769.(in Chinese)
(編輯 郭云雁)

