枳DREB基因家族的鑒定及其對非生物脅迫的響應


摘要:為了解枳(Poncirus trifoliata)DREB基因家族參與非生物脅迫的調控機制,基于枳基因組數據,利用生物信息學方法對枳DREB基因家族成員(PtrDREB)進行全基因組鑒定,討論PtrDREB各基因的物種進化關系及各基因在不同組織中的表達模式,并用 qRT-PCR 技術檢測9個PtrDREB家族成員在非生物脅迫處理下的相對表達量。結果表明,從枳基因組中共鑒定出48個DREB成員,不均勻地分布在9條染色體上,這些DREB成員編碼的蛋白質氨基酸序列長度范圍為144~639 aa,相對分子量范圍為15 638.35~76 776.34 u,等電點的范圍為4.72~9.62,均為親水性蛋白;34個PtrDREB亞細胞定位于細胞核中;48個PtrDREB基因分為5個亞族;DREB基因的啟動子順式作用元件含有大量光響應、植物激素、非生物脅迫及植物生長發育響應元件;DREB基因家族在不同組織中的表達具有明顯差異,在根、果實、葉片、胚珠、種子和幼芽中高表達的基因數目分別為17、13、4、4、6、8個;qRT-PCR數據表明,在經過低溫、高溫和干旱處理后,9個PtrDREB基因中分別有8、6、1個基因上調表達,上調幅度分別為1.27~5.85、1.44~2.05、2.06倍,因此推測PtrDREB家族成員在非生物脅迫中可能發揮重要的調控作用。
關鍵詞:枳;DREB基因家族;生物信息學;非生物脅迫
中圖分類號:S184;S666.401 文獻標志碼:A
文章編號:1002-1302(2024)15-0053-11
收稿日期:2023-09-27
基金項目:國家自然科學基金(編號:32160731);江西省教育廳科學技術研究項目(編號:GJJ2201233);贛南師范大學研究生創新基金(編號:YCX23A038)。
作者簡介:范麗珍(1995—),女,江西九江人,碩士研究生,主要從事柑橘功能基因挖掘與驗證方面的研究。E-mail:1035934736@qq.com。
通信作者:李興濤,博士,副教授,主要從事果樹逆境植物生理方面的研究。E-mail:lixt.gnnu@qq.com。
脫水反應元件結合蛋白(dehydration responsive element binding protein,DREB)屬于AP2/ERF家族,是一類存在于植物中的轉錄因子,其結構域由60~70個氨基酸組成,能特異性結合DRE/CRT元件,由此調控下游含DRE/CRT元件的抗逆性基因[1]。DREB家族蛋白在植物中廣泛存在,目前人們已經分別在擬南芥[2]、水稻[2]、玉米[3]、大豆[4]和甘藍[5]中鑒定到57、57、49、73、91個DREB基因成員。Nakano等將擬南芥DREB基因家族分為A-1、A-2、A-3、A-4、A-5、A-6等6個亞族,每個亞族的DREB基因發揮不同的生理功能[1]。
研究發現,DREB轉錄因子在植物應對干旱、低溫及高鹽等脅迫的過程中發揮重要的調控作用。在擬南芥中過表達小麥TaDREB3基因,能夠提高小麥對高溫、鹽的耐受性,在鹽、高溫處理下,分別有83%、55% TaDREB3-AI轉基因擬南芥存活,而在相同條件下,野生型擬南芥分別僅有20%、21%存活[6]。在擬南芥中超表達結縷草ZjDREB1.4基因可以顯著增強擬南芥對低溫、高溫的耐性[7],在水稻中過表達擬南芥AtDREB1A基因可以增強水稻對干旱和低溫的脅迫[8]。Shi等研究發現,在擬南芥中過表達AtCBF1、AtCBF2和AtCBF3能夠提高擬南芥對鹽、干旱和低溫脅迫的耐受性以及對丁香假單胞菌的抗性[9]。在菊花中過表達CmDREB6基因后,提高了菊花的耐熱性,2種轉基因菊花株系的存活率分別為85%和50%,而野生型菊花僅有3.8%的存活率[10];在菊花中過表達擬南芥AtDREB1A基因也可以增強菊花對熱脅迫的耐受性,在高溫處理下有70.8%的轉基因植株存活,而野生型植株僅有16.3%存活[11]。對黃瓜進行鹽脅迫處理,發現CsDREB07、CsDREB33、CsDREB41基因的相對表達量與對照相比分別上調了2.95、2.37、2.06倍[12]。目前,對DREB基因的研究主要集中于擬南芥和其他植物,關于多年生果樹的研究較少。
本研究擬用生物信息學方法對枳(Poncirus trifoliata)PtrDREB基因家族成員進行鑒定和系統性分析,用實時熒光定量qRT-PCR技術分析PtrDREB基因家族成員在低溫、高溫及干旱這3個非生物脅迫下的表達模式,以期為進一步研究PtrDREB基因家族的生物學功能提供參考。
1 材料與方法
1.1 試驗材料
本試驗于2022年6月至2023年8月在贛南師范大學國家臍橙工程研究中心進行。以枳橙品種作為研究試樣。待枳苗生長1年時,選擇生長良好的植株分別進行低溫[(0±0.5) ℃]、高溫[(38.0±0.5) ℃]和干旱(15%PEG-6000)逆境脅迫處理。收集處理0、3、6、12 h后的葉片,經液氮速凍后于-80 ℃低溫保存待用,試驗設置3個生物學重復。
1.2 試驗方法
1.2.1 枳DREB基因家族的鑒定及理化性質分析 從CPBD(http://citrus.hzau.edu.cn/index.php)中下載枳的全基因組數據。在UniProt數據庫中下載57個擬南芥DREB基因家族的氨基酸序列,并將其作為參考序列,對枳蛋白序列進行本地BLAST搜索,閾值設置為e×10-5。從Pfam數據庫(http://pfam.xfam.org)中下載DREB基因的隱馬爾科夫模型(PF00847),用HMMER軟件對枳蛋白數據庫進行搜索,獲取PtrDREB家族成員,對BLAST、HMMER的結果進行合并分析。通過CDD(https://www.ncbi.nlm.nih.gov/cdd/term)、SMART(https://smart.embl.de/smart/set_mode.cgi?NORMAL=1)和PfamScan(https://www.ebi.ac.uk/Tools/pfa/pfamscan/)等工具進行蛋白質結構域的驗證,僅保留含有1個AP2結構域,且第14位氨基酸為纈氨酸(V)、第19位氨基酸為谷氨酸(E)的蛋白序列,刪除沒有AP2結構域及含有2個AP2及AP2-B3結構域的序列[13]。根據枳DREB基因家族成員在染色體上的分布,對其進行命名。用在線工具ProtParam(https://web.expasy.org/protparam/)對PtrDREB家族成員進行理化性質分析。通過Wolf Psorf(https://www.genscript.com/wolf-psort.html/)進行亞細胞定位的預測。
1.2.2 枳DREB基因家族成員的染色體定位、二級結構及系統發育樹分析 使用TBtools獲取枳染色體長度和PtrDREB基因在染色體上的位置信息,將染色體長度和PtrDREB基因位置信息上傳至M2G2(http://mg2c.iask.in/mg2c_v2.0),繪制PtrDREB基因的染色體位置圖。用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa%20_sopma.html)對PtrDREB蛋白的二級結構進行預測分析。基于擬南芥的57個AtDREB蛋白序列與鑒定的枳PtrDREB蛋白序列,使用MEGA 6.0 軟件構建系統進化樹。
1.2.3 枳DREB基因家族成員的基因結構和蛋白質motif分析 將PtrDREB家族成員的基因序列和編碼序列(CDS)提交至GSDS(http://gsds.gao-lab.org/)進行基因結構的可視化分析。通過MEME(http://meme-suite.org)分析PtrDREB蛋白的motif,數量設置為10,用在線網站iTOL(https://itol.embl.de/itol.cgi)進行可視化分析。
1.2.4 枳DREB基因家族成員的共線性分析和順式作用元件預測 用TBtools進行枳基因組的共線性分析,獲得PtrDREB基因家族的共線性關系。用TBtool軟件提取PtrDREB基因的啟動子上游 2 000 bp 的序列,將其提交至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)進行順式作用元件的預測。
1.2.5 枳DREB基因家族成員在不同組織的表達從CPBD中下載枳根、葉片、果實、芽和種子等組織的轉錄組數據,獲取PtrDREB家族成員相應的表達量,使用R中的pheatmap包繪制PtrDREB表達量熱圖,基因相對表達量的上調、下調表示分別用紅色、藍色表示。
1.2.6 枳DREB基因家族成員在不同脅迫處理下的qRT-PCR分析 結合PtrDREB的組織表達分析和啟動子順式作用元件預測結果,選擇9個成員,利用Premier 5設計PtrDREB基因的 qRT-PCR 引物(表1)。總RNA的提取、反轉錄cDNA的合成及qRT-PCR反應體系試驗均用杭州新景生物試劑盒(SIMGEN)完成,以柑橘ACTB[14]基因作為內參基因,在Light-Cycler 480(Roche,Basel,瑞士)儀器上進行PCR,流程如下:95 ℃ 1 min;95 ℃ 20 s,52 ℃ 20 s,72 ℃ 30 s,共40個循環。每個樣品重復測定3次,基因的相對表達量用 法[15]計算,在DPS軟件中用Duncans新復極差法進行數據的差異顯著性分析,最后用Sigmaplot 14.0軟件繪制相對表達量圖。
2 結果與分析
2.1 枳DREB基因家族的鑒定和結構分析
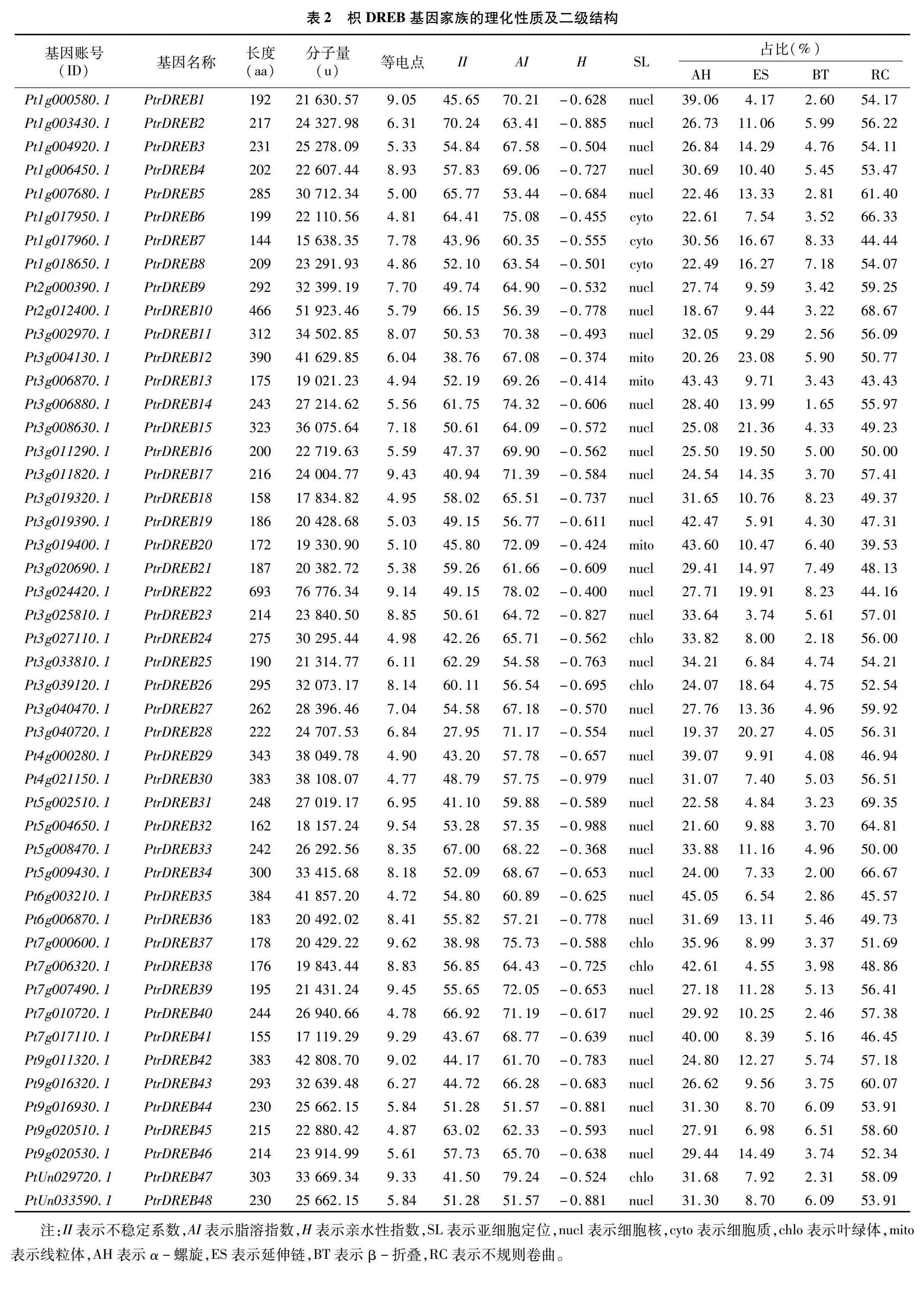
通過對枳基因組的分析,共鑒定到48個PtrDREB基因家族成員,將其命名為PtrDREB1~PtrDREB48(表2)。枳PtrDREB基因的蛋白質編碼氨基酸數量在144~639 aa之間,相對分子量最大的為76 776.34 u,最小的為15 638.35 u,平均相對分子量為28 059.64 u。48個PtrDREB基因的等電點范圍為4.72~9.62,其中21個(占比為43.75%)成員呈堿性(pH值>7),27個(占比為56.25%)成員呈酸性(pH值<7)。在48個PtrDREB蛋白中,大部分都是不穩定蛋白,僅PtrDREB12、PtrDREB28、PtrDREB37屬于穩定蛋白。該基因家族的蛋白脂溶指數為51.57~79.24。蛋白質的疏水性分析結果表明,48個PtrDREB蛋白具有高親水性,親水性指數(H)均小于0,屬于親水蛋白。亞細胞定位結果顯示,37個PtrDREB蛋白定位在細胞核,其他蛋白分別定位于細胞質(3個)、葉綠體(5個)及線粒體(3個)。
PtrDREB蛋白的二級結構預測結果顯示,PtrDREB蛋白中α-螺旋(AH)、延伸鏈(ES)、β-折疊(BT)、無規則卷曲(RC)的占比分別為 18.67%~45.05%、3.74%~23.08%、1.65~8.33%、39.53%~69.35%,無規則卷曲的占比最高,是PtrDREB蛋白結構的主要組成部分(表2)。
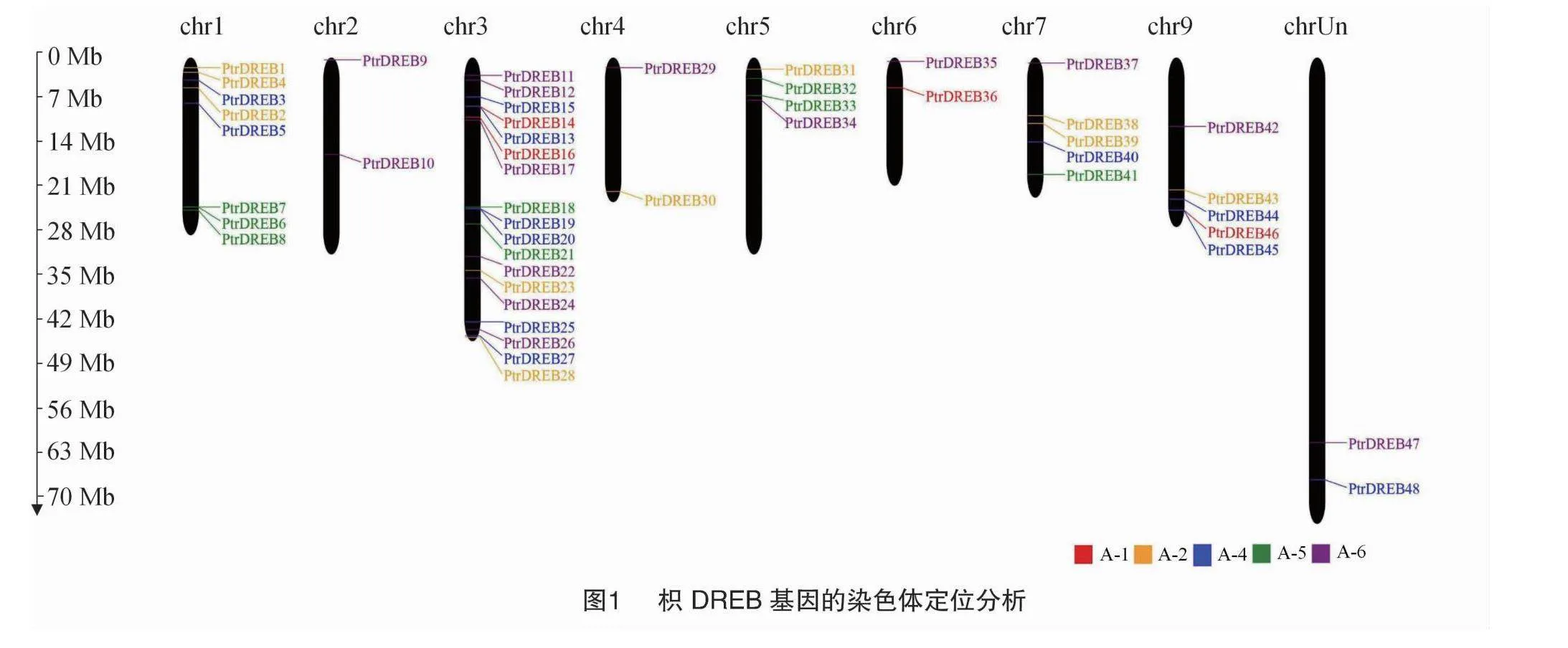
2.2 枳DREB基因家族成員在染色體定位分析
根據PtrDREB基因的位置信息,獲得其在染色體上的定位(圖1),48個DREB基因分布在枳的9條染色體上,3號染色體上分布的PtrDREB基因最多,有18個,2號染色體上分布8個PtrDREB基因,7、9號染色體上各分布5個PtrDREB基因,5號染色體上分布4個PtrDREB基因。Chr2、Chr4、Chr6和ChrUn均包含2個PtrDREB基因。
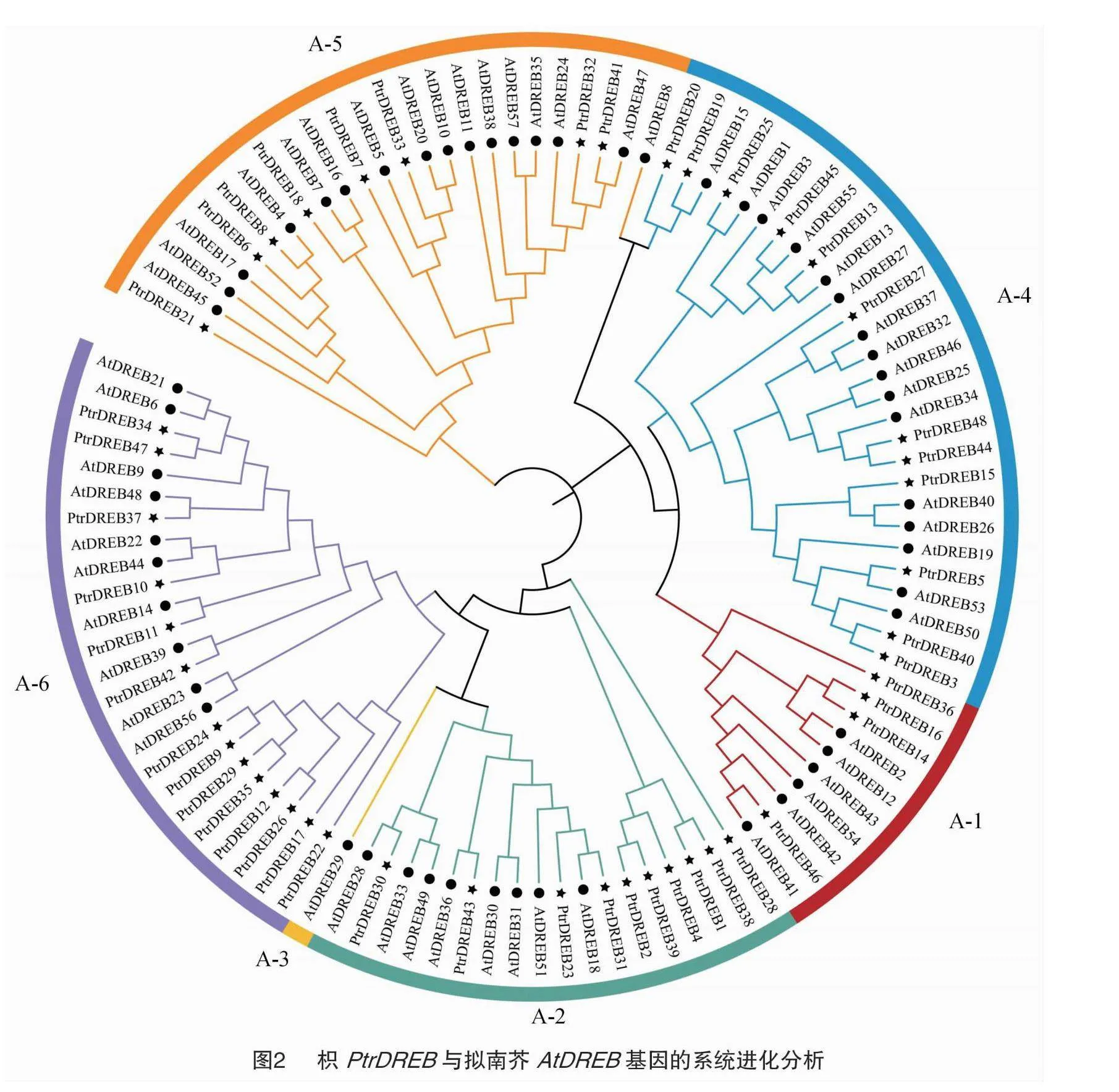
2.3 枳DREB基因家族成員系統發育樹分析
采用鄰接法生成擬南芥(57個DREB蛋白)和枳(48個DREB蛋白)的系統發育樹(圖2)。將枳的48個DREB基因分為A-1、A-2、A-3、A-4、A-5、A-6共6個亞族,枳最大的亞族為A-6,含有14個PtrDREB。在枳所有PtrDREB成員中,A-1、A-2、A-4、A-5亞族分別有4、10、12、8個成員;枳沒有A-3亞族成員,系統發育樹中A-3亞族僅含有擬南芥1個成員。
2.4 枳DREB基因家族成員基因結構和保守基序分析
枳DREB基因內含子、外顯子組成及PtrDREB蛋白的motif分析結果(圖3)顯示,34個(70.83%)PtrDREB基因不包含內含子,12個PtrDREB基因(25%)包含1個內含子,PtrDREB8基因含有3個內含子,而PtrDREB22基因含有的內含子最多,有5個,表明PtrDREB基因結構相對保守。由圖3-B可以看出,motif 1存在于所有PtrDREB蛋白中,大多數PtrDREB蛋白都含有motif 2、motif 3和motif 4,motif 5存在于A-1、A-4亞族中,此外A-5亞族的PtrDREB6、PtrDREB21、PtrDREB33基因中也含有motif 5,motif 6僅在A-1亞族和PtrDREB13、PtrDREB45基因中發現,而motif 9是PtrDREB44、PtrDREB48基因所特有的。
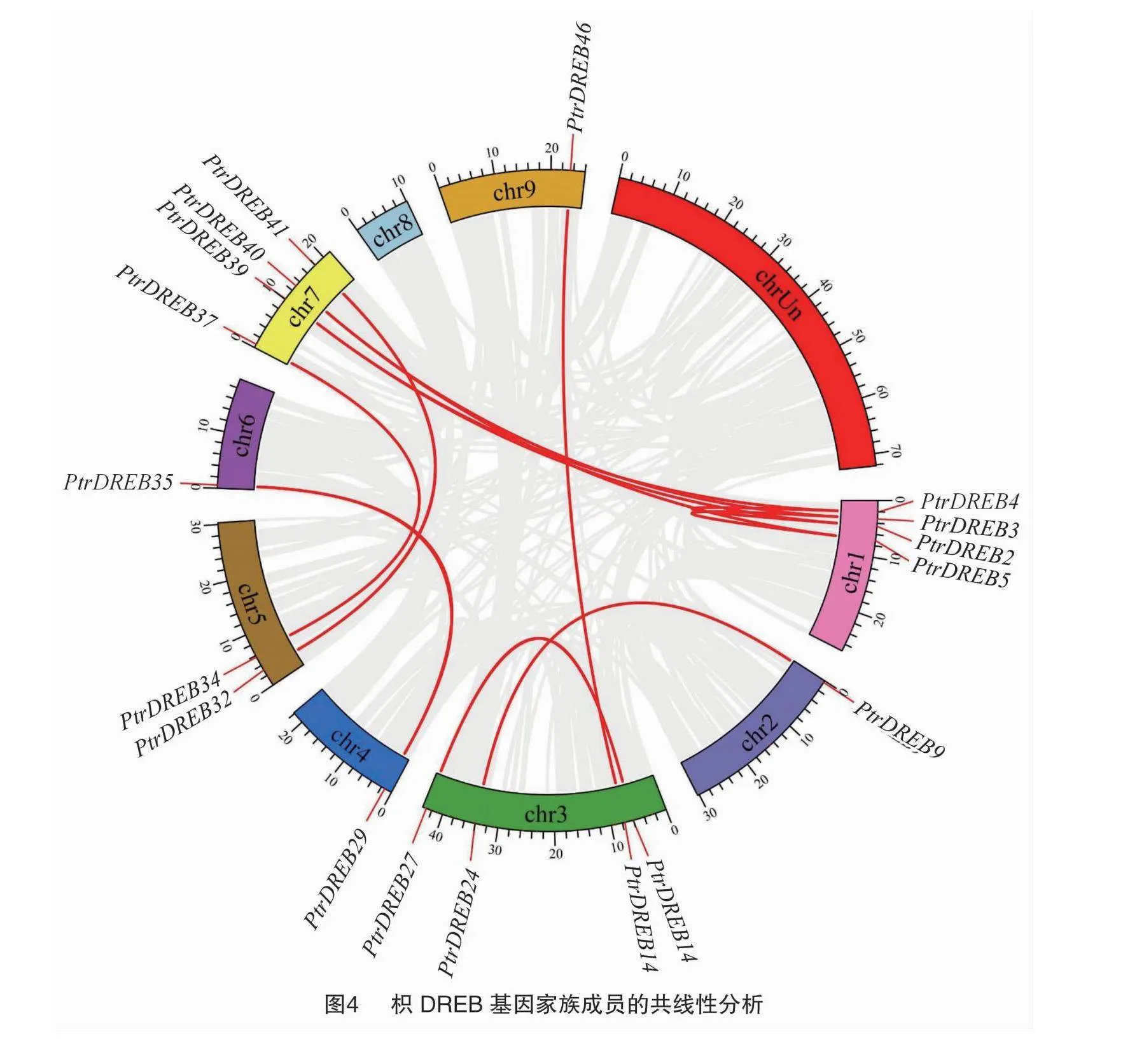
2.5 枳DREB基因家族成員的共線性分析
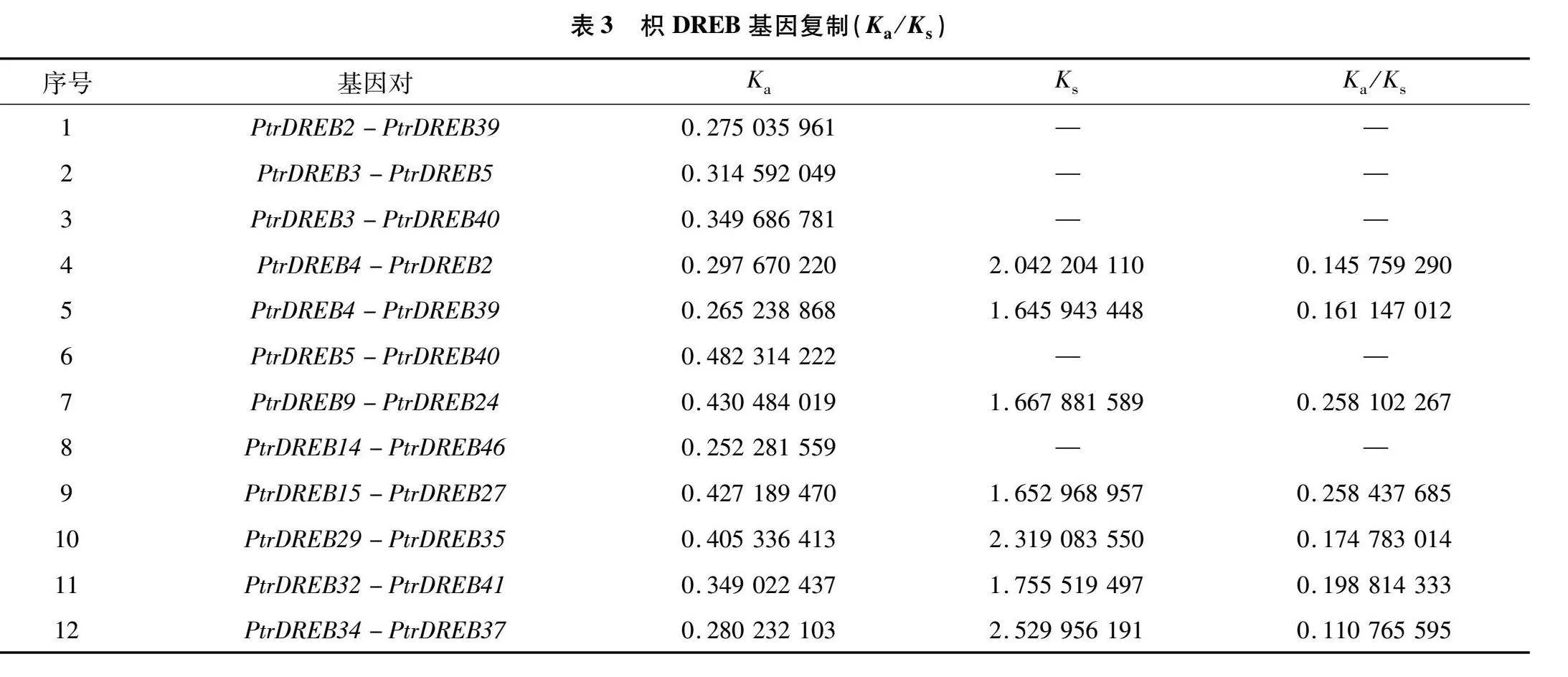
從PtrDREB基因家族中共檢測到9對片段復制基因(圖4),其中A-1、A-5亞族各有1對,分別是PtrDREB14-PtrDREB46、PtrDREB32-PtrDREB41,A-2、A-4亞族各有2對,分別是PtrDREB2-PtrDREB39、PtrDREB4-PtrDREB39和PtrDREB3-PtrDREB40、PtrDREB5-PtrDREB40,而PtrDREB9-PtrDREB24、PtrDREB29-PtrDREB35、PtrDREB34-PtrDREB37共3對基因則屬于A-6亞族 另外在1號染色體上檢測到2對串聯重復基因PtrDREB4-PtrDREB2、PtrDREB3-PtrDREB5,在3號染色體上有1對串聯重復基因PtrDREB15-PtrDREB27。這些存在共線性關系的基因占PtrDREB基因的比例為37.5%。
本研究計算了PtrDREB串聯基因、片段重復基因的Ka/Ks(表3),以確定促進PtrDREB家族進化的選擇類型。9對片段重復基因對的Ka/Ks為 0.11~0.26,4對串聯重復基因對的Ka/Ks為0.14~0.25,所有基因對的Ka/Ks均<1.00。上述結果表明 在PtrDREB基因的進化過程中可能發生了純化選擇。
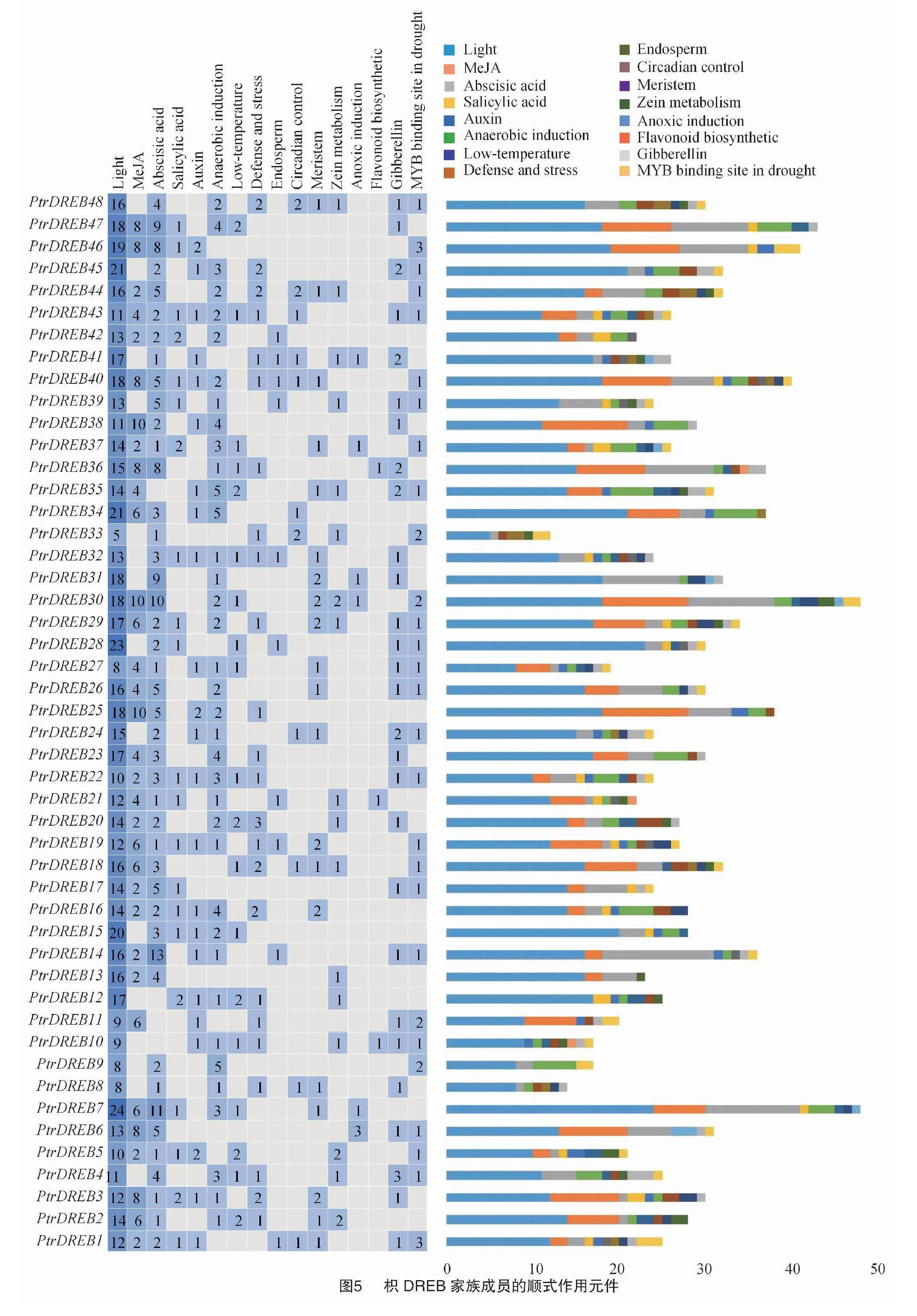
2.6 枳DREB基因家族成員的順式作用元件分析
用PlantCARE對PtrDREB上游的2 000 bp序列進行分析,結果(圖5)表明,在48個PtrDREB基因中共預測到1 369個順式作用元件,主要包括植物激素響應元件、脅迫響應元件和植物生長發育元件。其中,417個(30.46%)元件參與對脫落酸、生長素、茉莉酸甲甲酯、赤霉素和水楊酸等激素的響應。在1 369個元件中,有258個(18.85%)元件參與對低溫、干旱及防御與脅迫等逆境脅迫的響應,19個PtrDREB含有1個或多個低溫響應元件。44個PtrDREB包含1~13個脫落酸響應元件,28個PtrDREB包含1~3個干旱響應元件,24個PtrDREB包含1~3個防御與脅迫響應元件。總之,順式元件分析結果表明,所有PtrDREB基因中都至少有1種參非生物脅迫的順式作用調控元件。
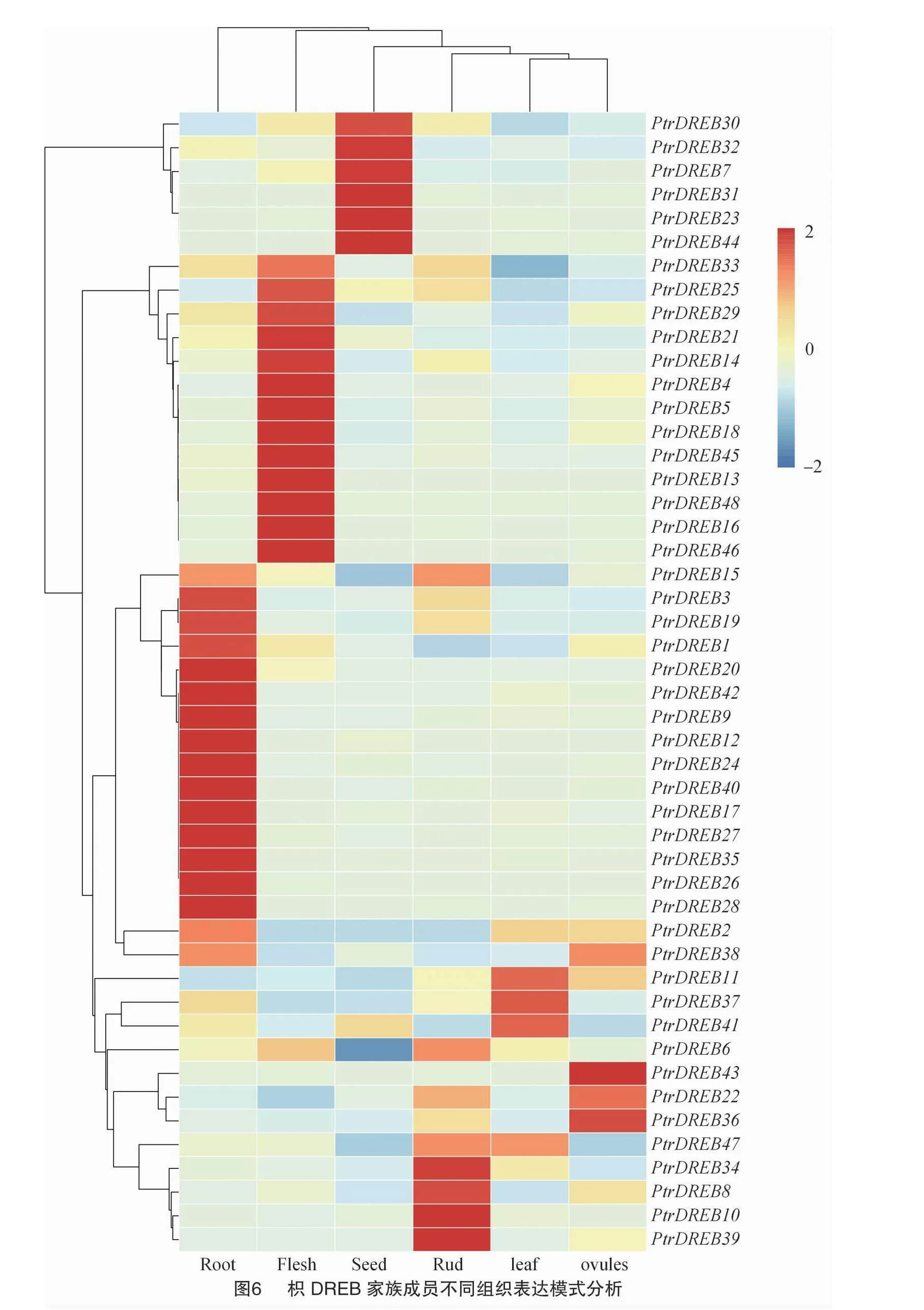
2.7 枳DREB基因在不同組織的表達分析
根據枳根、葉、芽等不同組織的轉錄組數據繪制PtrDREB基因在組織中的相對表達量熱圖。圖6結果顯示,17個PtrDREB在根中高表達,13個PtrDREB在果實中高表達,PtrDREB基因在葉、胚珠中高表達的數量最少,都只有4個,相對表達量最高的分別是PtrDREB37、PtrDREB43;在枳種子、芽中高表達的基因分別有6、8個。
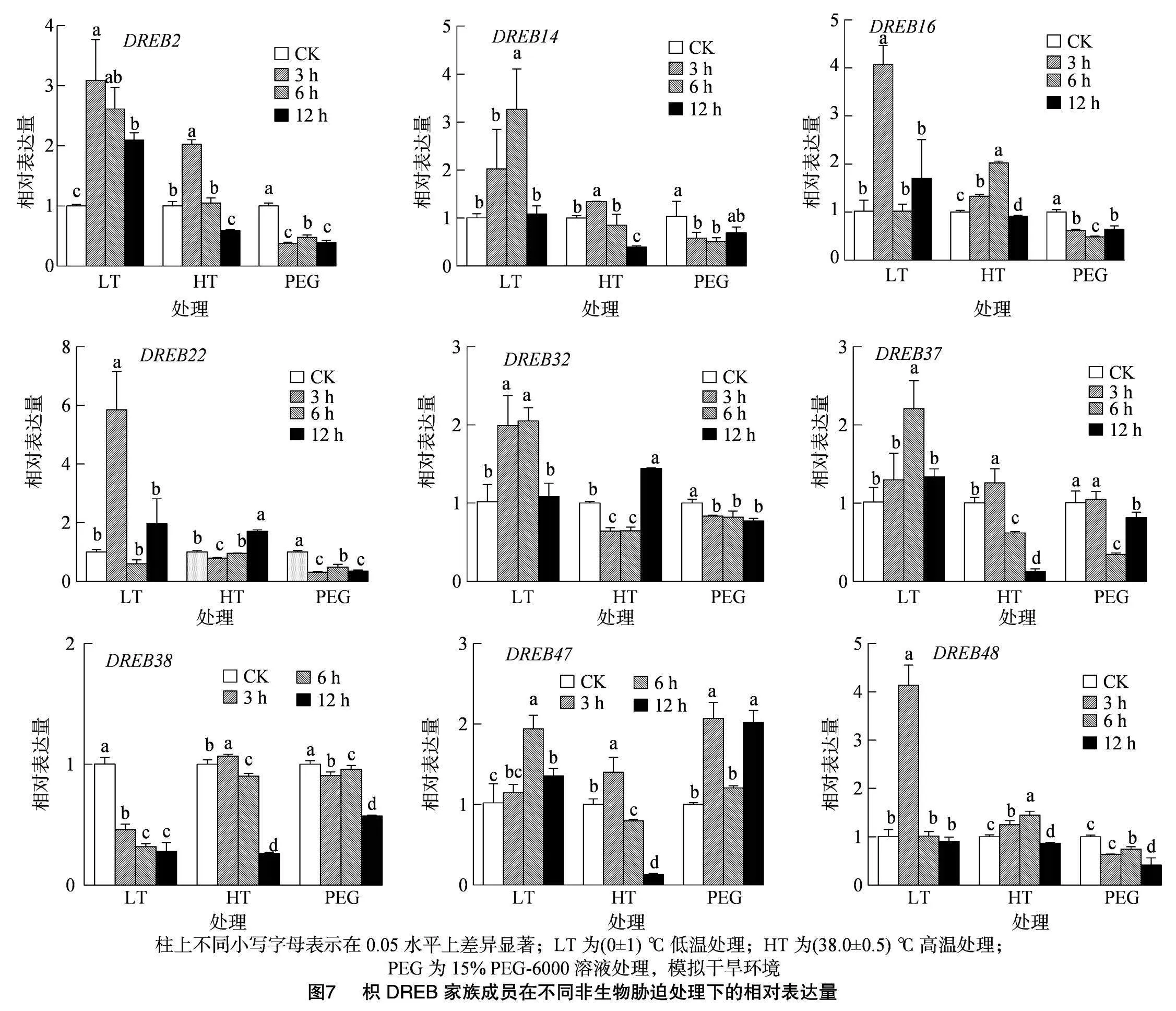
2.8 枳DREB基因家族在不同非生物脅迫處理下的表達分析
結合PtrDREB基因家族在不同組織中的表達熱圖及啟動子順式作用元件的預測結果,在48個基因中選取9個成員,用qRT-PCR技術檢測低溫、高溫和干旱脅迫處理的PtrDREB相對表達量。由圖7可以看出,PtrDREB16、PtrDREB22、PtrDREB48的相對表達量在低溫處理6 h后分別上調了4.08、5.85、4.15倍,PtrDREB2、PtrDREB14、PtrDREB32、PtrDREB37和PtrDREB47的相對表達量在低溫處理12 h后達到峰值,上調幅度為1.94~3.26倍,僅PtrDREB38的相對表達量沒有上調。在高溫脅迫處理后,PtrDREB2、PtrDREB16、PtrDREB32的相對表達量分別上調了2.02、2.02、1.44倍,其他基因的表達水平總體變化不大。在干旱脅迫處理后,PtrDREB47的相對表達量在干旱處理3、12 h達到峰值,分別上調2.06、2.02倍,另外8個PtrDREB基因的相對表達量呈現持續下降趨勢。
3 討論
Nakano等分別構建了擬南芥、水稻ERF基因家族的無根系統發育樹,根據進化關系,擬南芥、水稻DREB基因家族均被劃分為6個亞族[2]。在本研究中,系統發育樹的結果同樣為6個亞族,但是48個PtrDREB只有5個亞族,A-3亞族缺少枳DREB基因家族成員,在番茄與擬南芥的進化樹中,同樣發現番茄也缺少A-3亞族的成員[16],本研究結果與之一致。基因結構分析結果表明,少數PtrDREB基因含有1~5個內含子,不含內含子的PtrDREB基因占比高達70.83%,在其他物種中也發現DREB基因不含有內含子的成員占比很高,如黃瓜(78.18%)[12]、大豆(68.3%)[4]、馬鈴薯(87.69%)[17]以及甘藍型油菜(79.8%)[18]。一個沒有內含子或者內含子數量少的基因,其轉錄速度比內含子數多的基因快,沒有內含子的基因無需進行剪接,能夠更快地產生蛋白質產物[19],70.83% PtrDREB基因不含有內含子,可能是應對快速響應逆境脅迫的進化行為。依據枳DREB基因的復制事件分析可知,PtrDREB家族成員中存在9對染色體片段復制和3對染色體串聯復制,說明在枳DREB基因進化過程中,染色體片段復制是其進化的一個重要過程。
大量研究發現,DREB基因在植物響應逆境脅迫中發揮著重要作用。過表達DREB基因可以增強擬南芥[20-22]、水稻[23-24]、煙草[25-26]、馬鈴薯[27-28]等多種植物抗旱、耐低溫、抗凍和耐鹽的表達特性。本研究利用實時熒光定量技術檢測3個逆境脅迫條件(分別是低溫、高溫和干旱脅迫)下9個PtrDREB基因的相對表達量,發現與對照相比,PtrDREB2、PtrDREB14、PtrDREB16、PtrDREB22、PtrDREB32、PtrDREB37、PtrDREB47和PtrDREB48共8個基因響應低溫脅迫,PtrDREB2、PtrDREB14、PtrDREB16、PtrDREB22、PtrDREB32和PtrDREB47共6個基因響應高溫脅迫,僅PtrDREB47基因積極響應干旱脅迫,進一步說明枳PtrDREB基因家族參與非生物脅迫響應。本研究對枳DREB基因家族進行鑒定及其表達分析,為進一步探索枳DREB基因參與逆境響應的分子機制奠定了理論基礎。
4 結論
本研究基于枳基因組數據庫,用生物信息學對枳DREB基因家族進行全基因組鑒定和分析,鑒定出48個DREB基因,利用實時熒光定量技術檢測其中9個基因響應非生物脅迫的相對表達量。研究結果顯示,PtrDREB基因家族分布在9條染色體上,被劃分為5個亞族,18個基因發生了基因復制事件,qRT-PCR結果顯示,9個PtrDREB基因對低溫、高溫和干旱等脅迫都有響應,推測枳DREB基因家族可能參與了非生物脅迫的應答。
參考文獻:
[1]劉 坤,李國婧,楊 杞. 參與植物非生物逆境響應的DREB/CBF轉錄因子研究進展[J]. 生物技術通報,2022,38(5):201-214.
[2]Nakano T,Suzuki K,Fujimura T,et al. Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J]. Plant Physiology,2006,140(2):411-432.
[3]Zhuang J,Deng D X,Yao Q H,et al. Discovery,phylogeny and expression patterns of AP2-like genes in maize[J]. Plant Growth Regulation,2010,62(1):51-58.
[4]Zhou Y X,Zhou W,Liu H,et al. Genome-wide analysis of the soybean DREB gene family:identification,genomic organization and expression profiles in response to drought stress[J]. Plant Breeding,2020,139(6):1158-1167.
[5]Thamilarasan S K,Park J I,Jung H J,et al. Genome-wide analysis of the distribution of AP2/ERF transcription factors reveals duplication and CBFs genes elucidate their potential function in Brassica oleracea[J]. BMC Genomics,2014,15:422.
[6]Niu X,Luo T L,Zhao H,et al. Identification of wheat DREB genes and functional characterization of TaDREB3 in response to abiotic stresses[J]. Gene,2020,740:144514.
[7]Feng W Q,Li J,Long S X,et al. A DREB1 gene from zoysiagrass enhances Arabidopsis tolerance to temperature stresses without growth inhibition[J]. Plant Science:an International Journal of Experimental Plant Biology,2019,278:20-31.
[8]Latha G M,Raman K V,Lima J M,et al. Genetic engineering of indica rice with AtDREB1A gene for enhanced abiotic stress tolerance[J]. Plant Cell,Tissue and Organ Culture,2019,136(1):173-188.
[9]Shi H T,Qian Y Q,Tan D X,et al. Melatonin induces the transcripts of CBF/DREB1s and their involvement in both abiotic and biotic stresses in Arabidopsis[J]. Journal of Pineal Research,2015,59(3):334-342.
[10]Du X P,Li W Y,Sheng L P,et al. Over-expression of chrysanthemum CmDREB6 enhanced tolerance of chrysanthemum to heat stress[J]. BMC Plant Biology,2018,18(1):178.
[11]Hong B,Ma C,Yang Y J,et al. Over-expression of AtDREB1A in chrysanthemum enhances tolerance to heat stress[J]. Plant Molecular Biology,2009,70(3):231-240.
[12]王 燦. 黃瓜CsHSFA1功能鑒定及DREB家族生物信息學分析[D]. 泰安:山東農業大學,2022:46-55.
[13]馮 軍,鄭彩霞. DREB轉錄因子在植物非生物脅迫中的作用及應用研究[J]. 植物生理學報,2011,47(5):437-442.
[14]嚴佳文.柑橘內參基因篩選及轉pthA基因甜橙的表達分析[D]. 長沙:湖南農業大學,2010:31.
[15]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408.
[16]Maqsood H,Munir F,Amir R,et al. Genome-wide identification,comprehensive characterization of transcription factors,cis-regulatory elements,protein homology,and protein interaction network of DREB gene family in Solanum lycopersicum[J]. Frontiers in Plant Science,2022,13:1031679.
[17]Mushtaq N,Munir F,Gul A,et al. Genome-wide analysis,identification,evolution and genomic organization of dehydration responsive element-binding (DREB) gene family in Solanum tuberosum[J]. PeerJ,2021,9:e11647.
[18]Ghorbani R,Zakipour Z,Alemzadeh A,et al. Genome-wide analysis of AP2/ERF transcription factors family in Brassica napus[J]. Physiology and Molecular Biology of Plants,2020,26(7):1463-1476.
[19]Ma L T,Zhu T,Wang H R,et al. Genome-wide identification,phylogenetic analysis and expression profiling of the late embryogenesis-abundant (LEA) gene family in Brachypodium distachyon[J]. Functional Plant Biology,2021,48(4):386-401.
[20]Qin F,Kakimoto M,Sakuma Y,et al. Regulation and functional analysis of ZmDREB2A in response to drought and heat stresses in Zea mays L.[J]. The Plant Journal,2007,50(1):54-69.
[21]Chen M,Xu Z S,Xia L Q,et al. Cold-induced modulation and functional analyses of the DRE-binding transcription factor gene,GmDREB3,in soybean (Glycine max L.)[J]. Journal of Experimental Botany,2009,60(1):121-135.
[22]Chen M,Wang Q Y,Cheng X G,et al. GmDREB2,a soybean DRE-binding transcription factor,conferred drought and high-salt tolerance in transgenic plants[J]. Biochemical and Biophysical Research Communications,2007,353(2):299-305.
[23]Oh S J,Song S I,Kim Y S,et al. Arabidopsis CBF3/DREB1A and ABF3 in transgenic rice increased tolerance to abiotic stress without stunting growth[J]. Plant Physiology,2005,138(1):341-351.
[24]吳關庭,郎春秀,胡張華,等. 轉CBF1基因增強水稻的耐逆性[J]. 核農學報,2006,20(3):169-173.
[25]Liu X Q,Liu C Y,Guo Q,et al. Mulberry transcription factor MnDREB4A confers tolerance to multiple abiotic stresses in transgenic tobacco[J]. PLoS One,2015,10(12):e0145619.
[26]孫瑞芬,張艷芳,聶利珍,等. 向日葵HaDREBA5基因克隆及其對生物和非生物脅迫的響應[J]. 農業生物技術學報,2021,29(5):900-914.
[27]Watanabe K N,Kikuchi A,Shimazaki T,et al. Salt and drought stress tolerances in transgenic potatoes and wild species[J]. Potato Research,2011,54(4):319-324.
[28]Behnam B,Kikuchi A,Celebi-Toprak F,et al. Arabidopsis rd29A::DREB1A enhances freezing tolerance in transgenic potato[J]. Plant Cell Reports,2007,26(8):1275-1282.

