例析元素電負性的考查

電負性是理解化學鍵和化合物性質的重要概念,是元素的原子在化合物中吸引電子能力的標度,元素的電負性越大,表示其原子在化合物中吸引電子的能力越強.在化合物中,電子對偏向電負性更大的原子.
1 電負性與元素非金屬性的關系
電負性的強弱反映出元素原子的原子核對電子吸引能力的相對大小.同周期元素從左到右,原子半徑減小、核電荷數增大,原子核對電子吸引能力增強,因此同周期元素從左到右電負性逐漸增大;同主族元素從上到下電負性逐漸減小.對于不同周期也不同主族的元素,位于左上角與右下角的2種元素比較,右下角原子的電負性較強.此外,電負性不大于1.8的元素都是金屬元素,電負性大于1.8的元素絕大多數是非金屬元素.
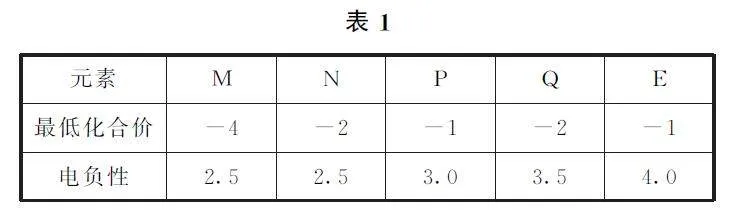
例1 表1是M、N、P、Q、E5種短周期元素的某些性質,下列判斷正確的是( ).
A.Q、E的非金屬性:Q>E
B.與元素N 同周期且第一電離能最小的元素的單質和E單質均能與H2O 發生置換反應
C.元素N、P之間不可能形成化合物
D.P、Q、E的氫化物的穩定性:E>P>Q
分析 由表1知,M 為C元素,N 為S元素,P為Cl元素,Q 為O 元素,E 為F元素.金屬性F>O,選項A 錯誤.Na能與H2O 發生置換反應生成NaOH 和H2,選項B正確.S的最外層有6個電子,Cl的最外層有7個電子,它們之間可形成S2Cl2、SCl2 等化合物,選項C錯誤.P、Q、E的氫化物分別為HCl、H2O、HF,穩定性:HF>H2O>HCl,選項D錯誤.答案為B.
點評 解答本題的關鍵是先根據最低化合價確定元素在周期表中族的序數(最低化合價=主族序數-8),再根據電負性相對大小判斷出具體元素.
2 電負性對化學鍵類型、物質結構的影響
成鍵元素電負性的相對大小對化學鍵類型、化合物結構有直接的影響,具體情況如下.1)當成鍵兩元素電負性差值大于17時,形成的化學鍵為離子鍵,相應的化合物為離子化合物;當差值小于17時多為共價鍵.2)形成共價鍵的兩元素,電負性差值越大,共價鍵的極性越強.
例2 已知X、Y、Z、W 是同周期的4種主族元素,其電負性:X>Y>18>Z>W,下列說法正確的是( ).
A.元素的第Ⅰ電離能:X一定比Y的大
B.非金屬性最強的是W
C.X與W 形成的化合物可能是離子化合物
D.最高價氧化物對應的水化物均是酸
分析 由電負性的關系可知,4種元素在周期表中的順序(從左到右)為W、Z、Y、X,若X是第ⅥA 族元素而Y是第ⅤA 族元素,則第一電離能的關系是X<Y,選項A 錯誤.金屬性最強的是W,非金屬性最強的是X,選項B、D錯誤,選項C正確.答案為C.
點評 同一周期元素從左到右電負性逐漸增大;電負性越大,元素的非金屬性越強.
3 電負性大小對物質性質的影響
1)對物質酸性的影響:元素的電負性越大,原子吸引鍵合電子能力越強,對于能電離出H+ 的物質來說,凡能導致物質中O—H 鍵的極性增強的誘因,均會導致物質更容易電離出H+ ,對應的酸性增強.
2)對物質酸性強弱的影響:對于組成為(HO)mROn 的含氧酸來說,當R相同時,n 值越大,R的正電性越高,導致R—O—H 中氧的電子越偏向R,進一步導致O—H 鍵鍵合電子更移向O,即導致O—H鍵極性增強,更易電離出H+ ,即(HO)mROn酸性越強.
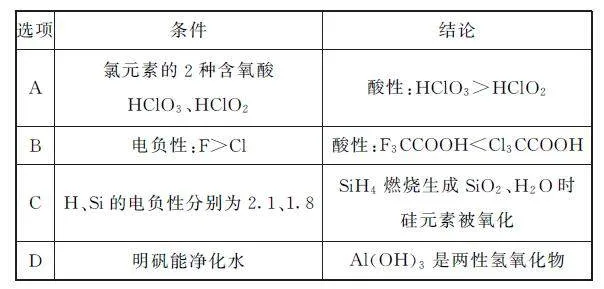
例3 由下列條件得出的結論正確的是( )
分析 HClO3、HClO2 可分別表示為HOClO2、HOClO,故前者中氯元素價態更高,O—H 鍵極性更強,相應酸的酸性更強,選項A 正確.電負性越大,吸電子能力越強,更容易電離出氫離子,酸性越強,故酸性:F3CCOOH>Cl3CCOOH,選項B錯誤.成鍵時,電負性較強的元素顯負價,故SiH4 中氫元素顯-1價,Si顯+4價,因此燃燒過程中被氧化的是H 元素,選項C錯誤.明礬能凈化水是因為鋁離子水解生成氫氧化鋁膠體,表面積大,能吸附水中懸浮的雜質,與Al(OH)3是兩性氫氧化物無關,選項D錯誤.答案為A.
點評 成鍵元素電負性差值越大,在溶液中越易發生斷裂,從而導致物質相應性質的強弱發生變化.
4 電負性與共價鍵的鍵角關系
對于組成為ABn 型的不同物質來說,當不同物質中的A 元素位于同一主族時,A 元素的電負性越大,鍵角越大;當各物質的A 原子種類相同時,配位原子B的電負性越大,鍵角越小.
例4 下列關于物質結構或性質及解釋有錯誤的是( ).
分析 由于N 的電負性大于P的,所以NCl3 的價電子對離中心原子更近,鍵角較大,選項A 不符合題意.F原子半徑小于Cl,H—F 鍵鍵長小于H—Cl鍵鍵長,則H—F鍵能較大,HF比HCl穩定,與氫鍵無關,選項B符合題意.H2O 中O 的電負性大于NH3中N 的電負性,則O 提供孤電子對的能力小于NH3中N 提供孤電子對的能力,NH3 形成的配位鍵更穩定,選項C不符合題意.同種能級,能層越高,對應能級能量越高,能級電子云半徑越大,4s電子的能量高,在離核更遠的區域出現的概率大,則電子云半徑:2s<4s,選項D不符合題意.答案為B.
點評 對于結構相似的分子,鍵角大小與中心原子的電負性有關,電負性越大,價電子對離中心原子越近,鍵角較大.
5 電負性與物質的性質
電負性可用于衡量元素非金屬性的強弱,因此電負性的相對大小會對組成物質的各元素化合價、物質的化學性質等產生影響.
例5 根據元素的電負性,寫出下列反應的化學方程式.
(1)已知電負性:Cl>H>Si,SiHCl3 在濃NaOH溶液中發生反應的化學方程式為____.
(2)硼氫化鈉(NaBH4)是研究最廣泛的儲氫材料之一.B的電負性為20,H 的電負性為21.向NaBH4水溶液中加入催化劑Ru/NGR 后,能夠迅速反應.寫出該反應的化學方程式: ____.
分析 (1)由電負性:Cl>H>Si可知,SiHCl3 中Cl元素為-1價,H 元素為-1價,Si元素為+4價.SiHCl3 與濃NaOH 溶液反應的化學方程式為SiHCl3+5NaOH=Na2SiO3+3NaCl+H2↑+2H2O.
(2)H 的電負性大于B的電負性,因此NaBH4 中B為+3價,H 為-1價,向NaBH4 水溶液中加入催化劑Ru/NGR后,能夠迅速發生H 的歸中反應,化學方程式為NaBH4+2H2O Ru/NGR→NaBO2+4H2↑.
點評 化合物中,電負性最大的元素一定顯負價;電負性最小的元素一定顯正價.
總之,電負性的大小既能體現相應元素金屬性、非金屬性的相對強弱,同時也會對所形成的化學鍵類型、化合物結構與性質產生重大影響.在學習過程中,我們要充分認識、理解上述關系并能利用這種關系解決實際問題.
(完)

