礬根胚性愈傷組織誘導與植株再生






摘要:為了建立礬根組培快繁體系,以礬根去頂尖幼嫩頂芽為外植體,研究不同培養基對胚性愈傷組織誘導、胚性愈傷組織增殖以及植株再生的影響。結果表明,愈傷組織最佳培養基為MS+2.4-D 3.0 mg/L+6-BA 0.3 mg/L,愈傷誘導率達到93.0%,團塊較大,結構較松散,有顆粒狀態,個別團塊呈水浸狀;以最優胚性愈傷組織增殖培養基為MS+2.4-D 2.0 mg/L+6-BA 0.2 mg/L進行擴增,愈傷組織發育較好,結構較松散,顆粒狀疣突分明,水分較少,呈淡黃綠色。胚狀體分化最佳培養基為MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L,胚狀體誘導率達91.8%。對幼根發育不良的植株,在1/2MS+IBA 0.1 mg/L+IAA 0.1 mg/L培養基上進行生根培養效果好,生根率100%,平均根數5.5條,根長2~3 cm,苗高4.1 cm。
關鍵詞:礬根;去頂尖幼嫩頂芽;胚性愈傷組織;誘導;植株再生
中圖分類號:S682 文獻標志碼:A 文章編號:2097-2172(2024)08-0747-05
doi:10.3969/j.issn.2097-2172.2024.08.009
Study on Embryonic Callus Induction and Plant Regeneration of
Heuchera micrantha
REN Yuxin
(Gansu Forestry Professional Technology College, Tianshui Gansu 741020, China)
Abstract: In order to establish tissue culture and rapid propagation system of Heuchera micrantha, using the young terminal buds of Heuchera micrantha as explants, this study investigated the effects of different media on the induction, proliferation, and regeneration of embryogenic callus tissues. The results showed that the medium MS+2.4-D 3.0 mg/L+6-BA 0.3 mg/L had a high callus induction rate of 93.0%. The callus formed was large, loosely structured, and grainy but immature, with some clusters appearing water-soaked. For the proliferation of embryogenic callus tissues, the medium MS+2.4-D 2.0 mg/L+6-BA 0.2 mg/L resulted in well-developed callus tissues that were loosely structured with distinct granular nodules and less water content, presenting a light yellow-green color. The differentiation medium MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L achieved a differentiation rate of 91.8%. For plants with poorly developed young roots, rooting culture on 1/2 MS+IBA 0.1 mg/L+IAA 0.1 mg/L resulted in a rooting rate of 100%, with an average of 5.5 roots per plant, root lengths of 2 to 3 cm, and plant height of 4.1 cm.
Key words: Heuchera micrantha; Terminal bud; Embryogenic callus; Induction; Plant regeneration
礬根(Heuchera micrantha)又名珊瑚鈴,為虎耳草科礬根屬多年生草本花卉[1 ],原產美洲中部,近年來在北方園林綠化中大量應用。礬根葉色艷麗繁多,極具觀賞價值,可盆栽種植后置于室內。園林中多在喬灌木下種植,可用于做花境、花壇、地被及庭院綠化等,也可用于土壤修復[2 ]。礬根耐寒,在肥沃濕潤排水良好的土壤中生長良好,喜中性偏酸、疏松透氣的土壤,適宜半遮陰的生長環境,忌強光直射。礬根小苗長勢較慢,成苗后生長旺盛,是少有的彩葉陰生地被植物,能耐-34 ℃低溫[3 ]。礬根品種繁多,種苗生產以組織培養與分株繁殖為主,部分品種可用種子繁殖,但種子發芽慢而且不整齊[4 ],關于礬根組織培養與快速繁殖的研究已有報道[5 - 7 ],但對其胚性愈傷組織誘導與植株再生的研究還尚未見報道。為了建立礬根組培快繁體系,筆者于2022 — 2023年以礬根優良品種甜茶去頂尖幼嫩頂芽為外植體,優化和改良培養基,誘導產生了胚性愈傷組織,并通過分化培養,建立了胚狀體再生體系,由胚狀體快速發育成完整植株,為規模化生產種苗奠定基礎,也為進一步研究礬根體細胞胚人工種子生產提供技術參考。
1 材料與方法
1.1 材料
材料來源于甘肅林業職業技術學院校區實訓基地,選擇礬根優良種苗,剪取頂芽,剝去小葉,用清水沖洗干凈后待用。
1.2 試驗方法
1.2.1 無菌體系建立 4月中旬剪取幼嫩頂芽,剝除全部葉片,用毛刷蘸1%的洗衣粉水刷掉上面的灰塵微粒,然后用清水將洗衣粉溶液清洗干凈。切去根莖部,保留錐形芽體,在超凈工作臺上用75%酒精浸泡30 s,用無菌水沖洗5遍,再轉入1 g/kg升汞溶液+吐溫-80(2滴)中浸泡5 min,再用無菌水沖洗5遍,然后置于高壓滅菌過鋪有濾紙的接種盤中,切去頂尖和底部致褐部分,接種于無激素的MS培養基中進行無菌材料的篩選,培養基中附加蔗糖3%、高強瓊脂0.6%、pH為5.8~6.0,培養溫度22 ℃,光照強度1 000 Lx,光照時間12 h/d,7 d后選擇無污染的外植體材料,進行愈傷誘導培養。
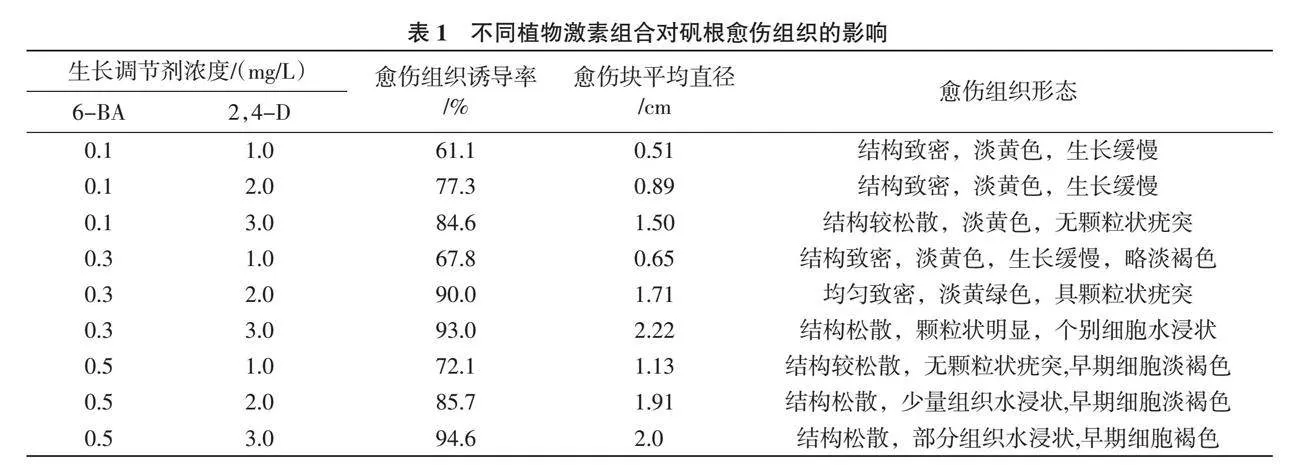
1.2.2 胚性愈傷組織誘導 將1.2.1培養所得的無菌材料接種到愈傷誘導培養基中,愈傷誘導以MS為基本培養基,分別添加植物生長調節劑6-BA和2,4-D,設計兩因素三水平共9個隨機處理(表1), 每處理10瓶培養基, 每瓶接種1個外植體, 3次重復。暗培養15 d再轉入500 Lx弱光培養[8 ],光照時間10 h/d,培養基中附加蔗糖3%,高強瓊脂0.6%,pH為5.8~6.0,培養溫度22~25 ℃,40 d后觀察并統計愈傷組織。
愈傷組織誘導率=(形成胚性愈傷組織的外植體數/接種外植體數)×100%。
1.2.3 胚性愈傷組織增殖培養 為促進胚性愈傷組織的成熟,提高胚狀體在愈傷組織中的比例,可采用降低激素濃度或沒有生長素的培養基進行愈傷組織的增殖和成熟培養[9 ],增殖培養基以愈傷誘導結果為依據,選擇愈傷誘導培養的最佳組合,適當降低培養基中6-BA和2,4-D的濃度組成增殖培養基。挑選發育較好,團塊較大的愈傷組織,切分成直徑為3~5 mm的小塊接種于增殖培養基上,培養基中附加蔗糖3%,高強瓊脂0.6%,pH為5.8~6.0。光照強度為1 500 Lx,光照時間12 h/d,培養溫度22~25 ℃,以20 d為培養周期,增殖培養兩代后轉入再分化培養基中,誘導植株再生。
1.2.4 植株再生培養 將增殖培養形成的大塊愈傷組織轉入分化培養基,分化培養基以MS為基本培養基, 添加不同濃度的6-BA、NAA和IBA,設計三因素兩水平共8個隨機處理(表2), 每處理10瓶, 每瓶接種3塊愈傷組織, 重復3次, 培養基中附加蔗糖3%,高強瓊脂0.6%,pH為5.8~6.0,培養溫度20~22 ℃,光照強度為1 500 Lx,光照時間12 h/d,40 d后觀察統計胚狀體誘導率。
胚狀體誘導率=(形成胚狀體的愈傷塊數/接種愈傷組織數)×100%
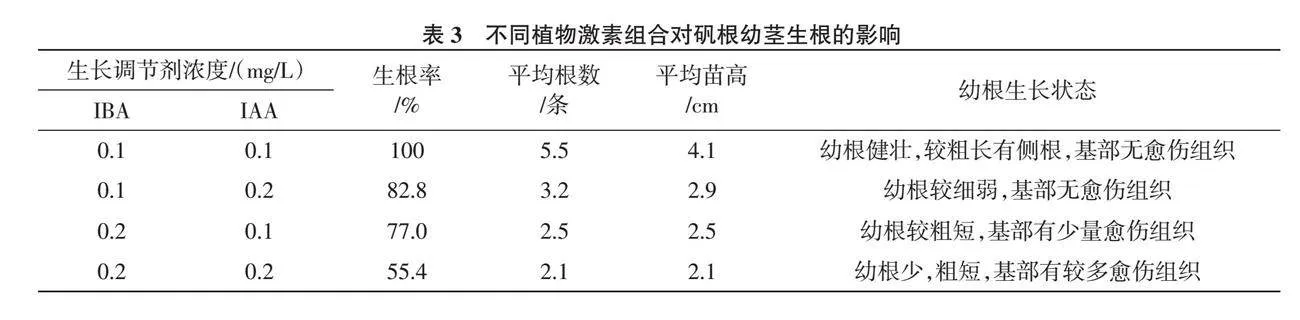
1.2.5 壯苗與生根 再分化產生的幼苗,有部分太弱小或無根,還需通過壯苗培養形成健壯幼莖后,以便生根和移栽,壯苗培養基采用無激素添加的MS培養基[10 ],并增加蔗糖和瓊脂的添加量[11 ],即MS+蔗糖5%+高強瓊脂0.7%,pH為5.8~6.0,培養溫度20~22 ℃,光照強度為2 000 Lx[12 ],光照時間12 h/d,壯苗培養25~30 d將健壯幼莖切下轉入生根培養基中。生根培養可選用1/2MS為基本培養基添加不同濃度的IBA和IAA,設計兩因素兩水平共4個隨機處理(表3),培養基中均附加蔗糖2%,其他條件與前述同,30 d后觀察生根情況,并統計生根率。
生根率=(生根苗數/接種苗數)×100%
1.3 數據處理及分析
采用Excel 2021進行數據分析與統計。
2 結果與分析
2.1 胚性愈傷組織誘導與增殖
根據觀察,外植體接種7 d后開始膨大(圖1),14 d后膨大部位快速生長并逐漸形成淡黃色的愈傷組織,隨著細胞團的不斷形成,整個芽體變成了愈傷組織塊。從表1可以看出,不同生長調節劑2,4-D與6-BA對愈傷組織的形成都有一定影響,在相同6-BA濃度下,隨著2,4-D濃度增大愈傷誘導率也增加,培養基MS+6-BA 0.3 mg/L+2,4-D 3.0 mg/L下外植體發育良好,愈傷誘導率較高,為93.0%,團塊較大,40 d后平均直徑為2.22 cm。結構較松散,有顆粒狀態,個別塊呈水浸狀(圖2),綜合分析,MS+6-BA 0.3 mg/L+2,4-D 3.0 mg/L為較適合的愈傷誘導培養基。根據胚性愈傷組織誘導結果,適當降低培養基濃度,即6-BA濃度為0.2 mg/L、2,4-D濃度為2.0 mg/L下進行增殖培養,從圖3可以看出,在降低激素濃度的MS+6-BA 0.2 mg/L+2,4-D 2.0 mg/L上增殖培養的愈傷組織發育較好,結構較松散,顆粒狀疣突分明,水分較少,呈淡黃綠色。
2.2 植株再生
將增殖后的大塊愈傷組織轉入分化培養基上。培養20 d后顆粒狀的愈傷組織表面疣突逐漸增大并轉綠,繼而形成小植株,40 d后可以看出,8種培養基上愈傷組織都能分化出小植物株,但隨著激素配比不同分化效果存在差異。以MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L組合的胚狀體誘導效果較好,占比較高,胚狀體誘導率達91.8%;且生長均勻,無根苗很少,大部分幼苗可直接進行煉苗與移栽(表2、圖4)。MS+6-BA 0.5 mg/L+NAA 0.2 mg/L+IBA 0.2 mg/L、MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L處理雖然分化率也較高,但再生植株幼根發育不良,或有少量玻璃化苗,需進行壯苗與生根培養后才能進行煉苗與移栽。
2.3 壯苗與生根培養
從表3可以看出,將胚狀體發育過程中形成的弱小株、無根幼芽轉接于無激素的MS培養基上,培養30 d后苗壯葉茂,大多根系發育良好。健壯無根幼苗在添加IBA和IAA的1/2MS培養基上都能生根,其中培養基1/2 MS+IBA 0.1 mg/L+ IAA 0.1 mg/L上生根率100%,幼苗生長較好,苗莖均勻直立,苗高可達4.1 cm,且有新根4~6條帶側根,長約2~3 cm(表3、圖5)。
3 討論與結論
研究表明,組織培養是礬根高效快繁的最佳途徑,而在外植體的選擇上有莖尖、莖段、葉片、葉柄等材料,但以莖尖為外植體誘導效果較好,因莖尖內含芽原基細胞,有潛在的不定芽分化能力,具誘導速度較快,誘導成功率較高等優點[13 ],且莖尖培養有脫病毒、復壯優良種性的特點[14 ],此外,分生組織細胞還具胚狀體發生能力。本次試驗選用了莖尖為外植體材料,對愈傷誘導和胚狀體分化都產生了顯著影響。愈傷誘導培養中2,4-D是較理想的生長調節劑,但其不能較好的促進胚性細胞的形成,通常采用生長素2,4-D 與低濃度細胞分裂素 6-BA配合使用,才能有效促進胚性細胞的發育[15 ],本試驗在培養基MS+6-BA 0.3 mg/L+2,4-D 3.0 mg/L條件下愈傷組織誘導效果最好。增殖培養周期對體胚發生具有顯著影響[16 ],因此為了獲得優質胚性細胞以促進胚狀體的形成,可適當縮短愈傷組織的培養周期,增加其培養代數,本試驗以20 d為周期,增殖兩代后進行再分化培養,有助于提高芽苗的再生能力。再分化過程中,以MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L的組合胚狀體分化效果較好,分化率較高,但MS+6-BA 0.5 mg/L+NAA 0.2 mg/L+IBA 0.2 mg/L的幼苗不同程度上存在愈傷和玻璃化情況。降低培養基中6-BA的濃度,提高瓊脂和蔗糖的添加量對芽苗的玻璃化有一定的控制作用,但瓊脂濃度過高,硬化的培養基會影響試管苗對養分的吸收,蔗糖濃度過高時水解緩慢,同時也影響其他物質的吸收。無根不定芽在試驗生根培養基上都可誘導生根,但從生根率、平均根數及平均苗高數據分析,IBA與IAA對幼根發生率都有顯著影響,但IAA影響大于IBA,且低濃度組合更有助于幼根發生,1/2 MS+IBA 0.1 mg/L+IAA 0.1 mg/L誘導根的數量較多且質量較好。
本試驗在胚性愈傷誘導過程中,MS+2,4-D 3.0 mg/L+6-BA 0.3 mg/L是較理想的培養基組合,誘導率可達93.0%,愈傷組織在MS+2,4-D 2.0 mg/L+ 6-BA 0.2 mg/L上進行擴增后,組織塊結構松散,顆粒分明,水分較少,有利于胚狀體分化;胚狀體誘導過程中,培養基MS+6-BA 0.5 mg/L+ NAA 0.1 mg/L+IBA 0.2 mg/L上分化效果較好,胚狀體誘導率達91.8%;且芽苗生長均勻健壯,大多無需生根培養;對于弱小株和無根幼芽需轉接于無激素的MS培養基上,培養30 d后苗壯葉茂,大多根系發育良好;在生根培養基1/2MS+IBA 0.1 mg/L+IAA 0.1 mg/L上,礬根幼苗生根率100%,生長健壯,苗體均勻,高達4.1 cm,且有新根4~6條帶側根,長約2~3 cm。
參考文獻:
[1] 李春輝,黃少玲,郭 翔,等. 我國礬根研究進展[J]. 安徽農學通報,2017,23(15):109-111.
[2] 孫 翊,殷麗青,張永春,等. 礬根葉柄和葉片不定芽高效再生體系優化[J]. 上海農業學報,2020,36(6):39-43.
[3] 劉 佳. ‘焦糖’礬根的組織培養與快速繁殖[C]. 2010北京園林綠化新起點,北京,2010-1045e7ef105198fb3db0111991bdebe96a045fd1396a7f0ecdc9f0d6f6585b4548-26,254-256.
[4] 張 露,李世峰,蔣雪彬,等. 礬根花粉離休萌發培養基組分及培養條件的優化[J]. 中國農學通報,2019,
35(30):64-70.
[5] 劉 丹,王 容,吳海峰,等. 不同激素濃度和培養條件對礬根組培快繁體系的影響[J]. 安徽農業科學,2022,50(14):46-49,56.
[6] 侯非凡,程宵婧,荊曉楠,等. 礬根‘萊姆里基’愈傷組織誘導及快速繁殖技術[J]. 山西農業大學學報(自然科學版),2020,40(6):21-28.
[7] 陳 琳,盧秋霜. 礬根葉片組培技術研究[J]. 綠色科技,2021,23(30):95-97.
[8] 沙月娥,歐陽樂軍,彭 舒. 桉樹胚狀體再生與遺傳轉化的研究進展[J]. 植物生理學報,2012,48(4):325-332.
[9] 劉 敏. 花卉組織培養與工廠化生產[M]. 北京:地質出版社,2002.
[10] 譚文澄,戴策剛. 觀賞植物組織培養技術[M]. 北京:中國林業出版社,1991.
[11] 曹孜義,劉國民. 實用植物組織培養技術教程(修定版)[M]. 蘭州:甘肅科學技術出版社,1999.
[12] 王 晶,劉立功,左麗娟,等. 柔毛礬根組培快繁技術研究[J]. 北方園藝,2012(23):116-118.
[13] 卜順法,方連明,陸錦明,等. 優良地被植物“礬根”組織培養技術及其在景觀綠化中的應用[J]. 上海農業科技,2020(3):73-74.
[14] 中國科學院上海植物生理研究所,上海市植物生理學會. 現代植物生理學實驗指南[M]. 北京:科學出版,1999:26-28.
[15] 王曉春,高 婷, 楊煒迪,等. 紫花苜蓿胚性愈傷組織誘導及胚狀體分化研究[J]. 作物雜志,2023(4):98-103.
[16] 任毓輝,聶 帥,彭春雪,等. 紅松胚性愈傷組織增殖的激素配比、糖源類型和增殖周期效應研究[J]. 植物研究,2022,42(4):704-712.

