基于活細胞的微生物砷離子傳感器的性能拓展與優化




摘要 在全細胞微生物傳感器的開發中,細胞的代謝活性狀態和信號輸出形式等因素會直接影響傳感器的穩定性和可重復性等性能,給傳感器的應用開發中標準化方法的建立帶來了挑戰。本研究選擇基于Replication protein L(RepL)信號放大器的砷離子傳感器為研究對象,探究了不同條件對砷離子傳感器的檢測性能的影響。研究結果表明,細胞的培養環境、生長狀態(如不同的生長期)、報告子的類型以及誘導時長等均會對砷離子傳感器的檢測性能產生顯著影響。傳感器在不同培養基中的穩定性差別較大,其中在LB培養基中展現出更高的穩定性。同時,不同生長期的細胞也展現出不同的檢測性能優勢:在平臺生長期的細胞中,傳感器的檢測靈敏度和線性度更佳;在對數期的細胞中,檢出限更低。此外,傳感器的響應存在最優的誘導時長,過長或過短的誘導時間都會影響傳感器的響應,本研究中砷離子傳感器的最佳誘導時間約為2~3 h。通過對3 種熒光蛋白報告子的對比研究發現,熒光蛋白的選取對傳感器檢出限的影響不大(均在5~10 μg/L 范圍內),但會顯著改變傳感器的響應時間(從40 min 到2 h);同時,熒光蛋白的發光亮度越高,傳感器響應越快。本研究結果表明,可以根據不同的需求選取不同狀態的細胞,以最大限度優化細胞傳感器的檢測性能,拓展傳感器的應用空間。本研究結果為微生物傳感器在實際檢測中的應用提供了可靠的依據。
關鍵詞 砷離子微生物傳感器;培養基;細菌生長階段;熒光蛋白報告基因;響應時間
近年來,得益于合成生物學的迅猛發展[1],越來越多的微生物細胞活體傳感器被開發出來[2]。這些微生物傳感器通過在細胞膜上或細胞質中引入受體蛋白,使其能夠與特定的化學物質或重金屬離子結合[3]。然后,通過信號傳導級聯效應[4-5],最終改變報告基因的轉錄活性,實現長期檢測。與傳統的化學和生化檢測方法不同,合成生物學的微生物傳感器檢測方法直接涉及活細胞內的基因表達活動。鑒于活細胞生物傳感器的信號輸出依賴于細胞一系列的生理過程,盡管微生物傳感器能夠實現比傳統檢測方法更低的檢出限或更高的靈敏度,但由于基因表達過程的復雜性,如轉錄和翻譯過程,影響其檢測結果的變量遠多于傳統的檢測方法。
目前,大多數微生物活細胞傳感器的研究側重于特定分子環路的設計以及對環路元件等細節的優化,通常忽視了微生物本身的生理狀態對用于檢測的分子環路的信號輸出可能產生的影響。同時,基因表達在不同階段的調控會在一定程度上影響微生物傳感器的穩定性,也為微生物傳感器實際檢測中標準化方法的建立提出了嚴峻的挑戰。考慮到上述因素的復雜性和多樣性,并處于實時動態變化之中,無法通過控制變量的方式逐一研究其對設計的分子環路的影響,因此,可以將微生物的宏觀表型,如生長速度和生理狀態等,作為這些因素的總和,并將其作為單一變量,測試其對微生物傳感器的影響。同時,通過改變輸出信號端的報告基因,可以研究輸入信號端和輸出信號端之間的關系,以降低這些宏觀因素對微生物傳感器的影響,從而為進一步優化微生物傳感器的檢測性能提供切實可行且簡便的方法。
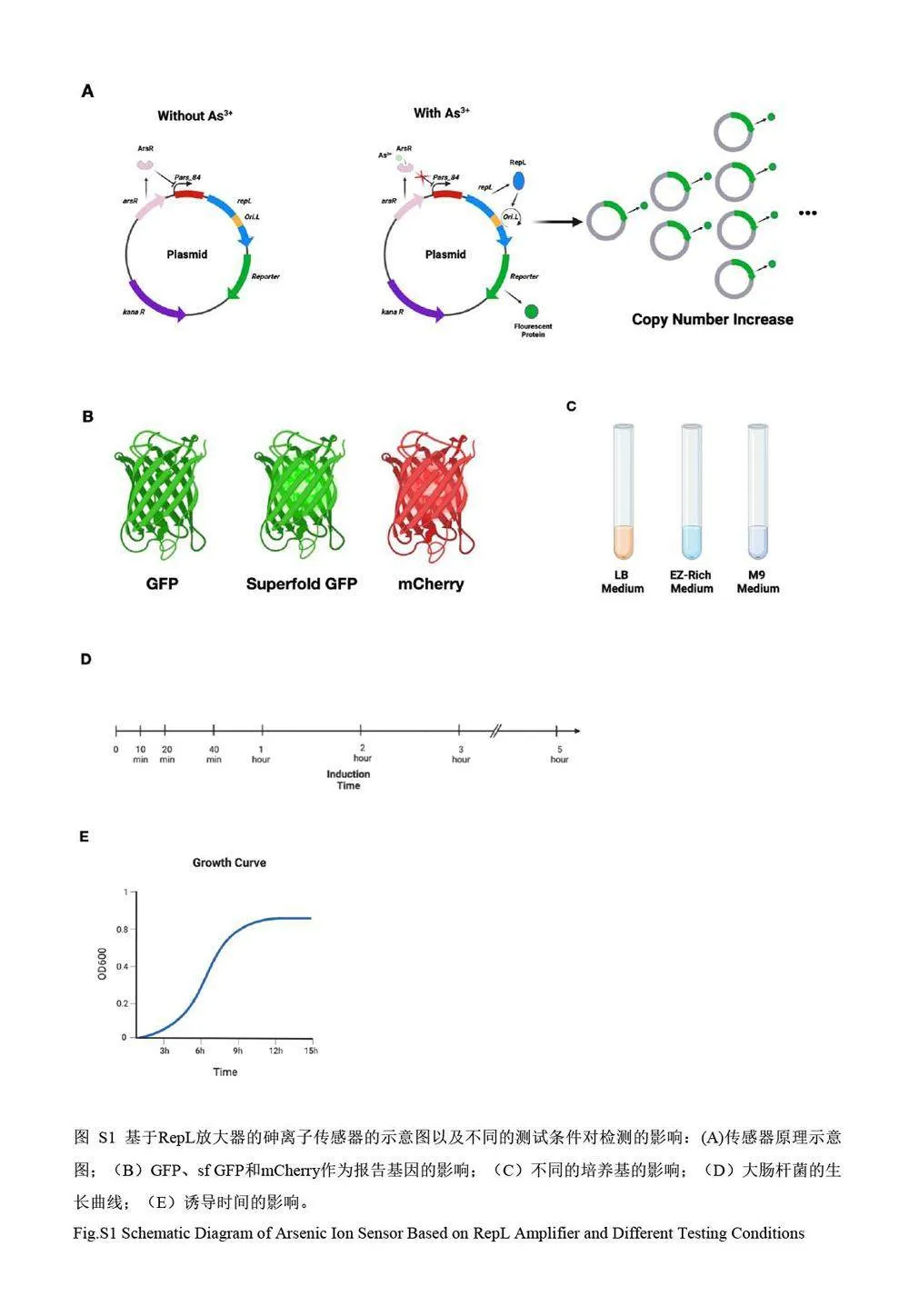
本研究利用基于Replication protein L(RepL)信號放大器[6-8]的砷離子傳感器作為研究對象,對影響微生物傳感器性能的參數進行了詳細研究。Rep L 是噬菌體P1 DNA L 復制子(Replicon L)內部的一個長度為281 個氨基酸的開放閱讀框編碼蛋白質。在裂解周期(Lytic cycle)內,該蛋白可與L 復制子相互作用,完成噬菌體DNA 的復制,從而實現噬菌體增殖[9]。由于Rep L 基因位于As3+誘導表達的啟動子之后,因而可以通過改變As3+濃度實現對Rep L 蛋白的表達控制;Rep L 蛋白可與位于其DNA 序列內的復制起始位點OriL 結合,調控工作質粒的拷貝數,通過基因數目的擴增實現As3+響應信號的放大(示意圖見電子版文后支持信息圖S1)。通過對3 組以不同熒光蛋白作為輸出信號的細胞傳感器進行對比測試,考察了不同的信號輸出形式和操作條件對傳感器性能的影響。
1 實驗部分
1.1 儀器、材料與試劑
Arhat 96 梯度PCR 儀(莫納生物科技有限公司);SPARKTM 多功能微孔板檢測儀(瑞士TECAN 公司);Sigma 3K15 臺式高速離心機(德國Sigma 公司);NanoDropTMOne/OneC 微量紫外可見光分光光度計(美國賽默飛世爾科技公司);PTX-JA210S 分析天平(華志電子科技有限公司);IS-RSDS 恒溫振蕩器(美國CRYSTAL 公司);D1008E 掌上離心機(大龍興創實驗儀器股份公司);Micro Pulser 電穿孔儀(美國BIO RAD 公司)。
質粒pMT012[10]和pMT018[10]由本實驗室在前期工作中構建, pASQ_mCherry 質粒是以pMT012 為載體改造而來(具體構建過程見電子版文后支持信息)。分別將以上3 個質粒通過熱激的方法轉化至DH5α的化學感受態細胞中,得到3 種細胞傳感器菌株DH5α(pMT012)、DH5α(pMT018)和DH5α(pASQ_mCherry),將3 種菌株細胞于–80 ℃凍存,待用。
SalI(1080S)和SphI(1246S)Restriction Enzyme(寶日醫生物技術(北京)有限公司);DpnI RestractionEndonuclease(美國New England Biolabs 公司);T4 DNA ligase(EL0011)、GeneJET Plasmid MiniPrep Kit(K0502)、GeneJET PCR Purification Kit(K0702)和GeneJET Gel Extration Ki(K0691)(美國賽默飛世爾科技公司);2 × Phanta Flash Master Mix PCR kit(P510,南京諾唯贊生物科技股份有限公司);As3+標準溶液(分析純,北京譜析標準技術有限公司);氨芐青霉素儲存液(100 mg/mL, A1170)、硫酸卡那霉素(K1030)、胰蛋白胨OXOID(LP0042K)、瓊脂粉(A8190)、酵母提取物(Y8020)和DH5α感受態細胞(C1100)(北京索萊寶科技有限公司);1×PBS 緩沖液(G4202-100ML,武漢塞維爾生物科技有限公司);PCR 引物pASQ vet F(5′-GCGTCGACATATTTTCCTCCTGGAAAGCTTCATTAC-3′)、pASQ vct R(5′-ACGCGCATGCTAACGACTCAGGCTGCTACTG-3′)、pASQ mCherry F(5′-GCGTCGACATGGTGAGCAAGGGCGAGGAGGATAAC-3′)和pASQ mCherry R(5′-ACGCGCATGCTTACTTATACAGCTCGTCCATGCCGCCGGT-3′)(吉林省庫美生物科技有限公司)。如無特殊說明,實驗用水均為去離子水。
1.2 實驗方法
1.2.1 基于不同報告子和培養基條件的測試
將–80 ℃凍存的DH5α(pMT012)、DH5α(pMT018)和DH5α(pASQ_mCherry)菌株取出,分別在含有卡那霉素的瓊脂平板上劃線,于37 ℃恒溫箱中培養過夜以獲取單克隆。第2 天,分別從培養平板上挑取3 種菌株的單克隆,接種到含有硫酸卡那霉素的5 ml LB 液體培養基中, 37 ℃恒溫搖床(250 r/min)培養過夜。測定3 種菌液在600 nm 的光密度(OD600)值,然后分別稀釋、轉接到2 mL 新鮮的LB 培養基、EZ-Rich 培養基和M9 培養基中,至OD600≈0.01, 37 °C 恒溫搖床(250 r/min)培養2~3 h,直到菌液的OD600≈0.4,即大腸桿菌處于指數/對數生長期。取適量As3+標準儲存液分別添加到上述菌液中,使As3+終濃度分別為0、0.1、0.5、1.0、5.0、10、30、50、80 和100 μg/L,繼續培養5 h,使菌株在As3+刺激下產生響應。
1.2.2 基于細菌不同生長狀態的測試
在瓊脂平板上挑選pMT012、pMT018 和pASQ_mCherry 的單克隆菌落,加入到含有硫酸卡那霉素的LB、EZ-Rich和M9液體培養基中, 37 ℃恒溫搖床(250 r/min)培養過夜。對于遲滯期(Lag phase)與平臺期(Stationary phase)進行的誘導實驗,分別將上述過夜培養的菌液在新鮮培養基中稀釋至OD600≈0.01 和1,并按照預先設定的As3+濃度梯度加入As3+標準儲存液, 37 ℃恒溫搖床(250 r/min)培養5 h, 取出樣本測試其熒光強度。對數期誘導實驗的實驗過程和條件與1.2.1 節相同。
1.2.3 基于不同誘導時長的測試
首先在pMT012、pMT018 和pASQ_mCherry 瓊脂平板上挑取單個菌落,接種到含硫酸卡那霉素的LB 液體培養基中, 37 ℃恒溫搖床(250 r/min)培養過夜。分別在新鮮的LB、EZ-Rich 和M9 液體培養基中稀釋至OD600≈0.01,繼續培養2~3 h, 或者至菌液的OD600≈0.4。然后,加入適量的As3+標準液至其終濃度為10 μg/L, 繼續誘導培養。在誘導的第10 min、20 min、40 min、1 h、2 h、3 h 和5 h 的時間點分別取出相應的菌液,進行后續的測試。
1.2.4 熒光測試
每種測試條件下的細菌菌液各取出500 μL, 以13000 r/min 離心1 min, 棄上清液,收集菌體;加入500 μL PBS 緩沖液進行洗滌, 13000 r/min 離心1 min,棄上清液;采用適量的PBS 緩沖液重懸細菌細胞,使細菌終濃度為OD600≈0.2~0.8。
取200 μL 重懸菌液加入到96 孔板中,使用酶標儀測定不同條件下細菌的OD600 和熒光強度值,以PBS 緩沖液作為對照。對于GFP 和sfGFP,激發波長為475 nm,檢測515 nm 處的熒光強度值作為輸出信號。對于mCherry,激發波長為560 nm, 檢測610 nm 處的熒光強度值作為輸出信號。各實驗均進行3 組平行實驗。
2 結果與討論
2.1 不同培養基條件下As3+的響應
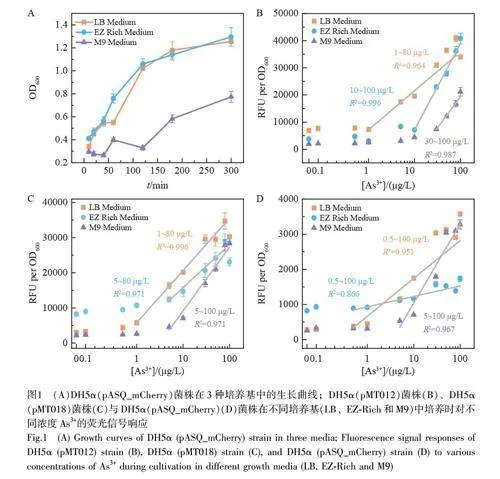
對比了3 種菌株(DH5α(pMT012)、DH5α(pMT018)和DH5α(pASQ_mCherry))在3 種培養基(LB、M9 和EZ rich)中對不同濃度As3+的響應。圖1A 為DH5α(pASQ_mCherry)菌株在3 種培養基中的生長曲線,細胞在M9 中的生長速度遠低于另外兩種培養基,因為M9 是貧乏培養基,細胞在其中生長速度較慢;在豐富培養基LB 和EZ-Rich 中細胞均展現出較快的生長和繁殖速度。其它兩個菌株也表現出了相同的趨勢。
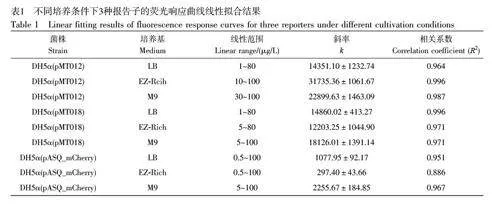
圖1B~1D 顯示了3 種菌株分別在不同的培養基中對不同濃度As3+的響應情況。結果表明, 3 種菌株在不同的生長環境中均在一定濃度區間內具有線性響應,但是不同培養基中的線性范圍差異較大。不同培養條件下3 種報告子的線性擬合結果見表1, DH5α(pMT012)菌株在LB 和EZ-Rich 中的線性范圍較寬,分別為1~80 μg/L 和10~100 μg/L,但是在M9 中的線性范圍明顯變窄,只有30~100 μg/L;DH5α(pASQ_mCherry)展現出類似的趨勢;而DH5α(pMT018)菌株的結果有所不同,在EZ-Rich 培養基中顯示出較窄的線性范圍。上述結果說明,傳感器檢測的線性范圍與培養基和報告基因的性質均密切相關。綜上,不同菌株在LB 培養基中的線性范圍變化較小,在其它兩種培養基中,線性范圍在不同報告基因的傳感器中變化較大。
3 種菌株在M9 培養基中對As3+的檢出限高于LB 和EZ-Rich,推斷可能是由于M9 屬于貧乏培養基,整體的蛋白合成和DNA 復制等過程處于較低水平,在較低濃度(如1 μg/L)As3+的誘導下,難以產生足夠的質粒拷貝數,最終導致熒光強度較低。DH5α(pMT012)和DH5α(pMT018)菌株在LB 中表現出更穩定的線性區間(1~80 μg/L)和斜率(約14500)。與LB 相比, DH5α(pMT012)菌株在EZ-Rich 中展現出相對更高的靈敏度, DH5α(pASQ_mCherry)菌株的檢測范圍更寬,但檢測靈敏度很低,而DH5α(pMT018)的檢測靈敏度和線性范圍位于兩者之間。這些結果表明,盡管EZ-Rich 培養基成分更簡單,理論上背景熒光信號應更低,但在3 種菌株中呈現出較差的穩定性。這可能因為與基于天然提取物的LB 培養基相比,由多種無機鹽組成的EZ-Rich 培養基成分相對簡單,由于細菌內部生理狀態之間存在隨機差異,成分相對簡單的EZ-Rich 培養基可能會放大這種差異。與此相反, LB 培養基由于營養成分更復雜和豐富,掩蓋了細菌群體內部生理狀態之間的隨機差異,因此呈現出更穩定的測試性能。
2.2 細菌在不同生長狀態下對As3+的響應
細菌在培養過程中的生長通常分為遲滯期(Lag phase)、對數期(Exponential phase)、平臺期(Stationaryphase)和衰亡期(Decline phase)4個階段[11],其中,前3個階段為活細胞最重要的時期。以往的研究中,微生物傳感器大多集中在細菌的對數期進行檢測[12],目前還沒有對其它2 個時期的檢測性能進行研究的報道。
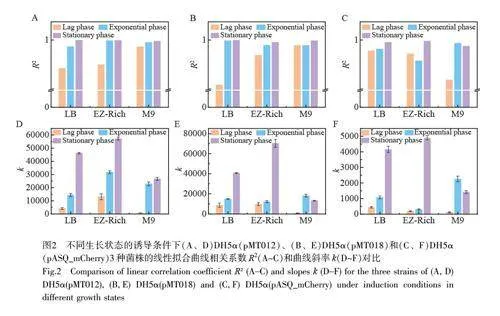
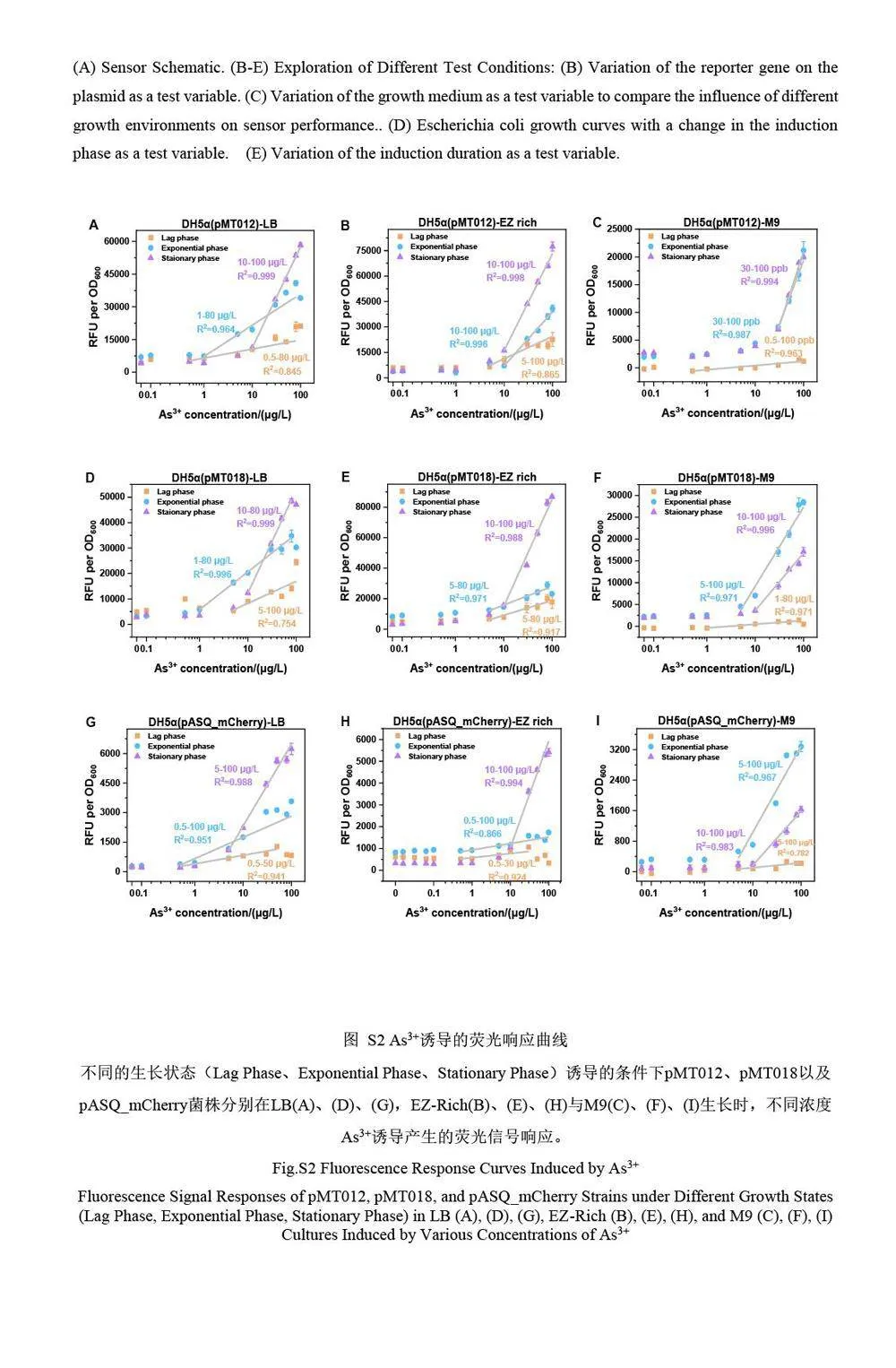
本研究分別對3 種菌株的不同的生長階段的菌體細胞對As3+的響應進行了對比研究(圖2 和電子版文后支持信息S2)。結果表明,傳感器在細菌不同生長階段對As3+的響應明顯不同,并且這種差異在3 種菌株中表現出一些共性(電子版文后支持信息S2)。首先,在遲滯期誘導的細菌均表現出很低的熒光信號響應,并且與菌株和培養基條件無關。遲滯期的細菌代謝活躍,大量合成細菌分裂所需的酶類、ATP以及其它細胞成分,為細菌分裂做準備,這一時期細菌的主要任務是積累物質和能量,對環境的刺激不太敏感[11],因此,遲滯期的細菌不適合用于檢測。在LB 和EZ-Rich 培養基中, 3 種菌株的平臺期誘導組相對于指數生長期組表現出更好的線性特性和更高的熒光信號。對比擬合曲線的斜率發現,在較高濃度范圍(10~100 μg/L)內, LB 和EZ-Rich 中平臺期的細菌響應靈敏度明顯高于對數期。然而,在M9 培養基中卻展現出了完全不同的結果, M9 培養基中平臺期的響應與對數期基本一致(如DH5α(pMT012))或更差(如DH5α(pMT018)和DH5α(pASQ_mCherry))。這可能是因為M9 培養基中細菌的生長環境營養缺乏,處于半饑餓狀態,細菌的生理狀態與平臺期處于饑餓狀態的細菌相似。因此,對數期與平臺期細菌生理狀態和代謝活性相差較小,傳感器對As3+的響應也更接近。
對比3 種菌株分別在不同生長階段誘導的線性曲線方程的相關系數(R2,圖2A~2C,以及電子版文后支持信息表S1)可知,平臺期細菌傳感器在其線性范圍內普遍表現出更優異的線性響應,穩定性較好;遲滯期和對數期的細菌的線性響應程度隨培養基和報告子的改變均會發生變化,并且在某些條件下線性響應很差,這種現象在遲滯期尤為明顯,進一步證實了遲滯期的細菌不適合作為微生物傳感器用于實際檢測。采用擬合線性曲線的斜率(k)表征細菌傳感器在其線性范圍內的靈敏度(圖2D~2F,電子版文后支持信息表S1),在兩種豐富培養基中, 3 種菌株的平臺期細菌的檢測靈敏度也均遠高于其它兩個生長階段的細菌,進一步顯示了利用平臺期細菌改善傳感器性能的巨大潛力。
雖然平臺期的細菌具有更好的線性響應和更高的靈敏度,但是其線性范圍明顯比對數期和遲滯期的細菌更窄。推測這可能因為在遲滯期或者對數生長期,細菌的大部分蛋白質表達系統用于與生長相關的基因表達,如各種rRNA 和核糖體大小亞基蛋白等[13];而在平臺期的細菌,由于生長速度下降,細菌內的轉錄和翻譯系統可以表達更多與生長無關的基因和蛋白質,這可能導致平臺期的檢出限較高。此外,由于平臺期營養物質逐漸缺乏,細菌更容易進入應激狀態[14],從而導致包括金屬離子外排蛋白質[15]的表達上調,進一步影響其在低濃度條件下的檢測性能。
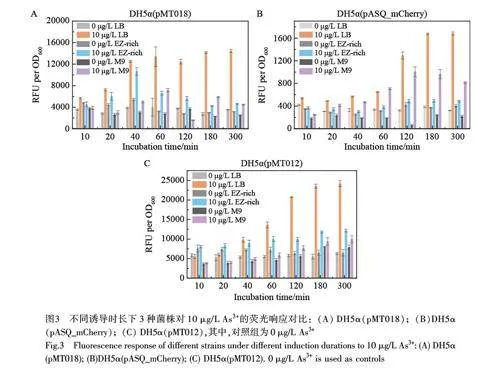
2.3 不同誘導時長條件下As3+的響應
本研究測試了3 種菌株在不同誘導時長內對10 μg/L As3+的響應,結果如圖3 所示, 3 種菌株在LB培養基中均表現出了更靈敏的響應和更高的熒光強度,在5 h 內均表現出穩定的高表達,這可能是由于LB 培養基營養豐富,能夠長時間支持熒光蛋白的高表達。與此相反, EZ-Rich 和M9 培養基中熒光信號相對較弱,并且隨著誘導時間延長,信號增強程度較小,甚至在DH5α(pASQ_mCherry)菌株中誘導2 h 后出現了熒光信號下降的趨勢。此外, DH5α(pASQ_mCherry)在EZ-Rich 中的響應低于在LB 和M9 中的響應。3 種菌株在所有培養基中誘導2~3 h 條件下,砷離子傳感器均表現出較高的信號響應,表明此傳感器最佳誘導時長約為2~3 h。上述結果表明,傳感器的響應時間均在數小時內,誘導時間并非越長越好,實際檢測中應根據具體的傳感器和培養環境選擇最佳的誘導時長。
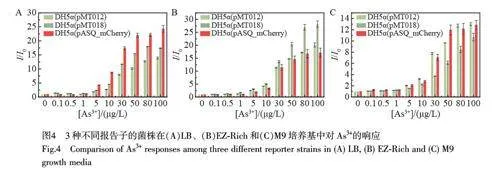
2.4 不同報告基因響應的對比
不同熒光蛋白的發光性質(包括量子效率、發光亮度和成熟時間等)存在較大的差異,選取不同的熒光蛋白作為輸出信號是否會影響傳感器的性能,目前還沒有明確的研究結論。本研究對基于3 種報告子(GFP、sfGFP 和mCherry)的細胞傳感器進行了對比。鑒于3 種熒光蛋白報告子的發光性質相差較大,對3 種菌株的相對熒光強度(即不同As3+濃度下各菌株的熒光強度I 與[As3+]=0 時的熒光強度I0 的比值)進行對比(圖4)。結果表明,不同的熒光蛋白的亮度差別較大, mCherry 的發光亮度遠低于GFP 和sfGFP,但是, DH5α(pASQ_mCherry)響應的最低濃度與其它兩個菌株差異較小,均在5 μg/L 時具有較明顯的響應。此外,盡管3 種菌株在不同的培養基中的響應程度存在差異,但這種差異不具有規律性,在LB 中DH5α(pASQ_mCherry)的響應程度更大, EZ-Rich 中DH5α(pMT018)的響應更明顯,而M9 中DH5α(pMT012)和DH5α(pASQ_mCherry)均表現出較強的信號響應。這種差異可能是檢測誤差或細菌生理活性等因素導致的隨機變化。以上結果表明,發光強且發光效率高的熒光蛋白不一定具有更優的信號響應。
通過與上述圖3 結果對比發現, 3 種不同報告子菌株的響應時間不同,在菌株DH5α(pMT018)和DH5α(pMT012)中, As3+誘導20~40 min 時, LB 和EZ-Rich 中培養的pMT018 菌株已經開始出現響應,而在LB 中生長的DH5α(pASQ_mCherry)需要60~120 min 時才出現明顯的響應,這可能與GFP 和mCherry的發光亮度和量子產率存在很大差異有關。與GFP 相比, mCherry 的發光效率和亮度較差[16],這說明選擇熒光蛋白作為報告子時,熒光蛋白的發光性能至關重要,在傳感器可選擇的范圍內應盡量選擇量子產率和熒光亮度較高的蛋白。熒光蛋白在發光之前需要經歷轉錄、翻譯和折疊等步驟,其中,折疊過程占據了大部分時間,該過程通常稱為蛋白質的成熟時間,只有正確折疊的成熟熒光蛋白分子才會產生發色團。DH5α(pMT012)和DH5α(pMT018)菌株的報告子熒光蛋白分別為sfGFP 和GFP,兩者最大的區別在于成熟時間。熒光蛋白的成熟時間可能會影響傳感器的響應速度,但本研究結果表明,雖然sfGFP 的成熟時間(幾分鐘)比GFP(~40 min)短很多[17],但快的成熟速度并未明顯縮短傳感器的響應時間。因此,傳感器的響應時間不僅與報告蛋白的折疊速度有關,還可能受報告子蛋白和傳感器調控環路中轉錄因子的成熟速度共同影響,為提高傳感器的響應速度,需要同時縮短二者的成熟時間。
3 結論
對比了3 種菌株(DH5α(pMT012)、DH5α(pMT018)和DH5α(pASQ_mCherry))在不同的宏觀因素(如生長環境、細菌生長狀態和As3+誘導時長)條件下,基于Rep L 放大環路的微生物傳感器的檢測性能。實驗結果表明,這些宏觀因素對于微生物活細胞傳感器的檢測性能具有顯著影響。采用LB 培養基可獲得更穩定的測試效果,平臺期的細菌在較高濃度(5~100 μg/L)As3+的誘導下具有更好的線性響應和靈敏度。在實際樣品的檢測過程中,可根據檢測需要合理選擇測試條件。同時,考察了不同的熒光蛋白作為輸出信號對傳感器性能的影響。熒光蛋白的發光性質對傳感器的性能(尤其是響應速度)至關重要,采用量子效率和發光亮度高的熒光蛋白會縮短傳感器的響應時間,這為開發快速響應的微生物傳感器提供了理論依據和可行性策略。由于生物系統自身的復雜性,影響基因表達的因素多種多樣,難以確定某個具體因素。但是,作為宏觀表型的細菌生長狀態可作為降低這些因素影響的重要參考,為優化微生物傳感器的檢測性能提供切實可行和簡單便捷的方法,在微生物傳感器的應用和標準檢測方法的建立方面具有重要意義。
References
[1] MENG F, ELLIS T. Nat. Commun. , 2020, 11(1): 5174.
[2] KIM H J, JEONG H, LEE S. Anal. Bioanal. Chem. , 2018, 410: 1191-1203.
[3] BONTIDEAN I, BERGGREN C, JOHANSSON G, CS?REGI E, MATTIASSON B, LLOYD J R, JAKEMAN K J, BROWNN L. Anal. Chem. , 1998, 70(19): 4162-4169.
[4] TYSON J J, CHEN K C, NOVAK B. Curr. Opin. Cell Biol. , 2003, 15(2): 221-231.
[5] ALON U. Nat. Rev. Genet. , 2007, 8(6): 450-461.
[6] GARDIOL D, GRAMAJO H C, HIRSCHBEIN L, MENDOZA D. Gene, 1993, 123(1): 39-44.
[7] ONGENAE V, AZEREDO J, KROPINSKI A M, ROZEN D, BRIEGEL A, CLAESSEN D. Sci. Rep. , 2022, 12(1): 17785.
[8] MOCHIZUKI S, HIRATSU K, SUWA M, ISHII T, SUGINO F, YAMADA K, KINASHI H. Mol. Microbiol. , 2003, 48(6):1501-1510.
[9] HANSEN E B. J. Mol. Biol. , 1989, 207(1): 135-149.
[10] LI J, CUI M, ZHAO J, WANG J, FANG X. Biosens. Bioelectron. , 2023, 221: 114937.
[11] PELEG M, CORRADINI M G. Crit. Rev. Food Sci. Nutr. , 2011, 51(10): 917-945.
[12] BEREZA-MALCOLM L T, MANN G L, FRANKS A E. ACS Synth. Biol. , 2015, 4(5): 535-546.
[13] DRYSELIUS R, IZUTSU K, HONDA T, IIDA T. BMC Genom. , 2008, 9(1): 559.
[14] VOGT S L, SERAPIO-PALACIOS A, WOODWARD S E, SANTOS A S, DE VRIES S P, DAIGNEAULT M C,BRANDMEIER L V, GRANT A J, MASKELL D J, ALLEN-VERCOE E. Gut Microbes, 2023, 15(1): 2190303.
[15] DAS S, DASH H R, CHAKRABORTY J. Appl. Microbiol. Biotechnol. , 2016, 100(7): 2967-2984.
[16] PADILLA-PARRA S, AUDUGé N, LALUCQUE H, MEVEL J C, COPPEY-MOISAN M, TRAMIER M. Biophys. J. , 2009,97(8): 2368-2376.
[17] SHASHKOVA S, WOLLMAN A J, HOHMANN S, LEAKE M C. Bio-protoc. , 2018, 8(2): e2710.

