三維打印技術在色譜分離中的應用



摘要 色譜法是生產活動和學術研究中最重要的分離分析技術之一。隨著應用需求的日益增長,開發具有針對性的分離裝置成本高昂,同時由于模型制作困難,色譜理論研究通常難以得到驗證。三維(3D)打印技術通過堆砌材料的方式自下而上地制造器件,可以針對特定需求自定義打印復雜結構,具有低成本、低廢料、高精度、高自由度和平行制造等優勢,在色譜分離領域展現出巨大的應用潛力。近年來,隨著3D 打印技術的飛速發展,打印分辨率和打印速度不斷提高,可打印的材料種類也大幅增加, 3D 打印技術在色譜分離領域得到了初步的研究和應用。本文介紹了3D 打印技術在色譜分離研究領域中的最新應用進展,包括3D 打印色譜柱管、3D 打印色譜固定相和3D 打印固相萃取器件,討論了3D 打印技術在色譜領域應用的現有挑戰和應用前景。
關鍵詞 色譜分離;三維打印;分離技術;評述
色譜分離利用不同分析物在流動相和固定相兩相之間的相互作用差異實現各組分的拆分。目前,色譜分離技術已在藥物純化、環境監測和實驗研究等諸多領域發揮了重要的作用。受傳統制造工藝的限制,經典色譜分離媒介為色譜柱,通常為圓柱形柱管和顆粒填充或整體聚合形成的柱床[1-3],這在很大程度上限制了色譜分離的理論研究和實際應用。一方面,許多色譜理論由于難以進行實物驗證,導致其研究僅停留在理論計算層面;另一方面,新的色譜應用通常需要現場分析,亟需將龐大的色譜分離系統進行集成化與小型化。同時,固定化的色譜分離模塊和器件難以應對日益復雜的分離需求,快速定制針對特定分離需求的解決方案是色譜分離應用的難點。為解決上述色譜研究與應用難題,提高色譜分離效率以及拓展色譜應用潛力、發展新的制造技術至關重要。三維打印技術(Three-dimensional printing, 3Dprinting)又稱為增材制造技術(Additive manufacturing, AM),是通過材料單元的堆積、組裝和聚合等過程,自下而上地實現物件的制造。自下而上的制造模式使得3D 打印技術不僅能輕松制造出具有復雜結構的加工件,同時生產過程幾乎不產生廢料,特別適合非標準零件和定制化器件的快速制造。目前,基于擠出成型、光固化成型和粒狀物料成型等原理, 3D 打印技術已經發展出多種加工技術,能夠應對不同材料、加工精度以及制造尺寸的打印需求,在醫療、航空航天、工業制造和科研等領域得到廣泛的研究與應用[4-8]。基于可高度自定義的制造能力和快速制造的特點, 3D 打印技術已成為解決上述色譜分離難題的有力工具,并在色譜機理研究和應用領域展開了初步嘗試和探索,如3D 打印色譜柱管、3D 打印色譜固定相和3D 打印固相萃取系統等[9-11]。基于此,本文綜述了3D 打印技術在色譜分離領域的應用進展,包括3D 打印技術的發展概況、3D 打印技術在色譜各個領域近十年的發展和應用現狀以及3D 打印技術在色譜領域的應用前景和挑戰。
1 3D打印技術概況
3D 打印技術又稱增材制造技術、快速成形技術(Rapid prototyping, RP)或快速原型制造技術(Rapidprototyping manufacturing, RPM)。作為一種制造技術, 3D打印基于自下而上(Bottom-up)的工作流程將材料單元堆積、組裝和聚合形成實體裝備,具有制造自由度高、無廢料和易制造復雜結構等優勢。1977 年,Swainson 在專利“Method, medium and apparatus for producing three dimensional figure product”中首次提出3D 打印的概念[12]。1984 年, Hull 提交了第一份立體光固化成型設備專利,并隨后發布了第一臺商品化3D 打印機[13]。
3D 打印技術的快速商品化極大地推動了其發展進程,并衍生出豐富的技術門類。其中,光固化成型(Vat photopolymerization)技術是最早出現的3D 打印技術,主要通過曝光聚合物單體溶液,可控地引發聚合反應來構筑器件[14],具有出色的分辨率,已成為3D 打印精細結構的首選技術;熔融沉積成型(Fuseddeposition modeling, FDM)技術依靠可移動的噴頭使熱熔性材料在特定位置凝固堆積[15],實現3D 打印,具有成本低廉、材料選擇范圍廣和打印器件機械性能好等優勢,是應用最廣泛的3D 打印技術。此外,還有噴墨3D 打印(Inkjet-based printing, IBP)[16]、定向能量沉積(Directed energy deposition, DED)[17]、分層實體制造(Laminated object manufacturing, LOM)[18]以及粉末床熔融(Powder bed fusion, PBF)[19-20]等技術(圖1)。基于技術原理的不同,上述技術門類還能被進一步細分,例如,光固化成型技術可分為立體光刻(Stereolithography, SLA)[21]、數字光處理(Digital light processing, DLP)[22]、液晶顯示(Liquid crystaldisplay, LCD)[23]、雙光子聚合技術(Two-photon polymerization, TPP)[24]以及連續液面生成(Continuousliquid interface production, CLIP)[25]等子技術。雖然面對的使用場景和需求有所不同,但提高3D 打印的精度與打印速度始終是各種3D 打印技術發展的首選方向。
除了發展各類3D 打印制造技術外, 3D 打印材料的種類也隨著材料科學的發展而逐漸豐富,諸如生物材料[26-27]、水凝膠[28-29]、陶瓷[30]和光子晶體[31]等新型打印材料已成功應用于3D 打印技術,極大地拓寬了3D 打印技術的制造能力和應用范圍。在打印技術與打印材料的協同發展下, 3D 打印技術獲得了更強大的制造能力,在工業生產以及科學研究中得到了更廣泛的應用,其中就包括了色譜分離領域。
2 3D打印技術在色譜分離中的應用
在分析化學領域中, 3D 打印技術主要被用于構建復雜或非標準化的分析系統硬件,包括樣品制備[32]、分離[33]、微流體[34]、檢測器[35]和傳感器[36]等組件,以此作為一種硬件制造的補充方案或擴寬原始系統功能。在色譜分離領域中, 3D 打印技術的應用仍處于萌芽階段,主要集中在色譜柱管制備、色譜柱床構建以及定制化色譜器件等方面。
2.1 3D打印色譜柱通道和柱管
高效液相色譜技術作為一項重要的分析技術,其廣泛的樣品適用性和快速高效的分離能力可以滿足眾多領域的分離純化需求。經典的高效液相色譜儀主要由溶劑輸送系統、進樣系統、分離系統、溫控系統和檢測系統構成,各組件模塊化的設計制約了儀器的小型化與便攜性。與傳統的減材制造技術不同, 3D 打印技術可以自由設計并制造復雜的微結構器件,并在實驗室中實現非標準零件的快速制備,為構建功能集成的小型便攜式液相色譜系統提供了可能。
2014 年, Sandron 研究組[37]首次采用選擇性激光融化技術(SLM)直接制造了鈦合金材質的毛細管柱通道。通過雙層螺旋結構的設計,在5 mm×30 mm×58 mm 的硬件空間內成功制造了內徑為0.9 mm、長為600 mm 的柱通道。鈦合金材料具有耐高壓、熱穩定性高以及優異的導熱效率等特點,采用鈦合金材料打印柱管時,可在承受較高的流體壓力的同時實現柱溫的快速靈活調控;此外,通過在色譜柱下方裝載30 mm×30 mm 帕爾帖熱電冷卻模塊(PTM)的方式進一步集成了柱溫箱的功能。在打印柱管內分別用反相C18 硅膠填料填充和原位整體聚合的方式制備了兩種色譜柱,成功分離了苯酮混合物,初步驗證了其用于色譜分離的可行性。盡管實際分離性能有限,但作為一種基于3D 打印的小型化色譜柱系統仍存在較大的優化空間。Paull 研究組[38]改進了該系統的聚合物整體柱配方,通過集成的熱電模塊控制分離柱溫,成功實現了10 種蛋白質混合物的溫度梯度分離。
使用3D 打印實現柱通道小型化的方案同樣適用于氣相色譜(GC)技術。Lucklum 研究組[39]通過高分辨的立體光固化成型(SLA)打印機在36 mm×36 mm×18 mm 模塊內制造了內徑為1 mm、長度為450 mm 的平面螺旋和堆疊螺旋的氣相色譜通道,用于分離水果儲存過程中產生的乙烯氣體。通過在打印色譜柱管內填充Carbosieve?-SII 微球作為固定相進行色譜分離,與通道更長的平面矩形硅基柱相比,3D 打印的螺旋柱管具有更高的固定相堆積密度、分析靈敏度及基線分辨率。采用此3D 打印的氣相色譜柱分離檢測乙烯分子時,檢出限為35 ppb(10–9),并且目標信號不與環境濕度信號重疊。該研究組進一步優化了乙烯傳感器系統,乙烯分子的檢出限低至2.3 ppb[40]。然而,使用聚丙烯酸酯材質打印的色譜通道在45 ℃恒溫條件下工作時,聚合物材料有限的熱穩定性會嚴重干擾目標信號,這在一定程度上限制了有機聚合物材料在氣相色譜中的應用;與此相反,具有高導熱性與熱穩定性的金屬材料更適合作為高溫氣相色譜的柱管材料。Lee 研究組[41]基于直接金屬激光燒結成型(DMLS)3D 打印技術在34 mm×33 mm×2 mm 的平面上集成制造了總長1 m、內徑為0.5 mm的鈦合金方形螺旋氣相色譜通道,并在微通道內壁涂覆聚二甲基硅氧烷固定相(OV-1),用于烷烴、芳烴、醇和酮類氣體混合物的色譜分離。該打印氣相色譜柱具有良好的色譜分離性能,在分離過程中未觀察到明顯的色譜峰拖尾或通道氣體滲漏等問題。
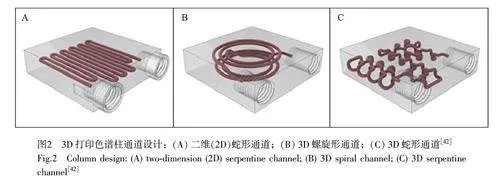
除了能將較大柱長的色譜柱進行小型化與高度集成化外, 3D 打印高度自定義的制造能力還能用于探究柱通道的幾何形狀對色譜分離效率的影響。Paull 研究組[42]分別設計并制造了等長的3 種通道結構(2D 蛇形、3D 蛇形和3D 螺旋形)的3D 打印柱管(圖2),并比較了3 種色譜柱的液相分離效果,結果表明, 3D 蛇形通道的色譜柱分離性能最優,同時卷曲匝數的增加有助于提高色譜的分離性能。該工作展示了3D 打印技術在研究色譜復雜結構動力學上的潛力與優勢。
2.2 3D打印色譜柱床
經典的色譜柱床主要采用球形固定相顆粒在高壓下堆砌而成。由于球形填料所配制的勻漿液黏度較低且非牛頓流體現象較弱,有利于在高壓勻漿填充時獲得相對有序的密堆積結構,從而獲得緊密的柱床和較一致的色譜性能[43-46]。但是,傳統高壓勻漿制柱法的填料堆砌過程隨機不可控,難以對填充柱床展開色譜動力學的定量研究,因此,目前對色譜柱床結構的研究更多地停留在理論計算或表征的層面,抑或是通過微加工技術制造微柱陣列柱來進行研究[47-49]。3D 打印可以低成本制造具有復雜微結構的色譜器件,為研究色譜柱動力學研究提供了一種全新方法。
Fee 研究組[50]采用計算機輔助設計(CAD)與立體光刻技術(STL),設計并打印了簡單立方堆積、直通型和人字形3 種有序柱床結構,并且色譜柱的接口、分流器、柱管以及柱床等作為一個整體一次性打印獲得。該打印色譜柱的工作流量和保留時間分布與結構設計時的理論預測結果相當,證明采用3D 打印技術構建的百微米尺度的有序微結構色譜柱床具備良好的保真度。在相同堆積結構(簡單立方堆積)條件下,該研究組進一步考察了不同堆積顆粒的形狀對色譜性能的影響[51],包括八面體、四面體、星形八面體和截棱二十面體等。結果表明,有序堆積的四面體結構獲得了最低的塔板高度,該結論挑戰了球形作為“理想”最佳填料幾何形狀的慣有認知。盡管在目前的實驗條件下得出“最佳填料幾何形狀”的結論為時尚早,但該項基于3D 打印構建有序色譜柱床的工作為色譜柱制造提供了一種潛在的替代方案。由于缺乏對表面張力、3D 打印機空間分辨率等因素的精確控制,該方法制造出的柱床不可避免地會出現結構的異質性,進而導致譜帶展寬,影響分離性能;另一方面,該方法制造的柱床的孔道尺寸與實際顆粒填充柱床相差近兩個數量級,為構建具有更精細微結構的色譜柱,需要極高精度的打印技術(如雙光子打印技術),耗時長、成本高,難以在實際中應用。因此, 3D 打印有序色譜柱床的發展還有賴于3D 打印技術的持續發展。除了機理研究, Fee 研究組[52-53]將3D 打印有序柱床結構應用于病毒的親和分離,通過3D 打印制造了螺旋二十四面體結構的蠟模,通過灌注纖維素溶液,并去除蠟模的方式制備有序的纖維素柱床,該柱床同時具有300 μm 直徑的3D 打印結構孔與10~40 μm 的纖維素內部孔,能有效避免病毒在分離純化過程中堵塞柱床,提高分離流量。使用二乙氨基乙基(DEAE)功能化的色譜柱成功用于純化溶瘤腺病毒與慢病毒載體,回收率分別為69%±6%和57%。
通過3D 打印制造有序微結構同樣也被用于平板色譜系統。Paull 研究組[54]利用聚合物噴射成型(PolyJet)技術,在3D 打印的支持板表面制造出具有微結構的聚丙烯酸酯薄層,并用染料和熒光標記的肌紅蛋白和溶菌酶初步驗證了該打印薄層色譜的分離能力。該研究首次提出了一步法制備平板色譜支持板和表面固定相的方案,無需額外的表面修飾即可實現分離,并有望進一步降低薄層色譜的制造成本,加快制造速度。Fichou 等[55]采用噴墨3D 打印技術在玻璃支持板上精確沉積出一定長度、寬度和結構的硅膠固定相(圖3),并在染料混合物分離的實驗中獲得了與市售薄層色譜板相當的分離性能。通過該3D 打印技術制造薄層色譜,除了能降低制造成本、增加支持板和固定相的可定制性外,還能提高固定相沉積的均一性,以此提升薄層色譜的分離性能。
2.3 3D打印固相萃取系統
固相萃取(Solid-phase extraction, SPE)是基于液固萃取技術和液相色譜技術對分析物進行預富集和樣品基質進行純化的樣品預處理技術[56]。3D 打印技術在固相萃取領域已有較廣泛的研究與應用[32],主要包括3D 打印固相萃取器件與3D 打印固相萃取固定相兩個方面。
利用3D 打印技術制備固相萃取器件突破了傳統硬件制造需要專業技術與專業設備的限制,在實驗室水平即可低成本實現器件的設計與制造。固相萃取器件通常無需耐受高溫高壓等極端操作條件,因此,普通的3D 打印系統即可快速實現固相萃取系統的搭建與概念驗證。同時,基于3D 打印技術定制化制造的優勢,研究者還可根據特定需求開發針對性的固相萃取裝置,簡化復雜的流路系統和操作方式。Hu 研究組[57]采用3D 打印技術構建了微流注射(3D-μFI)分析平臺,用于高效液相色譜的樣品前處理,能夠在線吸附提取生物標本中的抗菌劑。該平臺包括光固化3D 打印的多端口選擇閥和微流固相萃取(μSPE)芯片,芯片內填充有聚苯胺(PANI)修飾的磁性納米顆粒。該萃取裝置擁有20 次以上的使用壽命和良好的基質耐受能力,對尿液與唾液模型中分析物的檢出限低至1.10~1.45 ppb。Maya 研究組[58]采用光固化(SLA)3D 打印技術制備了含有互聯立方矩陣混合器的流體歧管和用于容納固相萃取盤的檢測器接口, 3D 打印裝置與多注射器流動注射分析技術(MSFIA)結合,用于Cr(Ⅵ)的在線衍生、預濃縮以及光學檢測,能夠一站式實現含Cr(Ⅵ)樣品與1,5-二苯卡巴肼(DPC)的自動混合、絡合、吸附和洗脫全過程。該平臺具有良好的溶劑穩定性,日內與日間重現性分別為4.8%和3.4%,該方法對Cr(Ⅵ)的線性檢測范圍為1.6~300 ng/mL, 檢出限為0.5 ng/mL, 加標回收率為95%~105%。
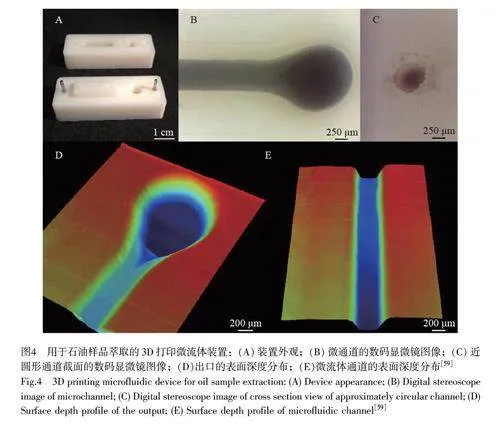
3D 打印技術除了能制造具有特殊結構的器件而簡化操作外,還能將多步驟實驗裝置進行小型化和集成化,例如集成單個墨盒大小或設計成微流體芯片而實現固相微萃取。Hantao 研究組[59]通過熔融沉積(FDM)3D 打印技術制備了一次性的微流體平臺,并應用于石油加工領域(圖4)。該研究組在25 mm×50 mm×10 mm 的微芯片內填充Celite 545 活性硅藻土作為固定相,用于石油樣品的萃取與制備,將痕量石油樣品的處理時間縮短至原來的1/10,具有高溶劑耐受性,對馬青烯的萃取回收率為98%。Barron 研究組[60]構建了可多維組裝的3D 打印固相萃取模塊,可以無篩板封裝多種市售吸附劑顆粒。該裝置對多種基質中微量爆炸物的回收率大于70%,檢出限低至60~154 pg(與市售SPE 相當),可多維組裝的結構提高了裝置的便攜性和應用的靈活性。Maya 研究組[61]報道了一種含有多孔篩板的3D 打印濾芯,通過優化篩板厚度與打印取向,可獲得孔隙率最佳的篩板,并通過在打印濾芯內填充商品化吸附劑構建完整的固相萃取裝置。該裝置在分離模式上具有高度通用性,總體積僅為28 mm×12 mm×1.6 mm。Belka 研究組[62]設計并3D 打印了一種簡單的提取容器,解決了分散固相萃取(Dispersive SPE, DSPE)過程中液固兩相分離困難與可靠性較差的難題。
除了構建固相萃取器件, 3D 打印技術還能制造萃取固定相的載體,通過構建高度復雜的微結構增大材料的比表面積,提升固相萃取效率。Ceballos 等[63]設計了一種具有復雜結構的3D 打印固相萃取裝置,在小體積組件內將小立方體單元以面心立方的形式堆積起來,獲得了更高的比表面積和吸附性能,同時避免了經典SPE 使用過程中出現的柱床易堵塞的問題。該裝置將商品化樹脂固定在未固化的打印器件表面,用于選擇性吸附U(Ⅵ), 10 次重復萃取實驗的萃取效率均大于90%。Gupta 等[64]設計了一種具有3D 分支結構的固相萃取通道裝置,通過復雜的3D 分支結構延長樣品在萃取裝置中的駐留時間,以期獲得更高的萃取效率。上述工作均為搭建小型化、低成本和高效的樣品預處理平臺提供了良好的解決方案,后續將通過進一步開發3D 打印自定義制造能力并結合更多樣化的固相萃取材料,充分挖掘3D 打印技術在固相萃取領域中的應用潛力。
除了打印固相萃取器件外,一些3D 打印材料的化學特性及功能化的特點使其自身具有吸附特性,因此, 3D 打印技術也可直接打印固相萃取固定相柱床。Su 等[65]以光固化3D 打印機和聚丙烯酸酯聚合物為打印材料,制備了一種固相萃取裝置(圖5),用于選擇性地從海水樣品中提取痕量元素和去除部分鹽基質。該裝置的提取通道內規則地排列著立方體陣列,極大地提高了萃取效率;通過與質譜系統聯用,該裝置表現出高的檢測靈敏度和可忽略的基質干擾效應。隨后,該研究組[66]通過改進打印方案與柱結構提升萃取裝置的性能,采用雙打印頭熔融沉積成型(FDM)的方式同時打印有ABS 樹脂外殼和多孔復合材料內芯的復合柱體,其中,柱體Lay-Fomm 40 材料對Mn2+、Co2+、Ni2+、Cu2+、Zn2+、Cd 和Pb2+的萃取效率均高于99.2%。Simon 等[67]基于光固化3D 打印技術制造了基于光固化相分離的多孔空心柱體結構吸附器。通過將帶正電荷的季胺基團與丙烯酸酯基團的雙功能單體與生物相容交聯劑聚乙二醇二丙烯酸酯(PEGDA)共聚制備具有陰離子交換性質的吸附材料,并采用聚乙二醇制孔增大材料的比表面積,使得該吸附器在牛血清白蛋白(BSA)與c-藻藍蛋白(CPC)的吸附實驗中表現出與商品化季胺吸附劑相當甚至更優的吸附性能。Carrasco-Correa 等[68]設計并制備了具有空心柱體結構的吸附裝置,用于實現廢水中雙氯芬酸的免疫親和萃取。
3 總結與展望
3D 打印技術具有高度自由和快速靈活的制造能力,為制造色譜分離系統各部組件提供了一種全新的解決方案,并已在多個色譜應用領域取得初步的研究成果,在色譜理論研究和實際應用方面極具潛力。首先, 3D 打印技術高自定義的制造能力使以往許多僅存在于理論中的模型和結構得以制造出來,并以此探索色譜分離的機理,突破現有色譜分離的極限。其次, 3D 打印技術能根據實際分離的對象與任務快速定制出所需的分離裝置,可高效且低成本地解決實際分離難題。同時, 3D 打印技術高度自動化和可重現的特點使其能快速地被用戶掌握,更有利于該項技術的推廣與使用。
然而, 3D 打印技術的推廣應用仍面臨諸多挑戰。(1)常規3D 打印技術的加工精度在101~102 μm 之間,遠大于實際色譜柱和萃取柱中填料顆粒的尺寸,這一方面使得3D 打印的色譜柱床和萃取柱床受限于打印精度,難以超越或匹敵現有商品化的分離或萃取效果;另一方面導致3D 打印色譜柱床模擬的色譜分離過程無法完全擬合實際過程,極大地限制了3D 打印技術在色譜分離領域中的應用。但是,如果采用雙光子打印技術(打印精度可低至20 nm)制造色譜柱或分離器件,可提升打印精度,但是也極大地提高了加工的時間和成本,反而不利于該技術的實際應用。(2)常用的3D 打印材料多為有機聚合物體系,但這類材料的化學耐受性和熱穩定性不佳,壽命不長,無法在色譜領域大規模應用;機械強度高、化學耐受性好、熱穩定性優良的無機材料或金屬材料則存在加工難度大和打印精度較差等問題。(3)無論是萃取還是分離,都需要柱床具有豐富的孔道,以此提供足夠的作用位點進行吸附和分離,而常規3D 打印制造出的材料多為實心結構,需要在打印體系中額外摻雜致孔劑提升材料的孔隙度,這種方法難以平衡材料本身的通透性和比表面積,導致打印出的材料與經典的色譜柱和萃取裝置存在差距。
盡管3D 打印技術在色譜應用中還有著諸多的限制和不足,但隨著3D 打印技術的不斷發展和材料科學的持續進步, 3D 打印技術有望解決和突破上述問題,充分發揮其高度自定義制造的能力,為色譜的實際應用和理論研究提供強有力的工具支持。
References
[1] SHERMA J. Anal. Chem. , 2000, 72(12): R9-25R.
[2] BAO Xiao-Ling, XU Xu. Chin. J. Anal. Chem. , 2005, 33(11): 1653-1658.
鮑笑嶺, 許旭. 分析化學, 2005, 33(11): 1653-1658.
[3] BROECKHOVEN K, DESMET G. Anal. Chem. , 2021, 93(1): 257-272.
[4] SHAFIEE A, ATALA A. Trends Mol. Med. , 2016, 22(3): 254-265.
[5] KANG H W, LEE S J, KO I K, KENGLA C, YOO J J, ATALA A. Nat. Biotechnol. , 2016, 34(3): 312-319.
[6] CERUTI A, MARZOCCA P, LIVERANI A, BIL C. J. Comput. Des. Eng. , 2019, 6(4): 516-526.
[7] ZHAI Xiao-Fei, CHEN Jing-Yi, ZHANG Xue-Qin, WANG Wen-Qing, ZHANG Lu, SU Ru-Yue, HE Ru-Jie. J. Ceram. ,2023, 44(5): 831-848.
翟小菲, 陳婧祎, 張學勤, 王文清, 張路, 蘇茹月, 何汝杰. 陶瓷學報, 2023, 44(5): 831-848.
[8] SHAHRUBUDIN N, LEE T C, RAMLAN R, JEN T C, AKINLABI E, OLUBAMBI P, AUGBAVBOA C. Procedia Manuf. ,2019, 35: 1286-1296.
[9] AGRAWAAL H, THOMPSON J E. Talanta Open, 2021, 3: 100036.
[10] KALSOOM U, NESTERENKO P N, PAULL B. TrAC, Trends Anal. Chem. , 2018, 105: 492-502.
[11] GROSS B, LOCKWOOD S Y, SPENCE D M. Anal. Chem. , 2017, 89(1): 57-70.
[12] SWAINSON W K. United States Patent, 4238840: 1980.
[13] HALL C W. United States Patent, 4575330: 1986.
[14] KODAMA H. Rev. Sci. Instrum. , 1981, 52(11): 1770-1773.
[15] WANG X, JIANG M, ZHOU Z W, GOU J H, HUI D. Composites, Part B, 2017, 110: 442-458.
[16] MAGAZINE R, VAN BOCHOVE B, BORANDEH S, SEPP?L? J. Addit. Manuf. , 2022, 50: 102534.
[17] DASS A, MORIDI A. Coatings, 2019, 9(7): 418.
[18] DERMEIK B, TRAVITZKY N. Adv. Eng. Mater. , 2020, 22(9): 2000256.
[19] ZHOU L Y, FU J, HE Y. Adv. Funct. Mater. , 2020, 30(28): 2000187.
[20] FINA F, GAISFORD S, BASIT A W. AAPS Advances in the Pharmaceutical Sciences Series, Vol 31. Cham, Switzerland:Springer, 2018, 31: 81-105.
[21] VAEZI M, SEITZ H, YANG S. Int. J. Adv. Manuf. Technol. , 2013, 67: 1721-1754.
[22] AMINI A, GUIJT R M, THEMELIS T, VOS J D, EELTINK S. J. Chromatogr. A, 2023, 1692: 463842.
[23] SALIH R M, KADAUW A, ZEIDLER H, ALIYEV R. J. Manuf. Mater. Process, 2023, 7(2): 58.
[24] O’HALLORAN S, PANDIT A, HEISE A, KELLET A. Adv. Sci. , 2023, 10(7): 2204072.
[25] TUMBLESTON J R, SHIRVANYANTS D, ERMOSHKIN N, JANUSZIEWICZ R, JOHNSON A R, KELLY D, CHEN K,PINSCHMIDT R, ROLLAND J P, ERMOSHKIN A, SAMULSKI R T, DESIMONE J M. Science, 2015, 347(6228): 1349-1352.
[26] RAMAKRISHNA S, MAYER J, WINTERMANTEL E, LEONG K W. Compos. Sci. Technol. , 2001, 61(9): 1189-1224.
[27] LI J H, WU C T, CHU P K, GELINSKY M. Mater. Sci. Eng. , R, 2020, 140: 100543.
[28] MALDA J, VISSER J, MELCHELS F P, JüNGST T, HENNINK W E, DHERT W J A, GROLL J, HUTMACHER D W.Adv. Mater. , 2013, 25(36): 5011-5028.
[29] BAE J, LI Y, ZHANG J, ZHOU X, ZHAO F, SHI Y, GOODENOUGH J B, YU G. Angew. Chem. Int. Ed. , 2018, 57: 2096-2100.
[30] GUO F, ARYANA S, HAN Y, JIAO Y. Appl. Sci. , 2018, 8(9): 1696.
[31] LIU Y J, WANG H, HO J F, NG R C, NG R J H, HALL-CHEN V H, KOAY E H H, DONG Z G, LIU H L, QIU C W,GREER J R, YANG J K W. Nat. Commun. , 2019, 10: 4340.
[32] LI F, CEBALLOS M R, BALAVANDY S K, FAN J, KHATAEI M M, YAMINI Y, MAYA F. J. Sep. Sci. , 2020, 43(9-10):1854-1866.
[33] ZHUA Q, LIUB C, TANGA S, SHENA W, LEE H K. J. Chromatogr. A, 2023, 1697: 463987.
[34] FAN Yi-Qiang, WANG Mei, ZHANG Ya-Jun. Chin. J. Anal. Chem. , 2016, 44(4): 551-561.
范一強, 王玫, 張亞軍. 分析化學, 2016, 44(4): 551-561.
[35] WANG Y C, ZENG Z H, YANG L Y, ZENG H, LI Y, PU Q S, ZHANG M. Anal. Chem. , 2023, 95(4): 2146-2151.
[36] GUO S Z, QIU K, MENG F, PARK S H, MCALPINE M C. Adv. Mater. , 2017, 29(27): 1701218.
[37] SANDRON S, HEERY B, GUPTA V, COLLINS D A, NESTERENKO E P, NESTERENKO P N, TALEBI M, BEIRNE S,THOMPSON F, WALLACE G G, BRABAZON D, REGAN F, PAULL B. Analyst, 2014, 139(24): 6343-6347.
[38] GUPTA V, TALEBI M, DEVERELL J, SANDRON S, NESTERENKO P N, HEERY B, THOMPSON F, BEIRNE S,WALLACE G G, PAULL B. Anal. Chim. Acta, 2016, 910: 84-94.
[39] LUCKLUM F, JANSSEN S, LANG W, VELLEKOOP M J, URBAN G, WOLLENSTEIN J, KIENINGER J. Procedia Eng. ,2015, 120: 703-706.
[40] ZAIDI N A, TAHIR M W, VINAYAKA P P, LUCKLUM F, VELLEKOOP M, LANG M. Procedia Eng. , 2016, 168: 380-383.
[41] PHYO S, CHOI S, JANG J, CHOI S, LEE J. Lab Chip, 2020, 20(18): 3435-3444.
[42] GUPTA V, BEIRNE S, NESTERENKO P N, PAULL B. Anal. Chem. , 2018, 90(2): 1186-1194.
[43] ANDERSON D J. Anal. Chem. , 1995, 67(12): R475- R486.
[44] BARNES H A. J. Rheol. , 1989, 33(2): 329-366.
[45] WYSS H M, TERVOORT E V, GAUCKLER L J. J. Am. Ceram. Soc. , 2005, 88(9): 2337-2348.
[46] WAHAB M F, POHL C A, LUCY C A. J. Chromatogr. A, 2012, 1270: 139-146.
[47] GZIL P, VERVOORT N, BARON G V, DESMET G. Anal. Chem. , 2003, 75(22): 6244-6250.
[48] MALSCHE W D, EGHBALI H, CLICQ D, VANGELOOVEN J, GARDENIERS H, DESMET G. Anal. Chem. , 2007,79(15): 5915-5926.
[49] PRA M D, MALSCHE W D, DESMET G, SCHOENMAKERS P J, KOK W T. J. Sep. Sci. , 2007, 30(10): 1453-1460.
[50] FEE C, NAWADA S, DIMARTINO S. J. Chromatogr. A, 2014, 1333: 18-24.
[51] NAWADA S, DIMARTINO S, FEE C. Chem. Eng. Sci. , 2017, 164: 90-98.
[52] FEAST S, FEE C, MOREIRA A S, SILVA R J S, ALVES P M, CARRONDO M J T, HUBER T, FEE C, PEIXOTO C. J.Chromatogr. A, 2021, 1652: 462365.
[53] MOLEIRINHO M G, FEAST S, MOREIRA A S, SILVA R J S, ALVES P M, CARRONDO M J T, HUBER T, FEE C,PEIXOTO C. Sep. Purif. Technol. , 2021, 254: 117681.
[54] MACDONALD N P, CURRIVAN S A, TEDONE L, PAULL B. Anal. Chem. , 2017, 89(4): 2457-2463.
[55] FICHOU D, MORLOCK G E. Anal. Chem. , 2017, 89(3): 2116-2122.
[56] ZHANG Hai-Xia, ZHU Peng-Ling. Chin. J. Anal. Chem. , 2000, 28(9): 1172-1180.
張海霞, 朱彭齡. 分析化學, 2000, 28(9): 1172-1180.
[57] WANG H, COCOVI-SOLBERG D J, HU B, MIRó M. Anal. Chem. , 2017, 89(22): 12541-12549.
[58] CALDERILLA C, MAYA F, CERDà V, LEAL L O. Talanta, 2018, 184: 15-22.
[59] KATAOKA E M, MURER R C, SANTOS J M, CARVALHO R M, EBERLIN M N, AUGUSTO F, POPPI R J, GOBBI A L,HANTAO L W. Anal. Chem. , 2017, 89(6): 3460-3467.
[60] IRLAM R C, HUGHES C, PARKIN M C, BEARDAH M S, O′DONNELL M, BRABAZON D, BARRON L P. J. Chromatogr.A, 2020, 1629: 461506.
[61] REN X P, BALAVANDY S K, LI F, BREADMORE M C, MAYA F. Anal. Chim. Acta, 2022, 1208: 339790.
[62] SZYNKIEWICZ D, GEORGIEV P, ULENBERG S, B?CZEK T, BELKA M. Microchem. J. , 2023, 187: 108367.
[63] CEBALLOS M R, SERRA F G, ESTELA J M, FERRER V C L. Talanta, 2019, 196: 510-514.
[64] GUPTA V, PAULL B. Anal. Chim. Acta, 2021, 1168: 338624.
[65] SU C K, PENG P J, SUN Y C. Anal. Chem. , 2015, 87(13): 6945-6950.
[66] SU C K, LIN J Y. Anal. Chem. , 2020, 92(14): 9640-9648.
[67] SIMON U, DIMARTINO S. J. Chromatogr. A, 2019, 1587: 119-128.
[68] CARRASCO-CORREA E J, HERRERO-MARTíNEZ J M, SIMó-ALFONSO E F, KNOPP D, MIRó M. Microchim. Acta,2022, 189(5): 173.

