基于液相色譜-質譜聯用技術的重組人生長激素低豐度產品相關物質結構表征


摘要 重組人生長激素(Recombinant human growth hormone, rhGH)是一種采用基因工程技術在大腸桿菌中表達的蛋白質藥物,廣泛用于治療兒童及成人生長激素缺乏癥等多種疾病。在rhGH 藥物工藝開發與生產過程中,可能產生多種產品相關物質,對藥物質量構成潛在影響。因此,對rhGH 主成分及產品相關物質進行深入的結構表征和合理的質量控制對保障藥品質量具有重要意義。《歐洲藥典》收錄了用于rhGH 產品相關物質質量控制的反相高效液相色譜方法,以及高豐度色譜峰的結構鑒定信息,但對于低豐度產品相關物質的結構分析并沒有詳細記載。本研究采用反相高效色譜與液相色譜-質譜聯用技術,成功分離并鑒定了rhGH 產品中的3 種低豐度產品相關物質。研究結果表明, rhGH 低豐度產品相關物質普遍含有多種修飾或罕見修飾,包括N99 和N149 雙位點脫酰胺、N 端缺失兩個氨基酸同時N149 脫酰胺、Q122 脫酰胺、N 端氨基甲酰化和N 端丁二酰化,其中首次在rhGH 中發現N 端丁二酰化修飾。本研究對rhGH 產品相關物質進行了深入表征,為rhGH 藥物的研發和工藝改進提供了依據。
關鍵詞 重組人生長激素;結構表征;產品相關物質;翻譯后修飾;液相色譜-質譜聯用
生長激素(Growth hormone, GH)是一種由人腦垂體前葉分泌的蛋白質激素,可與生長激素受體結合,誘導胰島素樣生長因子1(Insulin-like growth factor, IGF-1)分泌,從而促進人體骨骼的生長發育。1958 年, Raben 等[1]首次從人腦垂體中提取人生長激素(Human growth hormone, hGH),用于治療生長激素缺乏癥;1982 年,基因重組人生長激素(Recombinant human growth hormone, rhGH)獲批用于生長激素缺乏癥的臨床治療,主要適應癥為內源性生長激素缺乏引起的兒童矮小癥[2]。自此,研究者開始對rhGH進行了廣泛的研究和應用探索。近年來, rhGH 在促進脂肪分解和肌肉再生[3]、神經保護[4]、燒燙傷[5]、輔助生殖[6]和肝組織再生[3]等領域的作用也被逐步發掘。截至2023 年, rhGH 在全球范圍內的臨床應用歷史已超過40 年,獲批的適應癥達十余種。
隨著生物技術的發展和進步, rhGH 的表達系統和生產工藝也經歷多次迭代改進[7],天然GH 分子無糖基化修飾,因此,絕大部分生產商選擇原核表達系統對rhGH 進行規模化生產。在原核表達系統中,分泌型大腸桿菌表達技術借助特殊設計的信號肽將目標蛋白引導至周質腔,使其以可溶形式表達,有助于維持天然構象并避免被胞內蛋白酶降解。
人用藥品技術要求國際協調理事會(The international council for harmonisation of technicalrequirements for pharmaceuticals for human Use, ICH) Q6b[8]指導原則中,將雜質分為產品相關物質(Product-related substances)、產品相關雜質(Product-related impurities)以及工藝相關雜質(Process-relatedimpurities),其中,產品相關物質與藥物主成分的活性是可比的,但某些理化性質與主成分存在差異。產品相關物質的形成主要來自生產、運輸和儲存等過程。翻譯后修飾作用[9-12]是產生產品相關物質的最常見原因,包括蛋白質氧化[13]、脫酰胺[14]、氨基甲酰化[15]、聚合[16]和降解[17]等;此外,一級序列的改變,如信號肽的不完全(或過度)切除[18]和氨基酸突變[19]等也會導致產品相關物質的形成。產品相關物質的存在會影響藥物的分子量[20]和分子結構[21]等性質,從而影響藥物的安全性[22]和有效性[16,23-24],因此,對其進行準確的表征和嚴格質控十分必要。
《歐洲藥典》[25]中收錄了rhGH 的產品相關物質檢測方法,但主要記錄了部分高豐度產品相關物質的結構信息,對低豐度產品相關物質的研究尚顯不足。盡管如此,在生物藥的國際貿易中,《歐洲藥典》所收錄的方法仍是對rhGH 產品相關物質進行鑒定分析及實施質量控制的關鍵依據。
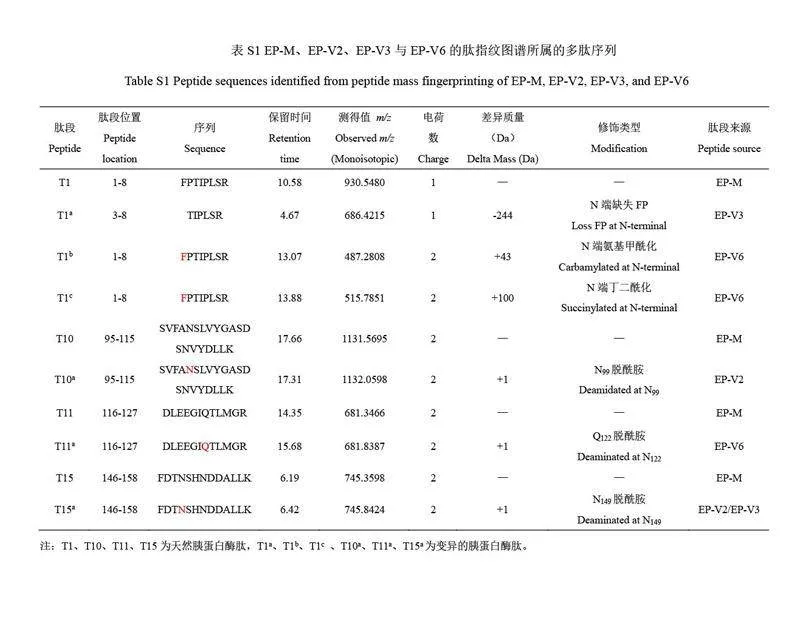
本研究采用色譜和質譜技術,對rhGH 原液中的產品相關物質進行分離、富集和結構鑒定[26-27],旨在全面表征《歐洲藥典》所列產品相關物質檢測圖譜中的低豐度組分。同時,制備了rhGH N 端丁二酰化修飾的樣品,可作為產品相關物質監控的參考物質,在rhGH 的生產工藝改進、安全性與有效性評價及產品質量提升等方面具有重要的參考意義。
1 實驗部分
1.1 儀器、試劑與材料
Triple TOF 6600 型超高效液相色譜-串聯高分辨質譜儀(美國AB SCIEX 公司);Micro 17R 高速冷凍離心機(美國Thermo 公司);DS-11 分光光度計(美國Denovix 公司);E2695 型高效液相色譜儀(美國Waters 公司)。NUCLEOSIL1000-7 C18 分析柱(250 mm × 4.6 mm, 7 μm, 美國Fisher 公司);Acquity UPLCBEH C4 分析柱(100 mm × 2.1 mm, 1.7 μm, 美國Waters 公司);Acquity UPLC BEH C18 分析柱(100 mm ×2.1 mm, 1.7 μm, 美國Waters 公司);超濾離心管(截留分子量10 kDa,美國Millipore 公司)。
NaH2PO4、Na2HPO4、(NH4)2SO4、HClO4 和丁二酸酐(國藥集團化學試劑有限公司);胰蛋白酶(Trypsin,美國Promega 公司);三氟乙酸(質譜級,日本Wako 公司);HCl(中國北京化工廠);三羥甲基氨基甲烷(Tris,中國惠世試劑公司);H3PO4 和異丙醇(色譜級,美國TEDIA 公司);三(2-羧乙基)膦(TCEP,美國Sigma 公司);乙腈(質譜級, Fluka 公司)。rhGH 注射液由長春金賽藥業有限責任公司提供(標示含量為每瓶30 IU/10 mg/3 mL,批號:201706029)。
1.2 實驗方法
1.2.1 產品相關物質的富集與定位
采用《歐洲藥典》收錄的反相高效液相色譜(Reversed phase-high performance liquid chromatography,RP-HPLC)方法進行分析[25]。采用E2695型高效液相色譜儀,配備NUCLEOSIL1000-7 C18 分析柱(250 mm ×4.6 mm, 7 μm)。流動相A 為NaH2PO4-HClO4 溶液(稱取82.6 g Na2HPO4 和34.5 g NaH2PO4·2H2O,溶于2950 mL 色譜水中,加入25 mL HClO4 及2000 mL 乙腈,以超純水定容至5000 mL)。流動相B 為80%乙腈溶液。梯度洗脫程序:0~60 min, 23%~28% B;60~61 min, 28%~23% B;61~72 min, 23% B。流速:1.0 mL/min, 柱溫:室溫;紫外檢測器波長:215 nm。根據色譜峰的分離情況,對各個組分進行收集,合并相同餾分后進行超濾濃縮,終濃度控制為1.0 mg/mL。對濃縮后的餾分采用色譜分離所述的反相色譜方法進行定位分析,色譜設備、條件、色譜柱、流動相組成及梯度洗脫程序與前述相同。
1.2.2 產品相關物質解析
采用聯用ExionLC 超高效液相色譜儀的Triple TOF 6600 高分辨質譜儀進行完整分子量分析。色譜柱選擇Acquity UPLC BEH C4 柱(100 mm × 2.1 mm, 1.7 μm), 流動相A 為0.1%甲酸, B 相為0.1%甲酸-乙腈。梯度洗脫程序:0~1 min, 5% B;1~3.5 min, 15%~60% B;3.5~4.5 min, 60%~90% B;4.5~6.0 min,90% B;6.0~6.5 min, 90%~15% B;6.5~9.0 min, 15% B。流速:0.3 mL/min;柱溫:40 ℃;檢測波長:220 nm;用超純水將樣品稀釋至0.1 mg/mL, 進樣4 μL;自動進樣器溫度設置為2~8 ℃。質譜主要參數如下:采用正離子模式分析,掃描范圍m/z 400~2500;氣簾氣流速35 psi (1 psi = 6.89 kPa);輔助氣流速50 psi;離子源溫度550 ℃;離子源電壓5500 V;累加時間0.25 s;碰撞電壓20 V;去簇電壓120 V。取2 μL 待測樣品進行液相色譜-質譜聯用(Liquid chromatography-mass spectrometry, LC-MS)分析。
質量肽圖檢測設備與前述相同,色譜柱采用Acquity UPLC BEH C18 柱(100 mm × 2.1 mm, 1.7 μm)。流動相A 為0.05%三氟乙酸,流動相B 為0.05%三氟乙酸-乙腈。梯度洗脫程序:0~3 min, 0~15% B;3~15 min, 15%~25% B;15~25 min, 25%~50% B;25~30 min, 50%~80% B;30~30.1 min, 80%~0% B;30.1~35 min, 0% B。流速:0.5 mL/min;柱溫:40 ℃;檢測波長:220 nm;進樣量:20 μL。質譜分析采用正離子模式掃描,一級質譜(MS1)的掃描范圍為m/z 100~1800。氣簾氣流速:35 psi;輔助氣流速:50 psi;霧化氣溫度:550 ℃;累加時間:0.25 s;離子源電壓:5500 V;碰撞電壓:10 V;去簇電壓:80 V。二級質譜(MS2)的掃描范圍為m/z 50~1800,碰撞電壓設定為“Rolling CE”,其它參數與一級質譜參數相同。
質譜數據采集采用Analyst 軟件(1.7.3 版本,美國AB Sciex 公司),數據分析采用BioPharma View 軟件(2.0 版本)和PeakView 軟件(2.2 版本)(美國AB Sciex 公司)。
1.2.3 rhGH N端丁二酰化樣品的制備
依據參考文獻[28]的方法制備N 端具有丁二酰化修飾的rhGH 產品相關物質。取rhGH 加入丁二酸酐溶液(44∶1, m/m),置于冰水浴中孵育2 h,即得丁二酰化修飾產品相關物質。將上述丁二酰化雜質同樣采用《歐洲藥典》[25]中的RP-HPLC 方法進行分離,收集洗脫時間為42.8 min 的色譜峰,為rhGH 的N 端丁二酰化修飾的產品相關物質。收集到的蛋白采用與其它收集的產品相關物質相同的方法進行色譜峰時間定位,確認產品相關物質的洗脫時間一致。
2 結果與討論
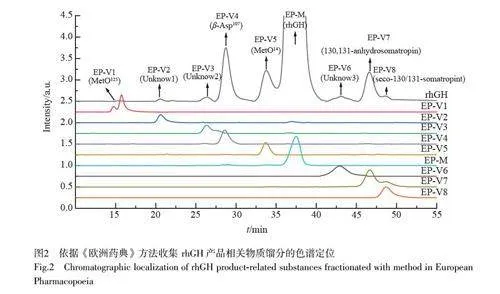
本研究開發了一套基于《歐洲藥典》[25]方法的rhGH 低豐度產品相關物質的收集、鑒定與驗證工作流程(圖1)。首先,對rhGH 中的各產品相關物質色譜峰進行收集,按照保留時間順序分別命名為EPV1至EP-V5、EP-M、EP-V6、EP-V7 和EP-V8。對收集的組分進行濃縮處理,并采用相同的方法進行色譜峰定位和純度分析(圖2),最終,通過LC-MS 對產品相關物質進行了結構鑒定分析。本研究首次在rhGH 產品相關物質中發現了N 端丁二酰化修飾組分,并采用化學方法制備了與此組分相同的N 端丁二酰化修飾rhGH 產品相關物質,通過色譜峰定位及質譜檢測證實了此組分與制備的rhGH 產品相關物質組分一致。
2.1 產品相關物質的色譜定位和純度分析
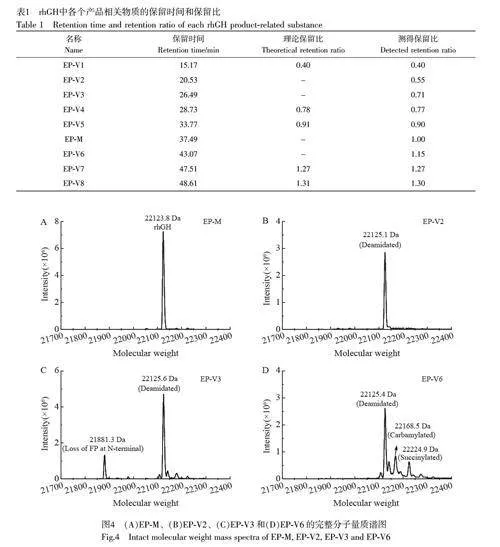
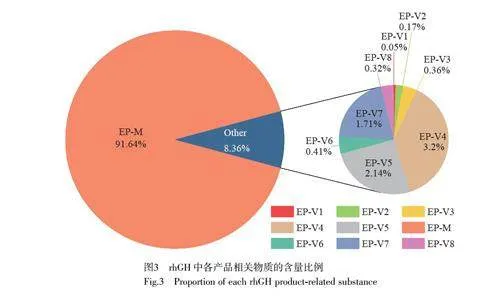
本研究采用的rhGH 的產品相關物質的總峰面積為8.36%(圖3),符合《歐洲藥典》[25]對總產品相關物質峰面積不得超過10%的規定;同時,各個產品相關物質的相對保留比均在規定范圍內(表1)。為確保各組分在處理過程中的結構穩定性,采用《歐洲藥典》[25]收錄的rhGH 產品相關物質反相色譜檢測方法進行了組分的富集與純化,并采用相同的方法進行色譜定位。如圖2 所示,收集的各產品相關物質餾分的主要成分與目標色譜峰的保留時間一致。通過計算峰面積得出各餾分中目標峰的純度分別為:EP-V2 為92%, EP-V3 為85%, EP-V6 為100%,均滿足后續組分鑒定的需求。
2.2 產品相關物質的結構解析
對8 個餾分樣品進行了完整分子量和質量肽圖的檢測,并利用BioPharma View 軟件(2.0 版本)與PeakView 軟件(2.2 版本)對獲得的數據進行分析,以確認已知組分并對未知組分進行結構表征。結果表明, EP-V1、EP-V4、EP-V5、EP-V7 和EP-V8 的結構與《歐洲藥典》[25]收錄的產品相關物質成分一致(見電子版文后支持信息表S1)。對于EP-V2、EP-V3 和EP-V6 色譜峰的結構,由于目前缺乏相關文獻報道,本研究將對其進行深入探討。
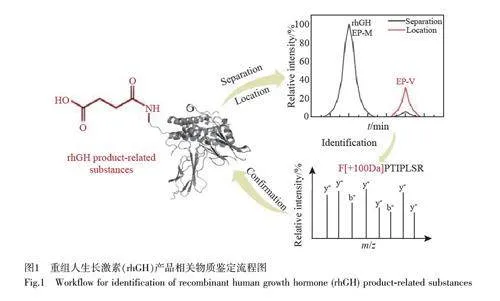
根據rhGH 的結構序列信息,其理論完整分子量應為22124.0 Da,經LC-MS 檢測得到的EP-M 分子量為22123.8 Da(圖4),與理論分子量高度一致。EP-V2 產品相關物質的分子量信號為22125.1 Da,比EP-M 略高1.3 Da,初步推測可能發生了脫酰胺修飾(+1.0 Da)。對于EP-V3產品相關物質,測得的分子量有兩種,一種比EP-M 低242.5 Da,另一種比EP-M 高1 Da。推測前者可能是由于片段缺失,而后者可能是脫酰胺修飾(+1.0 Da)。EP-V6產品相關物質可能含有3 種成分,分別比主峰高1.6、44.7和101.1 Da,初步推測這可能與脫酰胺(+1.0 Da)、氨基甲酰化(+43.0 Da)和丁二酰化(+100.0 Da)3 種翻譯后修飾有關[18]。
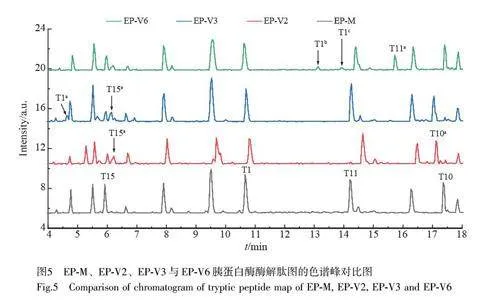
對上述樣品進行了基于胰蛋白酶的質量肽圖差異分析(圖5)。通過對比差異色譜峰的一級和二級質譜數據(見電子版文后支持信息表S1),對各產品相關物質進行進一步表征。
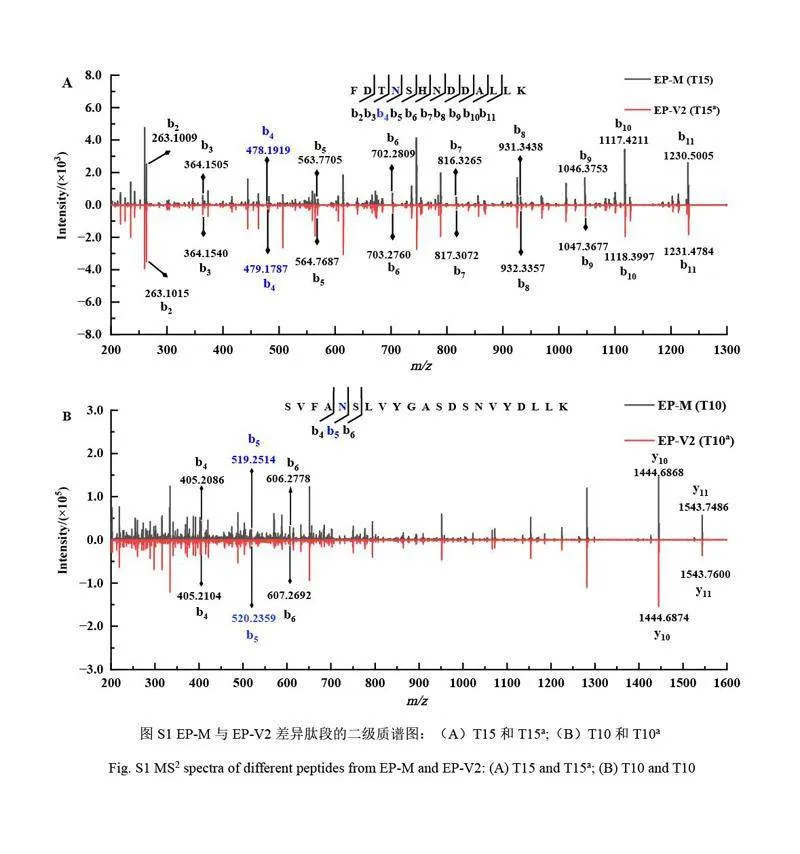
對EP-V2 產品相關物質進行了質譜分析。通過對EP-M 和EP-V2 肽圖樣品的色譜峰進行對比發現,在保留時間6.42 和17.31 min 處有顯著差異(圖5),這些差異來源于T15 肽段(FDTNSHNDDALLK)和T10 肽段(SVFANSLVYGASDSNVYDLLK)的變異。進一步分析二級質譜圖發現, EP-V2 的T15 肽段在N149 位發生了脫酰胺修飾,這可由b5~b11 離子的+1.0 Da 的質量偏移所證實(見電子版文后支持信息圖S1A)。同理, T10 肽段在N99 位也出現脫酰胺修飾(見電子版文后支持信息圖S1B)。分子量分析結果表明EP-V2 的N99 位和N149 位均發生了脫酰胺修飾。
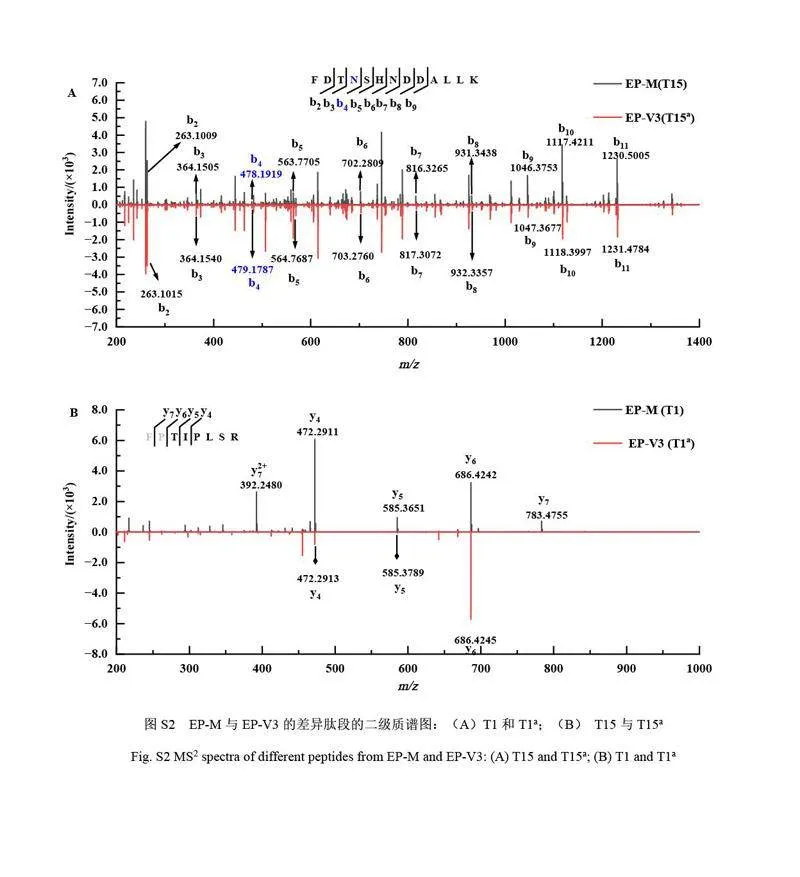
比較EP-M 與EP-V3 的質量肽圖(圖5)可見,在4.67 和6.42 min 處具有顯著差異,這些差異來源于T1 肽段(FPTIPLSR)和T15 肽段(FDTNSHNDDALLK)的變異。通過詳細比對T15 肽段的二級質譜圖(見電子版文后支持信息圖S2)可確認EP-V3 中的N149 位發生了脫酰胺修飾。此外, EP-V3 的T1 肽段的質譜數據顯示,其N 端缺失了苯丙氨酸(F)和脯氨酸(P)兩個氨基酸殘基,這與母離子質量減少244.1 Da 和二級質譜圖中y1~y6 離子的一致性相符。因此,可以確定EP-V3 的主要組分是N149 位脫酰胺修飾,同時伴有N 端F 和P 兩個氨基酸的缺失。
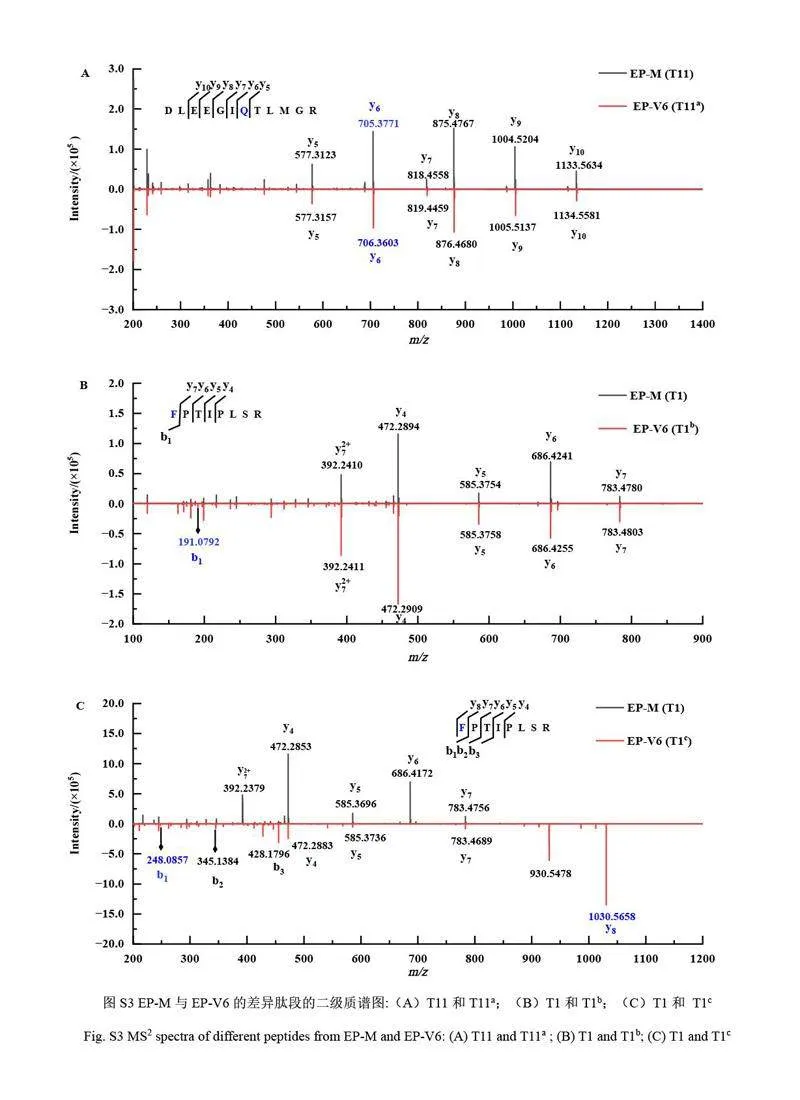
對EP-V6 的結構進行了質譜解析。EP-M 和EP-V6 的色譜峰(圖5)在保留時間15.68、13.07 和13.88 min 處存在差異,這些差異與T11 肽段(DLEEGIQTLMGR)和T1 肽段(FPTIPLSR)的變異相關。分析差異色譜峰的MS2 譜圖,推測T11 肽段的差異來源于Q122 位發生脫酰胺修飾(見電子版文后支持信息圖S3A);T1 肽段的MS2 分析結果表明, EP-V6 的N 端氨基酸發生了氨基甲酰化和丁二酰化修飾(見電子版文后支持信息圖S3B 和S3C)。特別地, N 端發生的丁二酰化修飾為首次發現的rhGH 的產品相關物質,因此對該產品相關物質進行了進一步的研究和驗證。
2.3 N端丁二酰化修飾rhGH的制備與確證
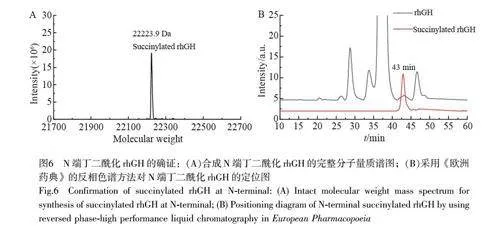
為了進一步確認EP-V6 成分N 端丁二酰化修飾rhGH 產品相關物質結果的準確性,同時為該產品相關物質的活性研究提供基礎數據,通過制備N 端具有丁二酰化修飾的rhGH 產品相關物質進行對比驗證。將rhGH 與丁二酸酐在低溫下進行孵育,采用與rhGH 產品相關物質相同的色譜方法進行分離、收集及質譜分析,結果顯示,制備的修飾蛋白的分子量為22223.9 Da(圖6A),與理論值相符。此外,RP-HPLC 檢測結果顯示,制備得到的N 端丁二酰化修飾rhGH 的色譜峰保留時間與EP-V6 完全吻合(圖6B)。綜上,本研究最終實現了對歐洲藥典中rhGH 相關蛋白的全部鑒定(表2),為未來產品質量的提升奠定了基礎。
3 結論
采用《歐洲藥典》中的RP-HPLC 結合LC-MS 方法,對rhGH 原液中的產品相關物質進行了表征分析。除已報道的產品相關物質EP-V1、EP-V4、EP-V5、EP-V7 和EP-V8 外,發現了未報道的低豐度產品相關物質EP-V2、EP-V3 及EP-V6,并證實EP-V2 中包含rhGH 發生N99、N149 位脫酰胺修飾的產物,EP-V3 中含有rhGH 發生了N 端缺失FP 和N149 脫酰胺2 種修飾產物,而EP-V6 中含有rhGH 發生Q122 脫酰胺、N 端氨基甲酰化和N 端丁二酰化3 種修飾產物。值得注意的是, N 端丁二酰化在rhGH 產品相關物質中首次被發現。本研究實現了對《歐洲藥典》中RP-HPLC 方法分離的rhGH 藥物產品相關物質的完全鑒定,加深了對rhGH 藥物的認識,同時也為相關產品質量升級和安全性研究奠定了基礎。
References
[1] RABEN M S. J. Clin. Endocrinol. Metab. , 1958, 18(8): 901-903.
[2] LEVITSKY L L, EDIDIN D V, BENVENISTE R. Pediatr. Res. , 1982, 15(12): 1545.
[3] I′HORTET A C D, ZERRAD-SAADI A, PRIP-BUUS C, FAUVEAU V, HELMY N, ZIOL M, VONS C, BILLOT K, BAUDV, GILGENKRANTZ H, GUIDOTTI J E. Endocrinology, 2014, 155(7): 2545-2554.
[4] ARCE V M, DEVESA P, DEVESA J. Neurosci. Res. , 2013, 76(4): 179-186.
[5] CHEN Heng-Xia. Jinagsu Med. J. , 2005, 31(7): 529.
陳衡霞. 江蘇醫藥, 2005, 31(7): 529.
[6] CHANG C W, SUNG Y W, HSUEH Y W, CHEN Y Y, HO M, HSU H C, YANG T C, LIN W C, CHANG H M. Front.Endocrinol. , 2022, 13: 1040503.
[7] WATERS M J, HOANG H N, FAIRLIE D P, PELEKANOS R A, BROWN R J. J. Mol. Endocrinol. , 2006, 36(1): 1-7.
[8] Q6B-1999. Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products. The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use.
[9] LIU Jing-Hui, LIU Yu-Lin, LIU Chen, XU Xiao-Ming, YANG Hong-Yu, LI Li. Chin. J. Biol. , 2015, 28(11): 1153-1156.
劉景會, 劉玉林, 劉晨, 徐曉明, 楊紅育, 李利. 中國生物制品學雜志. 2015, 28(11): 1153-1156.
[10] WALSH G. Drug Discovery Today, 2010, 15(17-18): 773-780.
[11] MAO Y, KLEINBERG A, LI N. Anal. Chem. , 2020, 92(14): 9682-9690.
[12] YANG Jing-Bo, HE Cheng-Yan, LU Ri-Feng, LIU Ning. Chin. J. Anal. Chem. , 2022, 50(10): 1465-1472.
楊靜波, 何成彥, 盧日峰, 劉寧. 分析化學, 2022, 50(10): 1465-1472.
[13] HEPNER F, CSASZAR E, ROITINGER E, POLLAK A, LUBEC G. Proteomics, 2006, 6(3): 775-784.
[14] TESHIMA G, JOHN T. STULTSG, LING V, DAVIS E C. Am. J. Biochem. Mol. Biol. , 1991, 266(21): 13544-13547.
[15] NOWICKI C, SANTOMé J A. Int. J. Peptide Protein Res. , 1981, 18(9): 52-60.
[16] MEYER R M, ALESHKEVICH S, BERGER L, NERKAMP J, SCHELER S, FRIESS W. Int. J. Pharm. , 2022, 621:121760.
[17] BATTERSBY J E, HANCOCK W S, CANOVA E, OESWEIN J, O′ONNOR B. Int. J. Peptide Protein Res. , 1994, 44(3):215-222.
[18] LIU H L, REN W C, ZONG L, ZHANG J L, WANG Y W. Anal. Biochem. , 2019, 564: 1-12.
[19] HEPNER F, CSZASAR E, ROITINGER E, LUBEC G. Proteome Sci. , 2005, 3(1): 1.
[20] BECK A, CIANFéRANI S, DORSSELAER A V. Anal. Chem. , 2012, 84(11): 4637-4646.
[21] YAN Y, WE H, FU Y, JUSUF S, ZENG M, LUDWIG R, KRYSTEK S R, CHEN G D, TAO L, DAS T K. Anal. Chem. ,2016, 88(4): 2041-2050.
[22] EON-DUVAL A, BROLY H, GLEIXNER R. Biotechnol. Prog. , 2012, 28(3): 608-622.
[23] KONTERMANN R E. Curr. Opin. Biotechnol. , 2011, 22(6): 868-876.
[24] ROOPENIAN D C, AKILESH S. Nat. Rev. Immunol. , 2007, 7(9): 715-725.
[25] Commission Medicines European Council for the Quality of. Ph. Eur.10.0. Somatropin solution for injection. ED.: European Medicines Quality Authority, 2020: 3621-3622.
[26] GELLERFORS P, PAVLU B, AXELSSON K, NYHLéN C, JOHANSSON S. Acta Paediatr. Scand. , 1990, S370: 93-100.
[27] LU Jun-Jie, LI Jing, CHEN Ying, LI Yi, ZHANG Wei, ZHANG Hui, LYU Ping, QIN Xi-Yue, GAO Xiang-Dong, LIANG Cheng-Gang. Chin. J. Pharm. Anal. , 2022, 42(1): 41-50.
陸俊杰, 李晶, 陳瑩, 李懿, 張偉, 張慧, 呂萍, 秦希月, 高向東, 梁成罡. 藥物分析雜志, 2022, 42(1): 41-50.
[28] ZHAO Y, MA C Y, YUEN S N, HILLIPS D L. J. Agric. Food Chem. , 2004, 54(7): 1815-1823.

