高鐵酸鉀在考題中的呈現角度解析

高中化學必備知識是高考必考的內容與命題依據,是根據?普通高中化學課程標準(2017年版2020年修訂)?及高校專業設置要求必須要掌握的內容.新高考試題要體現基礎性、綜合性、應用性與創新性,指向必備知識融合考查是高考命題的重要特征.本文多角度分析高考中高頻考查的高鐵酸鉀,以期把握命題方向,探尋解題規律,提高備考效率.
1 融合考查高鐵酸鉀的制備
1.1 融合元素化合物知識,考查高鐵酸鉀的實驗法制備
制備K2FeO4 一般有兩種方法,一是融合鐵、鈉及其化合物的性質與應用的干法制備.先通過反應:2FeSO4+6Na2O2 =2Na2FeO4 +2Na2O+O2 ↑ +2Na2SO4制得Na2FeO4,然后在低溫下,向Na2FeO4溶液中加入KOH 至飽和,可使K2FeO4 析出,過濾得粗品,用KOH 溶液溶解,蒸發濃縮,冷卻結晶,再用苯和95% 乙醇溶液進行脫堿、乙醚洗滌,干燥制得K2FeO4.二是融合鐵、氯及其化合物的性質與應用的濕法制備.是在KOH 堿性條件下,用Cl2 或ClO- 將Fe(OH)3 氧化生成K2FeO4,離子方程式為3Cl2 +2Fe(OH)3 +10OH- =2FeO24- +6Cl- +8H2O,2Fe(OH)3+3ClO- +4OH- =2FeO24- +3Cl- +5H2O.元素及其化合物知識是高考化學命題的重要考查內容,高鐵酸鉀的實驗法制備融合鐵、鈉、氯等核心元素及其化合物性質及應用,因此在高考中經常出現,復習備考時要予以強化.
例1 高鐵酸鉀(K2FeO4)是一種綠色、高效的新型水處理劑,對病毒的去除率可達99.95%.某興趣小組設計如下實驗制備K2FeO4 并探究其性質.
已知:① K2FeO4 為紫色固體,微溶于KOH 溶液;② FeO24- 具有強氧化性,在酸性或中性溶液中能快速產生O2,在堿性溶液中較穩定.
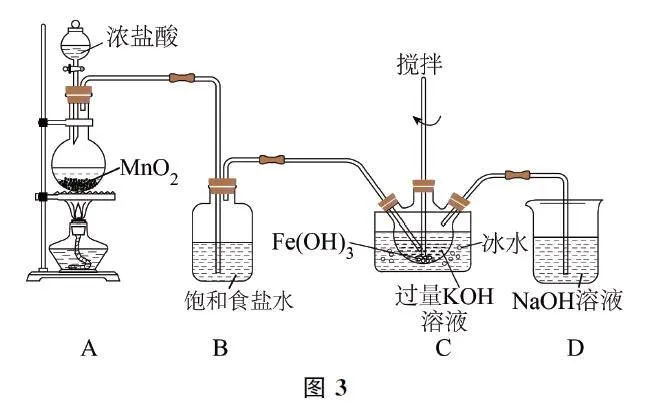
(1)如圖1所示(夾持裝置略),裝置A 為氯氣發生裝置,橡膠管的作用是______.
(2)裝置B的作用是______.
(3)裝置C中的KOH 溶液需過量,目的是______.
(4)C 中得到紫色固體.則C 中發生反應生成K2FeO4 和KCl的離子方程式為______.
解析
本題是融合氯及其化合物、鐵及其化合物性質的綜合考查.
(1)裝置A 用于制取Cl2,為了防止因反應過于劇烈,燒瓶內壓強增大而使液體無法滴落,應通過橡膠管將分液漏斗與蒸餾燒瓶連通,目的是平衡體系的壓強,確保濃鹽酸能順利流下.
(2)由于鹽酸具有揮發性,所得Cl2 中混有HCl和H2O(g);HCl會消耗Fe(OH)3、KOH,因此要用飽和NaCl溶液除去HCl.
(3)由題目已知信息可知,K2FeO4 在酸性或中性環境下不穩定,在堿性環境中能穩定存在,因此,裝置C需要確保堿性環境,即KOH 溶液要過量.
(4)裝置C在堿性條件下用Cl2 將Fe(OH)3 氧化生成K2FeO4,反應的離子方程式為3Cl2 +2Fe(OH)3+10OH-=2FeO24-+6Cl-+8H2O.
1.2 融合電化學知識,考查高鐵酸鉀的電解法制備
電化學是制備物質的重要方法和手段.電解法制備高鐵酸鉀是以石墨和鐵為電極材料,以濃KOH 溶液為電解質溶液,鐵與電源的正極相連,作為陽極發生氧化反應,電極反應為Fe-6e- +8OH- =FeO24-+4H2O,閉合開關,通電一段時間后,可觀察到陽極附近溶液變成紫紅色,是電解生成的FeO24-在溶液中呈現的顏色,實現了電解法制備高鐵酸鉀.高鐵酸鉀也可以作為新型化學電池的正極材料,高鐵酸鉀電池體積小、質量小、能量密度大、壽命長且無污染.融合電化學原理制備及應用高鐵酸鉀,充分說明了高考化學注重知識點在生產、生活中的應用情境,是學以致用的重要體現.
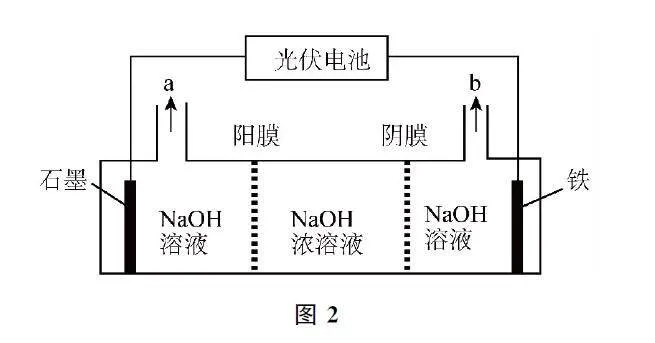
例2 (雙選)高鐵酸鉀(K2FeO4)是環保型水處理劑,以光伏電池為電源先制備Na2FeO4,再將其轉化為高鐵酸鉀,裝置如圖2所示.下列說法不正確的是( ).
A.石墨為陽極,鐵電極發生還原反應
B.a含有H2,b為Na2FeO4 溶液
C.鐵電極反應式為Fe-6e-+8OH-=FeO24-+4H2O
D.若電路中轉移1 mol電子,則石墨電極區NaOH 溶液質量增加23g
解析
本題融合電解池的工作原理及應用,先利用電解法制備Na2FeO4,再轉化為K2FeO4.鐵電極發生氧化反應生成Na2FeO4,則鐵為陽極,石墨為陰極,發生還原反應,選項A 說法錯誤.石墨電極的電極反應式為2H2O+2e- =2OH- +H2↑,a為H2、NaOH 溶液,b為Na2FeO4 溶液,選項B說法正確.鐵電極發生氧化反應生成Na2FeO4,根據得失電子守恒和電荷守恒配平離子方程式為Fe-6e- +8OH- =FeO24-+4H2O,選項C說法正確.每轉移1mol電子,濃NaOH 溶液中有1molNa+ 向左遷移,由2H2O+2e- =2OH- +H2↑可知,生成0.5molH2,石墨電極區的溶液質量凈增1mol×23g·mol-1-0.5mol×2g·mol-1=22g,選項D說法錯誤.答案為A、D.
2 融合考查高鐵酸鉀的性質與應用
2.1 融合氧化還原知識,考查高鐵酸鉀的強氧化性
高鐵酸鉀為暗紫色或紫色固體,具有金屬光澤,具有強氧化性,比Cl2、O2、ClO2、KMnO4 的氧化性強,微溶于KOH 溶液.干燥品在室溫下穩定,在0~5℃堿性溶液中較穩定,隨著pH 減小,穩定性下降,在酸性或中性溶液中與水快速反應產生O2.試題經常將高鐵酸鉀的性質與氧化還原反應及規律的探究考查有機融合,注重必備知識與關鍵能力的考查.
例3 探究K2FeO4 的性質.
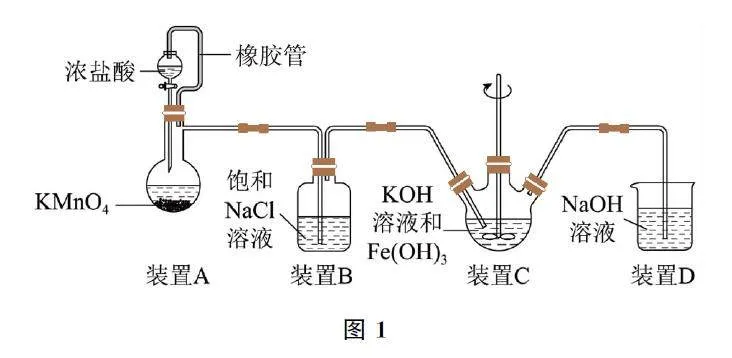
(1)取圖3裝置C 中紫色溶液,加入稀硫酸,產生黃綠色氣體,得溶液a,經檢驗,氣體中含有Cl2.為證明是否是K2FeO4 氧化了Cl- 而產生Cl2,設計表1所示方案.
ⅰ.由方案Ⅰ中溶液變紅可知a中含有______離子,但該離子的產生不能判斷一定是K2FeO4 將Cl- 氧化,還可能由反應產生______(用離子方程式表示).
ⅱ.方案Ⅱ可證明K2FeO4 氧化了Cl- .用KOH溶液洗滌的目的是______.
(2)根據K2FeO4 的制備實驗得出,氧化性:Cl2______ FeO24-(填“>”或“<”),而方案Ⅱ實驗表明,Cl2 和FeO24-的氧化性強弱關系相反,原因是______.
(3)資料表明,酸性溶液中的氧化性:FeO24- >MnO- 4 ,驗證實驗如下:將溶液b滴入MnSO4 和足量H2SO4 的混合溶液中,振蕩后溶液呈淺紫色.該現象能否證明氧化性:FeO24->MnO4-.若能,請說明理由;若不能,進一步設計實驗方案.理由或方案: ______.
解析
(1)溶液a中滴加KSCN 溶液至過量,溶液呈紅色,說明溶液a中含有Fe3+ ,K2FeO4 在酸性溶液中快速產生O2 和Fe3+ ,產生的Fe3+ 干擾了實驗檢驗,反應為4FeO24- +20H+ =3O2↑+4Fe3++10H2O.K2FeO4 在堿性溶液中較穩定,并且固體表面附有ClO- ,加入鹽酸時ClO- 能與鹽酸反應生成Cl2,所以用KOH 溶液洗滌的目的是使K2FeO4 穩定溶出,并除去K2FeO4 固體附著的ClO- ,防止ClO- 與Cl- 在酸性條件下反應生成Cl2,避免ClO- 干擾實驗.
(2)制備K2FeO4 的反應為3Cl2+2Fe(OH)3+10KOH=2K2FeO4 +6KCl+8H2O,Cl2 是氧化劑,K2FeO4 是氧化產物,則氧化性:Cl2>K2FeO4,方案Ⅱ反應的氧化性:K2FeO4>Cl2,二者相反.對比兩個反應的條件,制備K2FeO4 在堿性條件下,方案Ⅱ在酸性條件下,說明溶液的酸堿性不同會影響物質氧化性的強弱.
(3)將溶液b滴入MnSO4 和足量H2SO4 的混合溶液中,振蕩后溶液呈淺紫色,說明生成了KMnO4,根據實驗現象和氧化還原反應規律可知,能證明氧化性FeO24->MnO4-,因為 K2FeO4 在酸性溶液中快速生成O2 和Fe3+ ,使溶液呈黃色,振蕩后溶液呈淺紫色,一定是KMnO4 的顏色.
2.2 融合鹽類水解知識,考查高鐵酸鉀的應用
K2FeO4 易水解,保存時需防潮,是高效、安全、綠色無污染的水處理劑.主要用于飲用水的消毒凈化、生產生活污水的處理與再生使用.K2FeO4 可增加水體的溶氧量,對水體中亞硝酸鹽、氨氮等污染物具有良好的去除效果.K2FeO4 消毒是利用其強氧化性可迅速殺滅細菌,凈化水是與水反應產生具有強吸附性的Fe(OH)3 膠體,可除去水中細微的懸浮物.
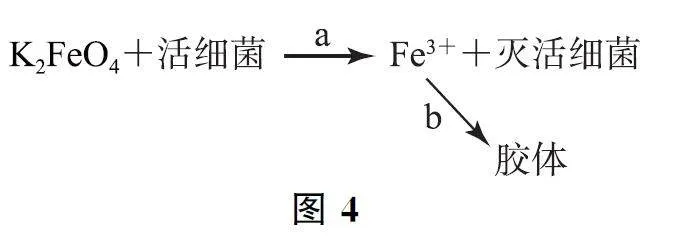
例4 高鐵酸鉀(K2FeO4)是高效、綠色的水處理劑,其原理如圖4,下列說法不正確的是( ).
A.K2FeO4 中鐵元素的化合價為+6價
B.在a過程中K2FeO4 被活細菌還原
C.在b過程中形成的Fe(OH)3 膠體能凈水
D.在a過程中活細菌發生還原反應
解析
K2FeO4 中鉀為+1價,O 為-2價,故鐵元素的化合價為+6價,選項A 說法正確.在a過程中K2FeO4 中Fe元素由+6價降為+3價,被活細菌還原,選項B說法正確.在b過程中Fe3+ 水解形成的Fe(OH)3 膠體能凈水,選項C說法正確.在a過程中活細菌被K2FeO4 氧化,發生氧化反應,選項D說法錯誤.答案為D.
綜上,高鐵酸鉀的考查融合了元素化合物、氧化還原反應、電化學、鹽類水解等必備知識,同時也融合了高中化學不同模塊知識的考查,在復習過程中要多角度、全面認識高鐵酸鉀的性質,提高備考的針對性.
(完)

