基于CRISPR/Cas技術的傳染性病原精準便攜化檢測系統



摘要以核酸為檢測靶向的分子診斷方法是傳染性病原體檢測的金標準,但將其應用于便攜化或現場快速診斷時仍存在多種限制和挑戰,如特異性差、操作繁瑣和便攜化難等。規律間隔成簇短回文重復序列(CRISPR)/CRISPR 相關蛋白(Cas)-熒光檢測方法有望大幅提升核酸識別的特異性和信噪比。本研究開發了環介導等溫擴增(LAMP)-CRISPR/Cas-便攜化灰度讀取儀檢測系統。在CRISPR RNA (crRNA)存在下,利用CRISPR/Cas12a 體系實現了對自主設計的甲型和乙型流感病毒核酸LAMP 擴增反應體系的精準熒光檢測,驗證了CRISPR/Cas 體系的高選擇性和通用性。配套自主開發的便攜化灰度讀取儀,可同時實現熒光信號的低成本采集和高可靠性可視化判讀,檢測結束后直接輸出樣品的陽/陰性結果。利用本檢測系統對實際樣本進行了分析,驗證了其可靠性和實用性,證明了本系統能夠實現流感病毒的高靈敏、高特異性便攜化分析。
關鍵詞等溫擴增;CRISPR-Cas;熒光;便攜化檢測;流行性病原;灰度讀取儀
快速、準確地檢測流行性病原體是治療傳染性疾病和流行病的關鍵。2019 年底爆發的新型冠狀病毒感染大流行對全球的公共衛生安全造成了重大威脅[1],也反映出對病原體便攜化檢測乃至現場即時檢驗(Point-of-care testing, POCT)的迫切需求。世界衛生組織(WHO)推薦的POCT 診斷應具備價格合理、敏感性高、特異性強、易于使用、快速、穩健以及可供最終用戶使用(ASSURED)等特性[2]。然而,目前能夠完全滿足這些要求的病原體核酸檢測產品依然十分匱乏,尚需對檢測原理、技術和儀器等進行綜合創新和改進。聚合酶鏈式擴增反應(PCR)是核酸檢測金標準,但具有耗時、需要復雜的熱循環儀設備和成本高等不足,難以脫離實驗室環境[3]。相比之下,環介導等溫擴增(LAMP)[4]、重組酶擴增(RPA)[5]和核酸依賴性擴增(NASBA)[6]等技術能夠在恒定溫度下完成核酸擴增,不需要苛刻和復雜的儀器運行條件,更具備便攜化潛力和條件[7]。其中, LAMP 是最具優勢和競爭力的等溫擴增方法之一,通過1 種聚合酶和4~6 個引物即可在1 h 內將低至單分子水平的DNA 模板擴增109~1010 倍,達到可檢出水平[4, 8]。然而,由于LAMP 的擴增產物是長度不一、形態復雜的花椰菜結構,因此可用于檢測的方法十分有限,最常用且高效的方法是熒光染料嵌插法和比濁法。熒光染料嵌插法是將小分子染料非特異性地嵌插到擴增后的雙鏈DNA 中,產生熒光增強效果;比濁法是將擴增后產生的焦磷酸根與二價金屬離子絡合,產生肉眼可見的沉淀。這兩種常用的檢測方法均缺少序列選擇性,因此無法識別干擾核酸或隨機擴增產生的副產物,易出現假陽性結果[9-10]。此性能缺陷也普遍存在于其它等溫擴增檢測方法中,嚴重限制了同類方法的實用化和推廣,這是實現便攜化檢測和POCT 需要解決的首要問題。
近年來,基于規律間隔成簇短回文重復序列相關蛋白(CRISPR/Cas)系統的基因編輯技術為解決上述難題提供了方法學基礎[11-14], Cas9、Cas12a、Cas12b 和Cas13a 等不同酶具有不同的靶向選擇性和切割CRISPR RNA 能力,能夠提供廣泛且靈活的檢測方式[15-18]。以CRISPR/Cas12a 體系為例,其檢測基本原理是通過CRISPR RNA(crRNA)高選擇性地識別與之序列互補的DNA 形成雙鏈,進而激活Cas12a 的無差別催化切割活性,將兩端帶有熒光基團和淬滅基團的單鏈DNA 切斷,使體系的熒光強度增加[19]。該策略既提高了特異性,又可實現二次信號放大,產生高信噪比信號,已廣泛用于檢測RPA 的雙鏈擴增產物[20]。近期,有研究者利用CRISPR/Cas12a 識別LAMP 擴增產物,實現了對非洲豬瘟(ASFV)和嚴重急性呼吸綜合征冠狀病毒2(SARS-CoV-2)等病原基因的高選擇性熒光檢測[21-22],但是該方法對其它病原基因或LAMP 產物序列的普適性尚有待驗證。此外,通過簡單的LED 光激發后即可通過肉眼直接觀測到檢測前后的熒光強度變化[23],然而,與其它比色或比濁方式類似,該方法也易產生肉眼誤差。通過手機拍照,再利用專業繪圖軟件對圖像進行處理,有望獲得更可靠的判讀甚至是定量檢測效果[20],但不同手機和圖像處理軟件所獲得的結果通常不盡相同。
因此,為進一步驗證CRISPR/Cas 系統對LAMP 檢測的通用性,并提高熒光信號的便攜化檢測能力和判讀可靠性,本研究開發了LAMP-CRISPR/Cas-便攜化熒光灰度讀取儀檢測系統。針對甲型和乙型流感病毒核酸序列設計了高效的LAMP 擴增引物和特異性crRNA。研究結果表明, crRNA 存在下, CRISPR/Cas12a 系統能夠對LAMP 產物進行高靈敏、高選擇性熒光檢測,可檢出低至1 copy/μL 的靶核酸。檢測流程和結果判讀可在自主開發的便攜化熒光灰度讀取儀中完成。此儀器采用四核ARM Cortex-A7 和8 GB 高速EMMC 存儲,支持TF 外擴32 GB SD 卡存儲,硬件配備5 寸液晶觸摸屏、具備PID 算法控制的可控加熱模塊以及特定可控光照單元和采集攝像模塊。本系統能夠提供0~95 ℃范圍內的可控樣本孵育和LED 熒光激發,直接將熒光信號轉化為圖像,并通過算法對灰度進行定量分析,在檢測程序運行完成后自動顯示陰性或陽性結果,無需人為判斷,大幅提升了判讀效率和檢測準確性。同時,此儀器支持藍牙與手機APP 無線連接,可通過手機調整本地儀器軟件算法參數及編輯檢測運行程序,因此適用于各類采用其它溫區和流程的等溫擴增檢測方法,可滿足更廣泛的應用需求。
1 實驗部分
1.1 儀器與試劑
DS-11 FX+分光光度計(美國DeNovix 公司);羅氏lightcycler96 熒光實時定量PCR 儀(荷蘭羅氏生物科技有限公司);Biometra PCR 儀(德國耶拿分析儀器股份公司)。
核酸熒光染料(美國Biotum 公司);Lba Cas12a(Cpf1)核酸酶、熱啟動反轉錄酶、RNA 酶抑制劑、Bst 2.0 DNA 聚合酶、10×r2.1 緩沖液、10×等溫擴增緩沖液和dNTPs(美國New England Biolabs 公司);甜菜堿(默克生物公司);病毒RNA 提取試劑盒(天根生化科技(北京)有限公司)。本研究中的引物序列、crRNA 以及熒光探針均由上海生工有限公司合成,序列如表1 所示。病毒實際樣本由吉林大學中日聯誼醫院標本庫提供,經吉林大學中日聯誼醫院倫理委員會批準(批準號: 2019071606)。本實驗所用試劑均為分析純,購于上海生工有限公司。實驗用水為超純水(四川沃特爾水處理設備有限公司超純水儀制備)。
實驗中所使用的緩沖液包括:1×等溫擴增緩沖液(20 mmol/L Tris-HCl 溶液(pH 8.8), 10 mmol/L(NH4)2SO4, 50 mmol/L KCl, 4 mmol/L MgSO4, 0.1% Tween 20);1×r 2.1 緩沖液(50 mmol/L NaCl,10 mmol/L Tris-HCl, 10 mmol/L MgCl2, 100 μg/mL 重組白蛋白, pH 7.9);1×TE 緩沖液(10 mmol/L Tris,1 mmol/L EDTA, pH 8.0)。
1.2 實驗方法
1.2.1 染料法實時LAMP擴增檢測模擬靶標基因
以不同濃度目標基因的質粒作為檢測模板,進行染料法實時LAMP 檢測。預先配制引物混合液,其中內引物FIP/BIP 濃度為20 μmol/L, 外引物F3/B3 濃度為5 μmol/L。LAMP 等溫擴增體系包括10 μL 不同濃度模板、3 μL 引物混合液、2 μL 10 mmol/L dNTPs、0.5 μL 100 mmol/L MgSO4 和5 μL 5 mol/L 甜菜堿,采用1×等溫擴增緩沖液稀釋,總體積為23 μL。將上述反應液在95 ℃變性2 min 后,迅速降溫至4 ℃, 靜置5 min(此過程并非必須,但可提高反應靈敏度)。最后加入1 μL 20×SYBER Green 熒光染料以及1 μL(8 U)Bst DNA 聚合酶,反應液終體積為25 μL。將裝有反應液的離心管置于羅氏Lightcycler96 熒光實時定量PCR 儀中,進行實時熒光檢測,反應溫度為63 ℃, 每隔2 min 進行熒光數據采集。
1.2.2 染料法實時逆轉錄(RT)-LAMP擴增檢測甲型流感實際樣本
實際樣本經咽拭子常規病毒試劑盒提取后,作為靶標進行后續擴增實驗。23 μL RT-LAMP 等溫擴增體系包括10 μL 咽拭子提取液、3 μL 引物混合液、2 μL 10 mmol/L dNTPs、0.5 μL 100 mmol/L MgSO4 和5 μL 5 mol/L 甜菜堿,采用1×等溫擴增緩沖液稀釋。上述反應液于80 ℃變性1 min 后,迅速降溫至4 ℃,靜置5 min(此過程并非必須,但可提高反應靈敏度)。最后加入1 μL 20×SYBER Green熒光染料、0.26 μL(4 U)熱啟動反轉錄酶以及1 μL(8 U)Bst DNA 聚合酶,總反應液體積為25 μL。置于羅氏lightcycler96 熒光實時定量PCR 儀中進行實時熒光檢測,反應溫度為63 ℃, 每隔2 min 進行熒光數據采集。
1.2.3 LAMP/RT-LAMP等溫擴增
24 μL LAMP/RT-LAMP 等溫擴增體系包括10 μL DNA 或RNA 模板、3 μL 引物混合液、2 μL10 mmol/L dNTPs、0.5 μL 100 mmol/L MgSO4 和5 μL 5 mol/L 甜菜堿,反應體系采用1×等溫擴增緩沖液稀釋。將24 μL 上述反應液變性1~2 min 后,迅速降溫至4 ℃, 靜置5 min(此過程并非必須,但可提高反應靈敏度)。最后加入1 μL(8 U)Bst DNA 聚合酶,對于RNA 樣本額外加入0.26 μL(4 U)熱啟動反轉錄酶后,置于Biometra PCR 儀中,反應溫度為63 ℃, 反應時間為60 min。
1.2.4 CRISPR/Cas實時檢測
CRISPR/Cas 實時熒光檢測法檢測的靶標是流感病毒LAMP 終點產物。20 μL 檢測體系中包含2 μLLAMP 產物、終濃度為200 nmol/L 的LbaCas12、終濃度為500 nmol/L 的crRNA、10 U RNA 酶抑制劑以及終濃度為200 nmol/L 的熒光探針,采用2×r2.1 緩沖液稀釋。反應體系置于羅氏Lightcycler96 熒光實時定量PCR 儀中進行實時熒光檢測,反應溫度為37 ℃, 每隔1 min 進行熒光數據采集。
1.2.5 灰度讀取儀的設計及開發
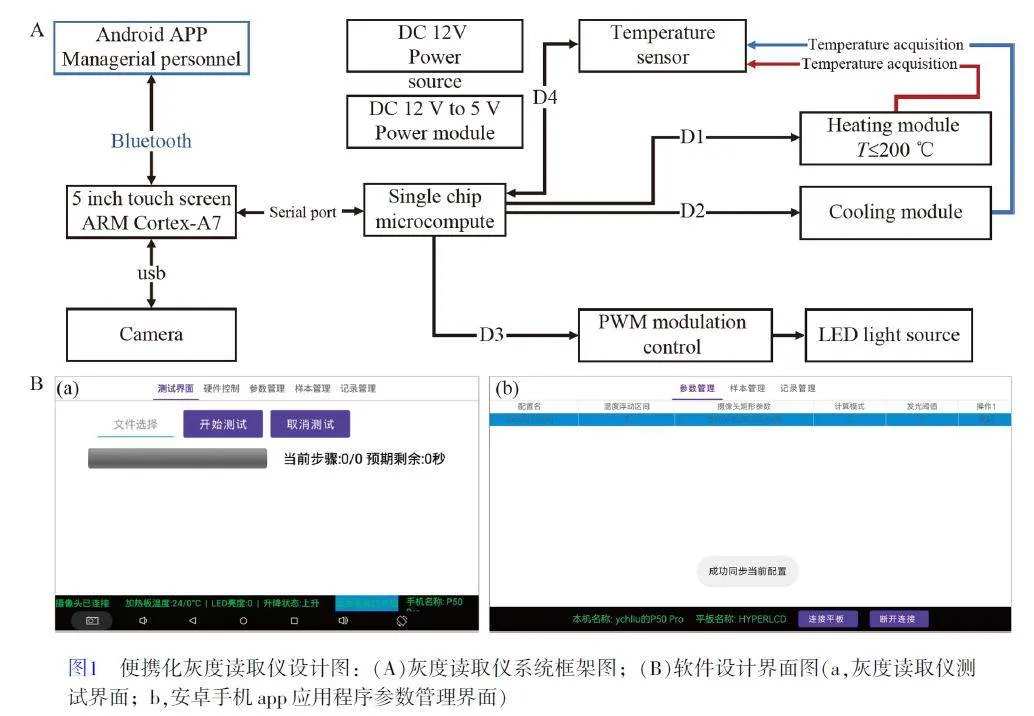
如圖1A 所示,灰度讀取儀主要包括處理器模塊、圖像采集攝像模組、光源以及升降溫模塊等,可通過手機連接灰度讀取儀對其進行參數調整及數據管理。灰度讀取儀軟件可在安卓操作系統中運行,主要分為5 個程序操作界面:測試界面、硬件控制、參數界面、樣品管理和記錄管理(圖1B-a)。其中,測試界面可提供操作人員需要運行的檢測程序,并可控制啟動和停止檢測程序;硬件控制界面可對攝像頭、溫度和光源亮度等進行測試;參數界面可查看當前儀器參數的設置條件,包括溫度浮動區間、攝像頭矩形參數、計算模式和檢測闕值等信息;樣品管理界面可設置新的樣品測試條件,并可對溫度控制程序進行編輯,例如可針對不同的檢測樣品和原理設置多個溫度控制循環等;記錄管理可對檢測結果進行查看和導出等。檢測時,將反應樣品放入灰度讀取儀中,再啟動檢測程序,選擇“開始測試”,儀器會對每個樣品進行第一次圖像采集并作為檢測背景,然后啟動預設定的升/降溫或放樣檢測程序。反應結束后,儀器對每個樣品進行第二次圖像采集,并與第一次圖像采集的背景灰度進行對比計算。計算結束后直接顯示陰性(黑色)或陽性(綠色)檢測結果,判定標準是通過計算每個樣品第二次圖像與第一次圖像灰度闕值,未超過參數設定的發光闕值判定為陰性,反之,超過參數設定中的發光闕值判定為陽性。
灰度讀取儀的手機端安卓APP 軟件可通過Wifi/藍牙查詢和導出本地儀器后臺數據,同時也支持對本地儀器軟件算法參數的調整和設置。手機APP 設置3 個應用程序界面(如圖1B-b):參數管理界面可修改當前儀器參數設置條件,包括溫度浮動區間、攝像頭矩形參數、計算模式和檢測發光闕值等;樣品管理界面功能與儀器樣品管理界面類似,可修改、添加或刪除樣品測試條件等;記錄管理界面可對檢測結果進行查看和導出等。
2 結果與討論
2.1 LAMP-CRISPR/Cas的檢測原理
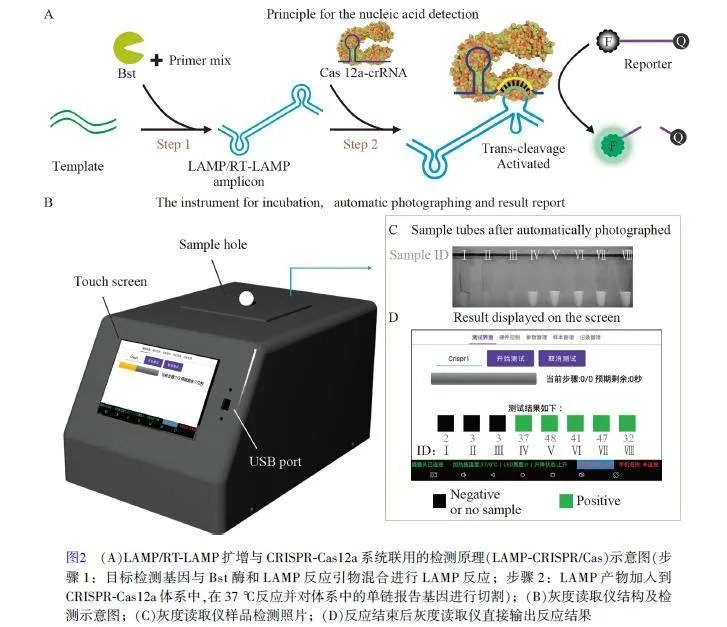
圖2A 顯示了LAMP/RT-LAMP 等溫擴增與CRISPR-Cas12a 系統聯用(LAMP-CRSIPR/Cas)檢測流感病毒的原理。來自病原體的目標基因(Template)由LAMP 擴增或逆轉錄后進行RT-LAMP 擴增,所產生的擴增子中單鏈環產物可被crRNA 特異性識別,從而激活Cas12a 蛋白的活性。由于Cas12a 特有的非特異性單鏈DNA 切割活性,可以高效地切割溶液中的單鏈報告基因(一端標記熒光基團,另一端標記猝滅基團),從而釋放出熒光基團,產生熒光。其中, LAMP 適用于DNA 擴增,而RT-LAMP 適用于RNA 擴增。
便攜化灰度讀取儀應用程序可以根據反應需要自定義設置,包括溫度、加熱時間和加樣暫停等。結合LAMP-CRISPR/Cas 檢測,可以設置為LAMP+CRISPR 程序,樣品可全程在儀器中進行反應;或在LAMP 反應完成后單獨設置CRISPR 反應條件,將LAMP 擴增產物引入Cas12a-crRNA 體系,并在儀器中進行CRISPR 反應。儀器外觀構造如圖2B 所示,樣品放入灰度讀取儀樣品孔后,啟動檢測程序,儀器會對樣品進行圖像采集(圖2C),檢測結果直接顯示出陰性或無樣品(黑色)和陽性(綠色)(圖2D),檢測采集的圖像(圖2C)和檢測結果(圖2D)相互對應。
2.2 LAMP-CRISPR/Cas檢測的可行性驗證
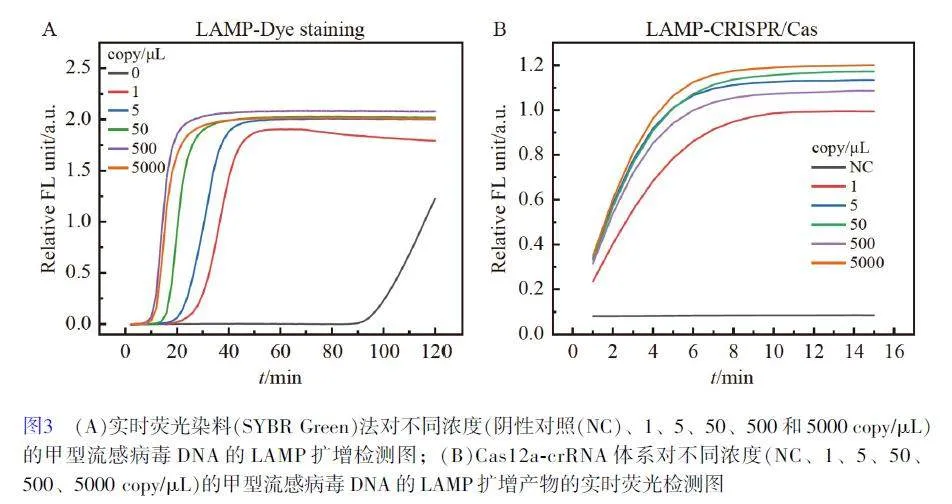
以甲型流感病毒一段基因片段的同序列DNA(FluA-Template)作為靶標,對LAMP-CRISPR/Cas 檢測體系的可行性進行驗證。首先利用常規的染料嵌插法(LAMP-Dye staining)對LAMP 引物的有效性進行實時熒光監測。圖3A 顯示40 min 內可實現對1 copy/μL FluA-Template 的有效LAMP 擴增,且起信號時間對于不同濃度模板具有一定的濃度依賴性。60 min 后,陰性對照出現明顯的熒光信號,說明此時出現了引物的非特異性擴增所導致的假陽性信號。在染料法中,染料可無差別地嵌插到核酸雙鏈中,并產生熒光增強現象,因此采用該方法很難區分正確的擴增產物和非特異性擴增,這也是LAMP 檢測中假象頻發的主要原因。基于LAMP-CRSIPR/Cas 檢測原理(圖2A),將LAMP 擴增終產物直接加入到Cas12acrRNA體系中, crRNA 僅能準確識別正確的擴增產物,并誘導Cas12a 對熒光探針的非特異性切割活性。如圖3B 所示,整個反應可在10 min 內達到熒光信號平臺,并且陰性對照未出現假陽性信號。
為了進一步驗證LAMP-CRISPR/Cas 方法的高特異性,進行了多組陰性對照的平行實驗。采用染料法檢測時(圖4A), 4/5 的陰性對照出現了假陽性熒光信號,說明非特異性擴增現象會高頻出現。在LAMP-CRISPR/Cas 檢測時,所有的陰性對照均未出現假陽性信號(圖4B(NC1~NC5))。如果將FluATemplate的LAMP 擴增產物替換為乙型流感病毒相關DNA(FluB-Template)的LAMP 擴增產物,結果也為陰性(圖4B(NC-Flu B)),表明LAMP-CRISPR/Cas 可得到兼具高靈敏度和高選擇性的檢測結果。
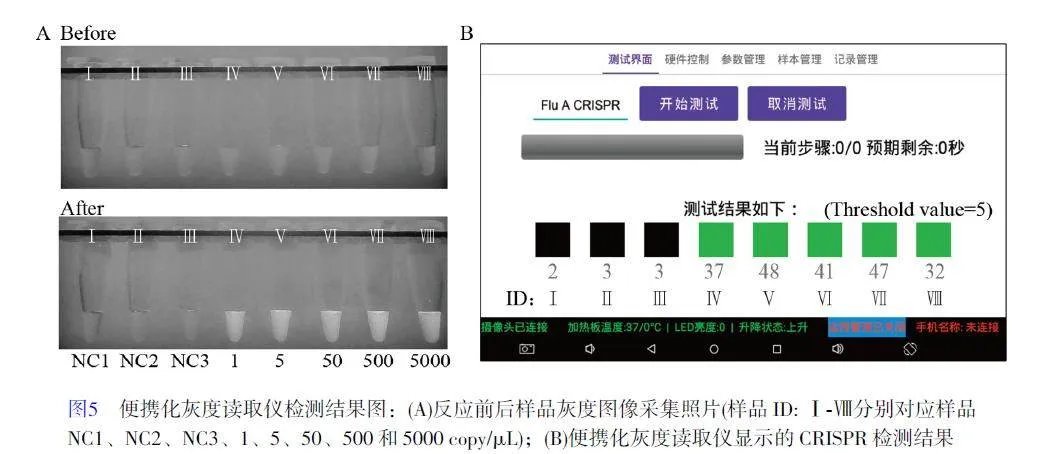
2.3 便攜化灰度讀取儀用于檢測甲型流感模擬靶標的可行性驗證
上述驗證實驗(圖3)是利用傳統的標準化熒光定量PCR 儀采集熒光信號。將檢測體系轉移到便攜化灰度讀取儀進行驗證。根據圖3B 提供的動力學信息,將不同濃度的FluA-Template(0、0、0、1、5、50、500 和5000 copy/μL)樣品在63 ℃下進行50 min 的LAMP 擴增。這一步可在常規加熱孵育裝置中進行,也可在灰度讀取儀中進行。將擴增產物轉移至Cas12a-crRNA 體系,設定灰度讀取儀反應程序溫度為37 ℃, 反應時間為20 min。反應開始后,儀器自動對樣品孔中的樣品進行圖像采集,并作為反應背景灰度(圖5A, Before)。加熱程序運行完畢后,儀器再次對樣品進行圖像采集(圖5A, After)。最后,灰度讀取儀通過兩次圖像采集結果進行計算,并對比預設置的發光闕值后,直接輸出計算結果(圖5B)。結果表明, ID 為Ⅰ(NC1)、Ⅱ(NC2)和Ⅲ(NC3)的樣品,其灰度闕值低于預設置闕值,因此被灰度讀取儀判定為陰性樣本;ID 為Ⅳ、Ⅴ、Ⅵ、Ⅶ和Ⅷ的樣品,其灰度闕值高于預設置闕值,被判定為陽性樣本。因此,利用便攜化灰度讀取儀可在短時間內實現對甲型流感病毒模擬靶標的高靈敏和高特異的便攜化分析,可檢測濃度低至1 copy DNA 分子,此結果與染料法檢測結果一致。需要說明的是,本研究僅提供了其中一種檢測流程和閾值設定方式,在實際檢測過程中可通過多種方式進一步縮短檢測時間,例如采用同一溫區的核酸擴增和Cas 酶體系或調整閾值。
2.4 LAMP-CRISPR/Cas-便攜化灰度讀取儀用于甲型流感實際樣本分析
采用1 個臨床陰性樣本和5 個臨床陽性樣本對LAMP-CRISPR/Cas-便攜化灰度讀取儀在實際臨床樣本檢測應用中的可行性進行驗證。提取后的樣本(1#~6#)與FluA-Template 空白樣品(NC)分別進行LAMP-CRISPR/Cas 檢測,并采用熒光定量PCR 儀和自制便攜化灰度讀取儀進行平行檢測。熒光定量PCR 儀檢測結果如圖6A 所示, FluA-Template 空白樣品和臨床陰性咽拭子樣本均未產生熒光信號,檢測結果均為陰性;5 個臨床陽性咽拭子樣本的檢測結果為陽性。便攜化灰度讀取儀檢測結果與熒光定量PCR 儀顯示結果一致(圖6B 和6C),樣品Ⅰ(NC)和Ⅱ(1#)的檢測結果為陰性,樣品Ⅲ~Ⅶ(2#~6#)的檢測結果為陽性,Ⅷ號顯示無樣品。以上實驗結果表明,利用便攜化灰度讀取儀可以實現對甲型流感實際樣本的快速分析。
2.5 LAMP-CRISPR/Cas-便攜化灰度讀取儀檢測系統的通用性驗證
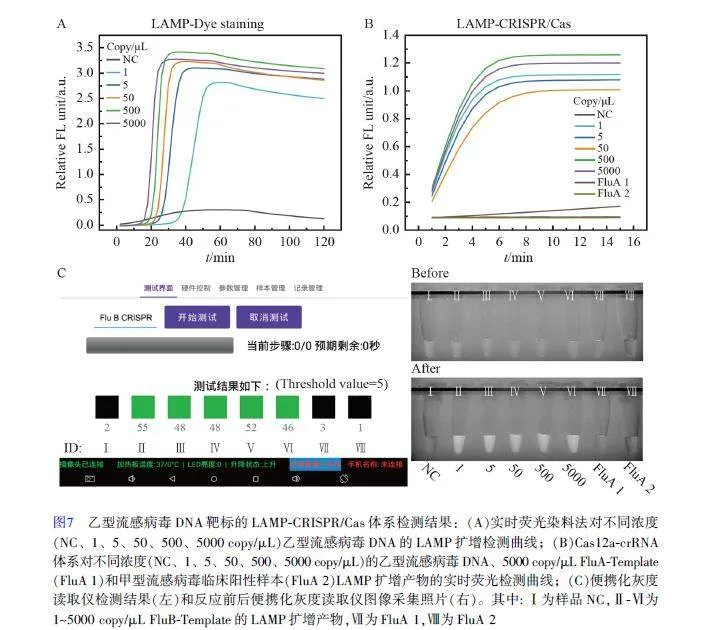
利用研制的LAMP-CRISPR/Cas-便攜化灰度讀取儀檢測系統對乙型流感病毒的模擬DNA 靶標(FluB-Template)進行分析。首先采用熒光染料法驗證了FluB-Template LAMP 引物的有效性(圖7A,利用傳統熒光定量PCR 儀進行信號采集), 40 min 內可檢出低至1 copy/μL 的FluB-Template。LAMP-CRISPR/Cas 體系檢測結果見圖7B(利用傳統熒光定量PCR 儀進行信號采集),其中還加入了FluA-Template 和FluA 臨床陽性樣本,實驗結果表明, LAMP-CRISPR/Cas 檢測體系對于FluB-Template 的檢測同樣具有高靈敏度和高特異性,可以有效排除假陽性。同時,便攜化灰度讀取儀的檢測結果(圖7C)與傳統熒光定量PCR 儀結果高度一致: 樣品NC(ID:Ⅰ)、FluA 1(ID: Ⅶ)和FluA 2(ID: Ⅷ)的檢測結果皆為陰性,其它樣品檢測結果為陽性。上述結果表明, LAMP-CRISPR/Cas-便攜化灰度讀取儀檢測系統具有較好的實用性和通用性。
3 結論
針對甲型和乙型流感病毒開發了LAMP-CRSIPR/Cas 核酸檢測方法,并研制了配套使用的低成本便攜化灰度讀取儀。其中, LAMP 可達到低至1 copy/μL 的超高靈敏度;CRSIPR/Cas 系統通過crRNA 高特異性識別正確的擴增產物,并將其轉化為催化放大的熒光增強信號;便攜化灰度讀取儀通過觸摸屏結合自主研發的軟件控制升/降溫模塊、光照單元和圖像采集模塊程序,完成檢測反應孵育和信號輸出;檢測程序運行結束后可直接顯示陰性或陽性結果。相較于實時熒光讀取模式,灰度讀取儀成本更低,軟件輔助的自動化拍照和量化也能夠有效避免傳統肉眼識別或手機拍照帶來的判讀誤差。LAMP-CRSIPR/Cas的檢測原理適用于其它病原基因的檢測,而便攜化灰度讀取儀兼具寬溫區控溫和程序編輯功能,因此在原理上也適用于各類采用其它溫區和流程的其它恒溫擴增檢測方法如RPA 等。同時,此儀器可通過藍牙與手機APP 無線連接,對儀器參數進行調整和程序編輯,可提供更靈活的檢測方式,更好地滿足應用需求。
References
[1] BHARDWAJ P, KANT R, BEHERA S P, DWIVEDI G R, SINGH R. Int. J. Mol. Sci. , 2022, 23(11): 6052.
[2] AMAN R, MAHAS A, MAHFOUZ M. ACS Synth. Biol. , 2020, 9(6): 1226-1233.
[3] FREIJE C A, SABETI P C. Cell Host Microbe, 2021, 29(5): 689-703.
[4] NOTOMI T, OKAYAMA H, MASUBUCHI H, YONEKAWA T, WATANABE K, AMINO N, HASE T. Nucleic Acids Res. ,2000, 28(12): e63.
[5] PIEPENBURG O, WILLIAMS C H, STEMPLE D L, ARMES N A. Plos Biol. , 2006, 4(7): 1115-1121.
[6] COMPTON J. Nature, 1991, 350(6313): 91-92.
[7] LI Y, FAN P, ZHOU S, ZHANG L. Microb. Pathog. , 2017, 107: 54-61.
[8] TANG Yi-Dan, LIU Yi-Chen, LYU Bai-Yang, GUO Lu-Lu, LI Bing-Ling. Chin. J. Anal. Chem. , 2018, 46(6): 865-874.
唐藝丹, 劉一辰, 呂佰陽, 郭路路, 李冰凌. 分析化學, 2018, 46(6): 865-874.
[9] CHOU P H, LIN Y C, TENG P H, CHEN C L, LEE P Y. J. Virol. Methods, 2011, 173(1): 67-74.
[10] NAGAI K, HORITA N, YAMAMOTO M, TSUKAHARA T, NAGAKURA H, TASHIRO K, SHIBATA Y, WATANABE H,NAKASHIMA K, USHIO R, IKEDA M, NARITA A, KANAI A, SATO T, KANEKO T. Sci. Rep. , 2016, 6(1): 39090.
[11] SON H A, HANG D T T, THUAN N D, QUYEN L T B, THUONG L T H, NGA V T, QUANG L B, HUNG T T, SON N T,LINH N T, NAM L V, VAN BA N, TIEN T V, QUYET D, VAN LUONG H, SU H X. J. Med. Virol, 2020, 92(11): 2839-2846.
[12] CASAGRANDE M, FITZEK A, PüSCHEL K, ALESHCHEVA G, SCHULTHEISS H P, BERNEKING L, SPITZER M S,
SCHULTHEISS M. Ocul. Immunol. Inflamm. , 2020, 28(5): 721-725.
[13] GUO Zi-Xuan, YANG Zhi-Qing, WAN Yi, LI Jing-Hong. Chin. J. Anal. Chem. , 2023, 51(5): 706-720.
郭子璇, 楊治慶, 萬逸, 李景虹. 分析化學, 2023, 51(5): 706-720.
[14] CHANDRASEKARAN S S, AGRAWAL S, FANTON A, JANGID A R, CHARREZ B, ESCAJEDA A M, SON S,MCINTOSH R, TRAN H, BHUIYA A, DERBY M D D, SWITZ N A, ARMSTRONG M, HARRIS A R, PRYWES N,LUKARSKA M, BIERING S B, SMOCK D C J, MOK A, KNOTT G J, DANG Q, VAN DIS E, DUGAN E, KIM S, LIU T N Y, CONSORTIUM MOEHLE E A, KOGUT K, ESKENAZI B, HARRIS E, STANLEY S A, LAREAU L F, TAN M X,FLETCHER D A, DOUDNA J A, SAVAGE D F, HSU P D. Nat. Biomed. Eng. , 2022, 6(8): 944-956.
[15] CHAN J F, YIP C C, TO K K, TANG T H, WONG S C, LEUNG K H, FUNG A Y, NG A C, ZOU Z J, TSOI H W, CHOI G K, TAM A R, CHENG V C, CHAN K H, TSANG O T, YUEN K Y. J. Clin. Microbiol. , 2020, 58(5): 310-320.
[16] YU F, YAN L, WANG N, YANG S, WANG L, TANG Y, GAO G, WANG S, MA C, XIE R, WANG F, TAN C, ZHU L, GUO Y, ZHANG F. Clin. Infect. Dis. , 2020, 71(15): 793-798.
[17] PARK M, WON J, CHOI B Y, LEE C J. Exp. Mol. Med. , 2020, 52(6): 963-977.
[18] PATCHSUNG M, JANTARUG K, PATTAMA A, APHICHO K, SURARITDECHACHAI S, MEESAWAT P,SAPPAKHAW K, LEELAHAKORN N, RUENKAM T, WONGSATIT T, ATHIPANYASILP N, EIAMTHONG B,LAKKANASIRORAT B, PHOODOKMAI T, NILJIANSKUL N, PAKOTIPRAPHA D, CHANARAT S, HOMCHAN A,TINIKUL R, KAMUTIRA P, PHIWKAOW K, SOITHONGCHAROEN S, KANTIWIRIYAWANITCH C, PONGSUPASA V, TRISRIVIRAT D, JAROENSUK J, WONGNATE T, MAENPUEN S, CHAIYEN P, KAMNERDNAKTA S, SWANGSRI J, CHUTHAPISITH S, SIRIVATANAUKSORN Y, CHAIMAYO C, SUTTHENT R, KANTAKAMALAKUL W, JOUNG J,LADHA A, JIN X, GOOTENBERG J S, ABUDAYYEH O O, ZHANG F, HORTHONGKHAM N, UTTAMAPINANT C.Nat. Biomed. Eng. , 2020, 4(12): 1140-1149.
[19] CHEN J S, MA E, HARRINGTON L B, DA COSTA M, TIAN X, PALEFSKY J M, DOUDNA J A. Science, 2018, 360(6387):436-439.
[20] MAO G, LUO X, YE S, WANG X, HE J, KONG J, DAI J, YIN W, MA Y. Anal. Chem. , 2023, 95(20): 8063-8069.
[21] TAO D, LIU J, NIE X, XU B, TRAN-THI T N, NIU L, LIU X, RUAN J, LAN X, PENG G, SUN L, MA Y, LI X, LI C, ZHAO S, XIE S. ACS Synth. Biol. , 2020, 9(9): 2339-2350.
[22] PANG B, XU J, LIU Y, PENG H, FENG W, CAO Y, WU J, XIAO H, PABBARAJU K, TIPPLES G, JOYCE M A,SAFFRAN H A, TYRRELL D L, ZHANG H, LE X C. Anal. Chem. , 2020, 92(24): 16204-16212.
[23] WANG B, WANG R, WANG D, WU J, LI J, WANG J, LIU H, WANG Y. Anal. Chem. , 2019, 91(19): 12156-12161.
國家自然科學基金項目(No. 22004118)和吉林省科技發展計劃重點研發項目(No. 20230203193SF)資助。

