CsSSK1基因調控暹羅炭疽菌脅迫應答和致病性的功能分析
魯婧文 關小靈 李瀟 張宇 繆衛國 林春花

關鍵詞:暹羅炭疽菌;CsSSK1 基因;功能分析;藥劑敏感性;致病性
微生物在環境中生長發育和繁殖,必須通過一系列復雜的細胞信號網絡來感知并適應各種環境壓力。雙組分系統(two-component signalingsystem, TCS)是細菌、真菌、粘菌及高等植物中普遍存在的一類信號傳遞調節系統,在細胞應答脅迫響應、調控病原菌藥劑敏感性和毒力中發揮重要作用[1]。真核生物的TCS 通常由組氨酸激酶(histidine kinase, HK)、組氨酸基團的磷酸轉移蛋白(phosphotransferase, HPt)及應答調節蛋白(response regulator, RR)三部分構成[2],如模式生物酵母的雙組分系統由Sln1-Ypd1-Ssk1 組成[3]。已有研究顯示雙組分信號蛋白對真菌病原體脅迫反應和抗藥性的重要性,如尖孢鐮刀菌(Fusariumoxysporum)中組氨酸激酶FHK1 缺失對高滲脅迫和氧脅迫敏感,增強對吡咯類藥劑的抗性[4];稻瘟菌(Magnaporthe oryzae)中同源的組氨酸激酶HIK1 的缺失突變體對高滲透壓有影響,但對致病力影響不大。同時發現稻瘟菌(M. oryzae)雙組分系統2 個RR 基因(MoSSK1 和MoSKN7)共同調控稻瘟菌對滲透壓和咯菌腈的敏感性[5-6]。
SSK1 是雙組分系統的應答調控蛋白,在真核細胞中充當接收和傳遞信號的功能[7-8]。大量研究顯示,病原真菌中的SSK1 與病原菌的形態建成、脅迫反應、耐藥性和致病力有關,但在不同病原菌中其功能存在差異。如在稻瘟菌(M. oryzae)中的MoSSK1 參與對滲透脅迫的響應以及對咯菌腈的敏感性調控[9];在灰霉菌(Botrytis cinerea)中,SSK1 同源基因的缺失喪失產孢能力,對滲透脅迫和氧脅迫敏感,并且對異菌脲、咯菌腈和三唑酮敏感性增強[10];在大麗輪枝菌(Vertilillium dahliae)中VdSsk1 基因與病原菌的壓力脅迫反應、黑色素的合成和致病力相關,還與咯菌腈、異菌脲等殺菌劑敏感性調控有關[11];而在白念珠菌(Candidaalbicans)中SSK1 缺失突變體對高鹽敏感并且參與氟康唑敏感性調控[12-13];但在克魯氏乳酸酵母菌(Kluyveromyces lactis)中SSK1 基因不影響高滲敏感性[14]; 在絲狀真菌柄孢霉(Podosporaanserina)中PaSSK1 基因也不影響氟康唑敏感性[15]。此外,SSK1 在炭疽菌中的功能尚無報道。
炭疽菌(Colletotrichum spp.)是一類重要的植物病原絲狀真菌,引起許多果樹、蔬菜等重要經濟作物的炭疽病[16]。暹羅炭疽菌(C. siamense)是膠孢炭疽菌復合群中的一個種,是我國橡膠樹炭疽病的田間優勢病原種,也是許多熱帶、亞熱帶作物的主要病原菌,如芒果[17]、荔枝[18]、咖啡[19]、檳榔[20]等。本課題組前期已克隆了暹羅炭疽菌CsSSK1 基因序列,本研究基于已有基礎,利用同源重組替換技術,構建暹羅炭疽菌的雙組分系統中CsSSK1 基因缺失突變體和回補菌株,并進行表型觀察,研究結果不僅有助于進一步了解暹羅炭疽菌中的CsSSK1 基因功能,還可為深入了解病原菌如何應答脅迫反應的分子機理奠定基礎。
1 材料與方法
1.1 材料
供試菌株和質粒:暹羅炭疽菌(C. siamense)HN08 菌株分離自海南省瓊中新進農場橡膠樹病葉,由本實驗室分離、鑒定、保存,重組載體pCX62-S(含抗性基因ILV1)由本實驗室前期構建并保存;酵母感受態XK-125、回補載體pXY203(S-tag 標簽、潮霉素抗性基因HPH)由本實驗室保存;大腸桿菌(Escherichia coli)DH5α 感受態細胞購自上海唯地生物技術有限公司。
培養基:PDA 培養基、PDS 培養基、CM 培養基、DCM 培養基、TB3 培養基、YPD 培養基、SD/-Trp培養基、LB 培養基,配置方法參照參考文獻[8]。
供試藥劑:99.5%氯化鈉(NaCl)、98%山梨醇(sorbitol)、98%葡萄糖(glucose)、99.7%蔗糖(sucrose),均購自西隴科學股份有限公司;Congo red(剛果紅)購于北京拜爾迪生物技術有限公司。使用前將99.3%咯菌腈原藥(廣州碩普生物科技有限公司) 用無菌水溶解, 配置成50 mg/mL 的母液;99%氟康唑原藥(海南正業中農高科股份有限公司)用無菌水溶解,配置成5 mg/mL 的母液;97%戊唑醇原藥(海南正業中農高科股份有限公司)用無菌水溶解,配置成50 mg/mL 的母液。
試劑:限制性內切酶XhoⅠ、EcoRⅠ、T4 連接酶購自寶生物工程(大連)有限公司;通用型DNA 純化回收試劑盒、DNA 提取試劑盒及質粒提取試劑盒購自美國Omega 公司;溶壁酶購自廣州微生物研究所;潮霉素、DIG High Prime DNALabeling and Detection Starter Kit Ⅰ購于Roche公司;引物合成和測序由生工生物工程(上海)股份有限公司完成。
主要儀器:高速冷凍離心機,Eppendorf 公司(德國);PCR 擴增儀,BIO-RAD 公司(美國);臺式恒溫振蕩器,美國精騏有限公司。
1.2 方法
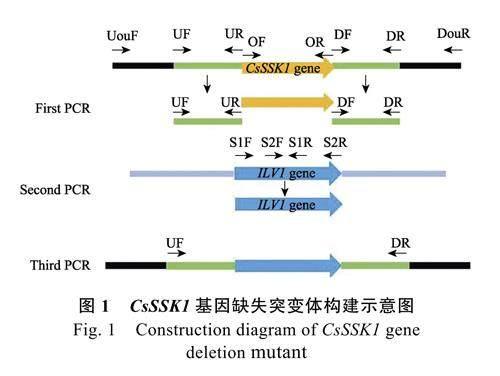
1.2.1 ΔCsSSK1 基因缺失突變菌株構建及驗證根據前人的研究方法[21],利用基因同源重組法,構建缺失突變體ΔCsSSK1(圖1),引物序列見表1。首先用帶有ILV1 基因接頭的引物對SSK1-UF/UR、SSK1-DF/DR 從野生型HN08 DNA 中擴增出CsSSK1 目的基因上下游片段,用引物S2R/S1F 從pCX62-S 載體中擴增出ILV1 基因全長,再利用融合PCR體系將擴增出的基因上下游片段與ILV1 基因片段連接起來,最后以連接的片段作為模板,用引物SSK1-UF/SSK1-DR 大量擴增融合片段,使用通用型DNA 純化回收試劑盒回收后,獲得同源重組片段。利用PEG 介導的原生質體和同源重組的方法[22],將片段轉入野生型HN08 原生質體中,在含有50 μg/mL 氯嘧磺隆的DCM 平板培養基上進行篩選。
初篩得到的轉化子再在含100 μg/mL 氯嘧磺隆的DCM 平板上復篩后,提取轉化子DNA 進行PCR 檢測(引物所在位置見圖1,引物序列見表1),分別利用外部引物對SSK1-UouF/DouR、基因內部引物對SSK1-OF/OR,以及和ILV1 基因內部引物S1R、S2F 組合進行PCR 驗證。此外,利用Southern Blot 技術對敲除轉化子內整合的ILV1 基因拷貝數進行驗證,提取野生型和ΔCsSSK1 突變體轉化子DNA,用EcoRⅠ內切酶進行酶切,以ILV1 基因的PCR 片段為探針進行雜交,雜交步驟參照DIG High Prime DNA Labeling and DetectionStarter Kit Ⅰ。
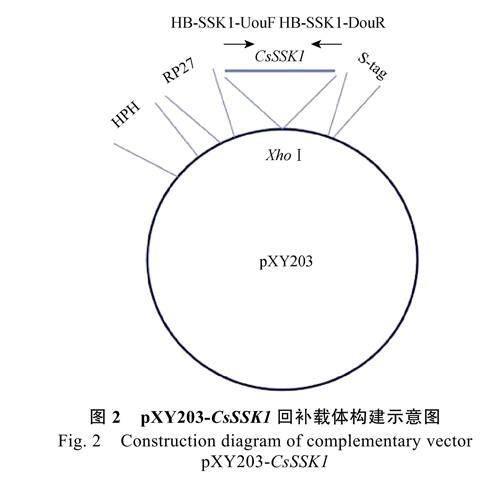
1.2.2 回補菌株ΔCsSSK1(CsSSK1)的獲得 以野生型HN08 DNA 為模板,用引物HB-SSK1-UouF/UouR 擴增CsSSK1 基因及其自身啟動子序列(3282 bp),將PCR 擴增片段與經XhoⅠ內切酶酶切回收的pXY203 載體一同轉化到酵母菌XK-125 中,然后涂布于SD/-Trp 平板上,置于30 ℃培養3 d 后挑取酵母單克隆進行菌落PCR 驗證。驗證正確的質粒再轉入大腸桿菌DH5α,獲得回補載體pXY203-CsSSK1,將回補載體轉入缺失突變體ΔCsSSK1 的原生質體中(原生質體轉化步驟同上),在含有300 μg/mL 潮霉素的PDS 平板培養基上進行篩選。待長出轉化子后,挑取轉化子到新的含有400 μg/mL 潮霉素的PDS 平板培養基上進行復篩,用引物HB-SSK1-UouF 與載體pXY203 引物stag-R 對回補轉化子進行PCR驗證(引物位置見圖2),最終獲得含有重組質粒pXY203-CsSSK1 的回補轉化子ΔCsSSK1(CsSSK1)。12.5 μL PCR 反應體系:6 μL 2×Taq PCRMaster Mix,10 μmol/L 引物各0.5 μL,0.5 μL 模板,加ddH2O 補足至12.5 μL。PCR 反應條件:95 ℃預變性5 min;95 ℃變性30 s,58 ℃退火30 s,72 ℃延伸2 min,35 個循環;最后72 ℃延伸10 min。4 ℃保存。
1.2.3 菌落形態觀察及生長速率測定 將野生型HN08、突變體ΔCsSSK1 及回補菌株ΔCsSSK1(CsSSK1)分別接種于PDA 平板,培養3 d 后刮取菌絲置于PD 液體培養基中于28 ℃、150 r/min 培養5 d,用滅菌Miracloth 過濾,5000 g 離心3 min后用無菌水重懸孢子。利用血球計數板調整孢子懸浮液濃度至105 個/mL,接種于CM 培養基上,置于28 ℃培養5 d 后測量菌落直徑。
1.2.4 分生孢子形態觀察及產孢量和萌發率測定分生孢子形態觀察:用上述方法培養野生型HN08(WT-HN08)、ΔCsSSK1、ΔCsSSK1(CsSSK1)分生孢子,分生孢子懸浮液濃度調至5×105 個/mL,備用。吸取供試菌株的分生孢子懸浮液20 μL 滴于載玻片表面,用顯微鏡觀察孢子形態,并分別選取100 個分生孢子,測量長度和寬度,重復3 次。
產孢量統計:用4 mL 無菌水洗下平板表面的分生孢子,再用滅菌Miracloth 過濾至2 mL 離心管中,用無菌水將孢子液定容至1 mL。吸取10 μL孢子液于血球計數板上,用血球計數板在顯微鏡下統計分生孢子數目。
萌發率統計:用無菌水收集孢子液并將濃度調至105 個/mL 左右。取10 μL 孢子液滴至疏水玻片表面,置于保濕盒中進行保濕處理,分別在0、2、4、6、8 h 在顯微鏡下觀察孢子萌發情況并記錄,重復3 次,根據試驗數據進行計算和處理。
1.2.5 脅迫響應及藥劑敏感性測定 配制含藥的CM 培養基,使其分別含0.5 mol/L NaCl、1.0 mol/LNaCl、1.0 mol/L 山梨醇、1.0 mol/L 蔗糖、1.0 mol/L葡萄糖、100 μg/mL 剛果紅,以及不同濃度藥劑咯菌腈(0.1、0.5、1.0、5.0 μg/mL)、2.5 μg/mL氟康唑、0.5 μg/mL 戊唑醇。分生孢子懸浮液配制方法同上,取10 μL 分生孢子懸浮液(105 個/mL)接種于含藥培養基平板中央,置于28 ℃培養5 d,采用“十”字交叉法測量菌落直徑并拍照記錄。計算抑制率,抑制率=(對照菌落直徑-處理菌落直徑)/對照菌落直徑×100%。
1.2.6 致病力測定 用血球計數板將分生孢子懸浮液濃度調至106 個/mL,將其接種于未刺傷和刺傷的離體橡膠樹葉片上,每次接種10 μL,重復30 張葉片,在接種后5 d 左右觀察發病情況,拍照并測量病斑面積。
1.3 數據處理
采用 SPSS 軟件對試驗數據進行統計分析,應用Duncans 新復極差法進行差異顯著性檢驗。
2 結果與分析
2.1 暹羅炭疽菌CsSSK1 基因敲除突變體及其回補菌株的獲得
利用基因同源重組法, 構建缺失突變體ΔCsSSK1。在含氯嘧磺隆藥劑平板上篩選獲得36個轉化子,經過多對引物PCR 驗證,篩選獲得1個缺失突變體ΔCsSSK1。PCR 驗證結果見圖3A,利用引物對SSK1-OF/SSK1-OR 在野生型菌株中可擴增獲得1 條大小為2018 bp 的條帶(泳道4),在ΔCsSSK1 突變體轉化子中未檢測到該序列條帶(泳道8);在ΔCsSSK1 中,利用引物SSK1-UouF和ILV1 基因內部S1R 在ΔCsSSK1 突變體中可擴增到1 條大小為2280 bp 的條帶(泳道6),利用SSK1-DouR 與ILV1 基因S2F 擴增到1 條大小為2548 bp 的條帶(泳道7),而野生型中未擴增出相應大小的條帶(泳道2 和3);用外部引物SSK1-UouF 及SSK1-DouR 在野生型菌株中可擴出1 條大小為3413 bp 的條帶(泳道1),在ΔCsSSK1 突變體中擴增出1 條大小為4212 bp 的條帶(泳道5)。經測序分析,顯示目的基因CsSSK1(2018 bp)被ILV1 基因(2817 bp)所替換。通過Southern blot分析顯示(圖3B),以ILV1 基因內部序列為探針,在ΔCsSSK1 基因組DNA 中雜交僅產生1 條條帶,而與野生型HN08 基因組DNA 雜交未產生條帶,說明ΔCsSSK1 基因組內僅整合1 個拷貝的ILV1基因序列。研究結果說明ΔCsSSK1 確實是CsSSK1基因缺失突變體。
通過原生質體轉化法,將構建的pXY203-CsSSK1 質粒載體轉入ΔCsSSK1 突變體中獲得回補轉化子ΔCsSSK1(CsSSK1),利用引物HB-SSK1-UouF 與載體pXY203 引物stag-R 進行驗證(圖3A)。在缺失突變體ΔCsSSK1 中未檢測到擴增條帶(泳道9),而回補轉化子ΔCsSSK1(CsSSK1)及回補載體pXY203-CsSSK1 可擴增到1 條大小為3382 bp 的目的條帶(泳道10 和11),說明目的序列已重新轉入,獲得基因回補菌株ΔCsSSK1(CsSSK1)。
2.2 暹羅炭疽菌突變體ΔCsSSK1 菌株的表型觀察
2.2.1 對菌落形態及生長速率的影響 在CM 培養基上突變體ΔCsSSK1 菌株的菌落形態和野生型菌株無明顯差異,但菌落直徑較小,菌落直徑測定結果顯示,ΔCsSSK1 菌株較野生型HN08 小12.50%(圖4)。結果說明CsSSK1 基因影響暹羅炭疽菌菌落的生長速率。
2.2.2 對產孢量、分生孢子形態及萌發率的影響經顯微觀察,ΔCsSSK1 的分生孢子比WT-HN08明顯較短圓(圖5A),長度比WT-HN08 短22.80%,寬度增14.01%(圖5B)。分生孢子產量測定結果顯示,WT-HN08 的孢子濃度約為(1.43±0.056)×106 個/mL,而ΔCsSSK1 敲除突變體的孢子濃度約為(0.43±0.043)×106 個/mL,回補菌株ΔCsSSK1(CsSSK1)的孢子濃度約為(1.13±0.032)×106 個/mL,ΔCsSSK1 敲除突變體的產孢量明顯減少(圖5C)。結果說明CsSSK1 基因影響暹羅炭疽菌分生孢子的產孢量及分生孢子的大小。
孢子萌發率測定結果顯示,在接種后0~8 h內,ΔCsSSK1 的分生孢子萌發率低于WT-HN08 和回補菌株ΔCsSSK1(CsSSK1),其中接種6 h 后,WTHN08分生孢子萌發率為82.75%±0.097%,ΔCsSSK1的萌發率為76.84%±0.10%,ΔCsSSK1(CsSSK1)的萌發率為83.95%±0.045%(圖5D)。說明CsSSK1的缺失會降低暹羅炭疽菌分生孢子的萌發。
2.2.3 對鹽脅迫、滲透脅迫及剛果紅脅迫的反應在含有0.5、1.0 mol/L NaCl,1.0 mol/L 山梨醇、1.0 mol/L 蔗糖、1.0 mol/L 葡萄糖、100 μg/mL 剛果紅的培養基上測量供試菌株菌落直徑, 與WT-HN08 相比,ΔCsSSK1 在含0.5、1.0 mol/L NaCl的平板上菌落直徑減小,抑制率分別為75.3%和100%,說明ΔCsSSK1 對高鹽脅迫反應敏感;ΔCsSSK1 在1.0 mol/L 山梨醇、1.0 mol/L 蔗糖、1.0 mol/L 葡萄糖平板上菌落直徑減小,抑制率依次為74.0%、81.5%、77.4%,說明ΔCsSSK1 對高滲透脅迫反應敏感;此外,在100 μg/mL 剛果紅平板上ΔCsSSK1 菌落直徑也減小,抑制率為15.1%,說明ΔCsSSK1 對剛果紅脅迫反應敏感,推測該基因影響細胞壁完整性(圖6)。結果表明,CsSSK1 基因參與應答鹽脅迫和滲透脅迫,可能影響細胞壁完整性。
2.2.4 對藥劑脅迫反應 通過測定化學藥劑咯菌腈、氟康唑和戊唑醇對供試菌株的影響,結果顯示,在含咯菌腈平板上,與WT-HN08 相比,ΔCsSSK1突變體的菌落直徑均極顯著增加,ΔCsSSK1 在咯菌腈濃度梯度為0.1、0.5、1.0、5.0 μg/mL 的平板上,其抑制率依次為15.6%、20.0%、17.5%、30.0%;在三唑類殺菌劑氟康唑和戊唑醇平板上,ΔCsSSK1突變體的菌落直徑減小,抑制率分別為21.6%和48.1%(圖7)。顯著性分析結果表明,CsSSK1 基因負調控炭疽菌對咯菌腈的敏感性,但正調控其對氟康唑、戊唑醇的敏感性。
2.2.5 致病力測定 在刺傷和未刺傷的橡膠樹葉片上分別接種供試菌株,5 d 后測量病斑面積。結果顯示,在刺傷和未刺傷葉片上,ΔCsSSK1 突變體的病斑面積均比WT-HN08 極顯著減小,分別減少79.8%和86.9%(圖8)。表明CsSSK1 基因參與暹羅炭疽菌的致病力調控。
3 討論
炭疽病是橡膠樹重要的葉部病害之一,目前國內外對橡膠樹炭疽菌的耐藥性分子機制及致病力的研究基礎還較薄弱。本研究構建了CsSSK1基因敲除突變體及回補菌株,表型觀察證實了暹羅炭疽菌CsSSK1 基因影響炭疽菌的菌落生長速率、分生孢子大小、產孢量及分生孢子萌發率,參與鹽脅迫、滲透脅迫和剛果紅脅迫反應,負調控炭疽菌對咯菌腈藥劑的敏感性,正調控其對氟康唑和戊唑醇的敏感性,且影響致病力。
SSK1 作為雙組分系統的應答調節蛋白,在病原菌中具有許多功能,但不同病原真菌的SSK1基因功能存在差異。很多研究均顯示,SSK1 可參與滲透脅迫反應,如稻瘟菌(Magnaporthe oryzae)與灰霉菌(Botrytis cinerea)中的SSK1 同源基因等[9-10]; 但克魯氏乳酸酵母菌(Kluyveromyceslactis)中的SSK1 基因缺失對高滲透壓的敏感性無影響[14]。在藥劑敏感性調控方面,不同病原菌中該基因缺失對藥劑敏感性的表型也不盡相同。有研究顯示該基因缺失可對吡咯類等藥劑表現抗性,如稻瘟菌中的MoSSK1[9]和鏈格孢菌(Alternaria alternata)中的SSK1[23];但在部分真菌中的表現卻相反,如灰霉菌中SSK1 的缺失對異菌脲、咯菌腈和三唑酮3 種殺菌劑更敏感,在白念珠菌(Candida albicans)中CaSSK1 突變體對氟康唑敏感[12-13];也有些病原菌,如絲狀真菌柄孢霉(Podospora anserina)中,ΔPaSSK1 突變株對氟康唑不敏感[15]。并且不同病原菌在致病力方面也存在差異,灰霉菌中的SSK1 同源基因Brrg-1 不參與毒力調控;而大麗輪枝菌(Verticillium dahliae)中的VdSsk1、萊氏野村菌(Nomuraea rileyi)中的Nrssk1、禾谷鐮刀菌(Fusarium graminearum)中的FgRrg-l(同源于釀酒酵母的Ssk1)均參與致病力的調控[11, 24-25]。本研究對暹羅炭疽菌的CsSSK1 基因功能進行分析發現,CsSSK1 基因的缺失不僅對鹽脅迫和滲透脅迫敏感,對咯菌腈抗性增強,還對剛果紅、氟康唑和戊唑醇敏感性增強,并且使炭疽菌致病力降低,研究結果說明在不同病原真菌中的SSK1 基因功能存在一定差異。但CsSSK1 基因的這些功能對調控炭疽菌的脅迫響應、耐藥性、致病力等分子機制尚無相關研究,后續可進一步分析CsSSK1 的互作蛋白及上下游調控因子,可為深入了解CsSSK1 如何影響相關功能進行深入分析,為解析炭疽菌致病機理和應答抗逆反應的分子機理奠定基礎。

