Wilson 病患者合并腦白質病變臨床相關的危險因素探討
王愛玲 胡文彬
Wilson 病(Wilson’s disease,WD),又稱之為肝豆狀核變性(hepatolenticular degeneration,HLD),是一種由13 號常染色體ATP7B 基因突變引起的罕見的可治性的遺傳性疾病,ATP7B 基因編碼一種運輸銅的P 型ATP 酶,該酶將銅離子轉運至高爾基體內合成銅藍蛋白,分泌入血供機體利用。ATP7B 基因突變導致機體銅藍蛋白合成減少,血清游離銅增多,銅離子沉積于肝臟、大腦、腎臟、角膜及骨骼等臟器,引起相應的臨床表現[1-2],包括肝功能障礙、精神行為異常,和以肌張力障礙、震顫為特征的運動障礙等。腦白質病變(white matter lesions,WMLs)是由神經病學專家Hachinski 等首次提出的神經影像學概念,是腦小血管病的影像學標記物之一,表現為腦室旁及大腦半球半卵圓中心有點狀的、泥沙狀的缺血灶[3]。目前有研究發現,WMLs 與患者的年齡、血糖、血脂、同型半胱氨酸、尿酸、肌酐等相關,且可引起認知障礙、步態平衡障礙、情緒異常和二便障礙等[4-7]。近年來研究發現,WD 患者頭顱MRI 檢查顯示其合并WMLs[8-13],存在此兩種疾病的共病。然而,目前WD 患者并發WMLs 的危險因素尚不清楚,且未查閱到該方面相關研究的文獻報道。本文回顧性研究WD 患者中沒有合并WMLs 與合并WMLs 兩組的臨床資料,以期為WD 患者進一步的精準治療提供新思路。
1 資料與方法
1.1 一般資料 回顧性分析2022年8月至2023年6月期間安徽中醫藥大學神經病研究所附屬醫院住院的WD 合并WMLs 的43例患者(研究組)的臨床資料,以同時期住院的不合并WMLs 的44例WD 患者作為對照組。WD 合并WMLS 組患者年齡15~60 歲,病程1~36年。WD 無合并WMLS 組患者年齡12~50 歲,病程1~35年。兩組患者年齡、病程、性別、臨床分型比較,差異無統計學意義(P>0.05),具有可比性,見表1。本研究方案得到了安徽中醫藥大學神經病學研究所附屬醫院倫理委員會的批準[審批編號:2023 倫字(29)號]。
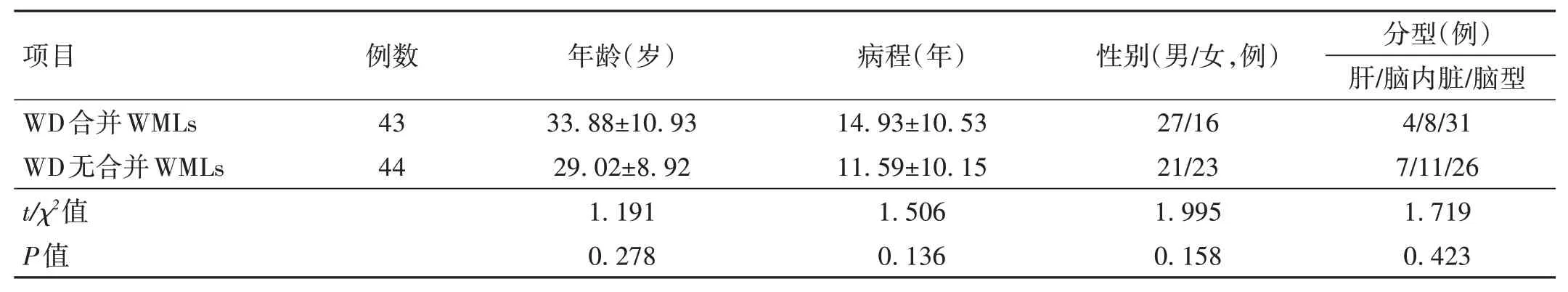
表1 兩組一般臨床資料分析
1.2 納入與排除標準
1.2.1 納入標準 WD 納入標準:依據《中國肝豆狀核變性診療指南2022》[2]所推薦的萊比錫評分系統[14],總分≥4 分即可確診WD。臨床分型依據《中國肝豆狀核變性診療指南2022》[2]自擬,肝型:無癥狀患者、急性肝炎、急性肝衰竭、慢性肝炎、肝硬化等多種形式;腦型:肌張力障礙、震顫、肢體僵硬和運動遲緩、精神行為異常等;腦-內臟型:兼有腦癥狀和肝臟癥狀同時表現為明顯的臨床癥狀。
WD 合并WMLs 組納入標準:符合WMLs 的影像學診斷標準[15],腦白質病變表現為T2WI、FLAIR 圖像上白質內邊界不清、形態不規則呈斑塊狀或片狀病變的高信號區,T1WI 圖像上無信號或弱的低信號區。見圖1A、B、C。
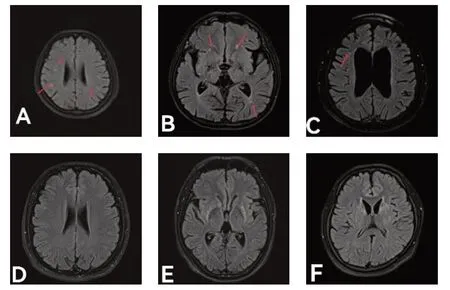
圖1 不同臨床分型WD患者合并WMLs與未合并WMLs的頭顱MRI的FLAIR成像
WD 不合并WMLs 組納入標準:無WMLs 的影像學診斷標準[15],見圖1D、E、F。
1.2.2 排除標準 ①有嚴重的焦慮抑郁、狂躁等精神行為異常;②有腦外傷、中毒、感染等病史;③伴隨其他影響腦萎縮的嚴重神經系統疾病,如阿爾茨海默病等;④有嚴重的心臟病、幽閉恐怖癥者等。
1.3 觀察指標 未使用二巰基丙磺酸鈉及其他口服驅銅藥物治療至少一周的24 h 尿銅值視為治療前尿銅,兩組患者入院第2 天留取除去晨尿后至第3 天晨尿的全部尿液置于統一規格的經去離子水處理過的尿桶中,尿量以>1 L 為宜,每次留尿后及時加蓋避免污染和揮發,尿銅的檢測采用GGX 系列原子吸收分光光度計。兩組患者均于入院第2 天清晨空腹抽取外周靜脈血5 mL 置于真空采血抗凝管中,并于1 h 內分離血漿,儀器采用日立7020 全自動生化分析儀,檢測血清銅藍蛋白、血清鐵、血糖、血脂、同型半胱氨酸、尿酸和肌酐。
1.4 統計學方法 采用SPSS 26.0 軟件進行數據統計學處理。計量資料符合正態分布的采用以x-±s表示,采用兩獨立樣本t檢驗分析。不符合正態分布的計量資料采用M(P25,P75)表示,兩組數據差異采用Mann-WhitneyU檢驗。計數資料以例或率表示,采用χ2檢驗。采用Spearman 相關性分析觀察療前24 h 尿銅與同型半胱氨酸的相關性,二分類logistic 回歸分析相關臨床指標與WD 合并WMLs 的相關性。以P<0.05 為差異具有統計學意義。
2 結果
2.1 兩組患者臨床檢驗指標比較 研究組患者的治療前24 h 尿銅和血清同型半胱氨酸高于對照組,差異有統計學意義(P<0.05)。兩組患者的銅藍蛋白、血清鐵比較,差異無統計學意義(P>0.05),兩組患者血脂(三酰甘油、膽固醇、高密度脂蛋白、低密度脂蛋白)、空腹血糖和尿酸、肌酐比較,差異均無統計學意義(P>0.05),見表2。
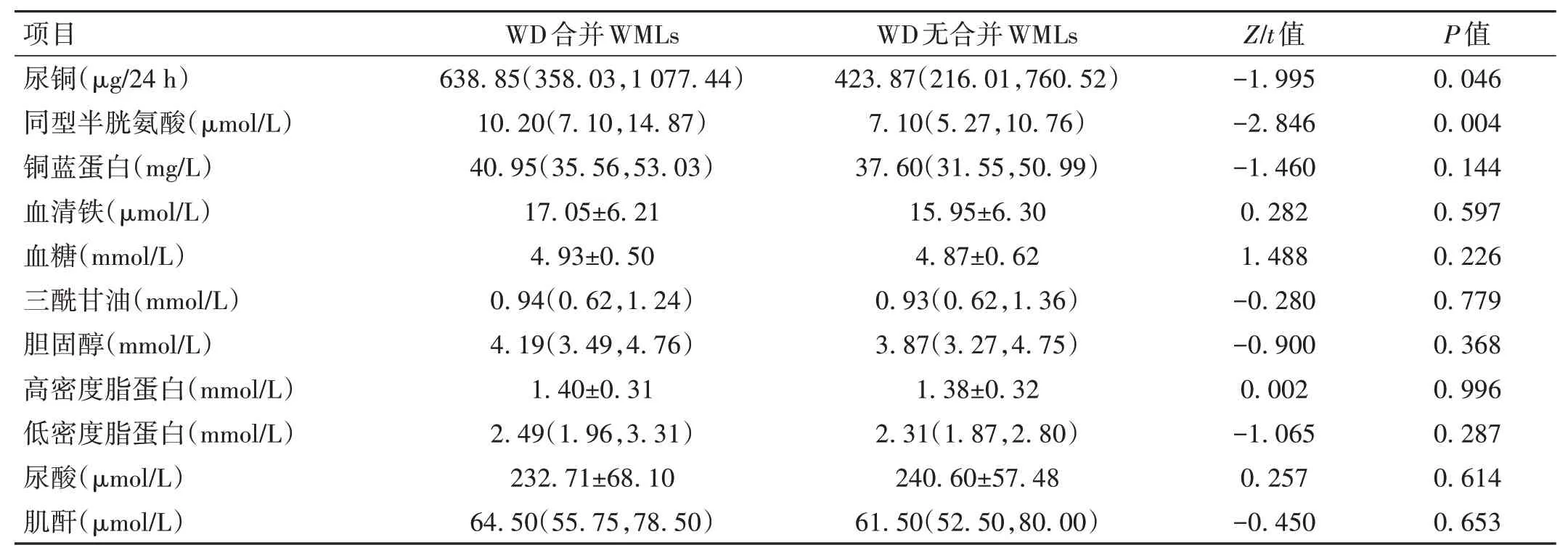
表2 兩組患者臨床檢驗指標比較分析
2.2 兩組患者治療前24 h 尿銅和血清同型半胱氨酸Spearman相關性分析 兩組患者治療前24 h 尿銅與血清同型半胱氨酸的無明顯相關性(P>0.05),見表3。
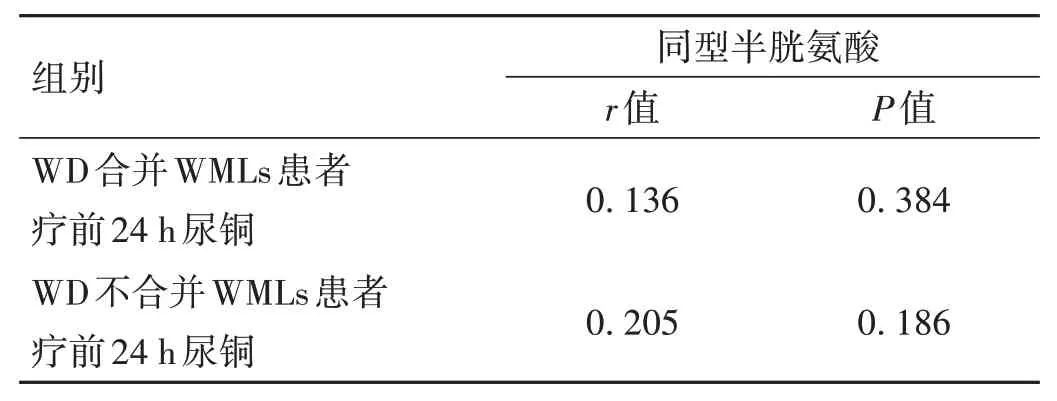
表3 兩組患者療前24 h尿銅與同型半胱氨酸的Spearman相關性分析
2.3 二分類logistic回歸分析 將治療前24 h 尿銅、同型半胱氨酸(具體數值)作為自變量,以是否合并WMLs(1=否;2=是)作為因變量,建立二分類logistic 回歸方程,結果顯示同型半胱氨酸是WD 合并WMLs 的危險因素(P=0.024),見表4。
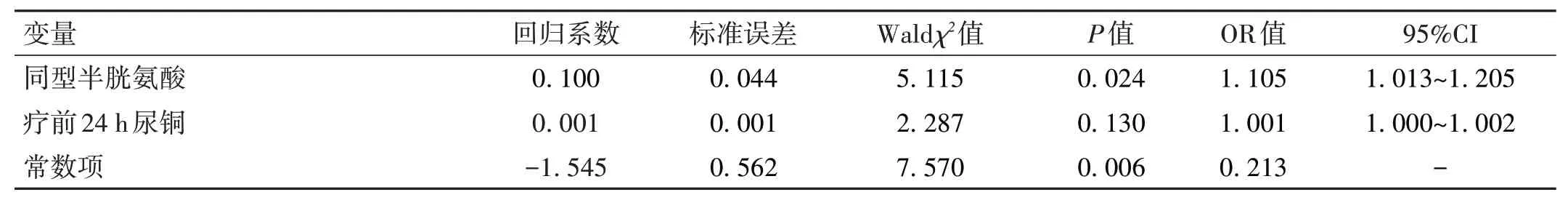
表4 二分類logistic回歸分析臨床指標對WD合并WMLs的影響因素分析
3 討論
WD 是銅代謝障礙性疾病,當過量的銅離子沉積于腦部時多累及豆狀核、尾狀核、丘腦、中腦、小腦等。研究顯示,WD 典型頭顱MRI 表現為基底節、丘腦、腦干、小腦等部位出現對稱性的長T1、長T2異常信號[16]。既往有研究發現,WD 患者頭顱MRI 顯示雙側的側腦室旁、半卵圓中心存在著缺血灶[7-12],推測WD 與WMLs之間可能存在某種聯系。WMLs 屬于缺血性腦小血管疾病范疇,發病機制尚未明確,劉璇等[17]認為其發生可能與血腦屏障的破壞、腦組織灌注降低、血管內皮細胞功能的紊亂、炎癥反應等相關。
既往有研究表明,年齡是WMLs 的獨立危險因素,Vedala 等[18]研究發現50 歲以上人群中發生WMLs 的概率顯著增加。WD 患者本身存在過量銅離子沉積于腦部血管,造成血管內皮細胞的損傷,導致腦血流灌注不足[19],故隨著年齡增長,可能會進一步加重WD 患者腦血流的灌注不足,促進WMLs 發生,與劉力生等[20]發現40 歲以上的晚發性WD 患者額頂葉皮質下、半卵圓中心、放射冠及腦室旁點片狀缺血灶多于非晚發性WD患者相符合。但本文研究的兩組WD 患者平均年齡在30 歲左右,分析可能原因是劉力生等學者研究關注晚發性WD 患者臨床特征,故臨床上收集患者的年齡可能高于本研究。且本研究兩組患者在年齡無差異,具有可比性,首次初步探討了合并WMLs 的WD 患者的危險因素。
同型半胱氨酸是蛋氨酸脫甲基后的產物,主要在肝臟產生與代謝,有研究顯示血清高同型半胱氨酸與WMLs 有密切的聯系[21-22]。蘇楠等[23]發現帕金森患者血清同型半胱氨酸偏高,伴發腦白質病變的風險高。WD 患者因過量的銅蓄積于肝臟,損害肝細胞,導致慢性肝損傷,從而引起同型半胱氨酸甲基化或轉硫途徑代謝障礙而使血中同型半胱氨酸升高。即往有研究顯示同型半胱氨酸可導致腦部缺血性病變的發生[24],故WD 患者同型半胱氨酸升高,可能會進一步導致和/或加重WMLs 的發生與進展。本文通過研究兩組患者的一般資料及多項與WMLs 相關的臨床檢驗指標,結果顯示同型半胱氨酸及療前24 h 尿銅增高與WD 合并WMLs 相關,且同型半胱氨酸是WD 合并WMLs 的危險因素。
24 h 尿銅通常作為患者體內含銅量高低和驅銅療效的觀察指標,相關研究通過大樣本調查表明,WD 患者的同型半胱氨酸與24 h 尿銅呈線性正相關,療前24 h 尿銅與第一療程24 h 尿銅數值高,患者的同型半胱氨酸亦高,且經過多年的臨床實踐觀察得出長期正規驅銅治療后,患者臨床表現改善,其第一療程24 h 尿銅及同型半胱氨酸均明顯下降,提出同型半胱氨酸水平的降低可能是患者腦組織的局部腦血流量改善的部分原因[25-26]。本文研究結果提示兩組患者的同型半胱氨酸與療前24 h 尿銅無明顯的相關性,推測其原因可能是研究納入的樣本量較小,導致線性相關分析結果存在著偏倚。
綜上所述,療前24 h 尿銅及同型半胱氨酸增高與WD 合并WMLs 有關,且同型半胱氨酸的增高是WD合并WMLs 的危險因素,促進WD 患者合并WMLs 的發生與進展,因此,臨床上在驅銅治療WD 患者的同時,可以考慮聯合使用改善腦組織缺血、缺氧和調控高同型半胱氨酸血癥的療法,從而縮短起效時間、提高患者的顯效率與總有效率。本研究仍然存在一些不足,首先,未能進一步研究這些相關臨床指標與WD 合并WMLs 嚴重程度的相關性;其次,因為WD 屬于罕見病,本研究為首次研究WD 合并WMLs 臨床相關危險因素,且收集納入的樣本量較小,尚需繼續積累病例數,進一步進行深入的研究。

