腦膠質瘤組織lncRNA BCAR4、MMP-7表達變化及其臨床意義
許海,魏民,楊德福,張恒柱
1 揚州大學附屬江都人民醫院神經外科,江蘇揚州 225202;2 揚州大學附屬蘇北人民醫院神經外科
腦膠質瘤是中樞神經系統最常見的惡性腫瘤,具有高復發率、高致殘率、高病死率等特征。在我國腦膠質瘤的年發病率為5/10 萬~8/10 萬,5 年病死率僅次于肺癌和胰腺癌[1-2]。但目前腦膠質瘤發病的分子機制尚不完全清楚。研究表明,長鏈非編碼RNA(lncRNA)雖然不具有蛋白編碼功能,但其異常表達與腫瘤的發生、發展密切相關[3]。乳腺癌抗雌激素耐藥基因4(BCAR4)是近年發現的一種lncRNA。有研究報道,lncRNA BCAR4異常表達與腦膠質瘤的惡性進展有關[4]。基質金屬蛋白酶7(MMP-7)是一種分泌型蛋白,能夠通過蛋白水解作用促進腫瘤細胞的增殖、侵襲和遷移等[5]。郭秀蓮等[6]研究報道,上調MMP-7表達可促進腦膠質瘤細胞增殖和侵襲并抑制其凋亡。但目前lncRNA BCAR4、MMP-7表達與腦膠質瘤患者臨床病理特征和預后的關系尚不完全清楚。鑒于此,我們進行了相關研究。現報告如下。
1 資料與方法
1.1 臨床資料 選擇2018 年2 月—2020 年8 月揚州大學附屬江都人民醫院神經外科收治的腦膠質瘤患者98例。納入標準:①經術后組織病理檢查明確診斷為腦膠質瘤;②初診,入院前未接受任何抗腫瘤治療;③接受腦膠質瘤次全切除術或全切除術;④臨床病理資料和術后隨訪資料完整。排除標準:①腦轉移瘤者;②合并顱內其他疾病者;③合并其他部位惡性腫瘤者;④合并急慢性感染者;⑤合并免疫或血液系統損害者;⑥年齡<18 歲者。其中,男55 例、女43例,年齡23~82(60.54 ± 8.54)歲,腫瘤位置:額部41 例、顳部57 例,腫瘤最大徑:<3 cm 48 例、≥3 cm 50 例,組織分化程度:低分化37 例、中高分化61例;WHO 分級[7]:Ⅰ級22 例、Ⅱ級34 例、Ⅲ級26例、Ⅳ級16 例。本研究經揚州大學附屬江都人民醫院倫理委員會批準(審批編號:2017 倫字1223),所有研究對象或其家屬知情同意并簽署書面知情同意書。
1.2 lncRNA BCAR4、MMP-7 mRNA 表達檢測 取術中切除的新鮮腦膠質瘤組織及其配對的瘤旁組織(經術后組織病理檢查明確為正常組織),液氮下速凍后研磨成粉末。采用TRIzol 法提取組織總RNA,經紫外可見分光光度計鑒定,OD260/OD280為1.8~2.0。按TaKaRa RNA PCR Kit 說明將總RNA 逆轉錄合成為cDNA。逆轉錄條件:37 ℃ 1 h,80 ℃ 5 s。以cDNA 為模板,按SYBR?Premix Ex TaqTM試劑盒說明進行PCR 擴增。引物序列由上海劍鈍生物科技有限公司設計合成。lncRNA BCAR4 上游引物5'-GCCACAGGAGCTAGAGCAGT-3'、下游引物5'-GCAGAGTATTCAGGGTAAGGGT-3',MMP-7 上游引物5'-GAAGGGCCGAAGAGCTCAAT-3'、下游引物5'-GGCTCGCAAAGTGTCTGTTG-3',GAPDH 上游引物5'-AACGGATTTGGTCGTATTGGG-3'、下游引物5'-CGCTCCTGGAAGATGGTGAT-3'。PCR 反應體系共20 μL:cDNA 模板1 μL,2 × Hieff?PCR Master 8 μL,上下游引物各0.5 μL,SYBR Premix Ex Taq 5 μL,RNase-free ddH2O 5 μL;反應條件:95 ℃ 90 s,95 ℃ 30 s、63 ℃ 30 s、72 ℃ 15 s 共40 個循環。PCR擴增反應結束,繪制熔解曲線,獲取循環閾值(CT)數。以GAPDH 為內參,采用2-ΔΔCT法計算lncRNA BCAR4、MMP-7 mRNA相對表達量。
1.3 隨訪 腦膠質瘤患者出院后通過電話或門診復查形式定期隨訪3年,第1年每3個月隨訪1次,之后每半年隨訪1次。隨訪截至2023年8月31日,終點事件為患者死亡或至隨訪截至日期,統計患者生存時間。以腦膠質瘤組織lncRNA BCAR4、MMP-7 mRNA相對表達量的均值為臨界值,將患者分為lncRNA BCAR4、MMP-7 mRNA 高表達者與低表達者,分析腦膠質瘤組織lncRNA BCAR4、MMP-7 mRNA表達與患者預后的關系。
1.4 統計學方法 采用SPSS28.0 統計軟件。符合正態分布的計量資料以±s表示,結果比較采用獨立樣本t檢驗。計數資料比較采用χ2檢驗。相關性分析采用Pearson 相關分析法。生存分析采用Kaplan-Meier法,生存率比較采用Log-rank檢驗。危險因素分析采用多因素Cox 回歸模型。P<0.05 為差異有統計學意義。
2 結果
2.1 腦膠質瘤組織與瘤旁正常組織lncRNA BCAR4、MMP-7 mRNA 表達比較 腦膠質瘤組織與瘤旁正常組織lncRNA BCAR4 相對表達量分別為2.42± 0.67、1.13 ± 0.22,MMP-7 mRNA 相對表達量分別為1.00 ± 0.17、0.54 ± 0.10。腦膠質瘤組織lncRNA BCAR4、MMP-7 mRNA 相對表達量均高于瘤旁正常組織(t分別為18.094、22.594,P均<0.01)。
2.2 腦膠質瘤組織lncRNA BCAR4、MMP-7 mRNA表達的關系 Pearson 相關分析顯示,腦膠質瘤組織lncRNA BCAR4 相對表達量與MMP-7 mRNA 相對表達量呈正相關關系(r=0.810,P<0.01)。
2.3 腦膠質瘤組織lncRNA BCAR4、MMP-7 mRNA表達與臨床病理特征的關系 見表1。

表1 腦膠質瘤組織lncRNA BCAR4、MMP-7 mRNA表達與臨床病理特征的關系
2.4 腦膠質瘤組織lncRNA BCAR4、MMP-7 mRNA表達與患者預后的關系 隨訪3年,98例腦膠質瘤患者失訪4例、死亡45例,3年生存率為54.08%,平均生存時間為26.596 個月。lncRNA BCAR4、MMP-7 mRNA高表達者分別有48、51例,其低表達者分別有50、47例。lncRNA BCAR4、MMP-7 mRNA高表達者平均生存時間分別為22.047、22.234個月,其低表達者分別為30.148、30.609個月。lncRNA BCAR4、MMP-7 mRNA 高表達者平均生存時間均低于其低表達者(Log-rankχ2分別為11.357、11.666,P均<0.01)。
2.5 腦膠質瘤患者死亡的危險因素 腦膠質瘤患者死亡者與存活者臨床資料比較見表2。以年齡(<60 歲=0,≥60 歲=1)、組織分化程度(中高分化=0,低分化=1)、WHO 分級(Ⅰ、Ⅱ級=0,Ⅲ、Ⅳ級=1)、lncRNA BCAR4 表達(原值錄入)、MMP-7 mRNA 表達(原值錄入)為自變量,以隨訪時間為時間變量,以生存狀態(存活=0,死亡=1)為因變量,納入多因素Cox 回歸模型。結果顯示,組織分化程度低分化和WHO 分級Ⅲ、Ⅳ級以及lncRNA BCAR4、MMP-7 mRNA 表達升高為腦膠質瘤患者死亡的獨立危險因素(P均<0.05),見表3。
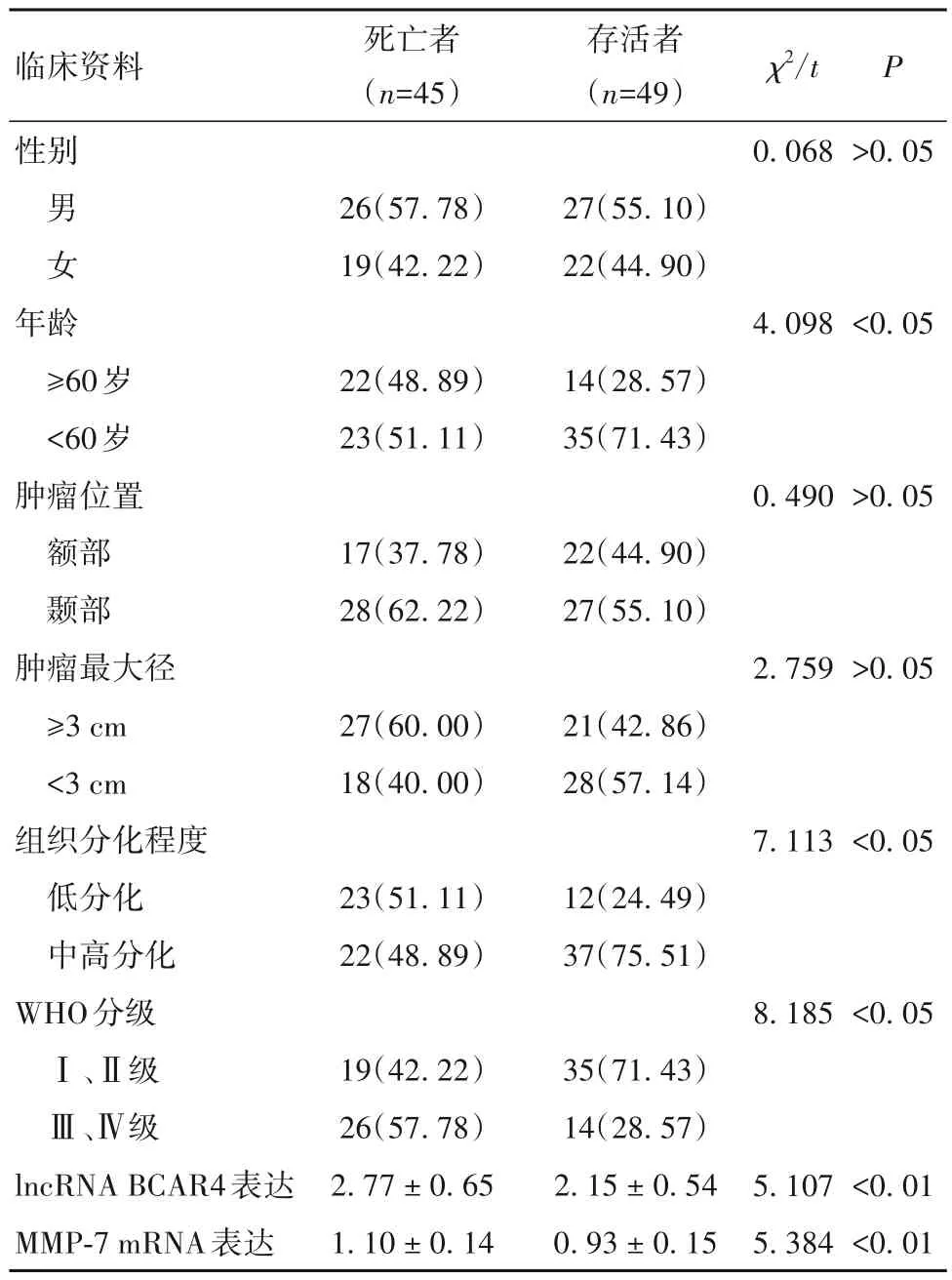
表2 腦膠質瘤患者死亡者與存活者臨床資料比較[例(%)]

表3 腦膠質瘤患者死亡的多因素Cox回歸分析結果
3 討論
腦膠質瘤是起源于神經膠質細胞的顱內惡性腫瘤,以顱內壓增高、神經功能障礙和癲癇發作為主要臨床表現。迄今為止,腦膠質瘤的病因尚不完全清楚,可能與高外顯率基因遺傳突變、高劑量電離輻射、細菌或病毒感染等因素有關[1]。近年來,盡管以外科手術、放療、化療為主的綜合治療取得了一定進步,但由于腦膠質瘤細胞具有高度增殖和侵襲特征,很難達到根治效果,并且復發率較高,預后仍然較差,尤其是WHO 分級Ⅲ、Ⅳ級患者[8]。目前,腦膠質瘤發病的分子機制尚不完全清楚。因此,深入探索腦膠質瘤發病的分子機制,對尋找腫瘤特異性治療靶點至關重要[9]。
表觀遺傳學在腫瘤的發生、發展中具有重要作用。lncRNA 作為新興的表觀遺傳調控因子,能夠通過直接或間接調控靶基因的表達,促進腫瘤的發生、發展[3]。lncRNA BCAR4定位于人染色體16p13.13,最初于乳腺癌抗雌激素耐藥基因篩查時被發現,后進一步研究證實其與乳腺癌細胞的惡性生物學行為有關[10]。近年研究發現,lncRNA BCAR4 還可在其他惡性腫瘤中發揮致癌作用,如lncRNA BCAR4 能夠靶向miR-181c-5p 上調LIM 和SH3 蛋白1,從而促進食管鱗癌細胞的增殖、侵襲和遷移[11];lncRNA BCAR4還能靶向大腫瘤抑制激酶2促進肝細胞癌細胞的增殖、遷移并抑制其凋亡[12]。但目前lncRNA BCAR4 與腦膠質瘤的關系尚不完全清楚。本研究結果顯示,腦膠質瘤組織lncRNA BCAR4 表達上調,并且其表達變化與組織分化程度和WHO 分級有關。結果表明,lncRNA BCAR4 高表達能夠參與腦膠質瘤的發生、發展。究其原因,lncRNA BCAR4 表達上調可激活膠質瘤相關癌基因同源蛋白2,而膠質瘤相關癌基因同源蛋白2是腦膠質瘤的重要致癌基因,其表達上調能夠促進腦膠質瘤細胞的增殖、侵襲和遷移[13]。
細胞外基質是細胞微環境的核心組分,可為細胞提供結構和機械支持,能夠參與細胞增殖、分化、遷移、侵襲等生物學過程。細胞外基質的降解則會破壞細胞結構導致癌變,同時變薄的細胞基底膜還會促進腫瘤細胞的侵襲和遷移[14]。MMP-7 是MMPs家族中最小的成員,其激活后可降解細胞外基質和基底膜,從而參與腫瘤的發生、發展。MMP-7 還能切割多配體蛋白聚糖-1-白細胞介素8復合物介導炎癥反應,從而促進腫瘤的侵襲和轉移[15]。例如,MMP-7 能夠通過降解細胞外基質促進胰腺癌細胞的增殖、侵襲和遷移[16];MMP-7 還能通過蛋白激酶B/核因子κB 信號通路介導炎癥反應,從而促進前列腺癌細胞的侵襲和遷移[17]。本研究結果顯示,腦膠質瘤組織MMP-7 mRNA 表達上調,并且其表達變化與組織分化程度和WHO 分級有關。結果表明,MMP-7 高表達能夠參與腦膠質瘤的發生、發展,與既往研究[6]報道一致。究其原因,MMP-7 高表達能夠加速細胞外基質破壞和增強炎癥反應,從而促進腦膠質瘤的惡性進展[18]。
本研究Pearson 相關分析顯示,腦膠質瘤組織lncRNA BCAR4 相對表達量與MMP-7 mRNA 相對表達量呈正相關關系,提示lncRNA BCAR4 與MMP-7可能共同參與腦膠質瘤的發生、發展。最近WANG等[4]研究亦證實,lncRNA BCAR4能夠靶向miR-2276上調MMP-7 表達,促進腦膠質瘤細胞的增殖和侵襲,進一步佐證了本研究結論。本研究結果還顯示,lncRNA BCAR4、MMP-7 mRNA 高表達者平均生存時間均低于其低表達者,并且lncRNA BCAR4、MMP-7 mRNA 表達升高為腦膠質瘤患者死亡的獨立危險因素。結果提示,lncRNA BCAR4、MMP-7 mRNA 高表達與腦膠質瘤患者預后不良密切相關,有可能成為腦膠質瘤患者預后的潛在預測指標。
綜上所述,腦膠質瘤組織lncRNA BCAR4、MMP-7 mRNA 表達顯著升高,二者表達變化與組織分化程度、WHO分級和預后密切相關。

