J、K亞群禽白血病病毒的分離和囊膜蛋白(gp85)基因序列分析
周釗燦 , 游廣炬 , 楊金易 , 蘇曉娜 , 高 麗 , 王永強 , 鄭世軍
(1. 中國農業大學動物醫學院 獸醫公共衛生安全全國重點實驗室 農業部動物流行病學重點實驗室 , 北京 海淀 100193 ;2. 華南農業大學食品學院 , 廣東 廣州 510642 ; 3. 溫氏食品集團股份有限公司 嶺南現代農業科學與技術廣東省實驗室云浮分中心 , 廣東 云浮 527100)
禽白血病是一種禽類免疫抑制疾病的總稱,是由反轉錄病毒科、反轉錄病毒屬的禽白血病病毒(Avian leukosis virus,ALV)引起的禽腫瘤性疾病,感染雞出現多種形式的腫瘤、免疫抑制、產蛋率下降和增重緩慢,增加對其他病原的易感性,進而增加疫苗接種失敗的風險,給世界養禽業帶來巨大的經濟損失[1]。ALV是一種有包膜的逆轉錄病毒,基因組大小約為7.2 kb,編碼核衣殼蛋白(Nucleocapsid protein)、多聚酶蛋白(Polymerase)和糖基化包膜蛋白(Glycosylated envelope protein)等結構蛋白和酶蛋白。根據病毒囊膜env基因序列、中和特性和宿主嗜性的不同,ALV被劃分成A~K 共11個亞群,其中A~E、J和K共7個亞群可感染雞[2-3]。囊膜蛋白(gp85)是ALV的主要包膜蛋白和突變率最高的結構蛋白,可與宿主細胞膜上的特異性病毒受體特異性結合,并參與病毒中和,對ALV毒力、進入宿主細胞機制和遺傳變異特性等研究有重要意義[4-5]。HPRS-103作為ALV J亞群(ALV-J)代表株,于1992年在英國首次從肉雞中分離[6]。我國于1999年從山東某種雞場發病雞中首次分離到ALV-J毒株,隨后,其在全國各地迅速廣泛傳播,占據主導地位[7-8]。2012年,在我國地方品種雞中分離到新的ALV毒株,其gp85基因序列與已知的ALV亞群毒株同源性不高,將其劃分為新亞群,即ALV-K[9-12]。有研究表明,ALV-K亞群病毒復制能力、致病性和致癌性相對較低,但容易與其他亞群ALV發生混合感染,從而加快了ALV的重組速率,也使ALV分離鑒定變得更加困難[13]。目前尚無針對禽白血病的疫苗或藥物。通過執行ALV定期檢測、淘汰陽性雞的措施實現規模化養禽場的禽白血病凈化是有效控制措施,目前國內部分大型養殖場已經滿足凈化標準。然而,ALV仍然在某些小型和地方家禽養殖場中流行[9,14-15]。本試驗在2021—2022年從國內某蛋雞場禽白血病凈化蛋清p27抗原陽性雞血漿中分離到7株ALV,其中3株為J亞群毒株,4株為K亞群毒株,對其gp85基因進行克隆和測序,并與國內外分離毒株進行比較分析,為后續研究ALV的遺傳變異特征和流行趨勢等提供參考依據。
1 材料與方法
1.1 主要試劑 胎牛血清(Fetal bovine serum,FBS),購自美國Gibco公司;磷酸緩沖鹽溶液(Phosphate buffer saline,PBS)、DMEM(Dulbecco's modified eagle medium)高糖培養基和胰酶,均購自北京中科邁晨科技有限公司;禽白血病病毒抗原p27 ELISA檢測試劑盒,購自廣東標允生物科技有限公司;RNA提取試劑盒,購自上海飛捷生物技術有限公司;第一鏈RNA反轉錄試劑盒,購自北京擎科生物科技有限公司;膠回收試劑盒,購自北京美基生物科技有限公司;Trans1-T1感受態細胞,購自北京全式金生物技術有限公司;TOPO-Blunt Cloning Kit和Phanta Flash高保真酶,均購自南京諾唯贊生物科技股份有限公司;M5Taq酶,購自北京聚合美生物科技有限公司;曲拉通 X-100(TritonX-100),購自北京索萊寶科技有限公司;牛血清白蛋白(Bovine serum albumin,BSA),購自美國AMRESCO公司;FITC標記山羊抗小鼠IgG抗體,購自北京博奧森生物技術有限公司;ALV p27單克隆抗體,本實驗室保存。
1.2 主要儀器 電泳成套設備和PCR儀,均為美國Bio-Rad Laboratories公司產品;凝膠成像分析系統,美國Alpha公司產品;臺式電子天平,德國Sartorius AG產品;熒光倒置顯微鏡,日本Olympus株式會社產品;電熱恒溫水槽,中國恒一科技股份有限公司產品;二氧化碳培養箱,美國Thermo Fisher科技公司產品。
1.3 樣品與細胞 于2021—2022年自國內某禽白血病凈化雞場蛋清ALV陽性雞采集無菌抗凝血樣本40份,雞胚成纖維細胞(Douglas foster-1,DF-1)由本實驗室保存。
1.4 病毒分離 無菌抗凝血樣本于4 ℃、3 000 r/min離心3 min,吸取上清液,4 ℃、12 000 r/min離心10 min,吸取透明淡黃色血漿,過0.22 μm濾器。用含10%FBS的DMEM培養基培養DF-1 細胞至密度達30%,更換為不含FBS的DMEM培養基(加入10%青鏈霉素雙抗),接種處理好的血漿樣品,每孔100 μL,每份樣品接種2個細胞孔并設立空白對照,于37 ℃、5%二氧化碳細胞培養箱中放置1 h,吸棄上清液,用含1% FBS的 DMEM 維持液培養(加入5%青鏈霉素雙抗),37 ℃、5%二氧化碳細胞培養箱中放置 6 d,盲傳2代,收取細胞上清液,用禽白血病病毒抗原p27 ELISA檢測試劑盒進行檢測。
1.5 病毒DNA提取和亞群鑒定 將1.4中ELISA檢測結果為陽性的細胞上清液接種于DF-1細胞,未進行接種操作的細胞孔為陰性對照,用含1%FBS的DMEM維持液培養4 d,收取病毒上清液,用RNA提取試劑盒提取ALV病毒基因組RNA,用第一鏈RNA反轉錄試劑盒將提取的RNA反轉錄為cDNA。根據參考文獻[16-17]中方法設計ALV-A、ALV-B、ALV-J和ALV-K的鑒定引物(表1),引物由生工生物工程(上海)股份有限公司合成,以提取的ALV cDNA為模板,用M5Taq酶進行PCR擴增。
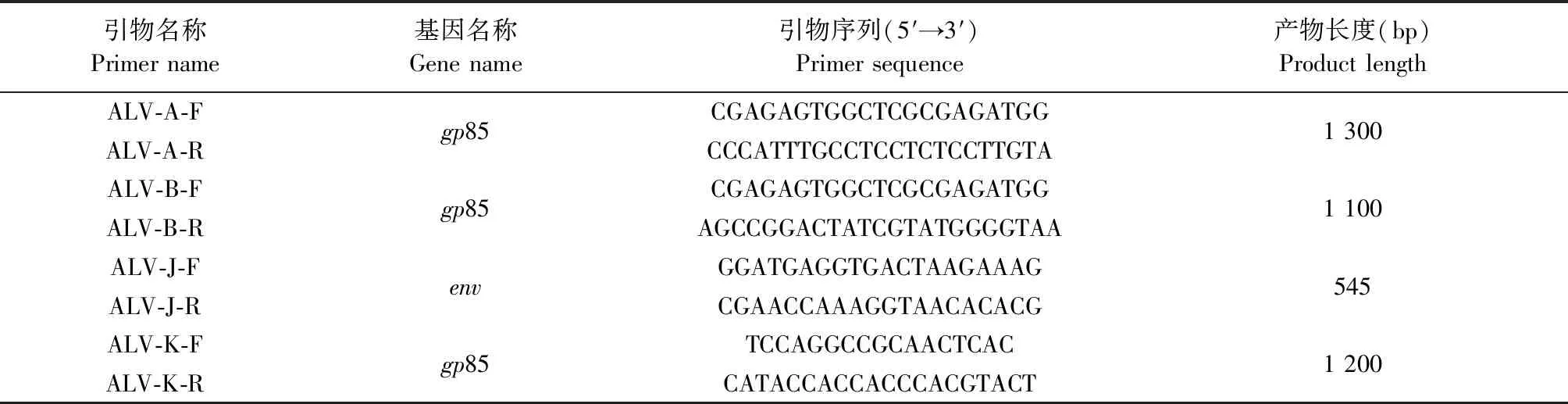
表1 ALV亞群PCR鑒定所用引物信息
1.6 病毒gp85基因PCR擴增和測序 根據ALV各亞群的gp85基因及其鄰近序列的保守區域,設計gp85基因PCR擴增引物(表2),以ALV cDNA為模板,用Phanta Flash高保真酶進行PCR擴增。所得PCR產物回收純化后,按說明書將目的片段連接到TOPO-Blunt Cloning Kit載體上,轉化Trans1-T1感受態細胞,接種氨芐抗性LB平板并過夜培養,挑取單菌落送往北京諾賽基因組研究公司測序。
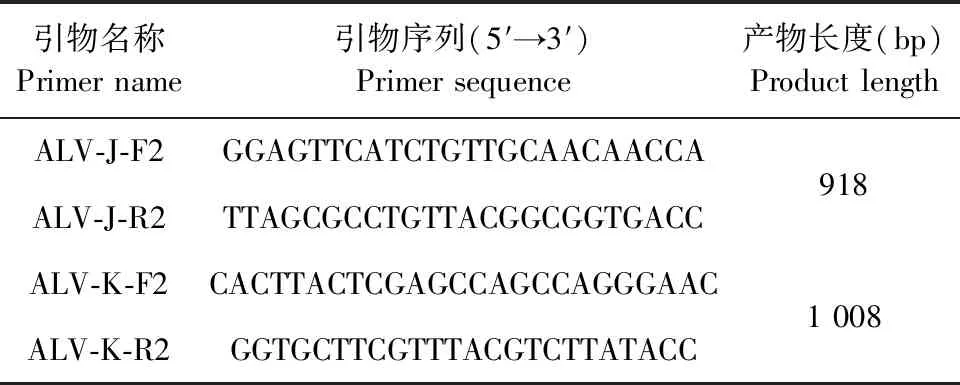
表2 ALV gp85基因PCR擴增引物信息
1.7gp85基因序列和遺傳演化分析 通過將分離毒株與NCBI數據庫中已有的 ALV毒株的gp85基因進行 BLAST比對,選取與分離毒株同源性較近的ALV各亞群參考毒株(表3)。用DNASTAR Lasergene軟件中MegAlign程序的Clustal W方法,對7株ALV分離毒株和ALV各亞群參考毒株的gp85基因核苷酸進行多序列比對,分析同源性,并利用DNASTAR Lasergene內的EditSeq程序將基因序列翻譯為氨基酸,進行同源性分析。使用DNASTAR Lasergene軟件中Protean程序的Jameson-wolf方法,預測ALV分離株gp85蛋白B細胞抗原表位,分析分離毒株gp85蛋白氨基酸突變對B細胞抗原表位的影響。使用MEGA 11軟件中的鄰接法(Neighbor-joining method)對ALV分離毒株gp85基因序列和ALV各亞群參考毒株進行遺傳進化樹分析,Bootstrap值設置為1 000。
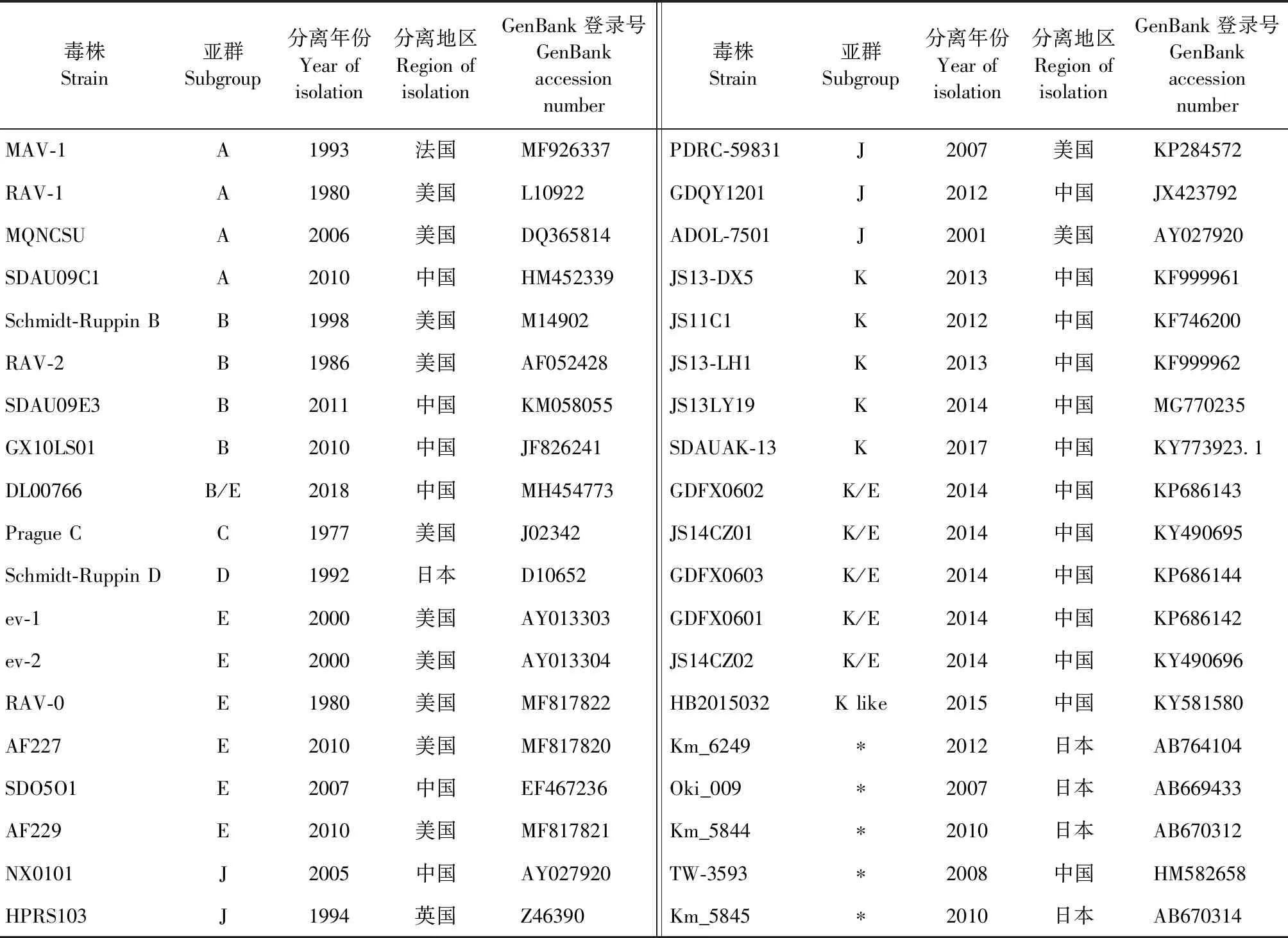
表3 ALV各亞群參考毒株信息
1.8 間接免疫熒光鑒定ALV分離毒株 從7株分離毒株中選取氨基酸變化差異較大的5株,將盲傳2代后收取的病毒液接種于48孔板培養的DF-1細胞,未進行接毒操作的細胞為陰性對照,放置于37 ℃、5%二氧化碳細胞培養箱培養7 d,進行間接免疫熒光鑒定。將培養好的細胞用PBS漂洗3次,4%多聚甲醛室溫下固定20 min,PBS漂洗3次,加入0.2%TritonX-100穿透細胞,冰上孵育20 min,預冷的PBS漂洗3次,1% BSA 37 ℃封閉1 h,預冷的PBS漂洗2次,使用ALV p27單克隆抗體 1∶100稀釋,4 ℃過夜孵育,PBST漂洗4次,加入1∶100稀釋的FITC標記山羊抗小鼠IgG抗體,37 ℃避光孵育1 h,于熒光倒置顯微鏡下觀察發光情況。
2 結果
2.1 病毒分離 ELISA檢測結果有7份樣品為陽性,陽性率為17.5%(7/40),空白對照檢測結果為陰性。結果表明,從40份蛋清p27抗原陽性雞的無菌抗凝血樣本中分離獲得7株外源性ALV毒株。
2.2 病毒DNA提取和亞群鑒定 結果顯示,7株分離毒株中有3株用ALV-J-F/R引物能擴增出特異性條帶,其余4株用ALV-K-F/R引物能擴增出特異性條帶,與預期條帶大小基本相符,陰性對照無特異性條帶(圖1)。結果表明,7株ALV分離毒株中3株屬于ALV-J毒株,分別命名為CAU4932、CAU4860和CAU2259;4株屬于ALV-K毒株,分別命名為CAU5006、CAU7168、CAU7049和CAU7176。
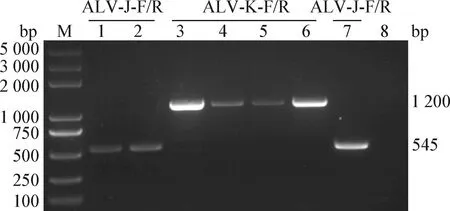
圖1 7株ALV分離毒株的亞群鑒定
2.3 病毒gp85基因PCR擴增和測序 PCR擴增結果顯示,7株分離毒株均在約1 000 bp位置擴增出特異性條帶,符合gp85基因片段長度,陰性對照無擴增條帶(圖2)。測序結果顯示,ALV-J分離株CAU4932、CAU4860和CAU2259的gp85基因片段長度為918 bp,編碼306個氨基酸;ALV-K分離株CAU7049、CAU5006、CAU7176和CAU7168的gp85基因片段長度為1 008 bp,編碼336個氨基酸。
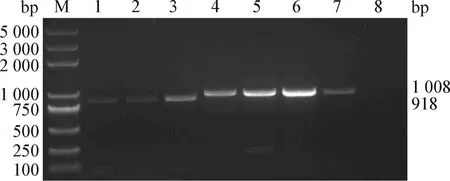
圖2 7株ALV分離毒株gp85基因的PCR擴增
2.4gp85基因序列和遺傳演化分析 分離毒株gp85基因核苷酸序列同源性比對結果顯示,同一亞群分離毒株間gp85基因核苷酸同源性較高,其中ALV-J分離毒株CAU4932、CAU4860和CAU2259的gp85基因核苷酸同源性為90.5%~95.2%,ALV-K分離毒株CAU5006、CAU7049、CAU7168和CAU7176的gp85基因核苷酸同源性為89.4%~92.3%。ALV-J分離毒株與ALV-J參考毒株HPRS103的gp85基因核苷酸同源性平均為83.2%(83.2%~83.3%);ALV-K分離毒株與ALV-K參考毒株JS11C1gp85基因核苷酸同源性平均為84.2%(84.0%~84.3%);其中ALV-J分離毒株中CAU2259與參考毒株SD13QJ01的gp85基因核苷酸序列同源性最高,為90.7%(圖3)。
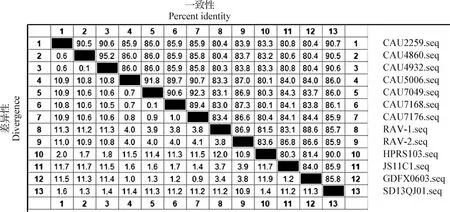
圖3 gp85基因核苷酸序列同源性比對
分離毒株gp85蛋白氨基酸序列同源性比對結果顯示,同一亞群分離毒株間gp85基因編碼氨基酸同源性很高,其中ALV-J分離毒株CAU4932、CAU4860和CAU2259的gp85蛋白氨基酸同源性為95.1%~99.3%,ALV-K分離毒株CAU5006、CAU7049、CAU7168和CAU7176的gp85蛋白氨基酸同源性為94.0%~99.7%;ALV-J分離毒株與ALV-J參考毒株HPRS103的gp85蛋白氨基酸同源性平均為86.7%(85.3%~87.6%),ALV-K分離毒株與ALV-K參考毒株JS11C1的gp85蛋白氨基酸同源性平均為93.9%(93.1%~94.6%);ALV-J、ALV-K分離毒株gp85蛋白氨基酸序列與ALV-A、ALV-B參考毒株同源性較低,3株ALV-J分離毒株與ALV-A參考毒株氨基酸同源性平均僅為39.8%(39.5%~40.3%),與ALV-B參考毒株氨基酸同源性平均僅為40.5%(40.3%~40.8%);4株ALV-K分離毒株與ALV-A參考毒株gp85蛋白氨基酸同源性平均為81.5%(81.1%~82.0%),與ALV-B參考毒株gp85蛋白氨基酸同源性平均為77.1%(75.7%~77.8%)(圖4)。

圖4 gp85蛋白氨基酸序列同源性比對
通過對氨基酸序列進行對比分析,ALV-J分離毒株CAU2259與英國分離參考毒株 HPRS103分別有45個氨基酸突變、3個氨基酸缺失和1個氨基酸增加;ALV-J分離毒株CAU4860與HPRS103株分別有38個氨基酸突變和2個氨基酸缺失;ALV-J分離毒株CAU4932與HPRS103株分別有39個氨基酸突變和2個氨基酸缺失,這3株ALV-J分離毒株突變率分別為16.0%、13.1%和13.4%。ALV-J分離毒株CAU2259、CAU4860和CAU4932在高變區(hr1和hr2)分別有22、19和19個氨基酸突變。3株ALV-J分離毒株之間有16個氨基酸突變和2個氨基酸缺失,在hr1和hr2有7個氨基酸變異。結果表明,gp85蛋白的氨基酸變異在整個序列均有發生,但在hr1和hr2相對變異較多(圖5)。
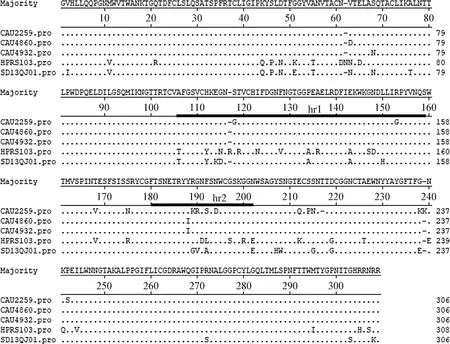
圖5 ALV-J分離毒株gp85蛋白氨基酸可變區序列比對分析
預測ALV-J分離毒株gp85蛋白B細胞抗原表位,結果顯示,3株ALV-J分離毒株均缺失了第117位氨基酸,CAU2259毒株第189、238、239位突變成賴氨酸,第190位突變成精氨酸,第192位突變成絲氨酸,第194、215位突變成天冬氨酸,第212位突變成谷氨酰胺,第214位突變成脯氨酸,第216位氨基酸缺失,以上氨基酸變化均發生在預測的gp85蛋白B細胞優勢抗原表位中(圖6),可能導致gp85蛋白抗原性發生變化。

圖6 ALV-J分離毒株gp85蛋白B細胞抗原表位預測
ALV-K分離毒株CAU5006與GDFX0603氨基酸同源性最高,為96.1%;ALV-K分離毒株CAU7176與中國分離參考毒株 JS11C1分別有22個氨基酸突變和1個氨基酸增加;ALV-K分離毒株CAU5006和CAU7049與JS11C1株分別有19個氨基酸突變和1個氨基酸增加,ALV-K分離毒株CAU7168與JS11C1株分別有18個氨基酸突變和1個氨基酸增加,這4株ALV-K分離毒株突變率分別為6.8%、6.0%、6.0%和5.7%,突變幅度差異不大。ALV-K分離毒株CAU7176、CAU5006、CAU7049和CAU7168在hr1和hr2分別有5、5、6和6個氨基酸突變;4株ALV-K分離毒株之間有24個氨基酸突變,在hr1和hr2有8個氨基酸變異(圖7)。

圖7 ALV-K分離毒株 gp85蛋白氨基酸可變區序列比對分析
預測ALV-K分離毒株gp85蛋白B細胞抗原表位,結果顯示,4株ALV-K分離毒株中CAU5006和CAU7176第139位氨基酸突變為蘇氨酸,CAU7049和CAU7168毒株第139位突變為精氨酸,CAU7176毒株第171位氨基酸,CAU5006、CAU7049和CAU7168毒株第176位氨基酸突變成天冬氨酸,CAU5006、CAU7049和CAU7168毒株第195位氨基酸突變為精氨酸,CAU7176毒株第197位突變為絲氨酸、第199位突變為苯丙氨酸,CAU5006、CAU7049和CAU7168毒株第200位突變為苯丙氨酸,4株ALV-K分離毒株在第216位均突變成精氨酸,CAU7176毒株第271位突變為甘氨酸,以上氨基酸變化均發生在預測的gp85 B細胞優勢抗原表位中(圖8),可能導致gp85蛋白抗原性發生變化。
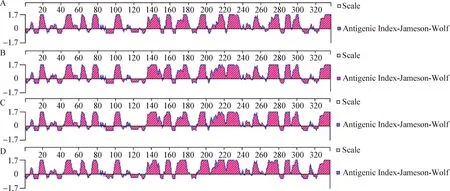
圖8 ALV-K分離毒株gp85蛋白 B細胞抗原表位預測
分離毒株gp85基因核苷酸序列遺傳進化樹如圖9所示,3株ALV-J分離毒株CAU4932、CAU4860和CAU2259與ALV-J各參考毒株在同一進化分支上,屬于ALV-J毒株;4株分離毒株CAU7049、CAU5006、CAU7176和CAU7168與ALV-K各參考毒株在同一進化分支上,屬于ALV-K毒株;3株ALV-J分離毒株間親緣關系很近,且與2001年美國分離毒株ADOL-7501親緣關系較近,屬于同一遺傳進化分支,而與ALV-J代表毒株HPRS103親緣關系相對較遠;4株ALV-K分離株與日本分離毒株Oki_009以及JS13-DX5、JS13-LH1和SDAUAK-13等國內分離的ALV-K毒株親緣關系較近。
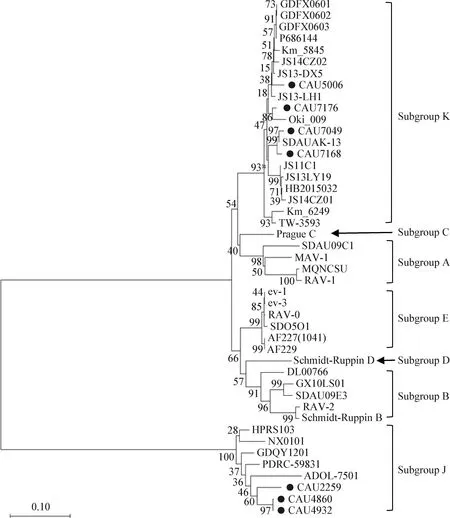
圖9 7株ALV分離毒株與參考毒株基于gp85基因核苷酸序列的遺傳進化樹
2.5 間接免疫熒光鑒定ALV分離毒株 使用ALV p27單克隆抗體進行間接免疫熒光鑒定,結果如圖10所示,5株分離毒株CAU7176、CAU5006、CAU4860、CAU2259和CAU7049在熒光顯微鏡下均可看到綠色熒光,陰性對照未見特異性綠色熒光。結果表明,該5株分離毒株可在DF-1細胞內復制并存在可被抗體識別的p27抗原表位。
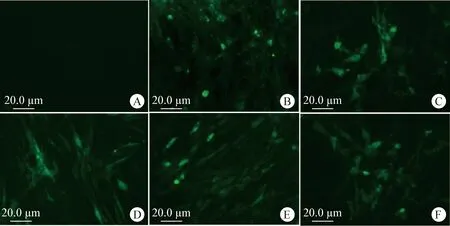
圖10 ALV分離毒株間接免疫熒光鑒定(200×)
3 討論
自從1868年雞的淋巴肉瘤癥狀首次被報道以來,禽白血病作為一種免疫抑制性疾病在世界各地流行傳播,給養禽業造成巨大經濟損失[18]。近十年來,我國大型種雞場高度重視禽白血病凈化并取得顯著成效,許多規模化雞場已達到規定的凈化標準[19]。但由于ALV高變異率和垂直傳播等特征,其仍在一些雞場流行,并不斷出現新毒株[20]。ALV-J毒株于1992年首次在英國被發現并報道,而后迅速傳播,導致家禽惡性腫瘤伴有骨髓性白血病,該亞群的高致病性使其相比ALV其他亞群更加普遍[21]。近年來,我國分離到的ALV新型K亞群毒株的復制能力和致病性較弱,但易與其他ALV亞群病毒混合感染,為ALV防控凈化增加難度[13]。ALV的糖基化包膜蛋白由env基因編碼,其中負責與宿主細胞受體結合的gp85蛋白具有高變異性[22]。
本試驗從國內某雞場無菌抗凝血樣本分離獲得7株ALV毒株,進行gp85基因片段克隆和測序,其中3株為ALV-J毒株,gp85基因片段長度均為918 bp,4株為ALV-K毒株,gp85基因片段長度均為1 008 bp。其中CAU5006毒株與國內分離株GDFX0603氨基酸同源性最高,為96.1%,遺傳進化樹屬同一分支,表明該雞場流行的ALV-K毒株可能與GDFX0603是同一祖先。
本試驗中分離獲得的ALV-K毒株與JS11C1毒株gp85蛋白氨基酸突變率為5.7%~6.8%;遺傳進化樹顯示,ALV-K分離毒株gp85基因序列與日本參考毒株Oki_009以及JS13-DX5、JS13-LH1和SDAUAK-13等國內分離毒株親緣關系較近,屬于同一分支,表明ALV-K毒株可能已在國內和日本的雞群中傳播并存在了較長時間,且與廣西和山東的ALV-K毒株發生過基因重組。此外,雞群存在ALV-J和ALV-K共感染現象,感染ALV多種亞群的病雞臨床癥狀更為明顯[23]。
本試驗中分離獲得ALV-J毒株與英國原型株HPRS103gp85基因片段核苷酸同源性為83.2%,氨基酸的變異在整個序列均有發生,但高變區hr1和hr2相對變異較多,其中某些氨基酸位點的變化可能導致蛋白疏水性改變,進而導致gp85蛋白抗原表位發生變化,該結果證實了gp85 基因片段具有很強的變異性,同時也證實了ALV-J毒株感染雞群的范圍正在逐步擴大。將ALV分離毒株gp85蛋白氨基酸序列與預測的gp85蛋白B細胞抗原表位對比發現,ALV分離毒株gp85蛋白部分氨基酸突變發生在預測的B細胞抗原表位上,這可能使gp85蛋白抗原性發生變化,增加ALV分群鑒定難度。
綜上所述,本試驗分離獲得7株ALV毒株,對其gp85基因進行克隆、測序和遺傳進化樹分析,豐富了ALV基因組庫資源,同時也為ALV演化特征提供了一定參考,但分離毒株gp85蛋白變異的具體流行規律和趨勢有待未來進一步研究。我國地方品系雞群背景復雜,加之ALV具有隱性感染、混合感染和易突變的特性,目前我國尚不能達到ALV的全面凈化,未來應進一步深入研究ALV致病特征、流行規律和遺傳進化演變等,通過健全完善嚴格的凈化體系,加速種雞群ALV凈化,減少禽白血病給我國養禽業造成的經濟損失。

