馬里苷靶向p38α增強卵巢癌細胞對DNA損傷藥物敏感度的研究
曹玉敏 郭凡凡 王 芳 張 熠 陳友國
卵巢癌是第三大常見的婦科腫瘤,致死率很高[1]。其標準化療方案以鉑為基礎,鉑類等DNA損傷藥物與DNA結合,形成單加合物來發揮細胞毒性作用[2,3]。盡管卵巢癌對鉑類化療的初始反應高達80%,但在大多數患者中,獲得性耐藥最終會導致復發和死亡。卵巢癌對化療抵抗的機制相當復雜,DNA損傷修復是其中之一[2]。
同源重組修復(homologous recombination repair, HRR)是一種精確的修復DNA雙鏈斷裂(double strand breaks, DSB)的途徑[4]。CtIP負責DNA切除,RAD51被招募到DSB位點,允許DNA入侵同源雙螺旋[5]。已有文獻報道CtIP為p38α底物,因此,p38α的降低能導致HRR受損,同時復制應激、DNA損傷和染色體不穩定增加,導致癌細胞死亡[6]。
馬里苷是金雞菊中提取的黃酮類活性成分[7]。近年來,關于馬里苷在抗氧化,調節糖脂答謝方面的作用多有報道,然而鮮有其在抗癌方面的相關研究[8~11]。為了探究馬里苷在抗腫瘤方面的潛在作用,筆者對于通過計算機模擬預測了馬里苷可能的結合靶點,對于馬里苷能否通過靶向p38α抑制HRR,從而對DNA損傷藥物有增敏作用作出如下研究。
材料與方法
1.細胞株及主要試劑、儀器:人卵巢癌細胞株 SKOV3、A2780均購自美國ATCC公司。RPMI1640、DMEM、胎牛血清(FBS)磷酸鹽緩沖溶液(PBS)均購自美國Gibco公司。雙抗(青霉素+鏈霉素)、0.25%胰酶消化液均購自上海碧云天生物技術股份有限公司。馬里苷、卡鉑、喜樹堿均購自中國中楚致遠科技有限公司。2-(2-甲氧基 -4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑單鈉鹽(CCK-8)購自中國科尤博生物科技公司。二甲基亞砜(DMSO)購自美國Sigma公司。Comet Assay試劑盒購自美國R&D Systems公司。p-p38α抗體、GAPDH抗體、γ-H2AX 抗體、RAD51抗體均購自美國CST公司。p38α抗體購自英國Abcam公司。CtIP抗體購自美國SANTA公司。鼠源、兔源二抗購自中國翊圣生物科技公司。pCBASceI質粒、pDRGFP均購自美國Addgene公司。酶標儀Labserv K3型購自美國Thermo Fisher公司。Western blot法檢測所需儀器購自美國Bio-Rad公司,流式細胞儀購自美國BD公司。共聚焦顯微鏡購自德國蔡司公司。
2.實驗方法:(1)細胞培養:人卵巢癌細胞株SKOV3,A2780分別培養于含有10%胎牛血清、100U/ml雙抗(青霉素+鏈霉素)的RPMI1640和DMEM高糖培養基中;置于37℃、5% CO2溫育箱中。(2)CCK-8實驗:取對數生長期的SKOV3或A2780細胞,以5000個/(100微升·孔)接種于96孔板,待細胞貼壁后,分別設立單用卡鉑、喜樹堿組和卡鉑/馬里苷、喜樹堿/馬里苷聯用組,作用72h后,吸出上清,每孔加入90μl培養基和10μl CCK-8試劑,培養1h后在全自動酶標儀上450nm波長下測量樣品吸光度(A)值。(3)克隆集落形成實驗:取生長狀態良好的細胞,分別設立單用卡鉑、喜樹堿、馬里苷組和卡鉑/馬里苷、喜樹堿/馬里苷聯用組,預處理48h后以每孔1000個細胞接種于6孔板中,培養10天。棄去培養基,PBS洗滌兩遍,加入預冷的4%多聚甲醛固定細胞30min,棄去多聚甲醛,用PBS洗滌兩遍;加入結晶紫室溫靜置30min,使用PBS洗滌兩遍,晾干,拍照。(4)Western blot法檢測:提取細胞總蛋白。設立空白對照組、單用甲磺酸甲酯、喜樹堿組和甲磺酸甲酯/馬里苷、喜樹堿/馬里苷聯用組,經SDSPAGE轉至PVDF膜,5%脫脂奶粉室溫封閉2h,加入一抗4℃孵育過夜,TBST漂洗3次,加入二抗孵育2h,TBST漂洗3次。美國LICOR公司Odyssey雙色紅外激光成像系統顯影。(5)免疫熒光實驗:將細胞以每孔5000個接種于24孔板,貼壁后,設立空白對照組、單用喜樹堿組和喜樹堿/馬里苷聯用組,收板時,PBS洗滌3遍,用4%多聚甲醛固定細胞30min,PBS洗滌3遍,0.1% Triton打孔30min,5%BSA封閉2h后,一抗4℃孵育過夜。次日,PBS洗滌3遍,孵育二抗室溫2h,PBS洗滌3遍,DAPI染色,PBS洗滌3 遍,封片,4℃保存,使用共聚焦顯微鏡拍攝。(6)彗星實驗:設立空白對照組、單用甲磺酸甲酯、馬里苷組和甲磺酸甲酯/馬里苷聯用組,以1×105/ml懸浮于PBS中,以1∶10的比例與瓊脂糖混勻后,取細胞懸液50μl滴于玻片上,隨后進行固化、裂解、解旋、電泳,取出玻片滴加染色液,共聚焦顯微鏡下觀察,測量拖尾長度。(7)HRR報告基因實驗:設立對照組和馬里苷組,使用pDRGFP和pCBASceI質粒共同轉染48h后,用流式細胞儀確定轉染細胞中GFP陽性細胞的百分比。(8)類器官藥敏實驗:類器官接種。待生長良好后,設立單用卡鉑組和卡鉑/馬里苷聯用組培養4天。加入30μl發光試劑室溫振蕩2min,孵育8min。使用多功能酶標儀進行化學發光檢測。(9)細胞熱轉移實驗:提取蛋白。將上清蛋白等分為2管,分別加入等體積的DMSO和馬里苷,孵育2h。將每組蛋白平分至離心管中,分別加熱至41、46、51、56、61、66℃,加熱樣品3min,室溫冷卻3min,置于冰上。蛋白變性,后續用Western blot法檢測。(10)藥物親和反應的靶點穩定性技術:提蛋白上清,按比例加入10×TNC緩沖液于蛋白上清液中。將上清均分加入等體積的DMSO和馬里苷,孵育1h。用TNC緩沖液將蛋白酶稀釋成適當濃度,再依次稀釋成不同比例的鏈酶儲存液,根據蛋白酶與裂解液中總蛋白的比例加入蛋白酶,室溫孵育30min,加蛋白上樣緩沖液終止反應。煮沸,-20℃儲藏備用,用于后續Western blot法檢測。
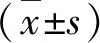
結 果
1.馬里苷增強卵巢癌細胞對DNA損傷藥物的敏感度:使用SKOV3和A2780進行試驗,分別給予卡鉑和喜樹堿這兩種已知的能夠引起DNA損傷的藥物進行處理,并聯合使用馬里苷觀察療效。CCK-8實驗表明,加入馬里苷能夠增強細胞對卡鉑與喜樹堿的敏感度(圖1中A~D)。克隆集落形成實驗也證實了聯合使用馬里苷,能進一步降低癌細胞的增殖能力(圖1中E和F)。

圖1 馬里苷增強卵巢癌細胞對DNA雙鏈損傷藥物的敏感度
2.馬里苷增加卵巢癌細胞的DNA雙鏈損傷:已知甲磺酸甲酯(methyl methanesulfonate,MMS)是一種經典的能引起DSB的藥物,接下來使用MMS和喜樹堿來對細胞分別進行誘導,Western blot法檢測實驗結果表明,馬里苷能使DNA損傷標志物γH2AX增加(圖2中A~C)。彗星實驗也表明,使用馬里苷能夠增加細胞的拖尾(圖2中D、E)。以上結果共同證明了馬里苷能增加細胞的DNA損傷。

圖2 馬里苷增加卵巢癌細胞的DNA雙鏈損傷
3.馬里苷通過抑制p38α來抑制同源重組修復:已有文獻報道,p38α能通過磷酸化DNA末端切除因子CtIP來促進DNA損傷修復[6]。為了進一步研究馬里苷的作用機制,采用MMS和喜樹堿分別誘導細胞產生DSB,并探究馬里苷能否進一步抑制細胞進行HRR。Western blot法檢測實驗發現,馬里苷能夠抑制p38α的磷酸化功能,降低CtIP的表達。已知Rad51是HRR途徑中的一個關鍵蛋白,Western blot法檢測顯示,馬里苷能夠降低Rad51的水平(圖中3A~D)。免疫熒光實驗也驗證了馬里苷能夠增加γH2AX的表達,降低Rad51的表達(圖3中E~H)。接下來采用HRR基因報告,實驗結果表明,馬里苷能抑制HRR(圖3中I、J)。綜上所述,馬里苷能夠靶向p38α抑制腫瘤細胞的HR能力。

圖3 馬里苷通過抑制p38α來抑制同源重組修復
4.馬里苷能增強卵巢癌類器官對卡鉑的敏感度:為了進一步探究馬里苷能否增強對DNA損傷藥物的敏感度,筆者選取了鉑耐藥的類器官進行實驗。類器官實驗結果表明,馬里苷能夠增強卵巢癌類器官對卡鉑治療的敏感度,聯合使用馬里苷后,類器官發生破裂(圖4)。

圖4 馬里苷能增強卵巢癌類器官對卡鉑的敏感度
5.馬里苷通過與p38α結合發揮功能:為了探究馬里苷是否通過與p38α相結合發揮作用。采用計算機模擬將馬里苷與p38α進行分子對接,發現馬里苷與p38α以LYS-53和MET-109相結合(圖5中A、B)。接下來進行了細胞熱轉移實驗,實驗結果表明,馬里苷能與p38α相結合(圖5中C、D)。此外,藥物親和反應的靶點穩定性技術的實驗結果再次驗證了此觀點(圖5中E、F)。

圖5 馬里苷通過與p38α結合發揮功能
討 論
卵巢癌的標準的一線治療是手術治療和以鉑為基礎的化療。然而在這樣的治療之下仍有80%的患者復發和死亡。鉑耐藥的出現可能是由于細胞內藥物積累減少、DNA修復增加或凋亡信號通路受損。因此使用馬里苷組合策略靶向DNA修復途徑從而克服DNA損傷藥物的耐藥是我們想要探究的問題[12,13]。
DSB對基因組完整性和細胞存活構成嚴重威脅[14,15]。HRR是一種精準的應對DSB的修復方式[16,17]。HRR在許多腫瘤的發生和進展中至關重要,DNA末端切除因子CtIP和Rad51重組酶是HRR途徑的關鍵效應器,是鉑耐藥性的決定因素[18~20]。因此需探究馬里苷能否抑制HRR途徑阻礙卵巢癌的發生和發展。
由于p38α在維持基因組穩定性和使癌細胞存活方面的重要作用, p38α可以直接磷酸化DNA修復調節劑,如CtIP[21~24]。既往研究報道,鉑類藥物和p38α抑制劑的組合會大大降低腫瘤生長[25]。這表明鉑類藥物的抗腫瘤作用可能受到p38α信號的調節。
通過計算機模擬預測到p38α是馬里苷的潛在靶點,對于馬里苷能否靶向p38α,抑制卵巢癌細胞進行HRR,從而能夠對鉑類,喜樹堿等DNA損傷藥物有增敏的作用。通過實驗發現馬里苷能夠增加對鉑類,喜樹堿等DNA損傷藥物的增敏作用,抑制卵巢癌細胞的增殖能力,其作用機制是通過抑制p38α的磷酸化,增加卵巢癌細胞的DNA損傷,使γH2AX增加,彗星拖尾增加。同時抑制HRR途徑中關鍵蛋白CtIP和Rad51的表達,抑制卵巢癌細胞的修復效率。接下來通過計算機模擬的方法加以一系列結合實驗驗證了馬里苷與p38α的結合,此外馬里苷還能夠增加卵巢癌類器官對卡鉑的敏感度。說明馬里苷能夠靶向p38α,抑制HRR。因此,馬里苷聯合DNA損傷藥物治療卵巢癌有助于避免獲得性耐藥的發生。接下來會繼續收集各種癌癥患者組織,構建類器官模型,以此來評估馬里苷作為新型HRR抑制劑的可能性和重要性,這項研究將幫助我們發現一個作為新型HRR抑制劑的天然單體化合物,為馬里苷的藥理學研究提供新的思路,為卵巢癌臨床治療新策略提供理論基礎和實驗依據。
利益沖突聲明:所有作者均聲明不存在利益沖突。

