小麥新種質“普冰3228”穗下節長度QTL定位與候選基因分析
王健勝,王二偉,馬愛鋤,程世平
(1. 平頂山學院,河南 平頂山 467000;2. 河南省生態經濟型木本植物種質創新與利用重點實驗室, 河南 平頂山 467000;3. 平頂山市農業科學院,河南 平頂山 467001)
【研究意義】莖稈是小麥植株形態的主要組成部分,也是小麥育種實踐中重點考察的指標。小麥莖稈具有多種重要功能,包括水分及營養物質的輸導和貯藏,對穗部的支撐,同時也具有一定的光合作用[1-2]。莖稈最突出的功能是其與小麥的倒伏性密切相關。育種實踐表明,抗倒伏是決定小麥最終產量的關鍵因素,倒伏性差可能導致小麥減產甚至絕產。小麥莖稈是由多個莖節組成,其中處于小麥穗部下的第一個節(穗下節)的作用尤為突出[1],目前穗下節已作為小麥種質篩選及新品種培育的重要指標,因此,開展小麥穗下節遺傳機制分析對其遺傳改良具有重要意義。【前人研究進展】目前,國內外有關小麥穗下節的相關研究非常有限,只有少數學者針對小麥穗下節進行了初步探索。項超等[1]利用91份小麥材料研究了穗下節性狀與灌漿速率及產量相關因素的關系,結果發現,穗下節長度、粗度、體積與千粒重均呈正相關線性回歸顯著關系,穗下節長度最長類型灌漿特性綜合表現最好,穗下節粗度與中等類型灌漿特性無明顯差異,穗下節長度最長類型具有較高千粒重,因此,該研究認為,在西南地區選擇穗下節最長、粗細中等的材料有助于選育灌漿特性、產量表現優異的小麥新品種。王瑞清等[2]探討了穗下節對小麥粒重的影響,研究發現,在對14個小麥品種穗下節遮光后,小麥千粒重均下降,下降幅度為4.88%~23.92%,表明穗下節不僅有支持和輸導作用,也是重要的光合器官,對小麥千粒重提高具有重要影響。Liu等[3]以5個重組自交系群體為材料,在構建其高密度分子遺傳連鎖圖譜的基礎上,利用該圖譜對小麥穗下節直徑及其相關性狀進行QTL定位分析,結果在1A、1D、2B、2D、3B、3D、4A、4B、4D、5A、5B、6B和7D染色體上共發現25個相關QTL,其中主效且穩定的QTL有5個,QUid.sau-2CN-1D.1、QUid.sau-2SY-1D和QUid.sau-SC-3D是首次發現的穗下節直徑QTL;同時,研究開發了與部分穗下節QTL連鎖的KASP標記,這些標記可以有效用于目標QTL近等基因系的構建;另外,基于發現的主效且穩定的QTL,研究預測分析了穗下節直徑候選基因。Yu等[4]利用2個重組自交系群體開展小麥穗下節長度QTL定位并對其在小麥株高方面的效應做分析,共檢測到穗下節長度相關QTL 18個,該QTL主要位于1B、1D、2A、2B、3A、3B、4A、4D、5A、5B、6B、6D和7B染色體上,其表型解釋變異率為2.50%~20.10%,該QTL中4個來自親本‘Opata85’,而其余14個均來自人工合成小麥‘W7984’。Sang等[5]利用2個中國小麥優異品種構建的雙單倍體對小麥穗下節的總維管束、大維管束、小維管束及大維管束/小維管束進行QTL分析,檢測到11個加性QTL和1對上位性QTL。【本研究切入點】雖然前人針對小麥穗下節開展了部分研究,但主要圍繞穗下節直徑、穗下節維管束等相關性狀展開,而專門針對小麥穗下節長度的研究極少,目前小麥穗下節長度遺傳機制仍不清楚。本研究材料“普冰3228”是普通小麥與冰草通過遠緣雜交獲得的遺傳穩定新種質[6-8],除具有突出的高產、抗病等優異性狀外,其穗下節長度表現也很突出,而有關該種質穗下節長度的研究鮮有報道。【擬解決的關鍵問題】本研究將以“普冰3228”與“京4839”構建的重組自交系群體為材料,對“普冰3228”穗下節長度進行QTL定位及候選基因分析,以期為小麥穗下節遺傳機制解析及“普冰3228”在育種實踐中的有效利用提供一定依據。
1 材料與方法
1.1 研究材料
本研究材料是小麥新種質“普冰3228”與“京4839”雜交產生的重組自交系群體(RIL),該群體通過單籽粒法構建,包括210個株系,均由中國農業科學院作物科學研究所李立會課題組提供。
1.2 小麥田間種植及其穗下節長度測定
在2019—2020年和2020—2021年將“普冰3228”ד京4839”RIL群體分株系在河南平頂山和陜西楊凌2種環境下種植,株系間采用隨機區組設計,每個株系種植4行,3個重復。種植行長保持2 m,行距20 cm,株距6.7 cm,單籽粒點播。試驗地周圍均種植保護行,按照普通產田水平進行田間統一管理。待小麥成熟后,在每個株系中隨機選擇5~6株,利用直尺對小麥穗下節長度進行測定,最后取其平均值作為該株系穗下節長度。
1.3 基因型檢測
采用SDS法提取基因組DNA[9],取親本和RIL群體幼苗葉片提取DNA,提取的DNA保存至TE中,并用瓊脂糖凝膠電泳法檢測其純度。然后將遺傳群體檢測質量合格的樣品DNA送往北京博奧京典生物技術有限公司,由該公司基于Illumina SNP Genotyping技術測試平臺使用微珠芯片技術檢測,其多態性使用Genomestudio v1.0軟件分析,最終獲得研究遺傳群體的有效基因型。
1.4 遺傳圖譜構建及QTL定位
基于遺傳定位群體的SNP基因型,利用QTL IciMapping 4.0 軟件構建分子標記遺傳連鎖圖譜,利用Mapmarker3.0軟件繪制遺傳連鎖圖譜。結合穗下節長度表型性狀,利用IciMapping 4.0軟件(http://www.isbreeding.net/)中的完備區間作圖法(ICIM-ADD)對穗下節長度進行QTL檢測[10-11],設置參數為步移距離1 cM,PIN 0.001,LOD閾值為2.5,并計算每個QTL的加性效應。QTL按照通用規則命名,具體為QTL+性狀英文縮寫+染色體+環境。
1.5 候選基因分析
以與穗下節長度性狀緊密連鎖SNP 標記序列為探針,以QTL定位置信區間作為候選基因的預測區間,在小麥基因組數據庫(http://wheatomics.sdau.edu.cn/)上獲得穗下節長度初步候選基因,然后將初步候選基因在小麥基因表達數據庫(http://www.wheat-expression.com)中進行表達分析,獲得穗下節長度相關候選基因,并對部分候選基因進行功能注釋。
2 結果與分析
2.1 “普冰3228” × “京4839” RIL群體穗下節長度表型性狀分析
“普冰3228” × “京4839” RIL群體穗下節長度存在較豐富的遺傳差異(表1,圖1)。在2020年平頂山地區,定位群體穗下節長度分布于34.00~117.50 cm,平均77.63 cm,而在同一地區的2021年,群體穗下節分布于16.00~77.00 cm,平均52.28 cm,由此可知,不同年度遺傳群體在平頂山地區均具有較長的穗下節。2020年和2021年在平頂山地區變異系數分別為20.95%、16.01%,可見遺傳群體在同一環境下的不同年度均具有豐富的遺傳差異。在楊凌環境下,群體穗下節長度分布于19~53 cm,平均37.40 cm,由此可知,與平頂山環境相比,楊凌環境下遺傳群體穗下節相對較短,同時該環境下的變異系數也較小,只有15.88%,表明楊凌環境下遺傳群體的遺傳差異相對較小。對該群體在3個環境下穗下節綜合比較發現,編號為2、3、8、10、41、89、98、104和126株系穗下節表現均較好。研究也對該遺傳群體穗下節長度的遺傳力進行估算,發現該群體的遺傳力表現較好,為86.39%。此外,研究對“普冰3228” × “京4839” RIL群體在不同環境下穗下節長度進行相關性分析,由表2可知,不同環境間該群體穗下節長度均呈正相關,在平頂山環境下的2020年和2021年其穗下節呈極顯著正相關。從遺傳群體穗下節長度在不同環境及不同年際的分布(圖1)可以看出,其均表現為正態或近正態分布,說明該性狀是受多基因控制的數量性狀。
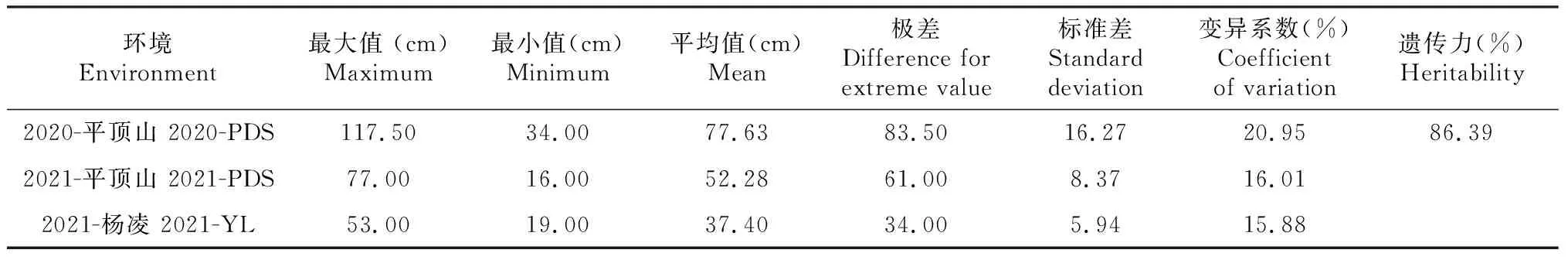
表1 “普冰3228” × “京4839” RIL群體穗下節長度差異及遺傳力分析Table 1 The difference and heritability analysis for uppermost-internode length in the RIL population of ‘Pubing3228’בJing4839’

表2 “普冰3228” × “京4839” RIL群體穗下節長度在不同環境下的相關系數Table 2 The correlation coefficient for uppermost-internode length of the ‘Pubing3228’בJing4839’ RIL population under the different environments
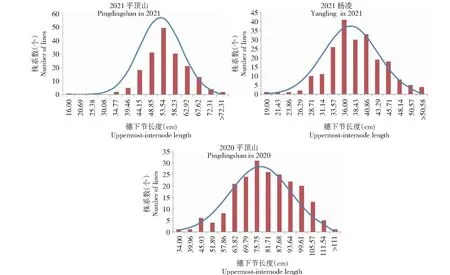
圖1 “普冰3228” × “京4839” RIL群體穗下節長度分布Fig.1 The distribution of the uppermost-internode length in the RIL population of ‘Pubing3228’בJing4839’
2.2 “普冰3228” × “京4839” RIL群體穗下節長度QTL定位
研究共檢測到小麥穗下節QTL 6個,該QTL主要分布于2B、4B、4D、5B和6D染色體上(表3,圖2)。這些QTL的LOD值介于2.55~7.88,解釋變異率分布于3.43%~15.84%。在發現的QTL中,定位于4B染色體上AX-109373490~AX-111540511區間和定位于4D染色體上AX-110984743~AX-109230716區間的2個QTL的表型解釋變異率均超過10%,說明其為穗下節的主效QTL。多環境下穩定QTL對小麥穗下節遺傳機制深入研究更為重要,本研究檢測到1個穗下節穩定QTL,其位于4D染色體上的AX-110984743~AX-109230716區間,該QTL在平頂山和楊凌環境下均被檢測到,同時從上述分析可知,該穩定QTL也是穗下節主效QTL,因此該QTL應作為穗下節重點基因位點在后期研究中予以關注。從QTL的加性效應來看,除4B、6D染色體上發現的2個QTL為負值外,其余QTL均為正值,表明絕大多數QTL均來自母本“普冰3228”。從不同環境下QTL檢測效果來看,本研究在楊凌和平頂山均分別發現了3個QTL。
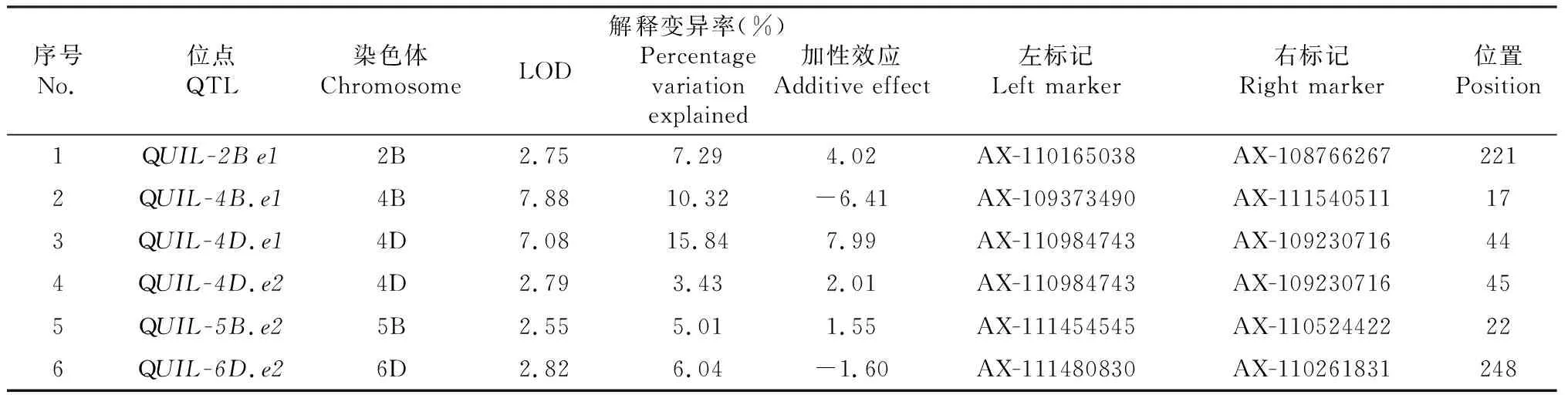
表3 “普冰3228” × “京4839” RIL群體穗下節長度QTL定位Table 3 QTL mapping for uppermost-internode length in the ‘Pubing3228’בJing4839’RIL population
2.3 小麥穗下節候選基因分析
基于上述穗下節長度QTL定位結果,在目標QTL定位遺傳區段內獲得穗下節初步候選基因674個。將這些候選基因分別在小麥根、莖、葉、籽粒等主要組織器官內進行模擬表達,篩選出只在小麥莖組織特異表達量大的基因作為穗下節長度候選基因,最終獲得穗下節長度候選基因15個(表4),這些基因分布在小麥4D染色體上9994582~36839260 bp區段內,其中與AX-110984743位點關聯的基因有9個,包括TraesCS4D01G014100、TraesCS4D01G019600、TraesCS4D01G035600、TraesCS4D01G026200、TraesCS4D01G039200、TraesCS4D01G040300、TraesCS4D01G041200、TraesCS4D01G044400、TraesCS4D01G045400,與AX-109230716位點關聯的基因有6個,分別是TraesCS4D01G040300、TraesCS4D01G041200、TraesCS4D01-G044400、TraesCS4D01G045400、TraesCS4D01G058000、TraesCS4D01G061100。
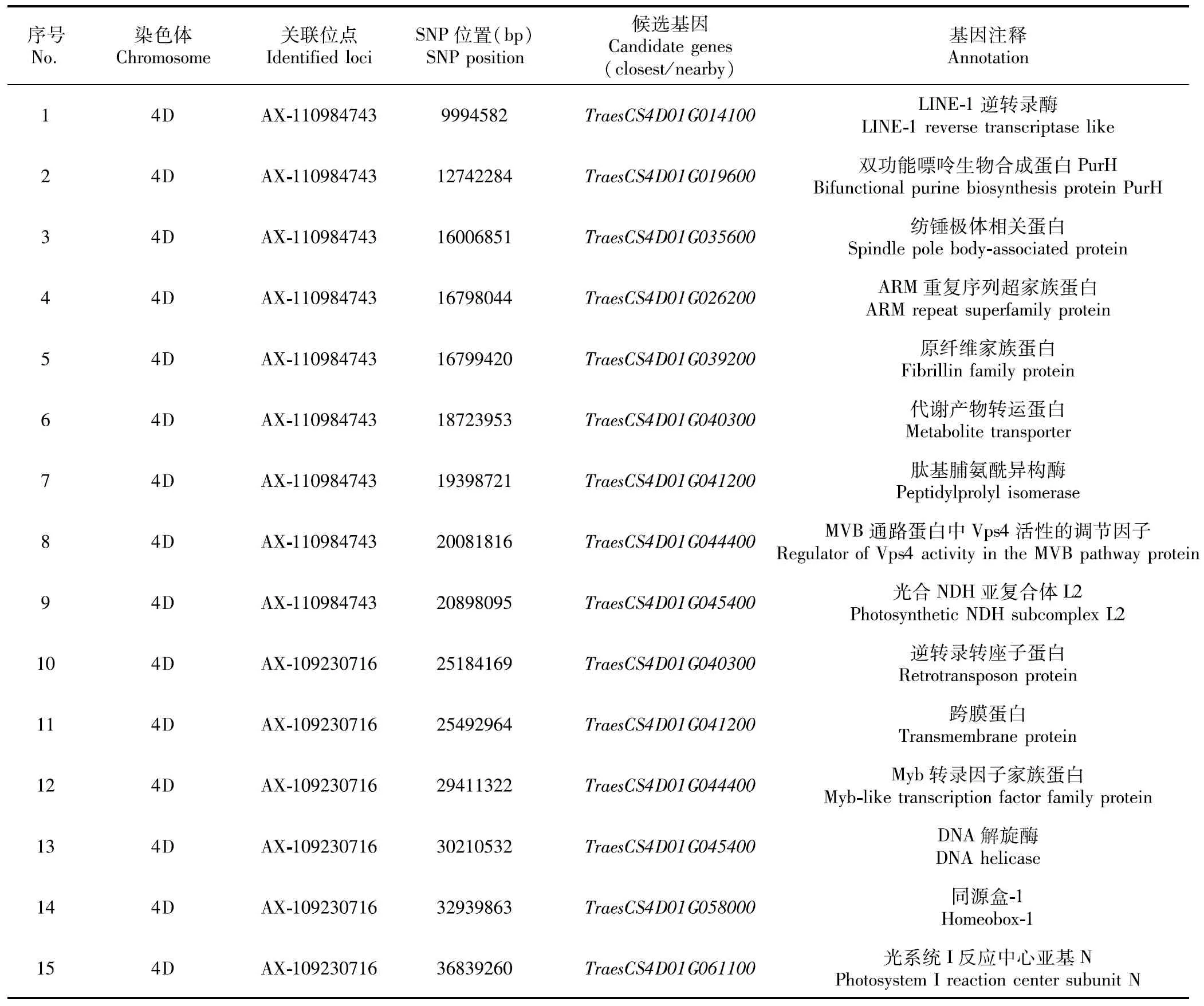
表4 本研究預測的小麥穗下節長度候選基因Table 4 The candidate genes and their information for wheat uppermost-internode length identified in the study
由表4可知,這些候選基因功能多樣,其中大部分候選基因編碼一些功能蛋白,例如,TraesCS4D01G019600可能編碼一種雙功能嘌呤生物合成蛋白,TraesCS4D01G035600可能編碼一種紡錘極體相關蛋白,TraesCS4D01G026200可能編碼一種ARM重復序列超家族蛋白,TraesCS4D01G040300可能編碼一種逆轉錄轉座子蛋白,TraesCS4D01G044400可能編碼一種Myb類轉錄因子家族蛋白。部分候選基因編碼一些功能酶,例如,TraesCS4D01G014100可能編碼一種逆轉錄酶,TraesCS4D01G045400可能編碼一種DNA解旋酶。也有部分候選基因編碼一些與光合作用相關的復合體或亞基,例如,TraesCS4D01G045400可能編碼光合NDH亞復合體L2,TraesCS4D01G061100可能編碼光系統I反應中心亞基N。個別候選基因編碼生物活性相關的調節因子,TraesCS4D01G044400可能編碼一種MVB通路蛋白中Vps4活性的調節因子。
3 討 論
與其它農藝性狀相比,目前有關小麥穗下節的研究極少,已有研究主要集中于穗下節的解剖及與產量的關系等方面[1-2, 12]。前人研究與育種實踐表明,穗下節長度對小麥株高、株型和產量等均有重要影響,一般來說,在株高相同的情況下,穗下節在合理范圍內相對較長,其株型和產量表現更好,因此在育種實踐中已將穗下節長度作為小麥新品種篩選的主要指標之一。本研究材料“普冰3228”是穗下節長度表現突出的小麥新種質,為探討該種質穗下節長度的遺傳機制并為其后期利用提供有效基礎,研究利用“普冰3228” 與 “京4839” 構建RIL群體,田間性狀調查發現,該群體穗下節長度表現突出,其遺傳差異也較豐富,在2020年平頂山環境下其穗下節長度分布于34.00~117.50 cm,平均達77.63 cm,Yu等[4]對Opata85×W7984和SHW-L1×Chuanmai32構建的2個重組自交系群體穗下節長度也進行了測定,發現其穗下節長度分布于27.23~50.00和24.14~59.06 cm,穗下節平均長度為40.80和42.67 cm。與Yu等[4]利用的2個遺傳群體相比,本研究定位群體穗下節長度表現更突出,這可能與本研究利用新種質材料“普冰3228”作為親本材料有關,該材料由普通小麥與冰草通過遠緣雜交獲得,很可能含有控制穗下節長度的外緣優異基因。
前人有關小麥穗下節長度QTL定位研究報道較少。為探討“普冰3228”穗下節長度的遺傳機制,本研究基于構建了“普冰3228” × “京4839” 重組自交系群體,利用55K SNP芯片構建高密度分子遺傳連鎖圖譜,結合多環境下穗下節長度表型數據對小麥穗下節長度進行QTL定位,結果在2B、4D、5B、6D染色體上檢測到控制穗下節長度QTL,Yu等[4]在2B、4D、5B染色體上也發現控制穗下節長度的QTL,表明2B、4D、5B染色體可能是小麥穗下節QTL存在的主要區域。本研究在4B染色體上發現控制穗下節的QTL,而Yu等[4]在該染色體并未發現目標性狀QTL,表明該QTL可能是控制穗下節長度新的QTL,進一步分析發現,該QTL的LOD值達7.88,表型解釋變異率為10.32%,說明其也是控制穗下節長度的主效QTL,應引起后期研究的重視。從現有文獻報道來看,目前只有本研究和Yu等[4]開展了有關穗下節長度的QTL分析。其他學者也針對小麥穗下節性狀開展了相關QTL研究,但該研究是針對穗下節莖稈直徑[3]和維管束組成[5]等其它性狀開展。
穗下節長度候選基因分析對穗下節遺傳機制深入解析及其基因資源挖掘十分重要,目前有關此方面的研究未見報道。本研究在QTL定位的基礎上,通過進一步分析共獲得與小麥穗下節長度相關的候選基因15個,從這些候選基因的功能來看,其主要為一些相關蛋白和功能酶,它們通過調節或影響植物代謝活動進而對小麥穗下節長度產生間接影響[13-15]。例如,TraesCS4D01G019600可能編碼雙功能嘌呤生物合成蛋白,該蛋白是許多具有調節代謝功能的同工酶的重要組成因子[16]。TraesCS4D01G039200可能編碼原纖維家族蛋白,已有學者發現這類基因在植物莖稈中表達[17-18]。TraesCS4D01G040300可能編碼代謝產物轉運蛋白,其可能通過調節代謝產物在穗下節區域的分配影響穗下節的長度。TraesCS4D01G045400和TraesCS4D01G061100可能編碼與植物光合作用相關的因子[19]。TraesCS4D01G044400可能編碼Myb轉錄因子家族蛋白,該蛋白具有調節次生代謝的功能[20]。當然,本研究只是對穗下節長度候選基因的初步分析,這些基因仍需更為深入的研究。本研究結果將為小麥穗下節長度的遺傳改良及“普冰3228”的有效利用提供一定科學依據。
4 結 論
本研究以“普冰3228”ד京4839”構建的重組自交系群體為材料,利用55K SNP芯片對穗下節長度進行QTL定位及候選基因分析。研究共檢測到與小麥穗下節相關QTL 6個,這些QTL主要分布于2B、4B、4D、5B和6D染色體上,其中QUIL-4B.e1、QUIL-4D.e1為主效QTL,QUIL-4D為多環境下穩定QTL。預測分析獲得與穗下節長度相關的候選基因15個。本研究不僅有助于小麥穗下節長度遺傳機制解析,也將為其遺傳改良提供新材料和新候選基因。
致 謝:感謝中國農業科學院作物科學研究所李立會研究員為本研究提供材料支持,感謝中國農業科學院作物科學研究所李立會研究員和張錦鵬研究員對本研究的技術指導。

