基于JNK信號通路和線粒體氧化應激研究兒茶素拮抗對乙酰氨基酚誘導肝損傷的作用機制
孫武燕,張 娟,張 炫,王春寶,彭秋玲,白慶云
? 藥理與臨床?
基于JNK信號通路和線粒體氧化應激研究兒茶素拮抗對乙酰氨基酚誘導肝損傷的作用機制
孫武燕,張 娟#,張 炫,王春寶,彭秋玲,白慶云*
宜春學院化學與生物工程學院,江西 宜春 336000
基于c-jun末端激酶(c-Jun-terminal kinase,JNK)信號通路探討兒茶素對對乙酰氨基酚(acetaminophen,APAP)誘導肝損傷的作用及機制。ICR小鼠隨機分為對照組、模型組以及兒茶素(50、100 mg/kg)組,小鼠連續3 d ig兒茶素,末次給予兒茶素1 h后ip APAP(400 mg/kg),6 h后采用蘇木素-伊紅(HE)染色評估小鼠肝臟組織病變,檢測血清中丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、天冬氨酸氨基轉移酶(aspartate aminotransferase,AST)活性及肝臟中谷胱甘肽(glutathione,GSH)水平、超氧化物歧化酶(superoxide dismutase,SOD)活性;考察兒茶素對細胞色素P450(cytochrome P450,CYP450)代謝酶活性的影響。人正常肝細胞L02給予40、80 μmol/L兒茶素,15 min后給予15 mmol/L APAP孵育6 h,檢測活性氧(reactive oxygen species,ROS)水平、線粒體膜電位變化、線粒體呼吸鏈復合物I活性、三磷酸腺苷(adenosine triphosphate,ATP)含量、胞質B淋巴細胞瘤-2相關X蛋白(B-cell lymphoma-2 associated X protein,Bax)、第2個線粒體衍生的半胱氨酸蛋白酶激活劑(second mitochondria-derived activator of caspases,Smac)、凋亡誘導因子(apoptosis inducing factor,AIF)蛋白表達以及線粒體動力相關蛋白1(dynamin-related protein 1,Drp1)、線粒體融合蛋白2(mitofusin 2,Mfn2)、Bax蛋白表達和p-JNK、JNK蛋白表達。給予JNK激活劑后,考察兒茶素對APAP誘導的肝細胞損傷作用。兒茶素顯著降低APAP誘導的肝損傷小鼠血清中ALT、AST活性(<0.05、0.01),顯著升高肝臟GSH水平和SOD活性(<0.05、0.01),改善肝臟損傷。兒茶素顯著升高APAP處理的L02細胞存活率、線粒體膜電位、呼吸鏈復合物I活性和ATP水平(<0.05、0.01),顯著降低ROS水平(<0.05),顯著下調線粒體中Drp1、Bax和胞質中Smac、AIF蛋白表達(<0.05),顯著上調線粒體中Mfn2和胞質Bax的蛋白表達(<0.05),并抑制JNK的磷酸化水平(<0.05)。給予JNK激活劑后,兒茶素的抗氧化作用和對肝臟的保護作用明顯減弱(<0.05、0.01)。兒茶素通過抑制JNK信號通路減輕線粒體氧化應激,進而拮抗APAP誘導的肝損傷。
兒茶素;對乙酰氨基酚;肝損傷;線粒體氧化應激;JNK信號通路
藥物性肝損傷(drug-induced liver injury,DILI)是由多種藥物及其代謝產物引起的肝臟疾病[1]。對乙酰氨基酚(acetaminophen,APAP)屬于非甾體抗炎藥,也是誘發DILI最為常見的藥物。過量的APAP可誘導肝細胞線粒體的氧化/亞硝化應激和細胞內信號傳導。過氧亞硝酸鹽具有細胞毒性,氧化硫氧還蛋白(thioredoxin,Trx)導致細胞凋亡信號調節激酶1(apoptosis signal-regulated kinase 1,ASK1)的活化[2-3]。ASK1與活化的混合譜系激酶3(mixed lineage kinase 3,MLK3)通過絲裂原活化蛋白激酶激酶4(mitogen-activated protein kinase kinase 4,MKK4)磷酸化將c-jun末端激酶(c-Jun-terminal kinase,JNK)激活為磷酸化形式,使磷酸化JNK易位至線粒體。磷酸化的JNK會通過Src介導的通路進一步抑制線粒體電子運輸[4-6]。B淋巴細胞瘤-2相關X蛋白(B-cell lymphoma-2 associated X protein,Bax)和糖原合成激酶-3β(glycogen synthase kinase-3β,GSK-3β)易位到線粒體,進一步激活線粒體氧化應激[7]。這些會改變線粒體的通透性并釋放線粒體膜間蛋白,如核酸內切酶G、凋亡誘導因子(apoptosis inducing factor,AIF)、細胞色素C和第2個線粒體衍生的半胱氨酸蛋白酶激活劑(second mitochondria-derived activator of caspases,Smac)。AIF和核酸內切酶G向細胞核的易位導致細胞核DNA斷裂及細胞壞死,進而引起肝損傷。
兒茶素是存在于兒茶、羅布麻、銀杏葉等藥用植物中的多酚類化學物質[8],具有抗炎、抗腫瘤、抗氧化和抗病毒等多種藥理作用[9],可用于治療心血管[10]、肝臟[11]等疾病。關于兒茶素類化合物先前的研究表明,表兒茶素對APAP誘導的急性肝損傷具有保護作用,其作用機制為抗炎和抗細胞凋亡活性[12]。表沒食子兒茶素-3-沒食子酸(epigallocatechin-3-gallate,EGCG)通過降低血清丙氨酸氨基轉移酶(alanine aminotransferase,ALT)活性、減輕氧化應激、抑制細胞凋亡和減少APAP的毒性產物,進而減輕APAP誘導的肝損傷[13-14]。最近一項研究表明,EGCG對肝臟的保護作用是通過降低APAP誘導的血清ALT活性,改善肝線粒體膜電位和呼吸鏈復合物[15]。上述研究表明,兒茶素異構體可以減輕APAP誘導的肝毒性,但其具體作用機制尚未闡明。同樣,關于兒茶素本身在APAP肝毒性中的作用和機制也鮮有報道。由于JNK在APAP誘導的肝毒性中起著關鍵作用,因此本研究旨在探討兒茶素是否能夠通過體內外調節JNK信號通路來減輕APAP誘導的肝毒性。
1 材料
1.1 動物和細胞
清潔級雄性ICR小鼠36只,8~10周齡,體質量(25±35)g,購自湖南斯萊克景達試驗動物公司,合格證號SCXK(湘)2016-0002。動物飼養于溫度(22±2)℃、自動通風、明暗光照周期12 h/12 h、相對濕度(50±5)%的環境中,自由進食飲水,實驗前適應性喂養1周。動物實驗經宜春學院動物倫理委員會批準,批準號為倫審科第2023(035)號。
人正常肝細胞L02由上海中醫藥大學季莉莉教授贈予。
1.2 藥品與試劑
兒茶素(質量分數≥98.0%,批號P10A8F41490)購自上海源葉生物科技有限公司;APAP(質量分數≥99.0%,批號C10090929)購自上海麥克林生化科技有限公司;JNK激活劑茴香霉素(批號20191122)、活性氧(reactive oxygen species,ROS)測定試劑盒(批號20180321)、線粒體膜電位測定試劑盒(批號20210708)、BCA蛋白檢測試劑盒(批號37)均購自上海碧云天生物技術有限公司;RIPA裂解緩沖液(批號170319)購自美國GIBCO生物技術公司;Vivid?CYP2E1檢測試劑盒(批號2833633)、Vivid?CYP3A4檢測試劑盒(批號2834649)、Vivid?CYP1A2檢測試劑盒(批號2830166)均購自賽默飛世爾科技有限公司;DDTC(批號161910);酮康唑(批號2102G48)均購自上海源葉生物科技有限公司;呋拉茶堿(批號ST023)購自范德生物科技有限公司;ALT檢測試劑盒(批號20200306)、天冬氨酸氨基轉移酶(aspartate aminotransferase,AST)檢測試劑盒(批號20200404)、超氧化物歧化酶(superoxide dismutase,SOD)檢測試劑盒(批號20210610)、還原型谷胱甘肽(glutathione,GSH)測定試劑盒(批號20210925)、三磷酸腺苷(adenosine triphosphate,ATP)檢測試劑盒(批號20220106)、線粒體呼吸鏈復合體I測定試劑盒(批號20201215)、線粒體提取試劑盒(批號10124339)均購自南京建成生物工程研究所;β-actin抗體(批號15)、細胞色素C氧化酶IV(cytochrome c oxidase IV,COX IV)抗體(批號4)、Bax抗體(批號12)、AIF抗體(批號3)、Smac抗體(批號1)、T-JNK抗體(批號15)、p-JNK抗體(批號15)、動力相關蛋白1(dynamin-related protein 1,Drp1)抗體(批號3)、線粒體融合蛋白2(mitofusin 2,Mfn2)抗體(批號3)、二抗(批號10)購自美國CST公司;其他試劑均為分析試劑均購自國藥集團化學試劑有限公司。
1.3 儀器
Ti2-U型熒光顯微鏡(日本Nikon公司);2IR型高速冷凍離心機(賽默飛世爾科技有限公司);BWS-10型恒溫水浴鍋(上海一恒科學儀器有限公司);1681130A型Imark酶標儀、703930型蛋白電泳儀(美國Bio-Rad公司);S10型手提式高速分散器(寧波新芝生物科技股份有限公司);AR224CN型電子天平(上海奧豪斯儀器有限公司);VORTEX-5型漩渦混合儀(上海析域儀器設備有限公司);722型可見光分光光度計(上海佑可儀表有限公司);HP型AlphaImager凝膠成像系統(美國Alpha科技有限公司);IMS-20型雪花制冰機(常熟市雪科電器有限公司)。
2 方法
2.1 動物分組、造模及給藥
36只ICR小鼠適應性飼養1周后,隨機分為對照組、模型組和兒茶素低、高劑量(50、100 mg/kg)組,每組9只。APAP溶于溫熱無菌生理鹽水溶液中,兒茶素溶于0.01% PBS溶液中。兒茶素組小鼠連續3 d ig藥物,對照組給予等體積的生理鹽水,末次給藥1 h后模型組和兒茶素組小鼠ip APAP(400 mg/kg),對照組ip等體積的生理鹽水,6 h后麻醉,心臟取血,采集肝臟。
2.2 血清ALT和AST活性檢測
將各組小鼠血液置于冰上3 h,4 ℃、3 500 r/min離心10 min,取上清液,按照試劑盒說明書測定血清中ALT和AST活性。
2.3 肝組織蘇木素-伊紅(HE)染色
將小鼠肝大葉置于10%中性福爾馬林溶液中固定,石蠟包埋,切片后進行HE染色,于顯微鏡下觀察并拍照,采用Suzuki評分[16]對肝組織結構損傷程度進行半定量分析。
2.4 肝臟SOD活性和GSH水平測定
取各組肝組織適量,加入9倍量的生理鹽水,勻漿后4 ℃、4 000 r/min離心10 min,收集上清液,采用BCA蛋白檢測試劑盒測定蛋白濃度。按照試劑盒說明書測定肝組織中SOD活性和GSH水平。
2.5 細胞色素P450(cytochrome P450,CYP450)代謝酶活性測定
將制備好的肝微粒體加入不同濃度的兒茶素(0.3、1、3、10、30、100 μmol/L),按照試劑盒說明書分析兒茶素對CYP2E1、CYP1A2和CYP3A4酶活性的影響。DDTC、呋拉茶堿和酮康唑為細胞色素P4502E1、P4503A4、P4501A2的陽性抑制劑,計算陽性抑制劑的抑制率。
抑制率=1-(X-B)/(A-B)
X、A和B分別代表兒茶素、溶劑對照和陽性抑制劑的速率
2.6 兒茶素對APAP誘導的L02細胞氧化應激、線粒體損傷和p-JNK蛋白表達的影響
2.6.1 細胞培養 L02細胞用含10%胎牛血清的RPMI 1640培養基,在37 ℃、5% CO2恒溫培養箱中培養。
2.6.2 ROS水平的測定 將L02細胞以1×105個/孔接種于6孔板中,設置對照組、模型組和兒茶素低、高劑量(40、80 μmol/L)組。待細胞貼壁后,兒茶素組分別加入不同濃度的兒茶素溶液孵育15 min,然后模型組和兒茶素組再加入APAP(15 mmol/L)孵育6 h。加入DCFH-DA探針孵育20 min,于熒光顯微鏡下檢測熒光強度。
2.6.3 線粒體膜電位的測定 按照“2.6.2”項下方法進行分組和給藥,藥物處理后,棄去培養液,PBS清洗細胞,加入0.5 mL細胞培養液和0.5 mL JC-1染色工作液,充分混勻。將孔板放于細胞培養箱中37 ℃孵育30 min,隨后吸棄培養液,各孔用1 mL JC-1染色緩沖液洗滌2次,并加入1 mL細胞培養液于熒光顯微鏡下觀察線粒體熒光的強弱。
2.6.4 細胞中ATP含量的測定 L02細胞以2×106個接種于直徑為6 cm的培養皿中,待細胞貼壁后,加入APAP(15 mmol/L)分別孵育0、6、12、18、24 h,按ATP檢測試劑盒說明書檢測ATP含量,用可見光分光光度計于636 nm處檢測各組吸光度()值,計算ATP含量。
L02細胞以2×106個接種于直徑為6 cm的培養皿中,設置對照組、模型組及兒茶素低、高劑量(40、80 μmol/L)組和兒茶素(80 μmol/L)單獨給藥組。待細胞貼壁后,兒茶素組分別加入不同濃度的兒茶素溶液孵育15 min,然后模型組和兒茶素組再加入APAP(15 mmol/L)孵育6 h。按ATP檢測試劑盒說明書檢測ATP含量。
2.6.5 線粒體呼吸鏈復合物I活性的測定 L02細胞以2×106個接種于直徑為6 cm的培養皿中,按照“2.6.2”項下方法進行分組,待細胞貼壁后,兒茶素組分別加入不同濃度的兒茶素溶液孵育15 min,然后模型組和兒茶素組再加入APAP(15 mmol/L)孵育6 h。使用線粒體提取試劑盒提取線粒體。復合物I會催化還原型煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)轉化為煙酰胺腺嘌呤四核苷酸。因此,根據試劑盒說明書,通過測量340 nm處值來計算線粒體呼吸鏈復合物I活性,以確定NADH的轉化率。
2.6.6 Western blotting檢測胞漿Bax、Smac、AIF和線粒體Mfn2、Drp1、Bax蛋白表達 L02細胞以2×106個接種于直徑為6 cm的培養皿中,設置對照組、模型組及兒茶素低、高劑量(40、80 μmol/L)組和兒茶素(80 μmol/L)單獨給藥組。待細胞貼壁后,兒茶素組分別加入不同濃度的兒茶素溶液孵育15 min,然后模型組和兒茶素組再加入APAP(15 mmol/L)孵育6 h。收集細胞,用RIPA裂解緩沖液提取胞質蛋白,線粒體提取試劑盒提取線粒體蛋白。測定蛋白濃度,蛋白樣品經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,轉至PVDF膜,孵育一抗和二抗,使用化學發光試劑盒顯影,使用β-actin或COX IV作為內部參照,對蛋白條帶的灰度進行量化分析。
2.6.7 Western blotting檢測細胞p-JNK、JNK蛋白表達 L02細胞以2×106個接種于直徑為6 cm的培養皿中,待細胞貼壁后,加入APAP(15 mmol/L)分別孵育0、0.5、1、3、6、12、24 h,收集細胞,用RIPA裂解緩沖液提取細胞總蛋白,檢測p-JNK、JNK蛋白表達。
按“2.6.6”項下方法處理細胞和給藥,收集細胞,用RIPA裂解緩沖液提取細胞總蛋白,檢測p-JNK、JNK蛋白表達。
2.7 JNK激活劑茴香霉素對兒茶素保護肝細胞作用的影響
L02細胞以2×106個接種于直徑為6 cm的培養皿中,設置對照組、模型組和茴香霉素低、高劑量單獨給藥(5、15 nmol/L)組。待細胞貼壁后,先用茴香霉素孵育15 min,然后加入APAP(15 mmol/L)孵育6 h。收集細胞,收集細胞,提取蛋白,檢測p-JNK、JNK蛋白表達。
設置對照組、模型組、兒茶素(80 μmol/L)組和兒茶素+茴香霉素(15 nmol/L)組,細胞先加入茴香霉素孵育15 min,再加入兒茶素孵育15 min,然后加入APAP孵育6 h。采用CCK-8法測定細胞活力,按照“2.6.3”項下方法測定線粒體膜電位水平,按照“2.6.4”項下方法測定細胞中ATP含量,按照“2.6.5”項下方法測定線粒體呼吸鏈復合物I活性,按照“2.6.6”項下方法測定胞質Bax、Smac、AIF和線粒體Mfn2、Drp1、Bax蛋白表達,按照“2.6.7”項下方法檢測p-JNK、JNK蛋白表達。
2.8 統計學分析
3 結果
3.1 兒茶素減輕APAP誘導的小鼠肝損傷
為了確定小鼠肝損傷的程度,檢測血清中ALT和AST活性。如圖1-A所示,與對照組比較,模型組小鼠血清中ALT和AST活性均顯著升高(<0.05);與模型組比較,兒茶素(50、100 mg/kg)組小鼠血清中ALT和AST活性均顯著降低(<0.05、0.01)。HE染色結果如圖1-B、C所示,與對照組比較,模型組小鼠血管周圍肝臟組織結構遭到大面積的破壞,實質性肝小葉中心壞死、肝竇充血,Suzuki評分明顯升高(<0.01);給予兒茶素后,肝臟組織損傷得到明顯的改善,Suzuki評分明顯降低(<0.01)。
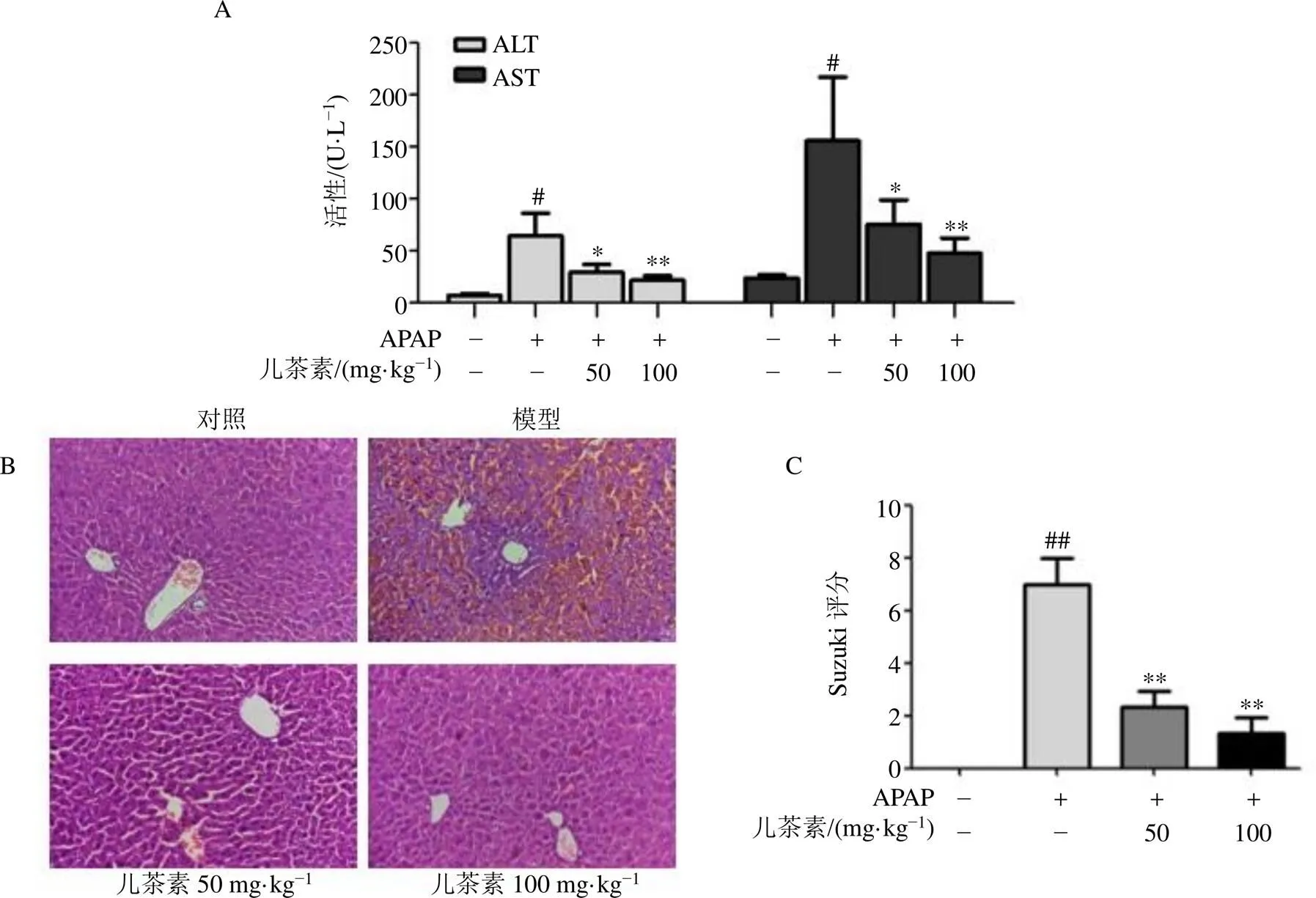
A-小鼠血清中ALT和AST活性;B-小鼠肝組織HE染色病理學評估(×200);與對照組比較:#P<0.05 ##P<0.01;與模型組比較:*P<0.05 **P<0.01。
3.2 兒茶素對APAP代謝酶活性的影響
CYP2E1、CYP1A2和CYP3A4是CYP450體系中的一員,它們在APAP的代謝活化中起重要作用[17]。如圖2所示,兒茶素對CYP2E1和CYP1A2酶活性沒有影響。低濃度的兒茶素對CYP3A4活性無影響,而高濃度(100 μmol/L)的兒茶素對CYP3A4活性具有一定的抑制作用,但與陽性對照組相比均無統計意義。
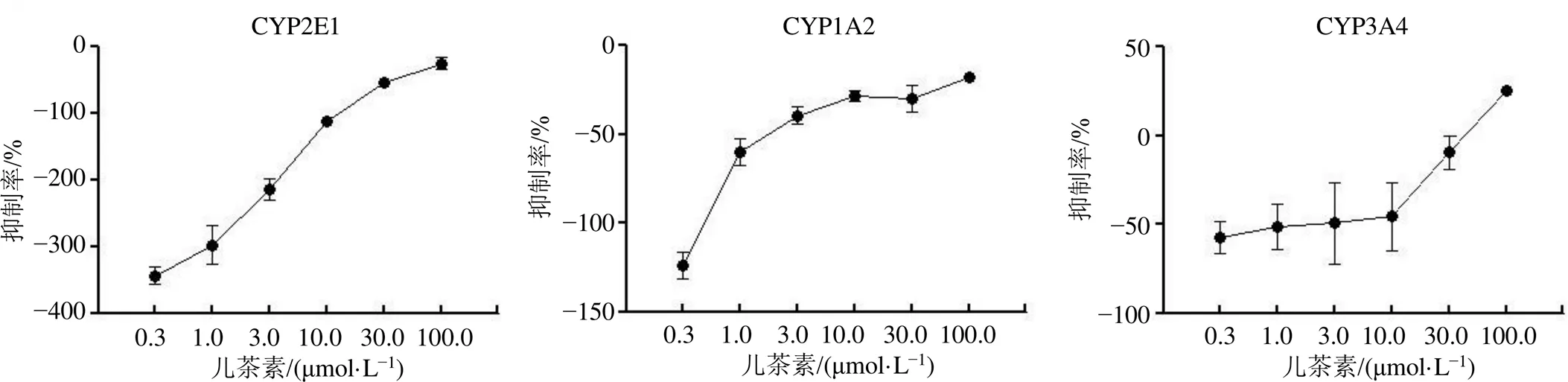
圖2 兒茶素對CYP450代謝酶活性的影響(, n = 3)
3.3 兒茶素減輕APAP誘導的氧化應激
SOD和GSH是機體重要的抗氧化劑。如圖3-A、B所示,與對照組比較,模型組小鼠肝組織GSH水平和SOD活性均顯著降低(<0.05);與模型組比較,兒茶素(50、100 mg/kg)組小鼠肝組織GSH水平和SOD活性均顯著升高(<0.05、0.01)。
ROS水平的增加與線粒體氧化應激有關。用熒光染色法檢測兒茶素對APAP誘導的L02細胞氧化應激的抗氧化作用。如圖3-C、D所示,與對照組比較,APAP顯著增加細胞ROS含量(<0.05),兒茶素(40、80 μmol/L)可以顯著降低APAP誘導的ROS含量(<0.05)。
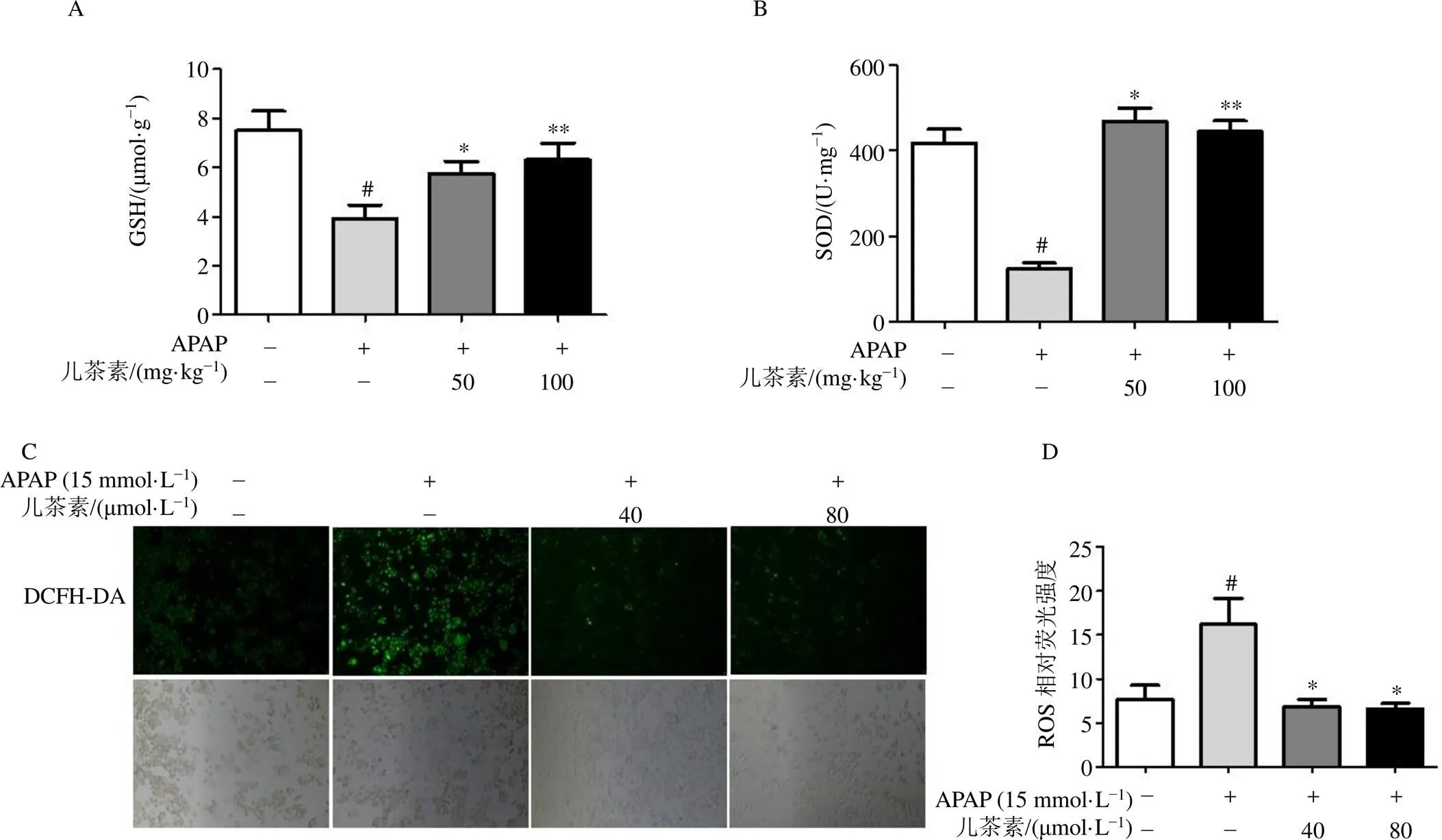
A-小鼠肝臟中GSH水平;B-小鼠肝臟中SOD活性;C、D-L02細胞給予40、80 μmol·L?1兒茶素,15 min后給予15 mmol·L?1 APAP孵育6 h,檢測ROS水平(×100);與對照組比較:#P<0.05;與模型組比較:*P<0.05 **P<0.01。
3.4 兒茶素減輕APAP誘導的線粒體損傷
細胞給予APAP(15 mmol/L)分別孵育0、6、12、18、24 h,檢測ATP濃度。如圖4-A所示,APAP(15 mmol/L)在24 h內呈時間相關性地降低ATP濃度(<0.05)。細胞用兒茶素(40、80 μmol/L)處理15 min,然后給予APAP(15 mmol/L)孵育6 h,如圖4-B所示,與模型組比較,兒茶素(40、80 μmol/L)組ATP濃度顯著升高(<0.05)。如圖4-E所示,與模型組比較,兒茶素(80 μmol/L)組線粒體呼吸鏈復合物I活性明顯增加(<0.05)。結果表明,過量的APAP導致線粒體呼吸鏈復合體I活性顯著降低,用兒茶素預處理可以恢復線粒體呼吸鏈復合物I的活性。
紅色(聚集體)/綠色(單體)熒光強度比的降低表明線粒體膜損傷導致去極化。如圖4-C、D所示,模型組觀察到綠色熒光強度增加,40、80 μmol/L兒茶素預處理導致APAP處理的細胞中紅色熒光顯著增加(<0.05、0.01)。以上結果表明兒茶素處理可阻止線粒體膜的去極化。
Bax、Smac和AIF是細胞凋亡相關蛋白。Bax可以轉移到線粒體并在線粒體外膜上形成孔隙,過量的APAP可導致膜間蛋白Smac和AIF的釋放。如圖4-F、G所示,與對照組比較,模型組胞質中AIF和Smac蛋白表達水平均顯著升高(<0.05),Bax蛋白表達水平顯著降低(<0.05);而APAP聯合兒茶素組以上蛋白表達水平均顯著回調(<0.05)。Mfn2和Drp1蛋白參與線粒體融合和分裂,在肝毒性過程中可以控制JNK的激活并影響氧化應激。如圖4-H、I所示,與對照組比較,模型組線粒體中Mfn2蛋白表達水平顯著降低(<0.05),Bax和Drp1蛋白表達水平顯著升高(<0.05);而用兒茶素處理則顯著回調以上蛋白表達(<0.05)。以上結果表明兒茶素可以預防APAP誘導的線粒體功能紊亂。
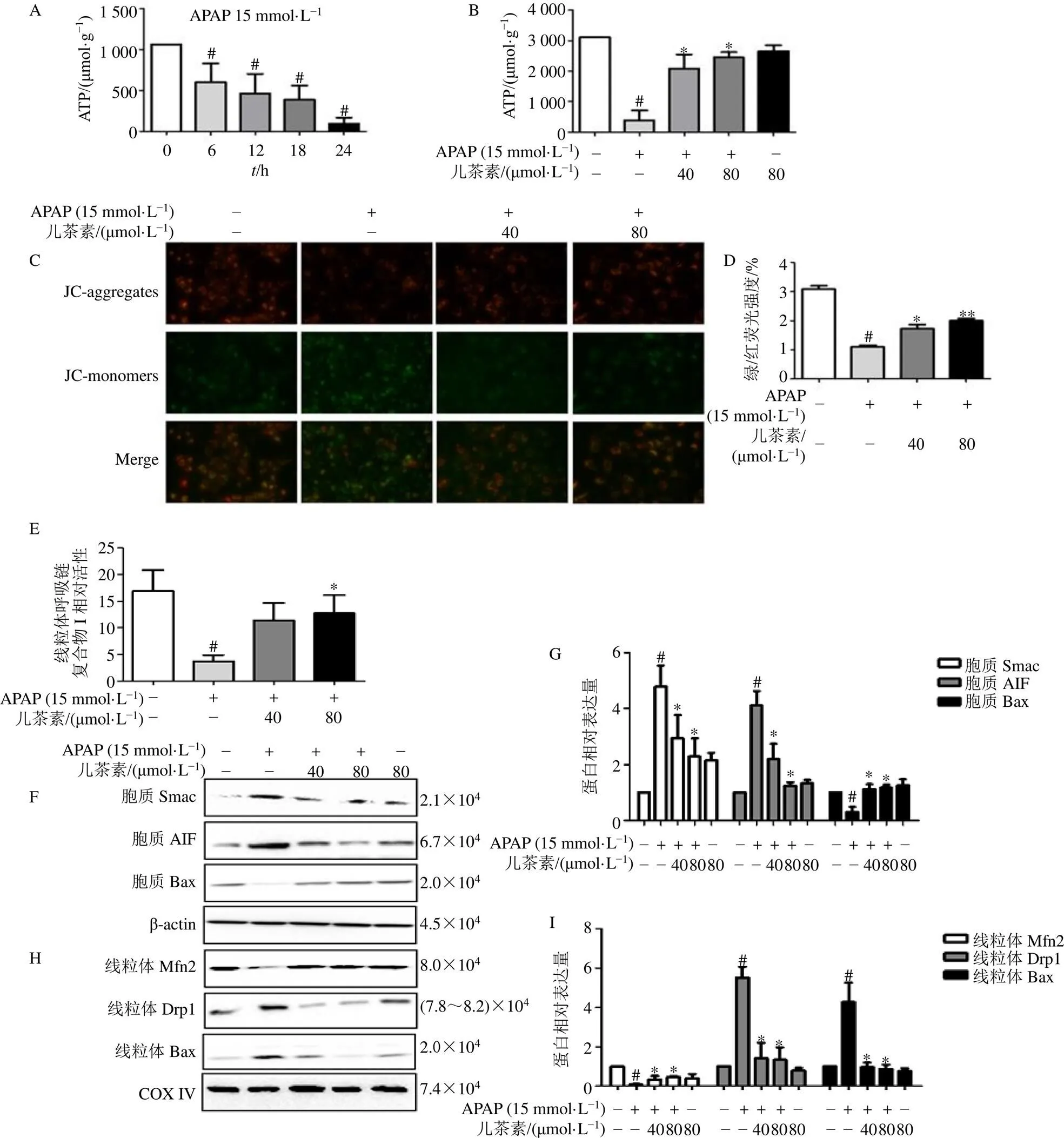
A-L02細胞給予15 mmol·L?1 APAP孵育0、6、12、18、24 h,檢測ATP濃度;B-L02細胞給予40、80 μmol·L?1兒茶素,15 min后給予15 mmol·L?1 APAP孵育6 h,檢測ATP濃度;C、D-L02細胞給予40、80 μmol·L?1兒茶素,15 min后給予15 mmol·L?1 APAP孵育6 h,檢測線粒體膜電位變化;E-L02細胞給予40、80 μmol·L?1兒茶素,15 min后給予15 mmol·L?1 APAP孵育6 h,檢測線粒體呼吸鏈復合物I活性;F~I-L02細胞給予40、80 μmol·L?1兒茶素,15 min后給予15 mmol·L?1 APAP孵育6 h,檢測胞質Bax、Smac、AIF和線粒體Mfn2、Drp1、Bax蛋白表達;與對照組比較:#P<0.05;與模型組比較:*P<0.05 **P<0.01。
3.5 兒茶素抑制APAP誘導的L02細胞中JNK蛋白的磷酸化
首先考察L02細胞給予APAP孵育不同時間點對JNK蛋白磷酸化的影響。如圖5-A、B所示,APAP(15 mmol/L)孵育6 h,JNK蛋白的磷酸化水平最高(<0.05)。接下來考察兒茶素對APAP誘導的L02細胞中JNK蛋白磷酸化的影響。如圖5-C、D所示,兒茶素預處理顯著降低了p-JNK的表達(<0.05)。表明兒茶素預處理降低了APAP誘導的L02細胞p-JNK蛋白的表達。
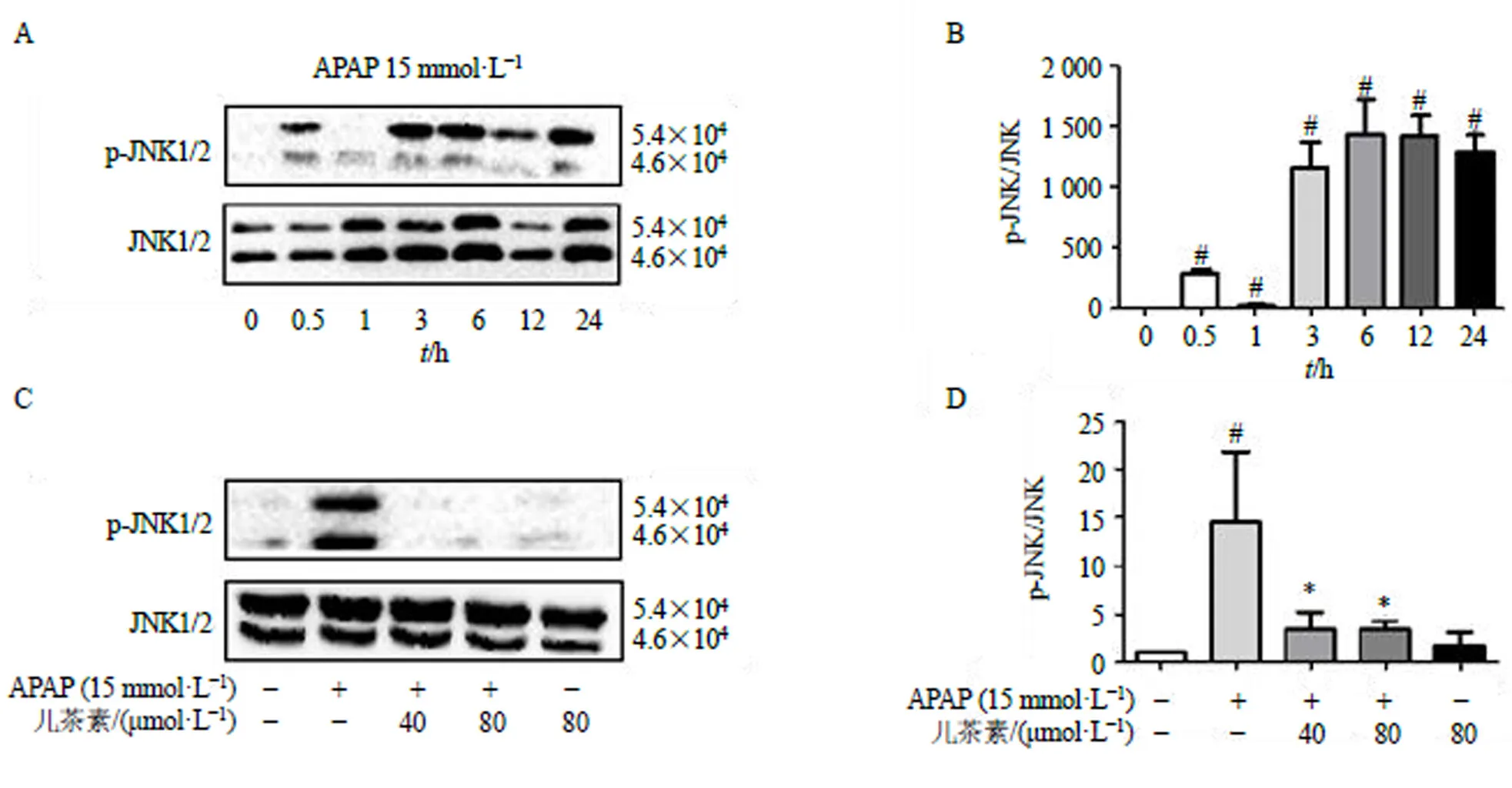
A、B-L02細胞給予15 mmol·L?1 APAP分別孵育0、0.5、1、3、6、12、24 h,檢測p-JNK、JNK蛋白表達;C、D-L02細胞給予40、80 μmol·L?1兒茶素,15 min后給予15 mmol·L?1 APAP孵育6 h,檢測p-JNK、JNK蛋白表達;與對照組比較:#P<0.05;與模型組比較:*P<0.05。
3.6 JNK激活劑茴香霉素減弱兒茶素對肝細胞的保護作用
為了進一步證實兒茶素對JNK通路活性的影響,本研究使用JNK激活劑茴香霉素對細胞進行干預[18]。先將細胞用JNK激活劑茴香霉素(5、15 nmol/L)孵育15 min,再用兒茶素(40、80 μmol/L)孵育15 min,然后再加入APAP孵育6 h。如圖6-A所示,15 nmol/L茴香霉素顯著增加了p-JNK的蛋白表達(<0.05)。如圖6-B所示,與模型組比較,兒茶素組p-JNK蛋白表達水平顯著降低(<0.05);而給予JNK激活劑后,p-JNK蛋白表達水平顯著升高(<0.05)。為了探討兒茶素對茴香霉素處理的L02細胞的保護作用,對細胞活力進行測定。如圖6-C所示,APAP(15 mmol/L)顯著降低細胞活力(<0.05),兒茶素預處理后能夠顯著回調細胞活力(<0.05)。在加入茴香霉素后,細胞活力顯著降低(<0.05)。以上結果表明,JNK信號通路是兒茶素拮抗APAP誘導的肝損傷的關鍵所在。
3.7 茴香霉素減弱兒茶素對線粒體的保護作用
為檢測JNK激活劑茴香霉素對線粒體功能的影響,對ATP含量、線粒體膜電位、線粒體呼吸鏈復合物I活性、胞質中Smac、AIF、Bax以及線粒體中Mfn2、Drp1、Bax蛋白表達進行檢測。如圖7所示,茴香霉素顯著逆轉了兒茶素對ATP含量、線粒體呼吸鏈復合物I活性、線粒體膜電位、胞質中Smac、AIF、Bax以及線粒體中Mfn2、Drp1、Bax蛋白表達的調控作用(<0.05、0.01)。以上結果表明兒茶素可以通過抑制JNK信號通路來減輕APAP誘導的線粒體損傷。
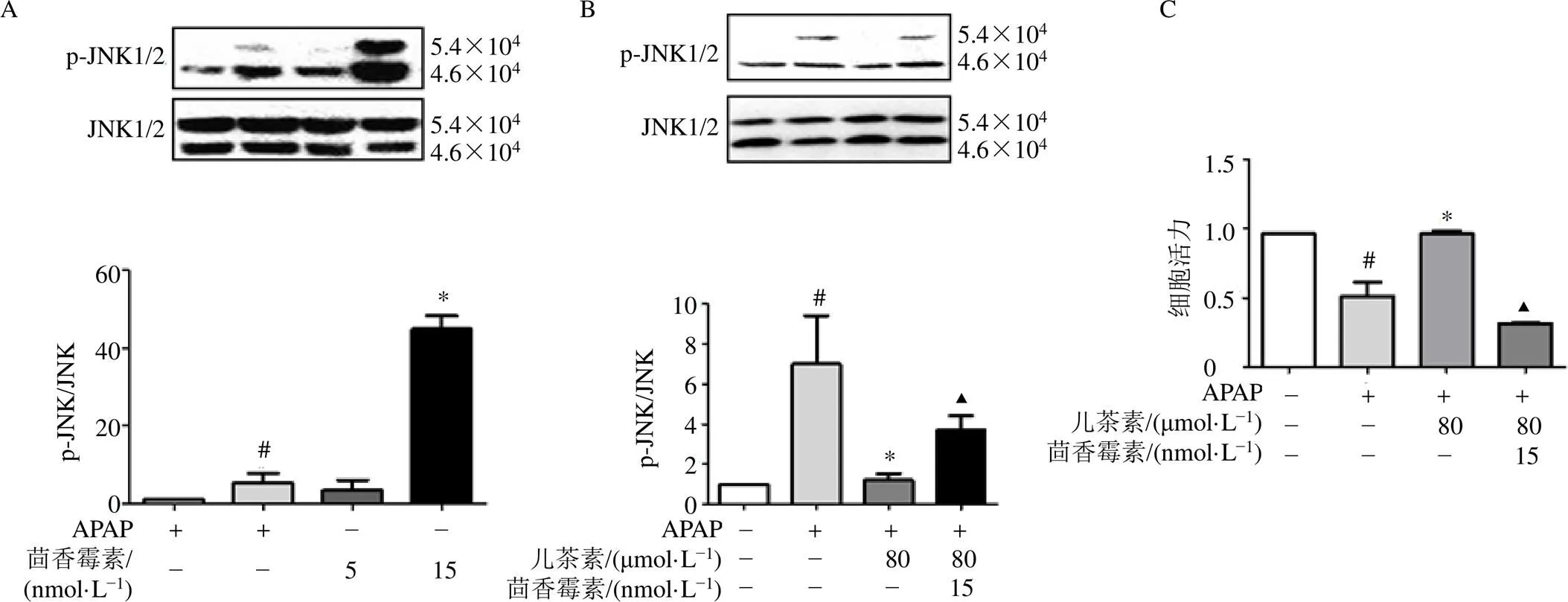
A-L02細胞給予JNK激活劑茴香霉素(5、15 mmol·L?1)孵育15 min,再加入15 mmol·L?1 APAP孵育6 h,檢測p-JNK、JNK蛋白表達;B-L02細胞給予15 mmol·L?1茴香霉素孵育15 min,再給予80 μmol·L?1兒茶素孵育15 min,然后給予15 mmol·L?1 APAP孵育6 h,檢測p-JNK、JNK蛋白表達;C-L02細胞給予15 mmol·L?1茴香霉素孵育15 min,再給予80 μmol·L?1兒茶素孵育15 min,然后給予15 mmol·L?1 APAP孵育6 h,檢測細胞活力;與對照組比較:#P<0.05;與模型組比較:*P<0.05;與APAP+兒茶素組比較:▲P<0.05。
4 討論
ALT和AST主要存在于肝細胞中[19]。如果肝臟受到損傷,血液中ALT和AST活性會急劇升高。因此,ALT和AST被認為是急性肝損傷的標志物[20]。在本研究中,與對照組比較,模型組小鼠血清中ALT和AST活性均顯著升高,并導致肝臟發生嚴重的組織病理學變化。給予兒茶素后,呈劑量相關性地降低了血清ALT和AST活性。表明兒茶素在APAP誘導的小鼠急性肝損傷中具有顯著的保肝作用。
當攝入過量APAP時,會引起CYP450酶被激活,產生反應性代謝產物-乙酰基-對苯并醌亞胺(-acetyl-para-amino-phenol,NAPQI)[21-22]。CYP450在APAP肝毒性中起關鍵作用是由于CYP450的幾種亞型如CYP2E1、CYP1A2和CYP3A4參與APAP代謝[17]。因此,本研究探究了兒茶素對CYP2E1、CYP1A2和CYP3A4酶活性的影響。結果表明,100 μmol/L兒茶素僅能抑制CYP3A4的活性,對CYP2E1、CYP1A2沒有影響。這說明抑制APAP的代謝酶只是兒茶素減輕肝毒性機制的一小部分。
大量研究表明,線粒體氧化應激是APAP誘導肝損傷的重要因素[23]。氧化應激的產生是體內氧化和抗氧化作用的失衡[24]。兒茶素可通過提高GSH水平和SOD活性,降低ROS水平,從而發揮保肝作用。氧化應激中會產生過量的ROS和自由基[25]。GSH是體內重要的抗氧化劑和自由基清除劑[26]。SOD的作用機制主要是清除對身體有害的超氧陰離子和自由基[27]。在本研究中,觀察到肝損傷小鼠體內GSH水平和SOD活性較低,ROS水平升高,而經兒茶素處理后顯著降低了GSH和SOD的消耗以及ROS的水平。這表明兒茶素的保肝作用與其抗氧化能力有關。
ATP是生物體內能量轉化最基本的載體,其含量的變化直接關系到各器官的能量代謝[28]。線粒體可以從產生ATP的分解代謝細胞器轉變為產生ATP的合成代謝細胞器[29]。因此,線粒體是細胞ATP最有效的來源。線粒體功能障礙是由細胞凋亡過程中ATP水平的改變和線粒體膜電位下降所引起的[30]。研究表明,兒茶素可以通過改善線粒體功能和生物能量學來預防線粒體功能障礙和有氧能量代謝的受損[31]。本研究結果表明,兒茶素預處理不僅提高了ATP水平,還恢復了線粒體膜電位,降低了與線粒體損傷相關的凋亡相關蛋白如AIF和Bax的表達。
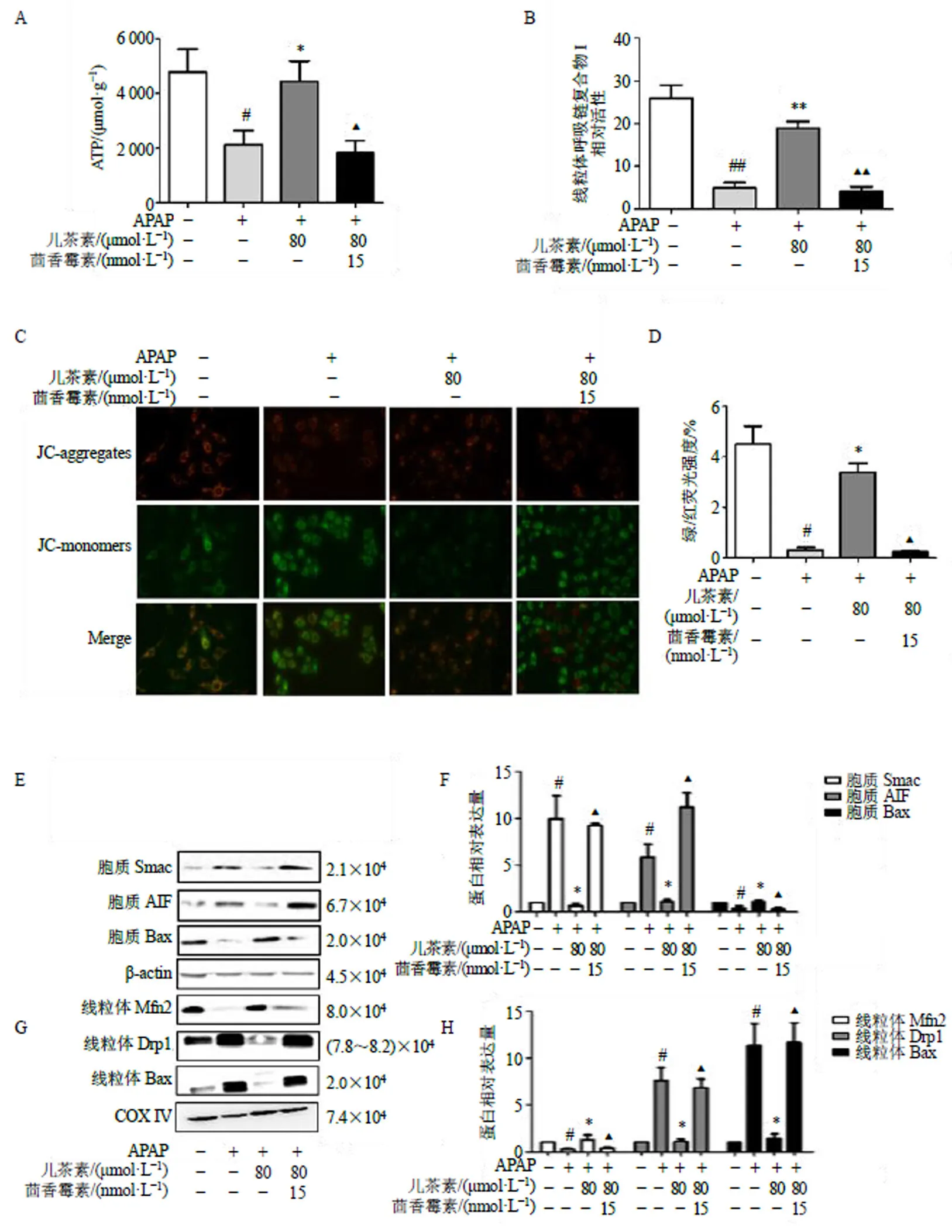
A-L02細胞給予15 mmol·L?1茴香霉素孵育15 min,再給予80 μmol·L?1兒茶素孵育15 min,然后給予15 mmol·L?1 APAP孵育6 h,檢測ATP含量;B-線粒體呼吸鏈復合物I活性;C、D-線粒體膜電位;E~H-胞質Bax、Smac、AIF和線粒體Mfn2、Drp1、Bax蛋白表達;與對照組比較:#P<0.05 ##P<0.01;與模型組比較:*P<0.05 **P<0.01;與APAP+兒茶素組比較:▲P<0.05 ▲▲P<0.01。
線粒體呼吸鏈復合體是線粒體內膜中電子傳輸鏈的重要組成部分[32]。線粒體呼吸鏈復合物I活性的降低會影響電子傳輸并增加ROS水平,導致線粒體功能障礙[33]。研究表明,APAP會干擾線粒體呼吸鏈復合物的形成,導致ATP水平下降、ROS活性增加,從而引起肝損傷[34]。本結果表明兒茶素預處理增加了線粒體呼吸鏈復合物I的活性。因此,恢復線粒體呼吸鏈復合物I的活性可能是治療APAP誘導的急性肝損傷的有效方法。
JNK信號通路的激活被認為是APAP誘導的肝損傷的重要機制[35]。ROS可激活JNK信號通路,增加線粒體膜通透性。ROS的產生和JNK的激活形成了正反饋循環,因此會增加氧化性損傷[36]。先前的研究表明,JNK的激活可導致Bax激活并易位到線粒體,并在線粒體外膜中形成孔隙,然后引起線粒體膜間蛋白Smac和AIF釋放,導致DNA斷裂[37-39]。本研究結果表明,在APAP處理的肝細胞中,p-JNK水平顯著升高,而兒茶素的保護作用在JNK激活劑處理后顯著減弱。這說明兒茶素對JNK的抑制作用在APAP誘導的肝損傷中至關重要。
綜上,本研究表明兒茶素在體內外均能抑制APAP誘導的肝損傷。在體內,兒茶素可以降低ALT和AST活性,減少肝組織損傷,并增加肝臟GSH水平和SOD活性,從而降低氧化應激;在體外,兒茶素可以提高人肝細胞的存活率以及線粒體中膜電位、線粒體呼吸鏈復合物I活性和ATP水平。進一步的研究結果表明兒茶素對肝損傷的保護作用與其對JNK的抑制有關。目前的文獻多是對兒茶素類化合物如表兒茶素、EGCG[40]等化合物保肝作用的研究,對兒茶素的保肝作用研究鮮有報道,本研究從體內外系統闡釋了兒茶素拮抗APAP的肝損傷的作用,并利用信號分子抑制劑對其保肝機制進行了較為深入的研究。但由于條件限制未在轉基因動物上進一步驗證,這也將是后續的研究內容之一。本研究為兒茶素的保肝作用提供了實驗依據。
利益沖突 所有作者均聲明不存在利益沖突
[1] Shehu A I, Ma X C, Venkataramanan R. Mechanisms of drug-induced hepatotoxicity [J]., 2017, 21(1): 35-54.
[2] Ramachandran A, Lebofsky M, Yan H M,. Hepatitis C virus structural proteins can exacerbate or ameliorate acetaminophen-induced liver injury in mice [J]., 2015, 89(5): 773-783.
[3] Jan Y H, Heck D E, Dragomir A C,. Acetaminophen reactive intermediates target hepatic thioredoxin reductase [J]., 2014, 27(5): 882-894.
[4] Hanawa N, Shinohara M, Saberi B,. Role of JNK translocation to mitochondria leading to inhibition of mitochondria bioenergetics in acetaminophen-induced liver injury [J]., 2008, 283(20): 13565-13577.
[5] Saito C, Lemasters J J, Jaeschke H. C-Jun-terminal kinase modulates oxidant stress and peroxynitrite formation independent of inducible nitric oxide synthase in acetaminophen hepatotoxicity [J]., 2010, 246(1/2): 8-17.
[6] Win S, Than T A, Han D,. C-Jun-terminal kinase (JNK)-dependent acute liver injury from acetaminophen or tumor necrosis factor (TNF) requires mitochondrial Sab protein expression in mice [J]., 2011, 286(40): 35071-35078.
[7] Shinohara M, Ybanez M D, Win S,. Silencing glycogen synthase kinase-3beta inhibits acetaminophen hepatotoxicity and attenuates JNK activation and loss of glutamate cysteine ligase and myeloid cell leukemia sequence 1 [J]., 2010, 285(11): 8244-8255.
[8] Musial C, Kuban-Jankowska A, Gorska-Ponikowska M. Beneficial properties of green tea catechins [J]., 2020, 21(5): 1744.
[9] 徐先祥. 兒茶素的藥理作用研究綜述[J]. 輕工學報, 2012, 27(4): 60-64.
[10] 顏俊杰, 黃靜雯, 金陸飛, 等. 兒茶素應用于心血管疾病的研究進展 [J]. 四川生理科學雜志, 2018, 40(4): 316-318.
[11] 萬星, 陶柏楠, 邵文翠, 等. 兒茶素干預硬脂酰輔酶A去飽和酶-1表達抗小鼠肝纖維化損傷 [J]. 中國藥理學通報, 2023, 39(2): 305-310.
[12] Wu H, Xie Y N, Xu Y L,. Protective effect of epicatechin on APAP-induced acute liver injury of mice through anti-inflammation and apoptosis inhibition [J]., 2020, 34(6): 855-858.
[13] Yao H T, Li C C, Chang C H. Epigallocatechin-3-gallate reduces hepatic oxidative stress and lowers CYP-mediated bioactivation and toxicity of acetaminophen in rats [J]., 2019, 11(8): 1862.
[14] Yao H T, Yang Y C, Chang C H,. Protective effects of (?)-epigallocatechin-3-gallate against acetaminophen-induced liver injury in rats [J]., 2015, 5(3): 15.
[15] Lin Y X, Huang J, Gao T F,. Preliminary study on hepatoprotective effect and mechanism of (?)-epigallocatechin-3-gallate against acetaminophen-induced liver injury in rats [J]., 2021, 20(3): 46-56.
[16] Suzuki S, Toledo-Pereyra L H, Rodriguez F J,. Neutrophil infiltration as an important factor in liver ischemia and reperfusion injury. Modulating effects of FK506 and cyclosporine [J]., 1993, 55(6): 1265-1272.
[17] Xiong W, Huang J, Li X Y,. Icariin and its phosphorylated derivatives alleviate intestinal epithelial barrier disruption caused by enterotoxigenicthrough modulate p38 MAPKand[J]., 2020, 34(1): 1783-1801.
[18] Laine J E, Auriola S, Pasanen M,. Acetaminophen bioactivation by human cytochrome P450 enzymes and animal microsomes [J]., 2009, 39(1): 11-21.
[19] Lala V, Zubair M, Minter D A.[M]. Treasure Island (FL): StatPearls Publishing, 2023.
[20] McGill M R. The past and present of serum aminotransferases and the future of liver injury biomarkers [J]., 2016, 15: 817-828.
[21] McGill M R, Jaeschke H. Metabolism and disposition of acetaminophen: Recent advances in relation to hepatotoxicity and diagnosis [J]., 2013, 30(9): 2174-2187.
[22] Du K, Ramachandran A, Jaeschke H. Oxidative stress during acetaminophen hepatotoxicity: Sources, pathophysiological role and therapeutic potential [J]., 2016, 10: 148-156.
[23] Yan M Z, Huo Y Z, Yin S T,. Mechanisms of acetaminophen-induced liver injury and its implications for therapeutic interventions [J]., 2018, 17: 274-283.
[24] Sies H. Oxidative stress: A concept in redox biology and medicine [J]., 2015, 4: 180-183.
[25] Albano E, Vidali M. Immune mechanisms in alcoholic liver disease [J]., 2010, 5(2): 141-147.
[26] García-Román R, Francés R. Acetaminophen-induced liver damage in hepatic steatosis [J]., 2020, 107(5): 1068-1081.
[27] Sakamoto T, Imai H. Hydrogen peroxide produced by superoxide dismutase SOD-2 activates sperm in[J]., 2017, 292(36): 14804-14813.
[28] Wang P, Jia J D, Zhang D. Purinergic signalling in liver diseases: Pathological functions and therapeutic opportunities [J]., 2020, 2(6): 100165.
[29] Weinberg S E, Sena L A, Chandel N S. Mitochondria in the regulation of innate and adaptive immunity [J]., 2015, 42(3): 406-417.
[30] Pearce E L, Poffenberger M C, Chang C H,. Fueling immunity: Insights into metabolism and lymphocyte function [J]., 2013, 342(6155): 1242454.
[31] Rafiei H, Omidian K, Bandy B. Dietary polyphenols protect against oleic acid-induced steatosis in anmodel of NAFLD by modulating lipid metabolism and improving mitochondrial function [J]., 2019, 11(3): 541.
[32] Seifert E L, Estey C, Xuan J Y,. Electron transport chain-dependent and-independent mechanisms of mitochondrial H2O2emission during long-chain fatty acid oxidation [J]., 2010, 285(8): 5748-5758.
[33] Dr?se S, Stepanova A, Galkin A. Ischemic A/D transition of mitochondrial complex I and its role in ROS generation [J]., 2016, 1857(7): 946-957.
[34] Ramachandran A, Visschers R G J, Duan L Q,. Mitochondrial dysfunction as a mechanism of drug-induced hepatotoxicity: Current understanding and future perspectives [J]., 2018, 4(1): 75-100.
[35] Win S, Than T A, Min R W M,. C-Jun-terminal kinase mediates mouse liver injury through a novel Sab (SH3BP5)-dependent pathway leading to inactivation of intramitochondrial Src [J]., 2016, 63(6): 1987-2003.
[36] Peng X W, Yang Y Q, Tang L,. Therapeutic benefits of apocynin in mice with lipopolysaccharide/-galactosamine-induced acute liver injury via suppression of the late stage pro-apoptotic AMPK/JNK pathway [J]., 2020, 125: 110020.
[37] Gunawan B K, Liu Z X, Han D,. C-Jun-terminal kinase plays a major role in murine acetaminophen hepatotoxicity [J]., 2006, 131(1): 165-178.
[38] Kim B J, Ryu S W, Song B J. JNK- and p38 kinase-mediated phosphorylation of Bax leads to its activation and mitochondrial translocation and to apoptosis of human hepatoma HepG2 cells [J]., 2006, 281(30): 21256-21265.
[39] Wang W, Wen D, Duan W,. Systemic administration of scAAV9-IGF1 extends survival in SOD1G93A ALS mice via inhibiting p38 MAPK and the JNK-mediated apoptosis pathway [J]., 2018, 139: 203-210.
[40] 石明亮, 王曉磊, 李江琳, 等. 基于Wnt信號通路研究表沒食子酸兒茶素沒食子酸酯對肝星狀細胞活化的作用及機制[J]. 中草藥, 2022, 53(3): 758-766.
Mechanism of catechin on antagonizing acetaminophen-induced liver injury based on JNK signaling pathway and mitochondrial oxidative stress
SUN Wuyan, ZHANG Juan, ZHANG Xuan, WANG Chunbao, PENG Qiuling, BAI Qingyun
School of Chemistry and Bioengineering, Yichun University, Yichun 336000, China
To explore the effect and mechanism of catechin on acetaminophen (APAP)-induced liver injury based on c-Jun-terminal kinase (JNK) signaling pathway.ICR mice were randomly divided into control, model and catechin (50, 100 mg/kg) groups. The mice were given catechin for three consecutive days through intragastric administration, and after the last dose of catechin for 1 h, mice were ip APAP (400 mg/kg). After 6 h, hematoxylin-eosin (HE) staining was used to evaluate liver tissue lesions in mice. The activities of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in serum, as well as the level of glutathione (GSH) and activity of superoxide dismutase (SOD) in liver were detected. The effect of catechin on activity of cytochrome P450 (CYP450) metabolic enzymes was observed. Normal human liver cells L02 were given 40 and 80 μmol/L catechin, incubated with 15 mmol/L APAP for 6 h after 15 min, reactive oxygen species (ROS) level, changes in mitochondrial membrane potential, mitochondrial respiratory chain complex I activity, adenosine triphosphate (ATP) content, protein expressions of cytoplasmic B-cell lymphoma-2 associated X protein (Bax), second mitochondrial derived activator of caspases (Smac), apoptosis inducing factor (AIF), as well as mitochondrial dynamin-related protein 1 (Drp1), mitofusin 2 (Mfn2), Bax, and p-JNK, JNK were detected. After administering JNK activators, the effect of catechin on APAP-induced liver cell damage was investigated.Catechin significantly reduced the activities of ALT and AST in serum of APAP-induced liver injury mice (< 0.05, 0.01), significantly increased GSH level and SOD activity in liver (< 0.05, 0.01), and improved liver injury. Catechin significantly increased the survival rate, mitochondrial membrane potential, mitochondrial respiratory chain complex I activity and ATP level of L02 cells treated with APAP (< 0.05, 0.01), significantly reduced ROS level (< 0.05), significantly downregulated the protein expressions of Drp1, Bax in mitochondria and Smac, AIF in cytoplasm (< 0.05), significantly upregulated the protein expressions of Mfn2 in mitochondria and cytoplasmic Bax (< 0.05), and inhibited the phosphorylation level of JNK (< 0.05). After administering JNK activators, the antioxidant and liver protective effects of catechins were significantly reduced (< 0.05, 0.01).Catechin alleviates mitochondrial oxidative stress by inhibiting JNK signaling pathway, thereby antagonizing APAP induced liver injury.
catechin; acetaminophen; liver injury; mitochondrial oxidative stress; JNK signaling pathway
R285.5
A
0253 - 2670(2024)08 - 2589 - 12
10.7501/j.issn.0253-2670.2024.08.010
2023-11-25
國家自然科學基金資助項目(81960748);江西省教育廳科技項目(GJJ211640)
孫武燕,碩士研究生,研究方向為藥物性肝損傷及中藥的保肝活性。E-mail: 1060798172@qq.com
張 娟,碩士研究生,研究方向為藥物性肝損傷及中藥的保肝活性。E-mail: 2103840739@qq.com
通信作者:白慶云,教授,研究方向為藥物性肝損傷及中藥的保肝活性。E-mail: baiqingyun@163.com
[責任編輯 李亞楠]

