鈣調蛋白3在膠質母細胞瘤中潛在的癌基因作用*
付瑤,黃宗瑤,劉洋
610054 成都,電子科技大學 醫學院(付瑤);610041 成都,四川省腫瘤臨床醫學研究中心,四川省腫瘤醫院·研究所,四川省癌癥防治中心,電子科技大學附屬腫瘤醫院 病理科(付瑤、黃宗瑤、劉洋)
膠質母細胞瘤(glioblastoma,GBM;WHO 4級)是最具侵襲性的原發性腦腫瘤,患者中位生存期為14.5~16.6個月[1-4]。GBM的標準治療方法是最大限度安全手術切除和化療或放療,然而在過去的10年中,已有的治療手段不能實現最佳緩解,GBM患者的預后仍然沒有改善[5],治療失敗的主要原因是腫瘤的異質性和浸潤性生長[6-7]。對GBM樣本的遺傳學、轉錄組學和蛋白質組學研究揭示了GBM的分子異質性。膠質母細胞瘤至少可以分為前神經元型、經典型和間充質型[8]。最近的scRNA-seq分析進一步確定了膠質母細胞瘤以不同的細胞狀態存在,包含異質性亞群,包括放射狀膠質樣腫瘤干細胞和少突膠質細胞前體細胞,這些細胞類型與膠質瘤的發生和侵襲有關[9-11]。這些數據集為我們探索和識別GBM發展所必需的新的分子調控因子提供了豐富的資源。鈣調蛋白3(calponin 3,CNN3)屬于肌動蛋白結合蛋白的鈣調蛋白家族,通過與f-肌動蛋白結合影響細胞骨架結構和肌動球蛋白相互作用。在之前的研究中,CNN3已被證明在多種癌癥類型中促進腫瘤進展,如骨肉瘤、宮頸癌、結直腸癌、胃腫瘤和結腸腫瘤,可能是通過促進腫瘤生長、侵襲、轉移和治療抵抗[12-16]。然而,CNN3是否以及如何影響GBM患者的腫瘤發展和預后尚不清楚。因此,在本研究中,我們利用各種公開的多組學數據集系統地評估了CNN3在GBM中的作用,并通過細胞實驗進行驗證。
1 材料與方法
1.1 公共數據集分析
為了對CNN3 mRNA表達進行泛癌分析,我們從UCSC公共中心的GDC泛癌數據庫下載了包含轉錄組譜和預后數據的泛癌隊列(https://xenabrowser.net/datapages/), 從TCGA數據庫(https://cancergenome.nih.gov/)下載批量RNA-seq數據集或微陣列數據和多種腫瘤類型患者的臨床信息,并利用CGGA數據庫(https://cancergenome.nih.gov/)和基因表達綜合數據庫(GEO)(GSE7696)進行進一步分析[17]。隨后,我們使用GEPIA (http://gepia.cancer-pku.cn/)分析TCGA-GBM隊列[18]中各亞型GBM中CNN3 mRNA的表達情況。對于CGGA數據庫,我們進一步按膠質瘤類別提取GBM樣本進行后續生存分析。我們從UCSC Cell Browser(http://gbm.cells.ucsc.edu)下載Bhaduri等[9]已發表的GBM scRNA-seq數據集,并計算每種細胞類型中CNN3的表達。我們利用HPA數據庫(https://www.proteinatlas.org/)分析CNN3和HDAC1蛋白在多種腫瘤類型中的表達。我們從CPTAC(https://proteomics.cancer.gov/programs/cptac)數據庫下載了Wang等[19]已發表的GBM相關的蛋白組學數據,進而分析了在GBM樣本及其配對癌旁樣本中CNN3蛋白水平的表達情況。我們從GEO數據庫下載Lo Cascio等[20]已發表的在膠質瘤干細胞(glioblastoma stem cells,GSCs)通過shRNA 敲低HDAC1基因的RNA-seq數據,包括BT145、BT187和GB3 3種GSCs,并計算各組中CNN3的表達量。
1.2 生存分析
通過對公共數據集中所有樣本的每個CNN3 mRNA表達值進行迭代,獲得最佳截點。采用survminer R包繪制生存曲線。
1.3 相關性分析
我們計算了基因表達之間的Pearson相關系數。采用ggplot2包[21]對散點圖進行可視化。
1.4 基因富集分析
我們首先計算TCGA GBM隊列中每個基因與CNN3的相關性,并通過Pearson相關系數將所有基因按降序排列,作為后續分析的輸入。采用GSEA軟件(v 4.0.3,http://www.broadinstitute.org/gsea)進行GSEA分析。采用P調整值和標準化富集評分量化統計學意義和富集程度。通過GSEA軟件[22]對KEGG通路進行富集分析。
1.5 差異分析
根據CNN3表達值的中位數,將患者分為高表達組和低表達組。然后對兩組數據進行差異分析,獲得在高表達組中表達尤其高的差異表達基因(differentially expressed genes,DEGs),并使用limma R包鑒定[23]。使用log2倍變化(FC)值> 5和校正的P值<0.01來鑒定上調的DEGs。
1.6 基因本體富集分析
使用clusterProfiler R軟件包進行GO富集分析,Benjamini-Hochberg校正P<0.01認為有統計學意義[22]。利用dotplot函數將GO Biological Process富集結果可視化。
1.7 計算上皮-間充質轉化(epithelial-mesenchymal transition,EMT)標志評分
我們從Zeng等[24]發表的研究中收集了EMT特征基因列表。對于給定的樣本,使用基于簽名基因列表的默認參數GSVA包[25]計算ssgsea標準化評分。采用ggplot2包[21,25]對箱線圖進行可視化。
1.8 細胞培養
U87細胞系是一種GBM細胞系,它維持在補充有10% FBS(Gibco;Thermo Fisher Scientific,Inc.),50 U/mL青霉素和50 mg/mL鏈霉素的DMEM(Invitrogen;Thermo Fisher Scientific,Inc.)。將細胞置于含5%CO2的37℃環境中培養。
1.9 shRNA質粒的設計與構建
我們按照多重生物信息規律,設計了兩個寡核苷酸(shRNA1和shRNA2)作為CNN3 mRNA的靶基因,一個寡核苷酸(scramble) 標識對照組構建的亂序序列,作為空白靶基因,不能靶向到人類任何已知基因。CNN3 shRNA 靶向序列示意圖: shRNA1: 5′-GCAGAAGAAGATCTTCGCAAT-3′;shRNA2: 5′-GACCACAATTAGTCTGCAGAT-3′;scramble: 5′-GCAGGTAACGCGACTATAAAT-3′。這些shRNA是由青島生物技術公司(北京)合成的。將shRNA序列克隆到攜帶嘌呤霉素耐藥基因的pLentiV2T載體中。每個shRNA由一個獨特的人類U6啟動子驅動。
1.10 慢病毒組裝和感染U87細胞株
通過磷酸鈣沉淀的方法在293T細胞中組裝并收獲攜帶質粒的慢病毒,并通過Lenti-X Concentrator(Takara)進行濃縮。將U87細胞培養于包被的6孔板中,首先用100 μL攜帶PLKO1-shRNA1、PLKO1-shRNA2或PLKO1-scramble的濃縮慢病毒感染細胞。在含1 μg/mL嘌呤霉素的培養基中進行篩選。qPCR檢測細胞中CNN3的mRNA表達水平。
1.11 RNA提取和qRT-PCR
使用Trizol試劑(Thermo Fisher Scientific)從U87細胞系中純化總RNA。每個樣本2 μg RNA用含gDNase (Tiangen)的FastKing RT Kit逆轉錄成cDNA,在iTaqTMUniversal SYBR Green Supermix(BioRad)中制備,用BioRad CFX96 Touch Real-Time PCR檢測系統進行分析。用于qPCR的引物列表如下: CNN3-cDNA-F(primer1): 5′-GCAGGGATGTTAGCACCAGGTA-3′;CNN3-cDNA-R(primer1): 5′-CTGTTCCTTGGCTTCCGTTGTG-3′;CNN3-cDNA-F(primer2): 5′-TTACGGGACTAGGAGGCATCT-3′;CNN3-cDNA-R(primer2): 5′-CCGGCTGTAATGTTAGCTTCTG-3′;GAPDH-cDNA-F: 5′-CATGGGTGTGAACCATGAGA-3′;GAPDH-cDNA-R: 5′-CAGTGATGGCATGGACTGTG-3′。
1.12 克隆形成試驗
為了測定對照組以及兩種CNN3敲低組(shRNA1 和 shRNA2)在U87 細胞系上的克隆形成能力,每組各2 000個細胞接種于6孔板中,培養至有明顯菌落形成。采用晶體紫染色(Beyotime生物技術),對每個孔中的克隆總數進行計數和比較。每個試驗重復3次。
1.5 治療與隨防 確診CH后立即給予優甲樂(左旋甲狀腺素鈉)替代治療。藥物治療2周后復查血清甲狀腺功能,根據指標調整藥物劑量,并定期隨防。隨防期間給予甲狀腺B超檢查、體格發育和心理發育評估等。PKU患兒給予低/無苯丙氨酸奶粉或食物治療;BH4缺乏癥補充BH4和神經遞質前質(多巴和5-羥色氨),定期隨訪監測血中Phe濃度在理想范圍,并定期評估體格發育、智能發育。其它遺傳代謝病根據具體疾病給予飲食控制、左旋肉堿、維生素B12等。隨防期間定期監測血中相應氨基酸譜、酯酰肉堿濃度,評估體格與智能發育。
1.13 Transwell實驗
在24孔Transwell系統中,通過Transwell?滲透性支撐試驗(聚碳酸酯膜,康寧)評估細胞的侵襲能力。將懸浮于無血清DMEM中的U87細胞(1×105)加入上室,將10% FBS DMEM加入下室。10 h后用多聚甲醛固定,結晶紫染色。將侵襲的細胞在顯微鏡下成像,用圖像測量結晶紫染色強度,每組至少測量6個成像視野并進行比較。
1.14 關鍵基因分層簇中的藥物發現
查詢癌癥藥物敏感性基因組學(genomics of drug sensitivity in cancer,GDSC)數據庫(https://www.cancerrxgene.org),根據CNN3的表達情況,尋找在不同組中表現出不同療效的候選藥物。我們篩選了癌癥細胞系百科全書(CCLE)數據庫(http://portals.broadinstitute.org/ccle)中的所有細胞系,只保留了GBM細胞系。根據CNN3表達值的中位數將所有細胞系分為高、低表達組,比較各組間藥物反應的AUC的差異。
1.15 統計學方法
采用R 4.0軟件進行統計學分析。連續變量比較采用Student’st檢驗。所有P值均為雙側,顯著性標準為P<0.05。在圖中,使用的是標準符號:**P<0.001和***P<0.0001。
2 結 果
2.1 在GBM中CNN3高表達與不良預后相關
我們首先使用TCGA數據庫進行泛癌分析,比較不同腫瘤類型和配對正常組織中CNN3的mRNA表達。CNN3在GBM、低級別膠質瘤、肉瘤和皮膚黑色素瘤中顯著上調(圖1A)。在這些腫瘤中,CNN3在GBM中上調最為顯著,其高水平表達與不良預后相關(圖1B)。我們進一步分別使用CGGA GBM隊列以及Murat等[17]已發表GBM數據進行獨立的驗證,該結果與TCGA結果一致(如圖1C)。在CGGA數據集中,我們還觀察到隨著膠質瘤惡性程度的提高,CNN3表達量也隨之增加的趨勢(圖1D)。考慮到GBM的異質性,我們根據分子類型(包括前神經元型、經典型和間充質型)對TCGA GBM隊列進行了細分,發現CNN3在所有分子亞型均上調(圖1E)。來自單細胞分析的GBM scRNA-seq數據集也表明,CNN3在多種細胞群中高表達,其中包括已被證明在GBM中介導侵襲表型的腫瘤干細胞-類似于胚胎神經干細胞放射狀膠質細胞以及已證明可以作為GBM 起始細胞的少突前體細胞(oligodendrocyte precursor cells,OPC)[9](圖1F)。為了檢驗CNN3在蛋白水平是否也在GBM中上調,我們分析了Wang等[19]和HPA公共數據集的蛋白質組學和免疫組化數據,發現從蛋白水平仍然可以看到CNN3在腫瘤組織中顯著高于匹配的正常組織(圖1G、H)。
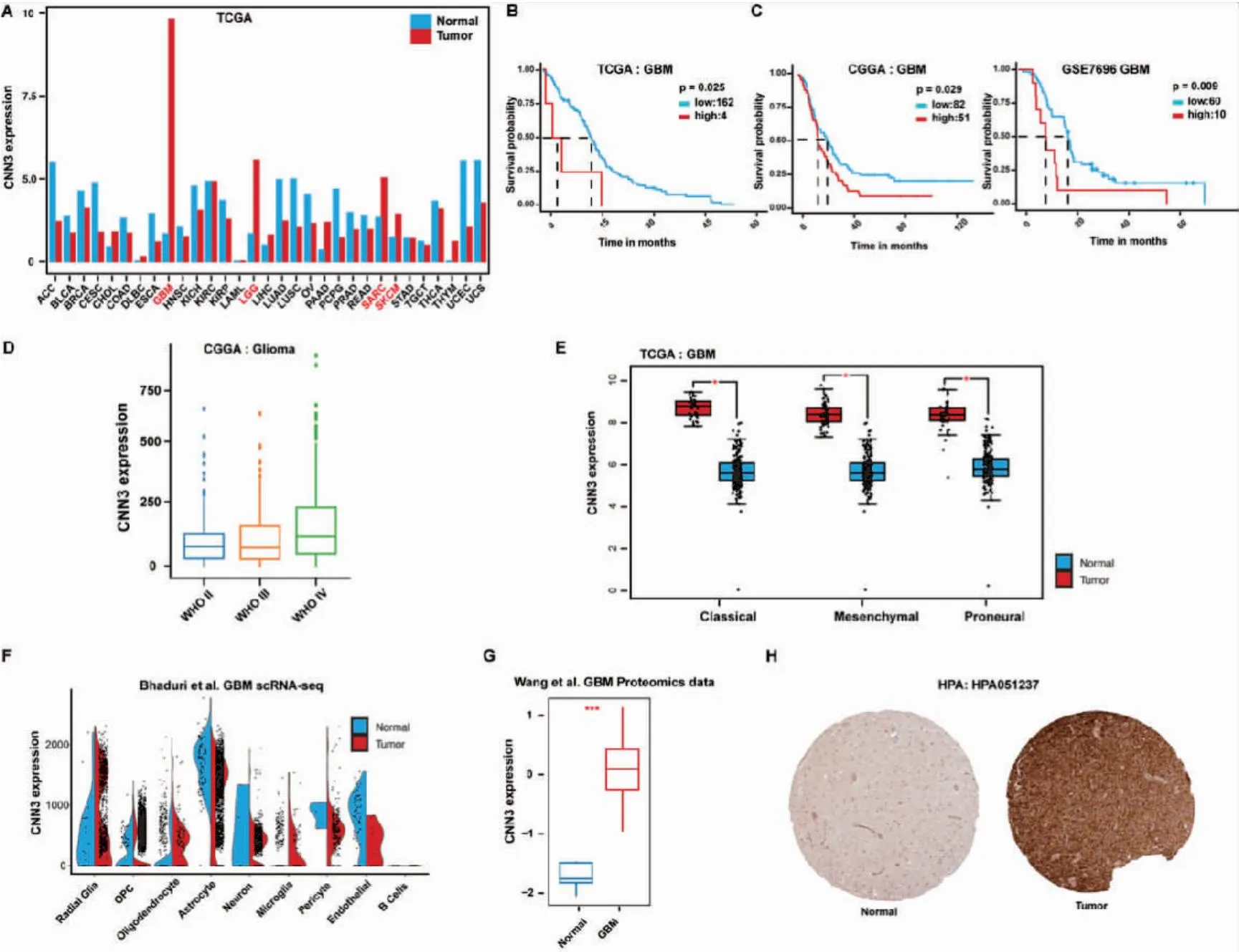
圖1 GBM中CNN3高表達與不良預后相關
2.2 CNN3促進GBM細胞的增殖和侵襲
為了研究CNN3在GBM中的功能,我們鑒定了TCGA GBM樣本中與CNN3表達相關的基因,并進行了GSEA分析。我們發現這些基因在已報道的腫瘤相關通路中富集,包括PI3K_AKT_MTOR信號通路、MAPK信號通路以及腫瘤侵襲和遷移基因集(圖2A)[26-27]。我們進一步分析了CNN3與增殖和侵襲相關的單個基因,如PCNA、VIM、CD44和SMAD1的關系,發現存在強正相關關系(圖2B)。此外,我們對CGGA GBM隊列中CNN3高表達組中高表達基因進行了功能富集分析。這些基因主要參與組蛋白修飾、正向細胞周期調控、EMT生物學過程調控,與GSEA分析一致(圖2C)。我們還發現,在CGGA GBM樣本中,CNN3高表達組的EMT評分遠高于CNN3低表達組(圖2D)。這些數據表明,CNN3的高表達與GBM的增殖和遷移/侵襲增加相關。
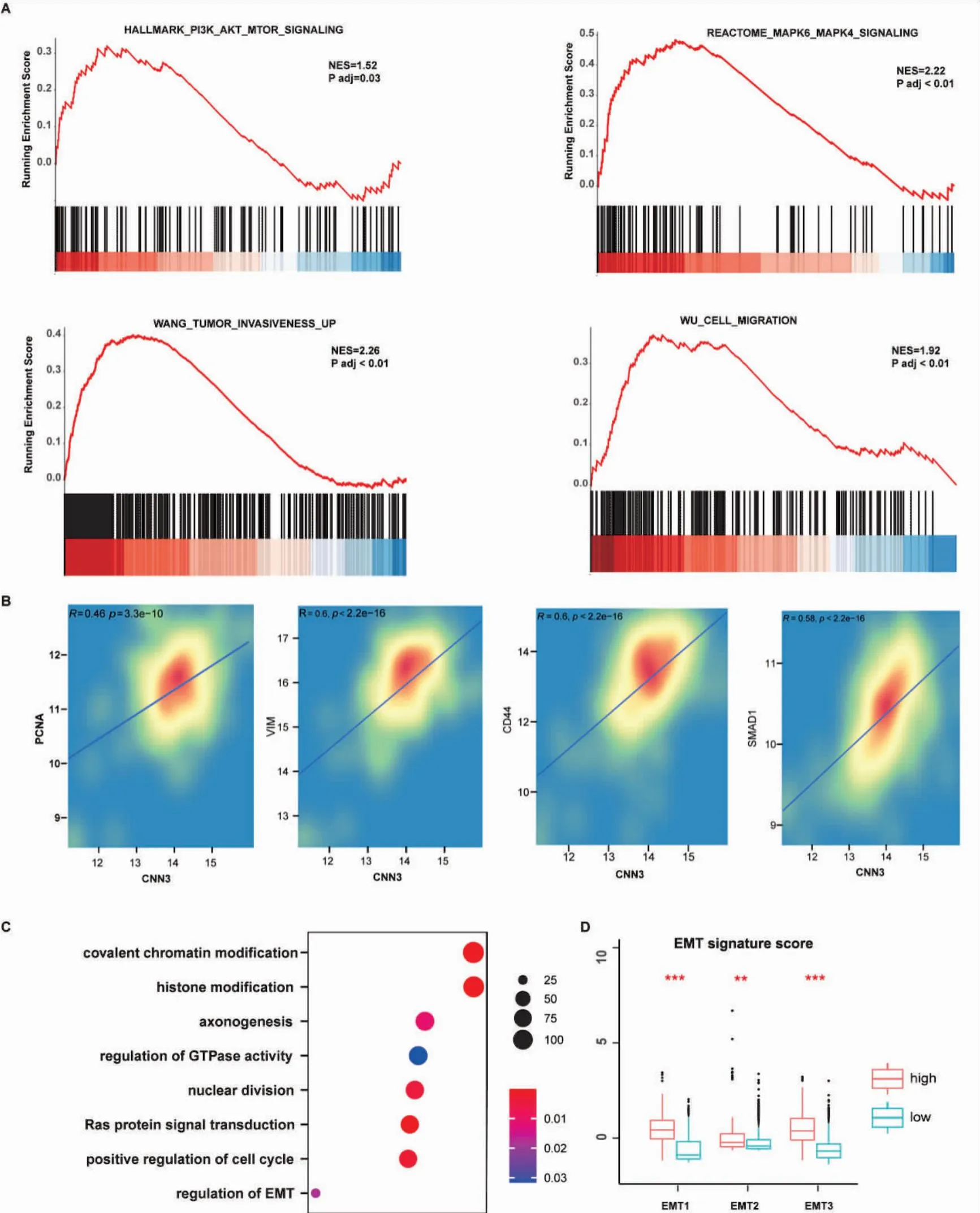
圖2 CNN3促進GBM細胞的增殖和侵襲
為了驗證這一結論,我們在U87 GBM細胞中進行了shRNA敲除實驗。我們設計并選擇了兩個針對CNN3的shRNA,并通過RT-qPCR在U87細胞中驗證了敲除效率(圖3A)。接下來,我們對CNN3敲除組和對照組進行功能分析。克隆形成實驗表明,CNN3敲除的U87細胞的克隆形成能力明顯低于對照組(圖3B,P<0.05)。在Transwell遷移實驗中,與對照組相比,CNN3敲除的U87細胞的遷徙能力明顯低于對照組(圖3C,P<0.05)。這些結果支持CNN3促進GBM細胞的增殖和遷移。
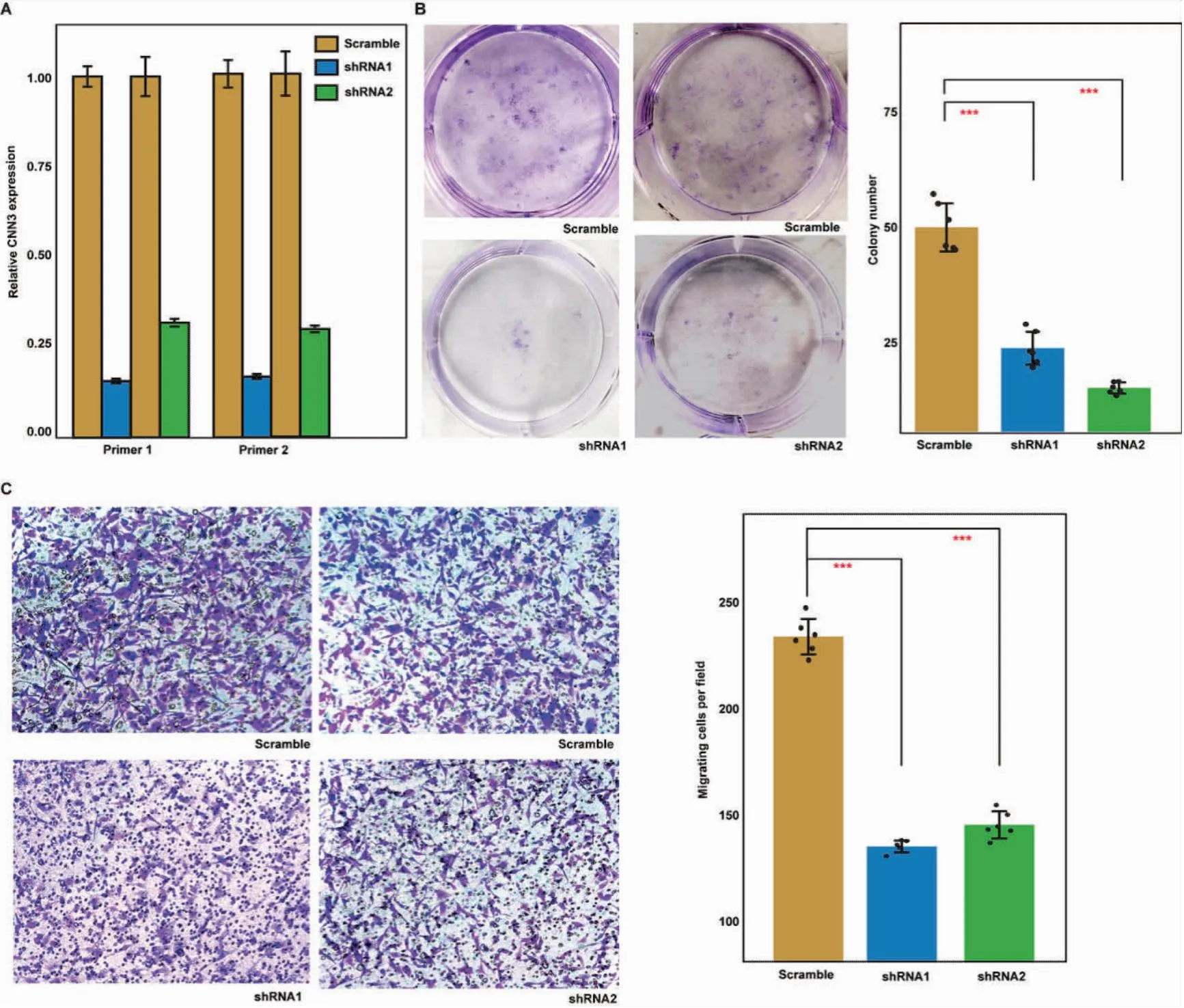
圖3 shRNA敲除實驗和Transwell遷移實驗
2.3 HDAC1是CNN3的候選上游調控基因
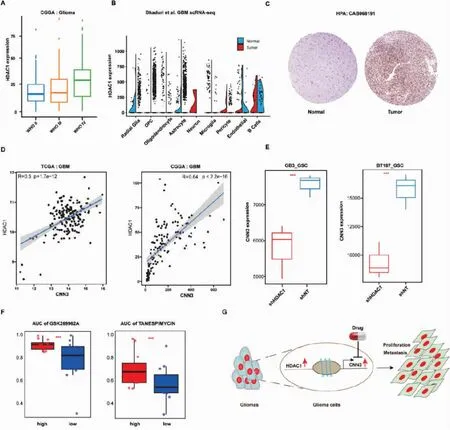
圖4 HDAC1是CNN3的候選上游調控基因
2.4 GBM治療中抗CNN3藥物的預測療效
為了確定GBM治療中可能對CNN3有效的潛在藥物,我們使用了GDSC數據庫中的預測模型。采用劑量-AUC評估藥物反應。在GDSC數據庫中,共有257種化合物在GBM細胞系上進行了測試。在這些化合物中,GSK269962A(一種選擇性ROCK抑制劑)和TANESPIMYCIN(一種由抗腫瘤抗生素格爾德霉素衍生而來的苯醌類抗腫瘤抗生素)被預測對CNN3高表達的GBM細胞最有效(圖4F)。這些結果為CNN3在GBM治療中的潛在靶點提供了見解(圖4G)。
3 討 論
GBM是一種具有高度侵襲性的腦腫瘤,在目前的治療手段下預后較差[5]。治療失敗的主要原因是腫瘤的異質性和浸潤性生長。確定調控膠質瘤細胞增殖和侵襲的分子通路和藥物靶點對延長患者生存期和改善其生活質量至關重要[1-2,7]。
既往的研究表明,CNN3在各種類型的腫瘤中發揮了重要作用。Dai等[12]研究表明,在骨肉瘤組織和細胞系中觀察到CNN3的高表達,CNN3表達沉默可以抑制體內皮下腫瘤生長和肺轉移。Nair等[14]證明CNN3與結腸癌的淋巴結轉移和治療抵抗作用有關。此外,CNN3還被發現可以促進胃癌中阿索魯比辛的細胞入侵和對治療的抵抗作用[13]。Xu等[32]報道,在TCGA中,CNN3的高表達預示著所有膠質瘤的不良預后。然而,該研究沒有區分低級別和高級別膠質瘤,也沒有提供機制分析。由于GBM和低級別膠質瘤是由獨特的驅動突變組合驅動的本質不同的疾病,因此這種全膠質瘤分析的臨床意義有限。此外,在Xie等[33]的研究證實了CNN3對膠質瘤細胞增殖、遷移和入侵的促進作用,但沒有對可能的分子機制進行深入分析以及可能用于GBM治療的靶向治療藥物。
本研究以GBM樣本為研究對象,在轉錄組、蛋白組、單細胞等多維度數據中比較了CNN3在GBM和正常組織中的表達,建立了其在不同GBM亞組和細胞類型中的表達模式,并建立了CNN3高水平表達與GBM不良預后的相關性。我們還功能性驗證了CNN3在促進GBM細胞增殖和侵襲中的作用,并確定了一個潛在的候選分子上游調控因子HDAC1。如果我們進一步在其他細胞系和體內模型中測試HDAC1和CNN3之間的相互作用,將有助于我們的研究。此外,我們預測了兩種小分子藥物的療效,可用于未來GBM的治療。
在本研究中,雖然我們使用多個公共數據庫解釋了CNN3在GBM中的表達模式,并在U87細胞中進行了實驗驗證,但本實驗僅基于細胞系以及公共數據集的分析,未來還需要進一步的實驗來驗證CNN3在動物模型中對腫瘤細胞增殖、侵襲的促進作用,以及上下游基因的敲低對腫瘤增殖、侵襲和對藥物治療的影響。此外,我們利用GDSC數據庫確定了2種可能用于GBM治療的小分子藥物,但需要更多的藥物治療實驗和動物模型來驗證我們的研究結果。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

