靶向人CD70的嵌合抗原受體巨噬細胞制備及其對腎癌的殺傷作用的研究*
張雅婷,杜玉菲,汪樂,肖漪,周一鳴
510120 廣州,中山大學孫逸仙紀念醫院 基礎與轉化醫學研究中心
腎癌每年影響全球近四十萬人,導致超過十萬人死亡,在發達國家的發病率普遍較高[1-2]。根據2022年第五版WHO分類對腎癌進行分類,腎癌可大致分為幾種亞型:透明細胞腎細胞癌、乳頭狀腎細胞癌、嫌色性腎細胞癌、集合管癌、分子定義的腎細胞癌和其他腎細胞癌,主要由生活方式、病史、環境和遺傳風險等致病因素引起[3]。目前腎癌的治療方案主要是在早期癌癥未轉移時進行手術切除,但手術后極有可能發生轉移,五年生存率比較低[4]。涉及手術、放療和化療的傳統治療方法存在重大缺陷,許多患者仍然面臨著復發的結果[5-7]。目前,免疫細胞療法成為癌癥治療的新型治療方案。嵌合抗原受體(chimeric antigen receptor,CAR)作為一種細胞表面受體蛋白,在被嵌入免疫細胞膜后,使免疫細胞具備靶向特定抗原蛋白的能力,CAR的結構由細胞外靶抗原結合域、 跨膜結合域和胞內結構域組成。細胞外靶抗原結合域主要負責識別并特異性結合抗原,識別位點為單克隆抗體的單鏈可變片段(scFv),跨膜結合域負責將CAR的細胞外結構域與細胞內結構域連接起來,胞內結構域由信號轉導結構域和共刺激信號結構域構成[8],主要負責給T細胞提供激活信號。以嵌合抗原受體T細胞(chimericantigen receptor T cell,CAR-T)為主的免疫細胞治療對某些B細胞白血病或淋巴瘤亞群有明顯的臨床反應[9],但研究發現其在實體瘤的應用中仍然存在很大的局限性,這與腫瘤微環境的抑制性和實體瘤本身的異質性有關[10]。一方面,因為腫瘤免疫微環境十分復雜,實體瘤腫瘤微環境相比轉移性腫瘤微環境,具有更強的免疫抑制特性,免疫抑制細胞或抑制因子會限制T細胞的免疫殺傷反應[11-12];另一方面,實體瘤具有高度異質性,對靶向單一抗原的CAR-T細胞療法有很大的限制,免疫細胞向病灶部位的募集減少,同時減少T淋巴細胞對腫瘤的浸潤程度。目前,嵌入CAR分子的巨噬細胞(CAR-macrophage,CAR-M)有望突破實體瘤的治療[13],通過分泌促炎型細胞因子改變腫瘤微環境,從而更好地靶向吞噬腫瘤細胞,同時還能將腫瘤抗原提呈給T細胞,募集和激活T細胞對腫瘤的免疫反應[14]。CD70分子是一種跨膜蛋白,屬于腫瘤壞死因子超家族[15],在腎透明細胞癌中呈高表達狀態,被認為是腎癌的特異性標志物[16-17],靶向CAR-M并有效殺傷CD70高表達的腎癌細胞,是當前腎癌治療的一個新策略。本研究擬構建靶向人CD70蛋白的CAR-M,探討 CAR-M對表達CD70的腎癌細胞的殺傷作用,為CAR-M治療腎癌的臨床應用提供實驗基礎。
1 材料與方法
1.1 材料
1.1.1 細胞株 腎癌細胞系(ACHN、786-O、OS-RC-2)和小鼠巨噬細胞RAW264.7購自武漢普諾賽生物科技有限公司。RAW264.7細胞培養于DMEM高糖培養基,腎癌細胞系(ACHN、786-O、OS-RC-2)培養于RPMI-1640培養基培養,培養基中均加入10%胎牛血清及1%青-鏈霉素溶液,置于37℃、5%CO2的細胞培養箱中培養。
1.1.2 主要試劑和實驗儀器 DMEM高糖、RPMI-1640培養基、胎牛血清均購自美國Gibco公司,慢病毒促感染試劑、CD70-CAR慢病毒、陰性對照病毒購自上海吉凱基因醫學科技股份有限公司,qRT-PCR引物購自廣州生工股份有限公司,流式抗體APC Rat Anti-CD11b購自美國BD公司,RNA快速提取試劑盒購自上海奕杉生物科技有限公司,反轉錄試劑盒和SYBR Green購自日本TaKaRa公司,FACS Canto Ⅱ流式細胞儀購自美國BD公司,實時熒光定量PCR儀購自Roche公司。
1.2 方法
1.2.1 數據庫分析 GEPIA數據庫得到腎癌細胞系相關資料,分析CD70在人體腫瘤組織中的表達情況。
1.2.2 抗CD70 CAR載體構建及鑒定 CD70 scFv序列來源于之前的文獻[18-19],我們通過基因重組技術將抗CD70-scFv、CD8α、4-1BB和CD3zeta合成DNA序列靶向CD70的CAR基因片段。重組質粒構建完成后將其轉化入大腸桿菌,提取質粒后用BamH1內切酶進行酶切、瓊脂糖凝膠鑒定后送檢測序驗證并留存(此質粒命名為CD70-CAR慢病毒質粒),對照組(不含人CD70 scFv序列,NC-CAR)慢病毒采用相同操作驗證。
1.2.3 慢病毒感染構建CAR-M 于96孔板每孔鋪1.0×104個RAW264.7細胞,培養24 h后,每孔加入MOI為50的慢病毒稀釋液和促感染試劑,感染12~16 h后,觀察細胞狀態。若細胞狀態良好,在24 h內更換新鮮培養基,于72~96 h后,在熒光顯微鏡下觀察細胞,看綠色熒光蛋白(green fluorescent protein,GFP)的表達。
1.2.4 流式多克隆分選CAR-M并用qRT-PCR檢測感染效率 擴培慢病毒感染后的CAR-M后,胰酶消化,制備成單細胞懸液,PBS清洗,流式分選儀篩選出GFP陽性細胞,并用流式檢測GFP陽性率。用RNA快速提取試劑盒提取CD70-CAR-M和NC-CAR-M的RNA,逆轉錄成cDNA,采用SYBR Green進行qRT-PCR檢測人CD70-CAR基因的表達情況。引物序列如下:CD70-CAR正向引物序列: 5′-TCGCTCCCGTTTCTCTGTTG-3′,反向引物序列:5′-CTTCTCGGCTTTCCCCCCAT-3′;CD70正向引物序列:5′-AGGAGGGCCATCTGCGTAT-3′,反向引物序列:5′-AGGCGCTGTAATGCCACTG-3′;GAPDH正向引物序列:5′-GGAGCGAGATCCCTCCAAAAT-3′,反向引物序列:5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.2.5 CD70-CAR-M對腎癌細胞系類器官的體外殺傷實驗 將1.0×104個腎癌細胞加入96孔V型細胞培養板進行3D懸浮培養48 h,使細胞聚合成球體,拍照記錄球體變化,第3天以1∶1的比例分別加入NC-CAR-M和CD70-CAR-M。共培養3天后,顯微鏡拍攝記錄白光和熒光圖片,小心取出類器官,用Accutase消化液在37 ℃消化30 min,期間用移液器不斷吹打,使其盡可能消化成單細胞懸液,PBS清洗,1 000 rpm離心5 min,加入5 μL CD11b抗體,混勻放置冰上,避光孵育30 min,再次用PBS清洗,洗去抗體,加入200 μL PBS,流式細胞儀上機檢測熒光。檢測結果采用FlowJo軟件分析。
1.2.6 Transwell共培養實驗 將3.0×105個RAW 264.7、CD70-CAR-RAW264.7和NC-CAR-RAW264.7分別接種在Transwell小室底面培養,加入高糖DMEM培養基,將3.0×104個786-O接種在小室內,加入RPMI-1640培養基,小室內外培養基液面齊平,共培養3天后,收集RAW264.7、NC-CAR-RAW264.7和CD70-CAR-RAW264.7細胞,提取RNA并逆轉錄進行qRT-PCR檢測巨噬細胞的表型變化。
1.3 統計學方法
采用SPSS 26.0和GraphPad Prism 9.0,均進行3次重復實驗,取其均數進行統計分析。符合正態分布的組間采用獨立樣本t檢驗,P值<0.05為差異具有統計學意義(*P<0.05,**P<0.01,***P<0.001)。
2 結 果
2.1 CD70分子在腎癌細胞系中高表達
GEPIA數據庫中顯示CD70在腎癌中表達水平顯著高于其他癌癥類型,但是對患者的生存率無明顯影響。這些結果提示CD70可能為腎透明細胞癌的診斷標記物及識別靶點(圖1A~C),通過qRT-PCR驗證發現相較于ACHN和OS-RC-2,786-O的CD70表達水平最高 (圖1D),提示CD70可以作為腎透明細胞癌特異性的作用靶點。

圖1 CD70在不同癌癥中的表達情況
2.2 設計和構建人CD70-CAR慢病毒表達質粒
慢病毒載體利用的是pLV-EF1α-EGFP-WPRE質粒,由EF1α作為啟動子,并同時表達GFP(圖2A)。CD70-CAR的基因片段組成依次為:CD8α信號肽、CD70-scFv、CD8α鉸鏈區、CD8α跨膜區、CD28、4-1BB和CD3zeta分子信號分析(圖2B)。NC-CAR序列由慢病毒空載體構建,GFP通過P2A鏈接和CAR的序列鏈接,目的是讓表達CAR的細胞會同時表達綠色熒光,用于后期的鑒定和篩選。
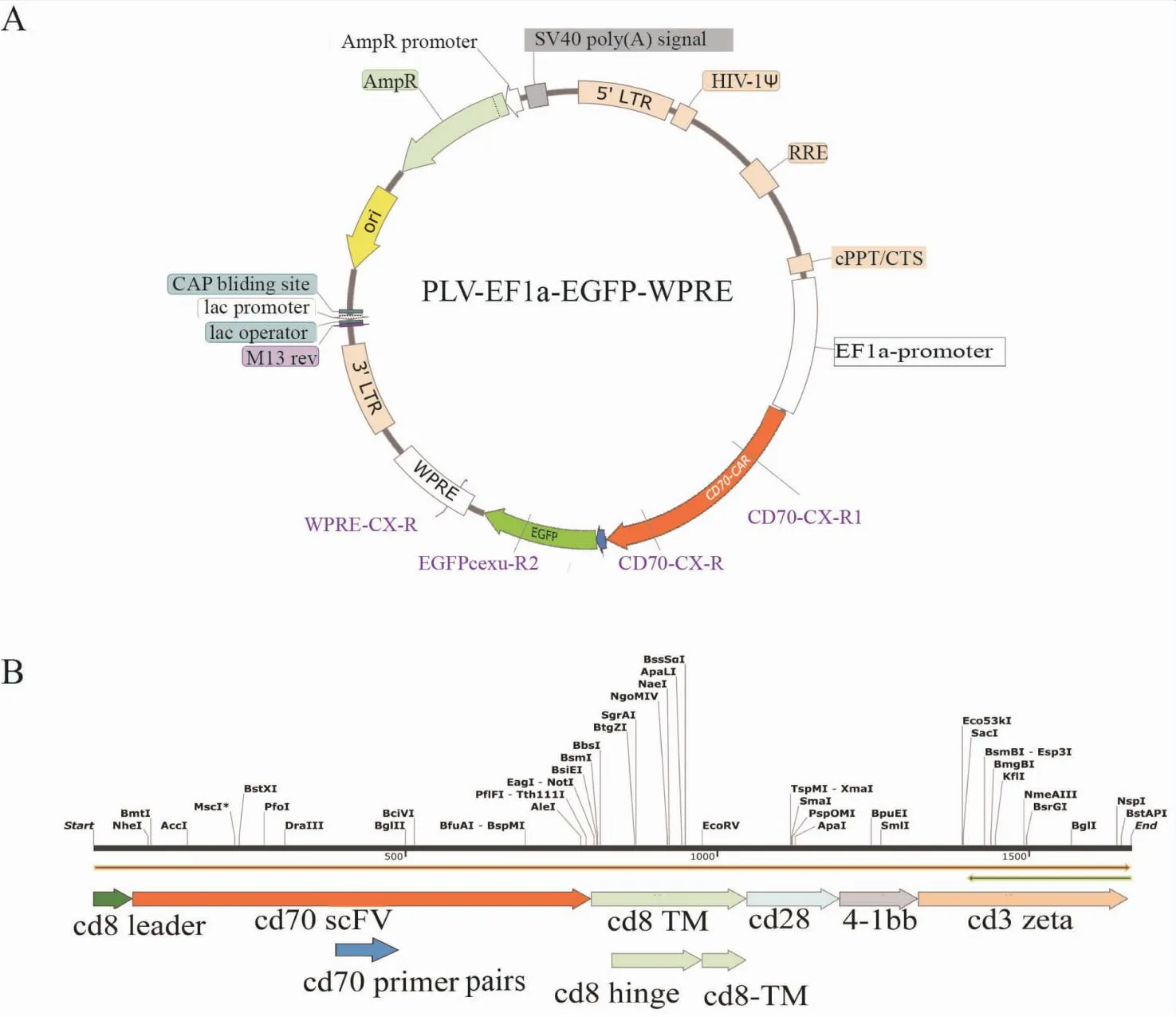
圖2 慢病毒載體質粒和CD70-CAR結構示意圖
2.3 成功構建CD70-CAR-M細胞
利用滴度MOI為50的對照和CD70-CAR慢病毒感染小鼠巨噬細胞RAW264.7,制備NC-CAR-M和CD70-CAR-M,熒光顯微鏡下可見,NC-CAR-M和CD70-CAR-M帶有綠色熒光(圖3),經過流式分選出GFP陽性細胞培養后,用流式細胞術檢測 NC-CAR和CD70-CAR慢病毒的感染效率可達80%以上(圖4A~B)。通過qRT-PCR檢測了CD70-CAR基因在NC-CAR-M和CD70-CAR-M中的表達情況,我們發現其在CD70-CAR-M中特異性高表達,證明CD70-CAR-M細胞構建成功(圖4C)。
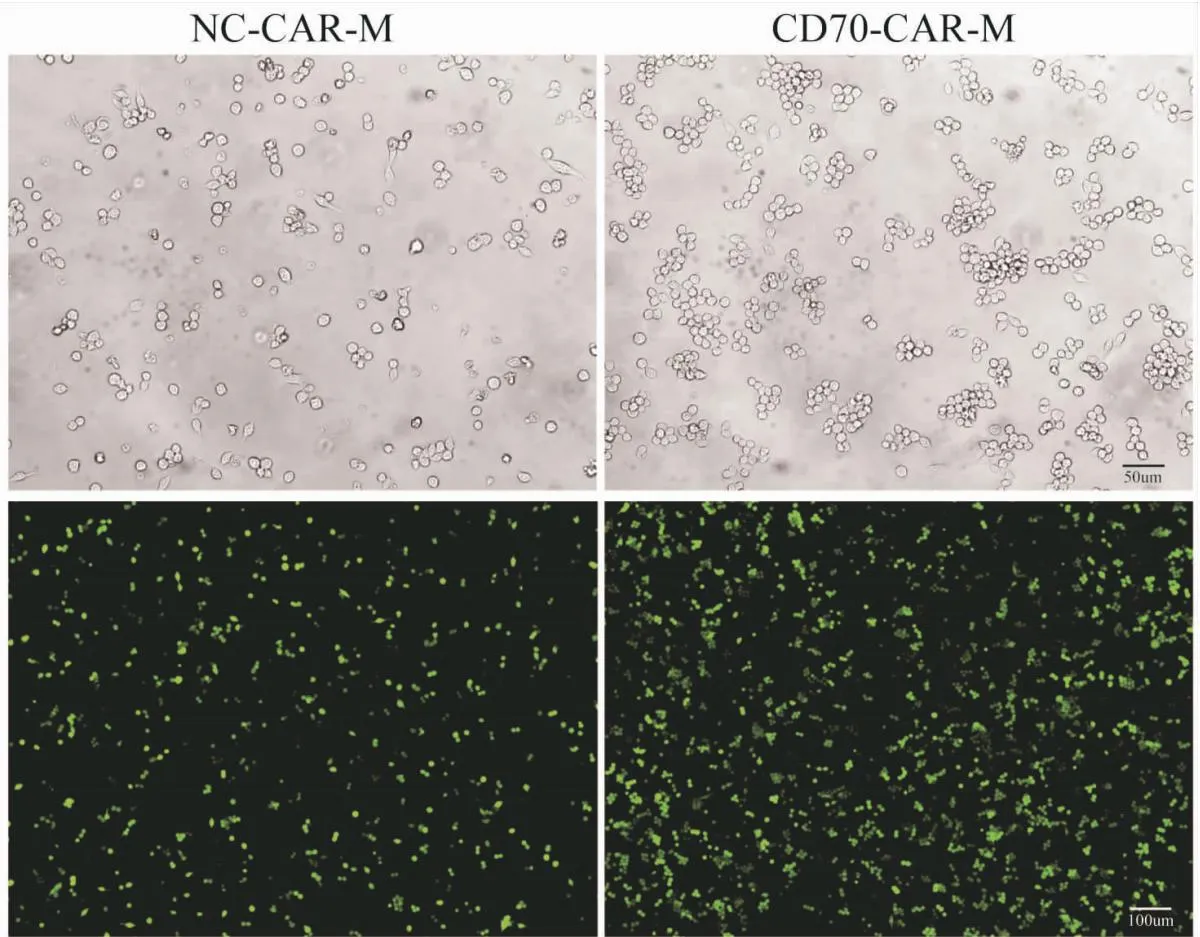
圖3 CD70-CAR慢病毒感染RAW264.7細胞
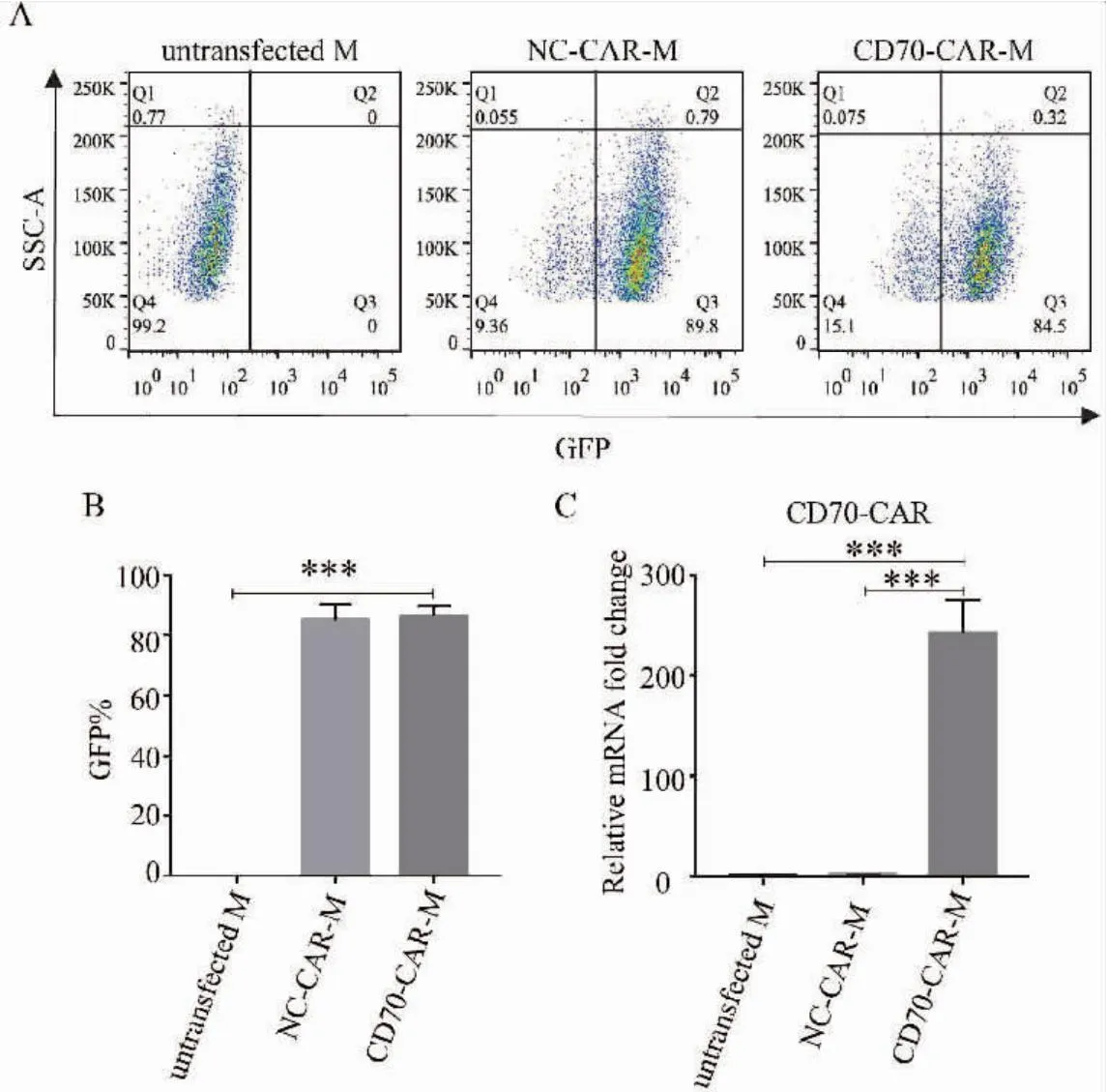
圖4 流式和qRT-PCR檢測CD70-CAR-M
2.4 嵌入CD70-CAR分子引起巨噬細胞的標志基因改變
將Transwell小室放入六孔培養板中,上室內培養786-O細胞,下室內培養巨噬細胞,上下層培養液以聚碳酸酯膜相隔。共培養3天后,收集下層巨噬細胞并提取其RNA逆轉錄后進行qRT-PCR檢測。我們發現相較于NC-CAR-M組,CD70-CAR-M組的TNF-α顯著性上調而TGF-β顯著性下調(圖5),說明巨噬細胞表達CD70的CAR后向促炎型巨噬細胞方向分化。
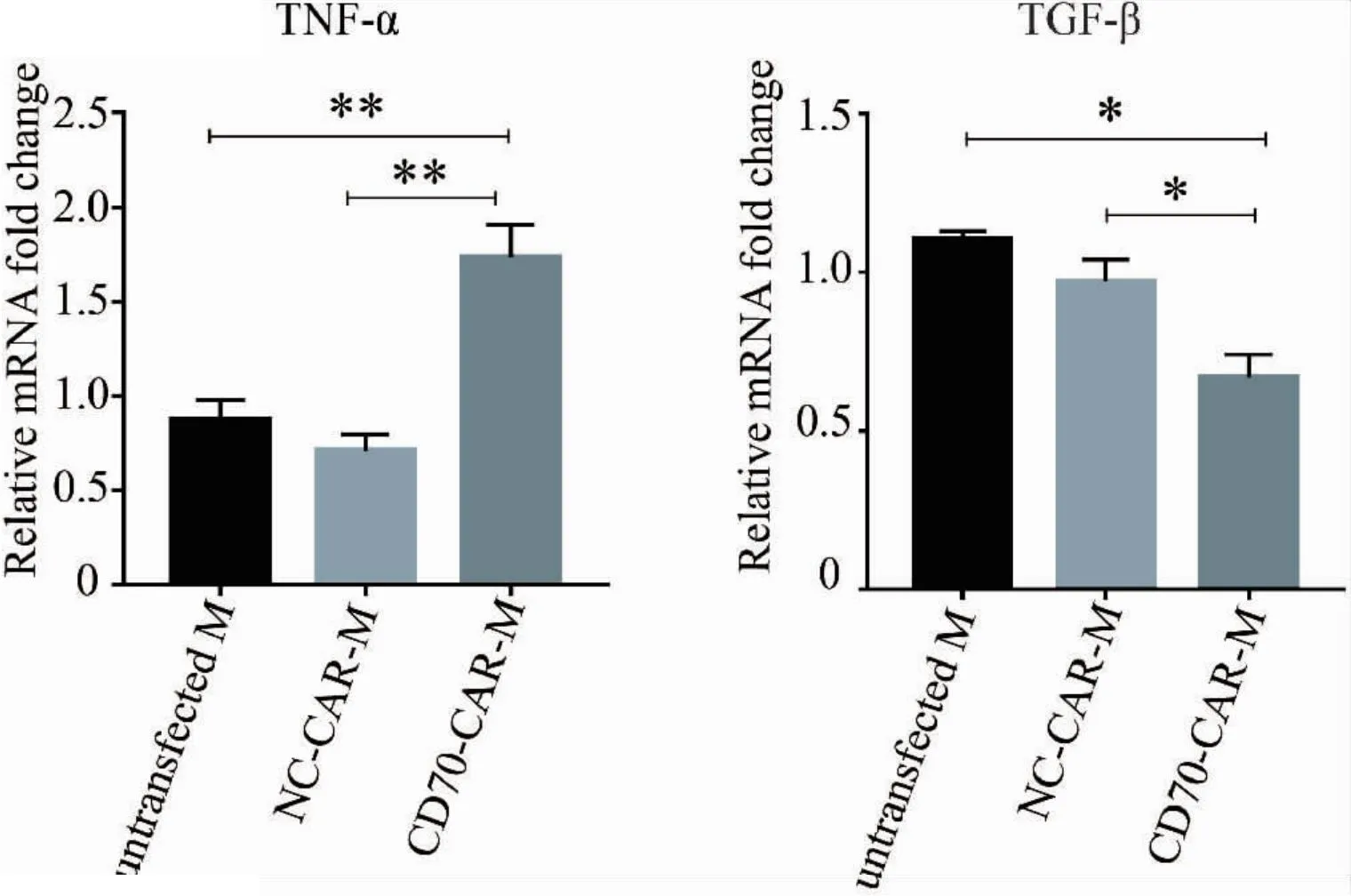
圖5 qRT-PCR檢測CAR-M中細胞因子的表達水平變化
3D細胞培養利用V型細胞培養板,是一種可以模擬細胞在體內的生長狀況及環境,使細胞在體外條件下進行三維生長的培養方法,能更加準確的檢測CD70-CAR-M的殺傷效果。我們將1.0×104個不同類型的腎癌細胞,包括786-O、ACHN和OS-RC-2分別鋪于96孔V型細胞培養板,培養兩天后,觀測到細胞形成球形腫瘤類器官。在第3天按1∶1的比例分別加入NC-CAR-M和CD70-CAR-M細胞繼續培養,共培養5天后,在光學和熒光顯微鏡下觀察腫瘤球體的形態變化(圖6)。和加入了NC-CAR-M相比,加入CD70-CAR-M的腫瘤球體結構更加松散,提示CD70-CAR-M巨噬細胞能更好地浸潤到CD70表達高的靶點腫瘤球體內部結構,具有更好的殺傷效果。共培養后將腫瘤類器官解離成單細胞懸液并計數,流式檢測出巨噬細胞所占比例(圖7),計算腫瘤細胞存活數量,發現相比對照組,786-O的細胞數量明顯減少,說明CD70-CAR-M對786-O有明顯的殺傷效果。

圖6 和CAR-M共培養后不同腎癌細胞的形態
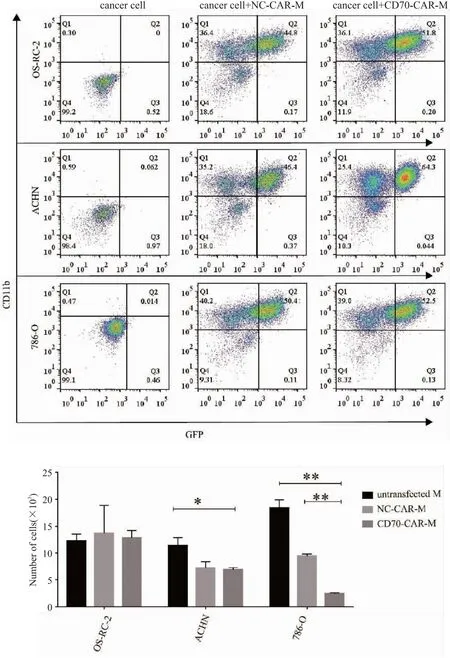
圖7 CD70-CAR-M顯著降低腎癌細胞的數量
3 討 論
腎癌包括多種不同類型,具有不同的組織學、臨床過程和治療反應的特征,主要作為實體瘤治療,具有一定的困難性,因此,找到更為創新有效的腎癌治療方法尤為重要,目前研究表明免疫細胞療法在治療腫瘤中具有很大的前景。
過繼細胞療法是一種針對癌癥的細胞免疫療法,利用來自人體自身免疫系統的細胞來消除癌癥,目前主流和新興的細胞免疫療法包括TIL、TCR-T、CAR-T、CAR-NK、CAR-M、DC、iNKT等。CAR免疫細胞療法是將患者的T細胞導入CAR,構建出穩定的CAR-T細胞,回輸至患者體內,從而殺死腫瘤細胞。但CAR-T細胞對于一些實體瘤治療效果并不理想[20],治療實體腫瘤的CAR-T細胞治療的主要挑戰之一是CAR-T細胞滲透到腫瘤腫塊中的效率低下。目前,研究表明嵌合抗原受體巨噬細胞療法已經取得臨床進展,HER2-CAR-M(CT-0508)是用人類表皮生長因子受體2(human epidermal growth factor receptor,HER2)為靶點,主要針對HER2陽性的實體瘤患者治療,2020年7月,CT-0508細胞療法獲FDA批準開展I期多中心臨床實驗研究,2021年3月,CAR-M細胞療法首次用于人體研究[21],Carisma公司完成首例靶向HER2的CAR-M細胞療法(CT-0508)受試者給藥。CAR-M在實體瘤治療領域中帶來了嶄新的希望。
CD70是一種在惡性腫瘤和實體腫瘤中被調節的泛癌靶標,使其成為CAR細胞療法具有吸引力的治療靶標,在本研究中,構建了靶向CD70的CAR-M細胞系,在體外利用3D培養技術,充分驗證了CAR-M的殺傷和吞噬效率,在3D培養過程中,我們發現,根據CD70表達水平的差異,CAR-M細胞對腎癌類器官有不同程度的浸潤,共培養后786-O的結構更加松散,此外,在共培養后我們發現CD70-CAR-RAW264.7可以促使巨噬細胞增加TNF-α表達,同時減少TGF-β表達,使其向促炎型巨噬細胞分化,從而具備更充分的腫瘤殺傷微環境。靶向CD70的CAR-M構建為腎癌治療提供了新的治療途徑,對786-O顯現出有效的殺傷腎癌細胞的作用,綜上所述,CAR-M在驅動實體瘤的抗癌免疫方面具有巨大潛力。然而CAR-M治療也面臨一些尚未解決的難題,巨噬細胞是細胞因子風暴的主要來源,可導致細胞因子釋放綜合征[22],由于巨噬細胞分布在全身,使用CAR-M可能會導致脫靶毒性并限制療效。然而在本研究中,靶向CD70的CAR-M對ACHN和OS-RC-2殺傷作用不顯著,在光學顯微鏡下觀察到其吞噬作用不強,與之前報道的文獻靶向HER2的CAR-M細胞療法殺傷效果有一定的差異,一方面,這個結果或許跟CD70的scFv的序列級或者腫瘤細胞自身特性相關,另一方面,也可能和體外實驗的條件相關,相比786-O,3D培養條件下的OS-RC-2成瘤效率不是很好。因此,需要進一步研究和優化CD70-CAR-M效率并確保其安全性。雖然CAR-M技術作為癌癥免疫療法仍處于發展的早期階段,仍然存在很大的挑戰,但巨噬細胞作為治療劑的潛力仍在繼續挖掘和探索,關于這一領域的新突破將對各種疾病的新療法的發展產生重大影響。
總之,本研究結果表明CD70-CAR-M在治療CD70陽性的腎癌上具有一定的臨床潛力,并為實體瘤治療帶來了新的希望。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

