雙頻超聲波處理對蛋白酶活性的影響
何靈芝,簡顯瑀,王達川,金建
1.四川保寧醋有限公司(閬中 637400);2.西南科技大學生命科學與工程學院(綿陽 621000)
醬油因其特有的風味和營養價值受到全球人民的追捧[1]。我國的醬油生產歷史十分悠久,國內主要在生產工藝優化[2-3]與新型原材料開發利用[4]、智能監控醬油發酵[5-6]、優良米曲霉菌株選育[7]和多菌種協同作用改善風味[8-9]等方面探索醬油釀造的新方向。
醬油發酵過程中由米曲霉產生的蛋白酶能有效分解原料中的蛋白質大分子,使醬油中的營養物質更易被人體吸收,同時賦予醬油其獨特的風味并保證醬油的品質[10-11]。提高酶活性可以加速物質的轉化,國內外開展了一系列處理技術的研究,如超聲波處理[12]、強電場處理[13]、輻照處理[14]、高壓處理[15]和化學試劑處理[16]。超聲波作為一項新興的物理加工處理技術,相對安全、操作簡單、經濟環保,被廣泛運用于活性產物輔助提取[17-18]和食品加工[19]。荊卉等[20]闡述了超聲波的物理、化學效應以及蛋白質改性相關方面的研究進展。Tra等[21]研究發現,優化超聲波處理條件后,α-淀粉酶活性可提高47%,在一定程度上為米曲霉所產蛋白酶的超聲波處理提供了借鑒。
醬油生產工藝分為低鹽固態發酵和高鹽稀態發酵。在稀態發酵過程中,若采用新型物理加工技術,可縮短醬油發酵周期和提高原料利用率。因此,試驗探討低強度雙頻超聲波處理對米曲霉代謝產生的蛋白酶活性影響,為新技術在傳統發酵食品中的應用提供一定借鑒。
1 材料與方法
1.1 材料與儀器
米曲霉、麩皮、豆粕(四川保寧醋有限公司);福林酚(生化試劑,上海藍季科技發展有限公司);三氯乙酸,分析純,福晨(天津)化學試劑有限公司;其他試劑均為分析純,成都金山化學試劑有限公司。
HH-8數顯恒溫水浴鍋(常州市金壇華特實驗儀器有限責任公司);KH-300SP雙頻數控超聲波清洗器(昆山禾創超聲儀器股份有限公司);Centrifuge 5425R德國艾本德高速冷凍離心機(艾本德中國有限公司);HZQ-160F全溫振蕩培養箱(上海齊欣科學儀器有限公司);V-5600(PC)紫外可見分光光度計,上海元析儀器有限公司。
1.2 試驗方法
1.2.1 米曲霉蛋白酶粗酶液的制備與提取
1.2.1.1 米曲霉的培養
制備PDA培養基,滅菌后趁熱倒平板。稱取0.1 g米曲霉菌粉于100 mL滅菌生理鹽水中,在無菌環境中振蕩20 min使之混合均勻,用移液槍吸取1 mL米曲霉液于9 mL生理鹽水的試管中,振蕩混合均勻后,重復上述操作步驟按梯度稀釋。取0.1 mL最終稀釋米曲霉酶液,用滅菌后的涂布器均勻涂抹平板,在30 ℃恒溫條件下倒置培養3 d。
1.2.1.2 孢子懸浮液的制備
用100 mL在121 ℃下滅菌20 min的生理鹽水將平板上的成熟米曲霉孢子洗脫,并用滅菌脫脂棉進行過濾,從而除去洗脫液中的菌絲體,將孢子懸浮液裝入無菌錐形瓶中,振蕩20 min使之達到混合均勻的效果。
1.2.1.3 米曲霉的搖瓶培養
取2 mL米曲霉孢子懸浮液入滅菌后的麩皮豆粕培養基中,在28 ℃恒溫條件下培養4 d并每隔16 h抖動錐形瓶進行1次翻曲[22]。
1.2.1.4 蛋白酶粗酶液的提取
取100 mL磷酸緩沖液于麩皮豆粕培養基中,在40℃下恒溫水浴攪拌1 h,用濾紙過濾,并在4 000 r/min條件下離心20 min,取其上清液,即為米曲霉產生的蛋白酶粗酶液。
1.2.2 蛋白酶活力的測定
1.2.2.1 蛋白酶活力單位的定義
蛋白酶在pH 7.5和溫度40 ℃條件下,1 min內水解酪蛋白產生1 μg酪氨酸的酶量為1個酶活力單位,用U表示。
1.2.2.2 蛋白酶活力的測定
移取1 mL蛋白酶液于試管中,在40 ℃下恒溫水浴5 min,加入2 mL質量分數2%的酪蛋白溶液,混勻并在40 ℃下恒溫水浴反應15 min,加入3 mL 10%三氯乙酸,室溫靜置20 min后以4 500 r/min離心20 min(4℃)。吸取1 mL上清液,加入5 mL 0.55 mol/L碳酸鈉溶液和0.5 mL福林酚試劑,在40 ℃下恒溫水浴20 min顯色,并在波長680 nm處測定吸光度。
1.2.2.3 蛋白酶活力計算
蛋白酶活力按式(1)計算。
式中:X為蛋白酶活力,U/mL;A為試驗組的吸光度;A0為空白對照的吸光度;0.002 9為標準曲線截距;0.010 4為標準曲線斜率;15為酶解反應時間,min;n為粗酶液稀釋的倍數。
1.2.3 單因素試驗
1.2.3.1 超聲波處理時間對蛋白酶酶活的影響
取50 mL酶液于500 mL燒杯中,加入200 mL磷酸緩沖液(pH 7.5)。固定超聲處理溫度20 ℃、25 kHz與40 kHz超聲工作時間比10∶50(s/s)、超聲功率密度50 W/L,分別超聲處理0,5,10,15,20和30 min,處理結束后,取1 mL酶液測定酶活。每個水平重復3次試驗,每次重復平行測定3次酶活。
1.2.3.2 超聲功率密度對蛋白酶酶活的影響
取50 mL酶液于500 mL燒杯中,加入200 mL磷酸緩沖液(pH 7.5)。固定25 kHz與40 kHz超聲工作時間比10∶50(s/s)、超聲處理溫度20 ℃,分別在超聲波功率密度25,50,100,125和150 W/L下處理10 min。其余操作同1.2.3.1。
1.2.3.3 超聲波處理介質溫度對蛋白酶酶活的影響
取50 mL酶液于500 mL燒杯中,加入200 mL磷酸緩沖液(pH 7.5)。固定25 kHz與40 kHz超聲工作時間比10∶50(s/s)、超聲功率密度25 W/L,分別在介質溫度15,20,25,30和40 ℃下超聲波處理10 min。其余操作同1.2.3.1。
對照組(恒溫水浴):取50 mL酶液于500 mL燒杯中,加入200 mL磷酸緩沖液(pH 7.5),在恒溫(15,20,25,30和40 ℃)水浴下保溫10 min。
1.2.3.4 雙頻超聲波工作時間比對蛋白酶酶活的影響
取50 mL酶液于500 mL燒杯中,加入200 mL磷酸緩沖液(pH 7.5)。固定超聲溫度25 ℃、超聲功率密度25 W/L,分別在25 kHz與40 kHz超聲工作時間比10∶50,10∶20,20∶30,10∶10,30∶20,20∶10(s/s)的參數下處理10 min。其余操作同1.2.3.1。
1.2.4 正交試驗設計
基于超聲處理各個單因素試驗結果,選取單因素的優水平及相鄰的2個水平,按照L9(34)正交表對超聲處理工藝參數進行試驗,因素與相關水平見表1。

表1 正交試驗設計因素水平表
1.2.5 最佳超聲波處理工藝驗證
試驗組:取50 mL酶液于500 mL燒杯中,加入200 mL磷酸緩沖液(pH 7.5)。設定超聲波處理溫度20 ℃、超聲功率密度25 W/L、25 kHz與40 kHz超聲波工作時間比20∶30(s/s),處理10 min后,取1 mL酶液,測定吸光度并計算酶液的酶活力。
對照組以恒溫水浴代替超聲波處理。處理結束后,分別取1 mL酶液,按照酶活力的測定步驟進行操作,測定吸光度并計算酶液的酶活力。
1.2.6 數據處理與分析
所有試驗均重復3次,每次重復平行測定3次。數據處理與圖形繪制采用Excel軟件,結果用“平均值±標準差”表示,統計檢驗設定顯著性水平α=0.05(n=9)。
2 結果與分析
2.1 單因素試驗結果
2.1.1 超聲波處理時間對蛋白酶活性的影響
固定超聲處理溫度20 ℃、25 kHz與40 kHz超聲工作時間比10∶50(s/s)、超聲功率密度50 W/L,超聲波處理時間對蛋白酶活性的影響見圖1。
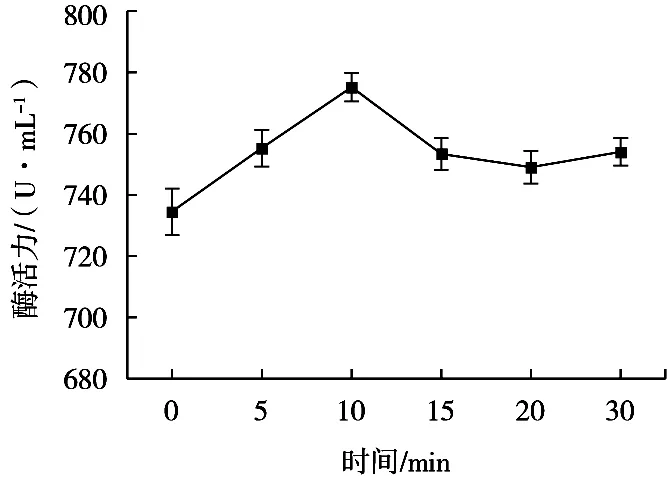
圖1 超聲波處理時間對蛋白酶活性的影響
隨著超聲波處理時間的延長,蛋白酶活性先增強后逐漸減弱。超聲波處理時間10 min時,酶活性到達最大值。超聲波空化效應引起的綜合作用,如局部高溫高壓、微射流和剪切力等會導致蛋白酶催化活性中心暴露,進而酶活性增強[12]。然而,長時間的超聲波處理可導致蛋白酶的變性,從而酶活性減弱[23]。
2.1.2 超聲波功率密度對蛋白酶活性的影響
固定超聲處理溫度20 ℃、25 kHz與40 kHz超聲工作時間比10∶50(s/s)、超聲處理時間10 min,超聲波功率密度對蛋白酶活性的影響見圖2。
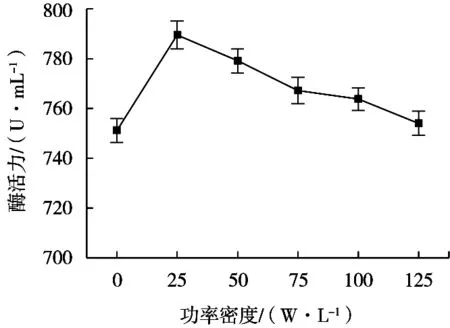
圖2 超聲波功率密度對蛋白酶活性的影響
隨著超聲波處理功率密度的增大,蛋白酶活性先增強后逐漸減弱,超聲波功率密度25 W/L時,酶活性達到最大值。超聲功率密度增大,超聲波引起的空化效應足以使蛋白酶空間構象發生變化,有利于酶與底物接觸,從而發揮催化作用,故而酶活性加強。然而,隨著超聲波處理功率密度繼續增大,蛋白酶的空間構象朝著不利于催化的方向變化,或者酶分子發生變性,活性喪失,酶活減弱[20,24]。
2.1.3 超聲波處理介質溫度對蛋白酶活性的影響
固定超聲波處理功率密度25 W/L、25 kHz與40 kHz超聲工作時間比10∶50(s/s)、超聲處理時間10 min,超聲波處理介質溫度對米曲霉產的蛋白酶活性的影響見圖3。
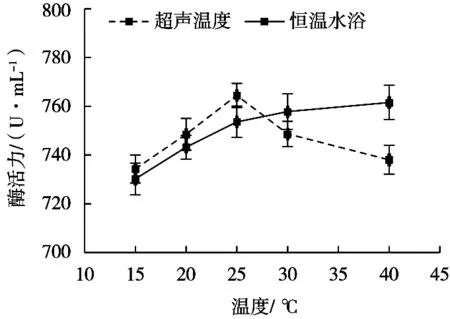
圖3 超聲波處理介質溫度對蛋白酶活性的影響
在相同溫度條件下,恒溫水浴下的蛋白酶活性隨溫度升高而增強,在恒溫水浴30 ℃條件下,蛋白酶活性趨于穩定[25-26]。與恒溫水浴處理相比,相同介質溫度下,超聲波處理后的酶活性先增強后逐漸減弱,超聲波處理溫度25 ℃時,蛋白酶活性最強且高于恒溫水浴處理下的酶活性。超聲波處理溫度低于25 ℃時,液體溫度越高,對空化效應的產生越有利,蛋白酶空間構象的變化越明顯,有利于酶與底物接觸,故而酶活性加強。但當超聲波處理溫度高于25 ℃且溫度逐步上升時,液體氣泡中蒸汽壓增大,因此氣泡閉合時增強了緩沖作用而使空化效應減弱[27],蛋白酶空間構象的變化減小,故而酶活性減弱。
2.1.4 雙頻超聲波工作時間比對蛋白酶活性的影響
固定超聲波處理功率密度25 W/L、超聲處理時間10 min、超聲波處理溫度25 ℃,雙頻率超聲波工作時間比對蛋白酶活性的影響見圖4。

圖4 雙頻超聲波工作時間比對蛋白酶活性的影響
25 kHz與40 kHz超聲工作時間比20∶30(s/s)處理蛋白酶活性高且穩定,蛋白酶活性隨著25 kHz頻率超聲波時間占比的增加大體上符合先增強后逐漸減弱的趨勢。超聲波頻率越低,在液體中產生空化越容易[28]。頻率越高,空化氣泡越小,空化強度越弱[29]。隨著25 kHz超聲波時間占比的增加,空化強度增大[30],蛋白酶空間構象的變化越明顯,故而酶活性加強。但當25 kHz超聲波時間占比繼續增大時,空化效應產生的大氣泡更易形成表面振蕩,小空化泡的非球形擾動主要發生在崩潰階段,易促使空化泡潰滅[31-32],從而降低空化強度,蛋白酶空間構象的變化減弱,故而酶活性減弱。
2.2 正交試驗結果
正交試驗結果見表2。各因素對蛋白酶活性的影響效果由大到小依次排序為超聲溫度(A)>工作時間比(C)>超聲時間(B)。直觀分析得出的最優組合為A1B2C2,即超聲波處理溫度20 ℃,超聲波處理時間10 min,25 kHz與40 kHz超聲波工作時間比20∶30(s/s)。
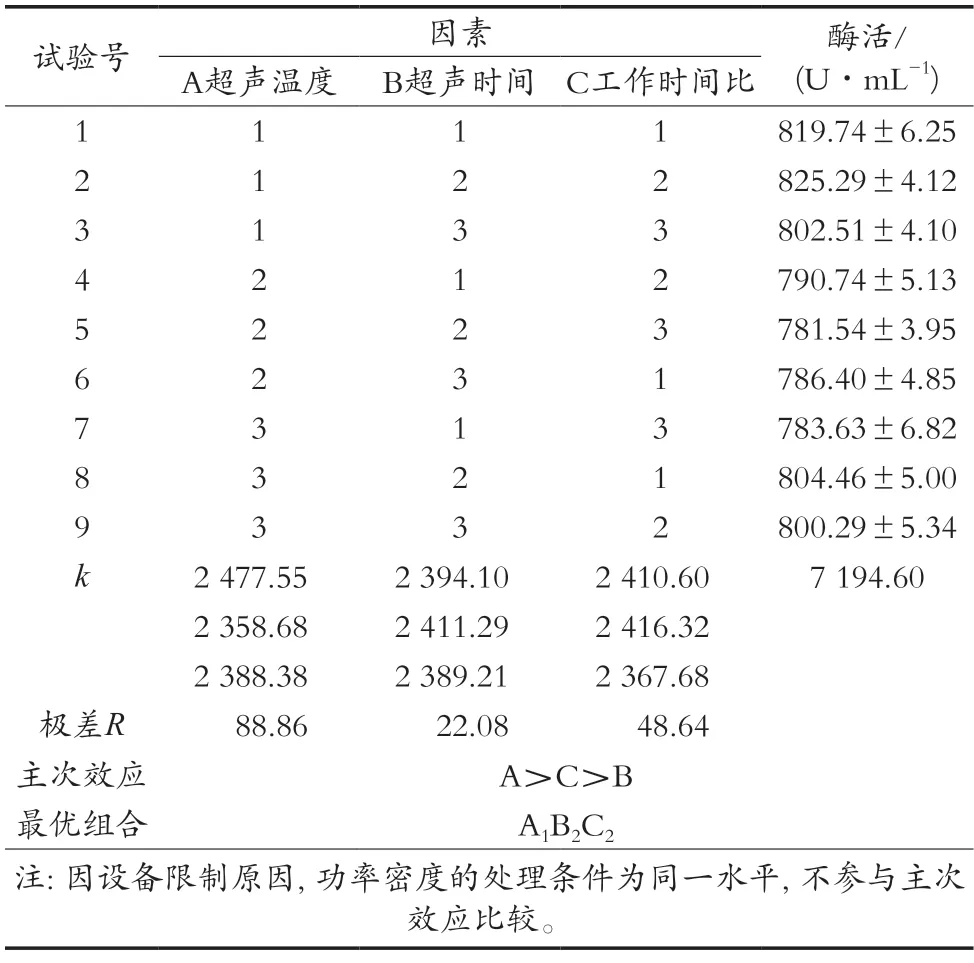
表2 正交試驗結果
正交試驗各因素方差分析結果見表3。結果表明,超聲波處理溫度對蛋白酶活性影響極顯著(P<0.01),25 kHz與40 kHz超聲波工作時間比對蛋白酶活性影響顯著(P<0.05),超聲波處理時間對蛋白酶活性影響不顯著(P>0.05)。
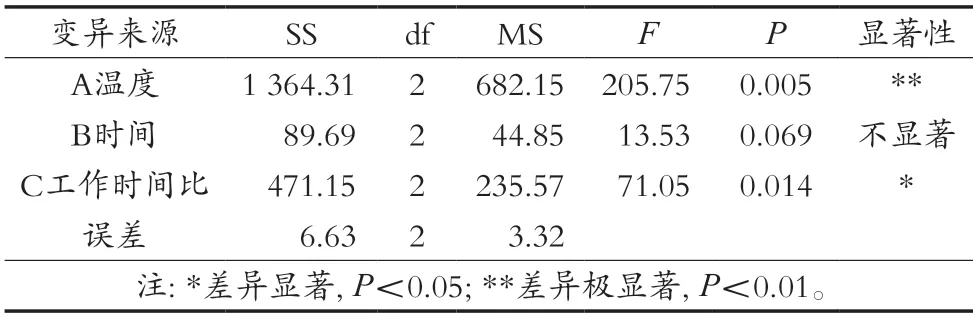
表3 正交試驗方差分析結果
2.3 最佳工藝驗證結果
由圖5可知,基于最優工藝參數[超聲波處理溫度20 ℃、功率密度25 W/L、處理時間10 min、25 kHz與40 kHz超聲波工作時間比20∶30(s/s)]處理下的蛋白酶,其活性較對照組的提高了5.68%,表明適當的超聲波處理可以提高蛋白酶的活性,這可能與超聲波的空化效應引起酶分子空間構象的變化有關[33]。
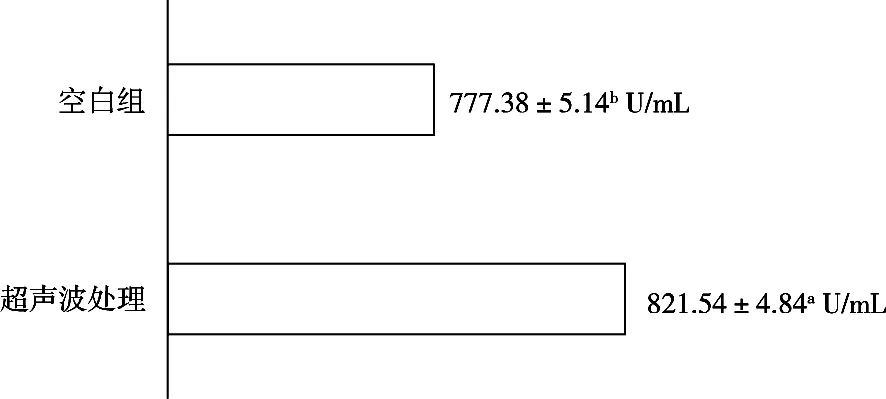
圖5 最佳超聲波處理與未超聲處理對照試驗結果
3 結論
蛋白酶分解蛋白質產生氨基酸和多肽是醬油釀造過程中的重要環節。以蛋白酶活力為評價指標,探討雙頻超聲波處理蛋白酶提高活性的工藝條件,經單因素試驗和正交試驗確定出雙頻超聲波處理的最優工藝參數,即超聲溫度20 ℃、超聲時間10 min、超聲功率密度25 W/L、5 kHz與40 kHz超聲波工作時間比20∶30(s/s),其活性較未經超聲波處理的對照組提高了5.68%。試驗結果表明雙頻超聲波對蛋白酶的酶解有促進作用,說明超聲波處理是提升蛋白酶活性的一種有效途徑,可為醬油釀造傳統工藝現代化提供參考借鑒。

