基于超高效液相色譜-高分辨質譜法高分辨非靶代謝組學的竹葉青組方發酵前后成分比較研究
蔚慧欣,張鑫,袁茂森
1(中國露酒植物提取與健康山西省重點實驗室,山西 汾陽,032205)
2(西北農林科技大學 化學與藥學院,陜西 楊凌,712100)
3(天津科技大學 生物工程學院,天津,300457)
發酵技術在中藥生產中應用廣泛,現代中藥發酵研究已成為當前中藥領域研究熱點之一[1-2]。中藥發酵技術是采用現代生物工程技術,在人體外建立一個“工業化腸胃系統”,通過添加人體腸道內的多種益生菌,把大分子的中間物質,分解和轉化成為能夠被直接吸收的有效小分子物質。中藥發酵菌株乳酸菌具有改善腸道菌群,降低膽固醇,增強人體免疫力的功效,且乳酸菌發酵還能改善食品風味。此外,中藥發酵后產品可一定程度上減少毒副作用[3-8]。雖然中藥發酵在我國具有幾千年悠久歷史,但是采用純菌種微生物發酵改性中藥材在近幾十年才興起,可以說是方興未艾,需要進一步拓展和深入。梅曉丹等[9-10]、王喻淇等[11]采用液態發酵技術對黃精覆盆子,玫瑰花、玫瑰咖、枸杞子及生姜進行乳酸菌發酵,并對開發的飲品化學成分進行超高效液相色譜-高分辨質譜法(ultra performance liquid chcromatography-high resolution mass spectrum,UPLC-HRMS)鑒定分析,明確了中藥發酵產品對食療和保健的正向作用。張妍等[12]以2種乳酸菌為發酵劑,以玉米及其副產物飲料為研究對象,利用非靶向代謝組技術對飲料發酵前后小分子質量物質變化進行了對比分析,結果發現,玉米及其副產物飲料發酵前后存在較大的代謝物差異。
利用中藥發酵技術創新求變,功能性轉化為賣點突出、形式新穎的產品是值得我們探索的新方向。竹葉青酒是中國唯一的露酒傳統名酒,具有獨特的草本古方,其出自明末清初的大學者傅山,源于傳統中醫藥學、藥食同源的理論與實踐經驗指導,具有極強的現代功能食品優勢[13]。竹葉青酒是以汾酒為基酒,配以淡竹葉(竹葉)、菊花、梔子等十幾味中藥材浸泡而成。現代研究表明,得益于山西杏花村得天獨厚的汾酒微生物體系,以及傳承千年的古法工藝釀造而成的竹葉青酒具有顯著的保肝、護胃、清心、除煩、消食之功效,它的健康功效成分已獲得8項國家發明專利[14]。
鑒于酒是物質與精神融合的風味嗜好品,目前在竹葉青酒與中藥材健康邏輯的研究上仍缺少有效論證。本研究以竹葉青傳統組方以及藥食同源文化為根本,選擇現代發酵中藥技術(液態深層發酵),優選3株純種益生菌與竹葉青藥食同源組方進行雙向發酵,制備無糖、高黃酮、零酒精新型中藥發酵液。研究采用超高效液相色譜-高分辨質譜法(ultra performance liquid chcromatography-high resolution mass spectrum,UPLC-HRMS)對竹葉青藥食同源組方發酵前后的化學成分進行分析,以期從活性成分變化的角度初步揭示竹葉青組方配伍的科學內涵。
1 材料與方法
1.1 材料與試劑
色譜乙腈(≥99.5%)、色譜甲醇(≥99.5%)、色譜甲酸(>99.0%),阿拉丁試劑(上海)有限公司;植物乳桿菌(Lactobacillusplantarum,CGMCC 17054,來自發酵泡菜)、發酵乳桿菌(Lactobacillusfermentum,CGMCC 22774,來自健康人體腸道)、青春雙歧桿菌(Bifidobacteriumadolescentis,CICC 6178,來自成人腸道),中國微生物菌種保藏管理委員會普通微生物中心(CGMCC)、中國工業微生物菌種保藏管理中心(CICC);中藥組方含淡竹葉、菊花、陳皮、梔子、丁香、砂仁,山西杏花村汾酒廠股份有限公司。
1.2 儀器與設備
Vanquish UHPLC超高壓液相色譜儀、Q Exactive HF-X質譜儀,Thermo;5430R低溫高速離心機,Eppendorf;ACQUITY UPLC HSST3色譜柱(2.1 mm×100 mm,1.8 μm),Waters;LT-36VLC8恒溫恒濕培養箱,PERCIVAL;ZHJH-C1109C超凈工作臺,ZHCHENG;MAC-350P高壓滅菌鍋,SANYO;Milli Q Plus超級純水儀,Bio-Rad。
1.3 實驗方法
1.3.1 供試品溶液的制備
工藝路線及參數:中藥超微粉碎(粉碎度200目)、生物酶解(40 ℃,1 h)、提取滅菌(80 ℃,30 min)、厭氧發酵(30 ℃,48 h,pH:5.5~3.5,接種量106CFU/mL)、低溫滅菌(80 ℃,30 min)、離心(濁度<100 NTU)、口感調配。
1.3.2 樣本提取方法
樣本在4 ℃環境下緩慢解凍后,取竹葉青組方發酵液(發酵前、后)(上機名稱依次為:ZYQBF、ZYQLF)600 μL于不同的1.5 mL EP管中,加400 μL純甲醇溶液,渦旋混勻后,再用40%甲醇水溶液分別稀釋2倍,離心15 min (16 000×g,4 ℃),取上清液分析。
1.3.3 色譜與質譜條件
色譜條件:樣品采用Vanquish UHPLC系統ACQUITY UPLC HSS T3色譜柱進行分離;柱溫35 ℃;流速0.3 mL/min;進樣量2 μL;流動相組成:0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B);梯度洗脫程序:0~17 min,5% B~98% B;17~17.2 min,98% B~5% B;17.2~20 min,5% B;整個分析過程中樣品置于4 ℃自動進樣器中。為避免儀器檢測信號波動而造成的影響,采用隨機順序進行樣本的連續分析。樣本隊列中插入QC樣品,用于監測和評價系統的穩定性及實驗數據的可靠性。
質譜條件:采用Q-Exactive系列質譜儀進行樣本一級、二級譜圖的采集。樣品經由Vanquish UHPLC系統分離后,進行質譜分析,分別采用電噴霧電離正離子和負離子模式進行檢測。ESI源及質譜設置參數如下:電噴霧電壓(+):3.8 kV,電噴霧電壓(-):3.0 kV;毛細管溫度:320 ℃;鞘氣流速:13.5 L/min;輔助氣流速:6 L/min;輔助加熱器溫度:370 ℃;一級質荷比掃描范圍:90~1 300m/z;數據依賴性MS/MS:Top 10;循環數:10。
1.3.4 數據處理
原始數據經ProteoWizard轉換成.mzXML格式,然后采用XCMS軟件進行峰對齊、保留時間校正和提取峰面積。對XCMS提取得到的數據首先進行代謝物結構鑒定、數據預處理,然后進行實驗數據質量評價,最后再進行數據分析。數據分析內容包括主成分分析(principal component analysis,PCA)、偏最小二乘判別分析(partial least squares discriminant analysis,PLS-DA)、正交偏最小二乘判別分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)和差異代謝物篩選等內容。OPLS-DA模型得到的變量權重值(variable important inprojection,VIP)能夠用于衡量各代謝物的表達模式對各組樣本分類判別的影響強度和解釋能力,挖掘具有生物學意義的差異代謝物分子。在本研究中,差異代謝物篩選標準設定為:OPLS-DA模型得到的VIP>1且P<0.05。
1.3.5 網絡藥理學分析
選取竹葉青組方發酵液發酵后顯著增加的成分以及發酵后新生成的成分,進行網絡藥理學分析,以初步探討其潛在的作用機制。使用SwissTargetPrediction軟件[15]預測化合物的靶點,使用clusterProfiler[16]對靶點功能進行GO生物學過程(biological process,BP)、細胞組分(cell components,CC)、分子功能(molecular function,MF)和KEGG富集分析,顯著性閾值設定為BH法校正后P<0.05。
1.4 統計分析
統計分析均采用R語言(版本4.4.2)進行,數據以均值±標準誤表示。組間差異顯著性通過Student T-test進行比較,P<0.05表示具有統計學意義。
2 結果與分析
2.1 竹葉青組方發酵液化學成分鑒定
根據設定的液相色譜及質譜條件,取發酵后樣品進樣分析。圖1為竹葉青組方發酵液在正、負離子模式下的總離子流色譜圖,對正離子模式下的主要峰進行標記,獲得25個峰(峰1~25),對負離子模式下的主要峰進行標記,獲得32個峰(峰26~54、12、14)。在電噴霧一級譜中獲得標記峰的相對分子質量信息,通過多級串聯質譜分析并結合保留時間及相關文獻對各主要分子離子峰進行指認,最終確定46個化合物,對應峰的相關信息見表1。鑒定所得的46個化合物包括24個苯丙素類和聚酮類化合物(其中19個是黃酮類化合物,5個是異黃酮類化合物),9個脂類和類脂分子(其中有4個萜類),4個氨基酸、肽及類似物,3個脂肪酸,4個有機氧化合物(2個醇及多元醇,2個碳水化合物及其結合物),1個苯類,及1個有機氮化合物(季銨鹽類)(表1)。
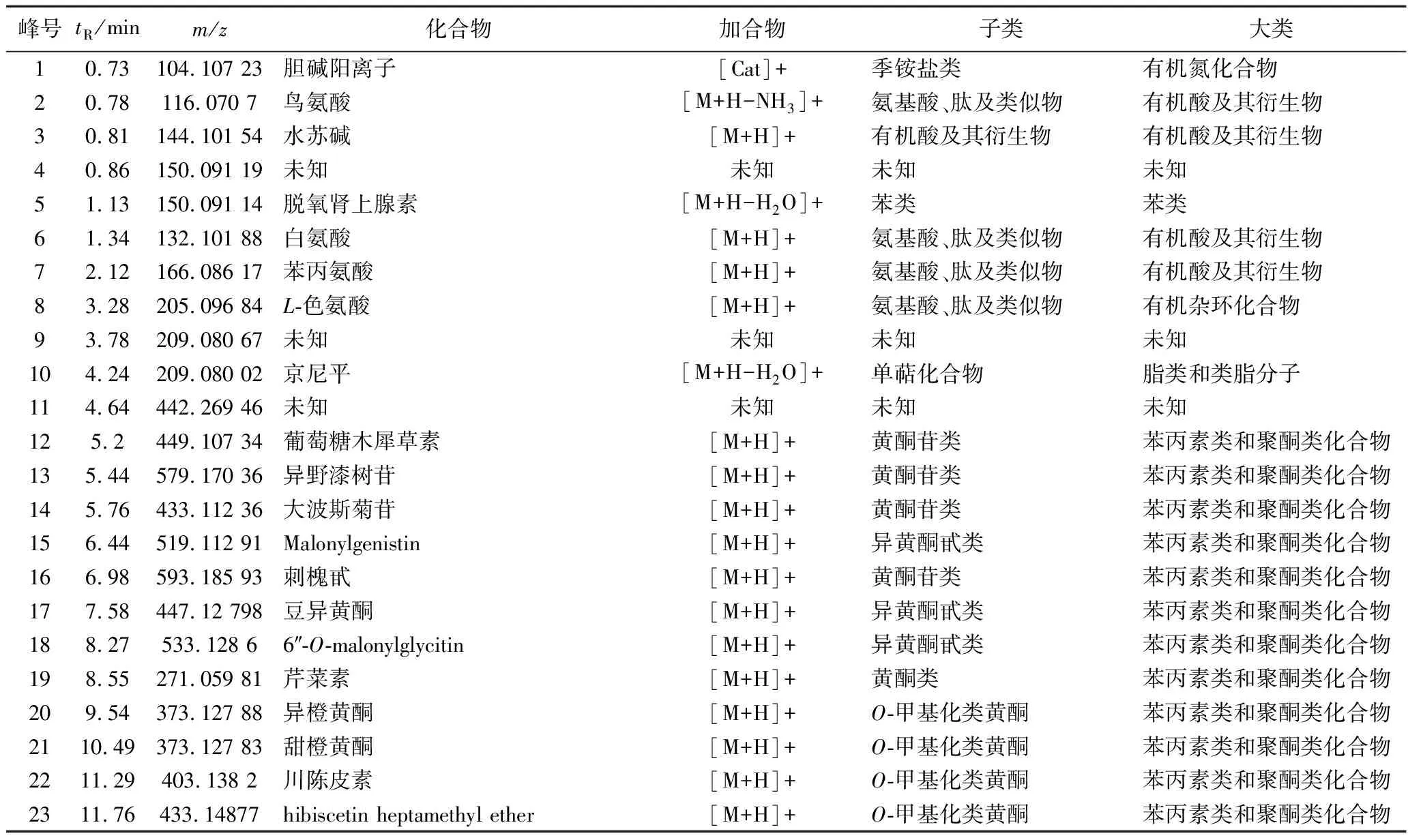
表1 竹葉青組方發酵液化學成分的基本信息
2.2 竹葉青組方發酵前后差異成分確認
竹葉青的藥食同源組方藥材中含大量黃酮類、萜類、生物堿、多糖、皂苷等有效成分,均具有較好的抗氧化活性,可調節和增強機體特異性及非特異性免疫功能,抑制自由基的產生。經乳酸菌深度發酵后,中藥成分溶出率提高了5.3倍,各類成分種類及含量均發生不同程度的變化。實驗結果表明發酵前后樣品的各色譜峰的響應強度與保留時間基本重疊,說明發酵前后樣品在整體化學成分類別上變異程度較小。高分辨非靶代謝組學主成分分析顯示,實驗樣本組內聚集度高,組間分離明顯,說明實驗結果可靠,組間有明顯差異(圖2-a,圖2-b)。發酵前后樣品在正、負離子模式下的OPLS-DA模型得分如圖2-c和圖2-d所示,可見OPLS-DA模型能較好地區分2組樣本。為了避免有監督模型在建模過程中發生過擬合,采用置換檢驗對模型進行檢驗,以保證模型的有效性。圖2-e和圖2-f分別展示了發酵前后樣品在正、負離子模式下OPLS-DA模型的置換檢驗圖,隨著置換保留度逐漸降低,隨機模型的R2和Q2均逐漸下降,說明原模型不存在過擬合現象,模型穩健性良好。
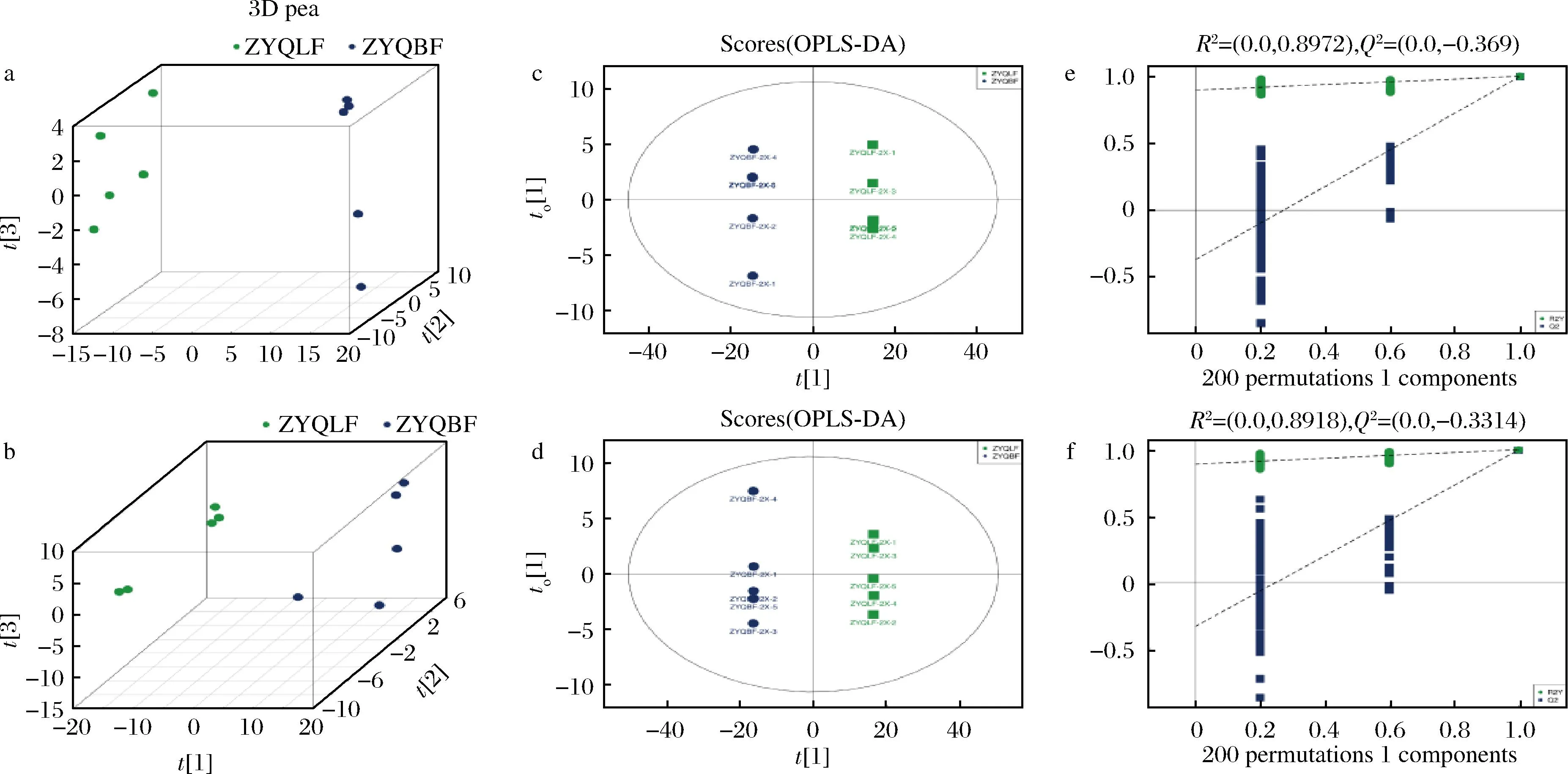
a-正離子模式PCA得分圖;b-負離子模式PCA得分圖;c-正離子模式OPLS-DA模型圖;d-負離子模式OPLS-DA模型圖;e-正離子模式OPLS-DA模型置換檢驗圖;f-負離子模式OPLS-DA模型置換檢驗圖
本研究以OPLS-DA VIP>1且P<0.05為顯著性差異代謝物篩選標準,在正離子模式下篩選到50個差異代謝物,有8個成分在發酵后含量上升,有42個成分在發酵后含量下降。包括27個苯丙素類和聚酮類化合物(其中21個是黃酮類化合物,4個異黃酮類化合物),4個有機雜環化合物,3個脂類和類脂分子,3個核苷酸及其衍生物,3個有機酸及其衍生物,2個有機氮化合物,以及2個有機氧化合物(圖3-a)。在負離子模式下篩選到41個差異代謝物(圖3-b),有9個成分在發酵后含量上升,有32個成分在發酵后含量下降。包括16個苯丙素類和聚酮類化合物(其中11個是黃酮類化合物,2個是異黃酮類化合物),13個有機氧化合物,7個有機酸及其衍生物,4個脂類和類脂分子,以及1個核苷酸及其衍生物。
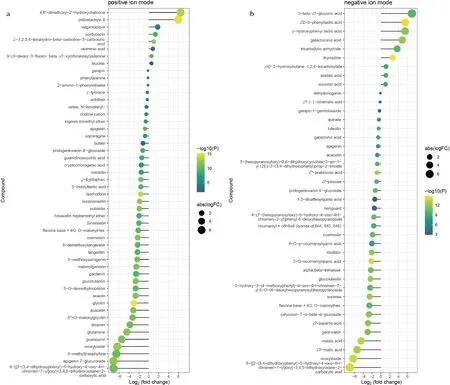
a-正離子模式差異分析氣泡圖;b-負離子模式差異分析氣泡圖
2.3 發酵前后差異成分豐度變化
以OPLS-DA VIP>1且P<0.05為顯著性差異代謝物篩選標準,在正離子模式下,竹葉青組方發酵后代表性上調化合物如圖4-a所示,分別為:4,6′-二甲氧基-2′-羥基查爾酮(4,6′-dimethoxy-2′-hydroxychalcone),松葉水蘇烯B(psilostachyin B),纈更昔洛韋(valganciclovir),蟲草素(cordycepin),L-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid;發酵后代表性下調化合物如圖4-b所示,分別為:6-{[2-(3,4-dihydroxyphenyl)-5-hydroxy-4-oxo-4H-chromen-7-yl]oxy}-3,4,5-trihydroxyoxane-2-carboxylic acid,芹菜素7-葡糖苷酸(apigenin 7-glucuronide),8-甲基茶堿(8-methyltheophylline),千層紙苷(oroxyloside),鳥嘌呤(guanosine),外源類多效唑(paclobutrazol)。
在負離子模式下,竹葉青組方發酵后代表性上調化合物如圖4-c所示,分別為:5-酮-D-葡萄糖酸(5-keto-D-gluconic acid),DL-3-苯乳酸(DL-3-phenyllactic acid),對羥基苯乳酸(P-hydroxyphenyl lactic acid),半乳糖酸(galacturonic acid),tricarballylic anhydride,表沒食子兒茶素(epigallocatechin gallate);發酵后代表性下調化合物如圖4-d所示,分別為:5-(hexopyranosyloxy)-2,6-dihydroxycyclohex-3-en-1-yl,(2E)-3-(3,4-dihydroxyphenyl)prop-2-enoate,葡萄糖苷酸(oroxyloside),DL-蘋果酸(DL-malic acid),馬來酸(maleic acid),芫花素(genkwanin)。
非靶代謝組學分析顯示,竹葉青組方發酵液經發酵后新產生70個化學成分(P<0.05),其中43個成分由正離子模式鑒定所得,27個成分由負離子模式鑒定所得(圖5)。正離子模式新增代表性成分如圖5-b所示,分別為:14,17,20-trihydroxy-1-oxowitha-2,5,24-trienolide,trans-3,5-dimethoxy-4-hydroxycinnamaldehyde,5-aminohexylamine,3-(1-hydroxyethyl)-2,3,6,7,8,8a-hexahydropyrrolo[1,2-a]pyrazine-1,4-dione,8-hydroxy-3-(4-ketopentyl)isochroman-1-one;負離子模式新增代表性成分如圖5-d所示,分別為:大豆甙元(daidzein),膽堿陽離子(cyanin cation),(3E)-4-(1-hydroxy-2,6,6-trimethyl-4-oxocyclohex-2-en-1-yl)but-3-en-2-yl 2-O-hexopyranosylhexopyranoside,吡咯-2-羧酸(pyrrole-2-carboxylic acid),龍膽酸(gentisic acid)、黃豆黃素苷(glycitin)。
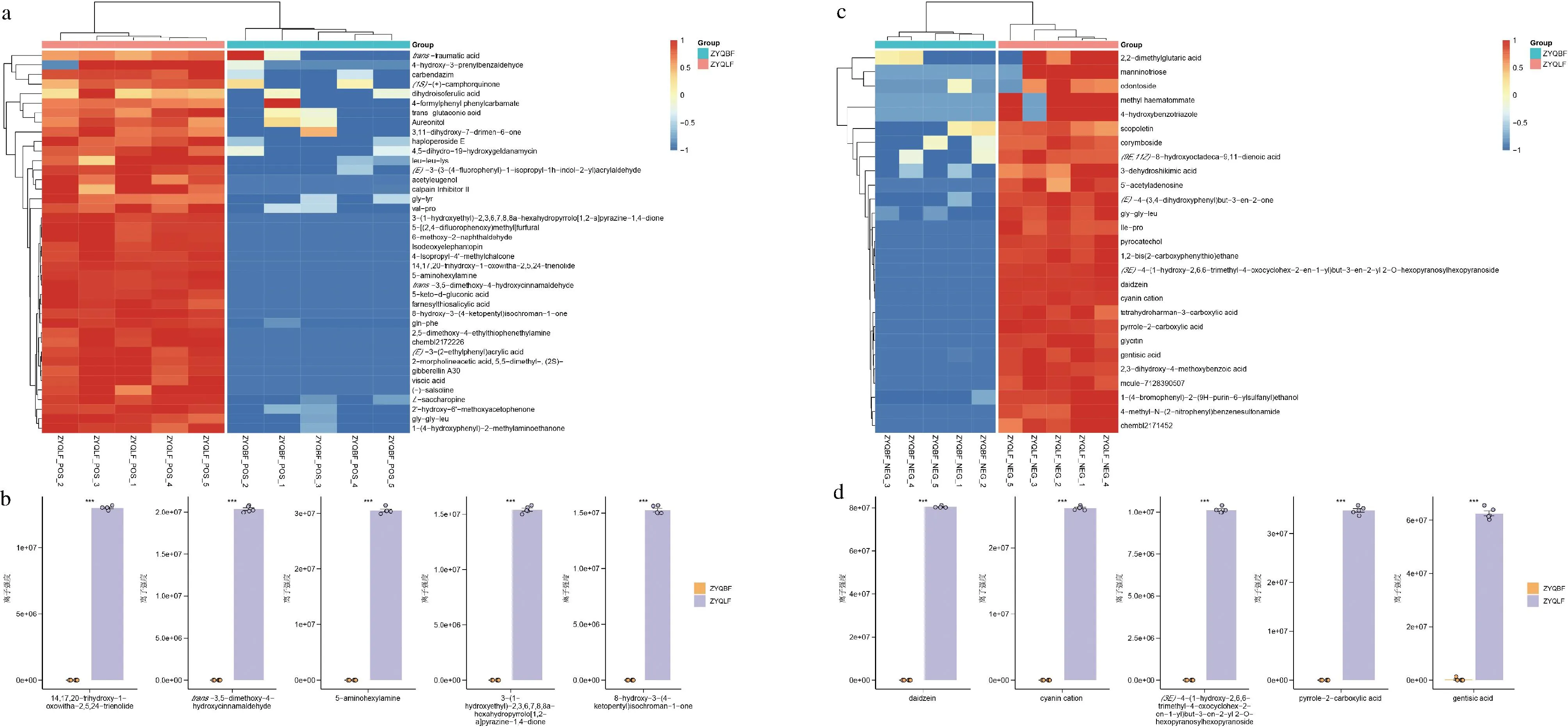
a-正離子模式新增化合物熱圖;b-正離子模式代表性新增化合物柱狀圖;c-負離子模式代新增化合物熱圖;d-負離子模式代表性新增化合物柱狀圖
非靶代謝組學差異性分析顯示,經乳酸發酵以黃酮類成分的變化最為顯著,發酵將大分子糖苷類物質轉化為易吸收的小分子苷元,如黃酮苷在發酵過程中微生物產酶的作用下發生水解反應,使大豆苷水解為相應的苷元——大豆苷元更利于有效成分在體內發生廣泛的代謝和轉化[17];發酵后新物質黃豆黃素苷具有防止心腦血管疾病、抗衰老和防止酒精中毒作用[18];發酵后有機酸類、氨基酸肽類會顯著增加,參與乳酸發酵過程相關的有機酸類特征物質如蘋果酸、檸檬酸與馬來酸酸等會顯著下降,而苯乳酸、對羥基苯乳酸與壬二酸等會顯著增加,同時可有效改善發酵液風味,氨基酸肽類如白氨酸、L-亮氨酸、阿魏酸等作為良好的膳食添加劑對人體有較高生物活性[19];其他活性物質如表沒食子兒茶素沒食子酸酯、蟲草素及萜類內酯松葉水蘇烯B等在提高人體免疫功力、延緩衰老、抗疲勞等方面廣受消費者接受[19-20];新型甜味劑新橙皮苷二氫查耳酮等也有顯著提升[22];這些生物源素小分子可直接作用于人體,具有強大的免疫激活力,同時極大地改善了藥材口感,飲用體驗更好。
2.4 竹葉青組方發酵后關鍵成分網絡藥理學分析
選取竹葉青組方發酵后顯著增加的5個代表性成分松葉水蘇烯B、胸腺嘧啶核苷、苯乳酸、4,6′-二甲氧基-2′-羥基查爾酮和半乳糖酸,以及發酵后新增的5個代表性成分大豆甙元、14,17,20-trihydroxy-1-oxowitha-2,5,24-trienolide、膽堿陽離子、(3E)-4-(1-hydroxy-2,6,6-trimethyl-4-oxocyclohex-2-en-1-yl)but-3-en-2-yl 2-O-hexopyranosylhexopyranoside和trans-3,5-dimethoxy-4-hydroxycinnamaldehyde進行網絡藥理學研究。化合物-靶點網絡如圖6所示,竹葉青組方發酵液發酵后含量顯著提升的8個化學成分(2個化合物未預測到作用靶點)作用于217個靶點節點。對這些化學成分的靶點進行GO富集與KEGG通路分析富集,取排名前五的條目進行結果顯示,竹葉青組方發酵液的靶點顯著富集在神經活性配體-受體相互作用(neuroactive ligand-receptor interaction)、TRP通道的炎癥介質調節(inflammatory mediator regulation of TRP channels)、鈣信號通路(calcium signaling pathway)等信號通路上,通過調控以上潛在的信號通路,進一步影響循環系統血管功能(vas-cular process in circulatory system)、MAP激酶活性(regulation of MAP kinase activity)、細胞鈣離子穩態(cellular calcium ion homeostasis)等生物學過程以及膜筏(membrane raft)、膜微區(membrane microdomain)、膜(membrane region)等細胞組分,從而發揮神經遞質受體活性(neurotransmitter receptor activity)、G蛋白偶聯受體活性(G protein-coupled amine receptor activity)、內肽酶活性(endopeptidase activity)等分子功能(圖7)。其中靶點預測最多的化合物是松葉水蘇烯B,表明這個化合物潛在調節作用較大。
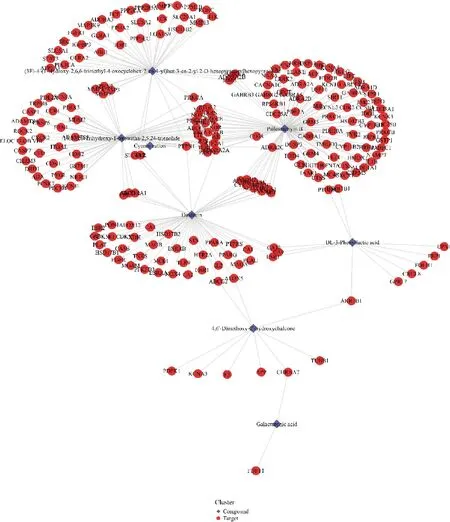
圖6 竹葉青組方發酵液關鍵成分的化合物-靶點網絡圖
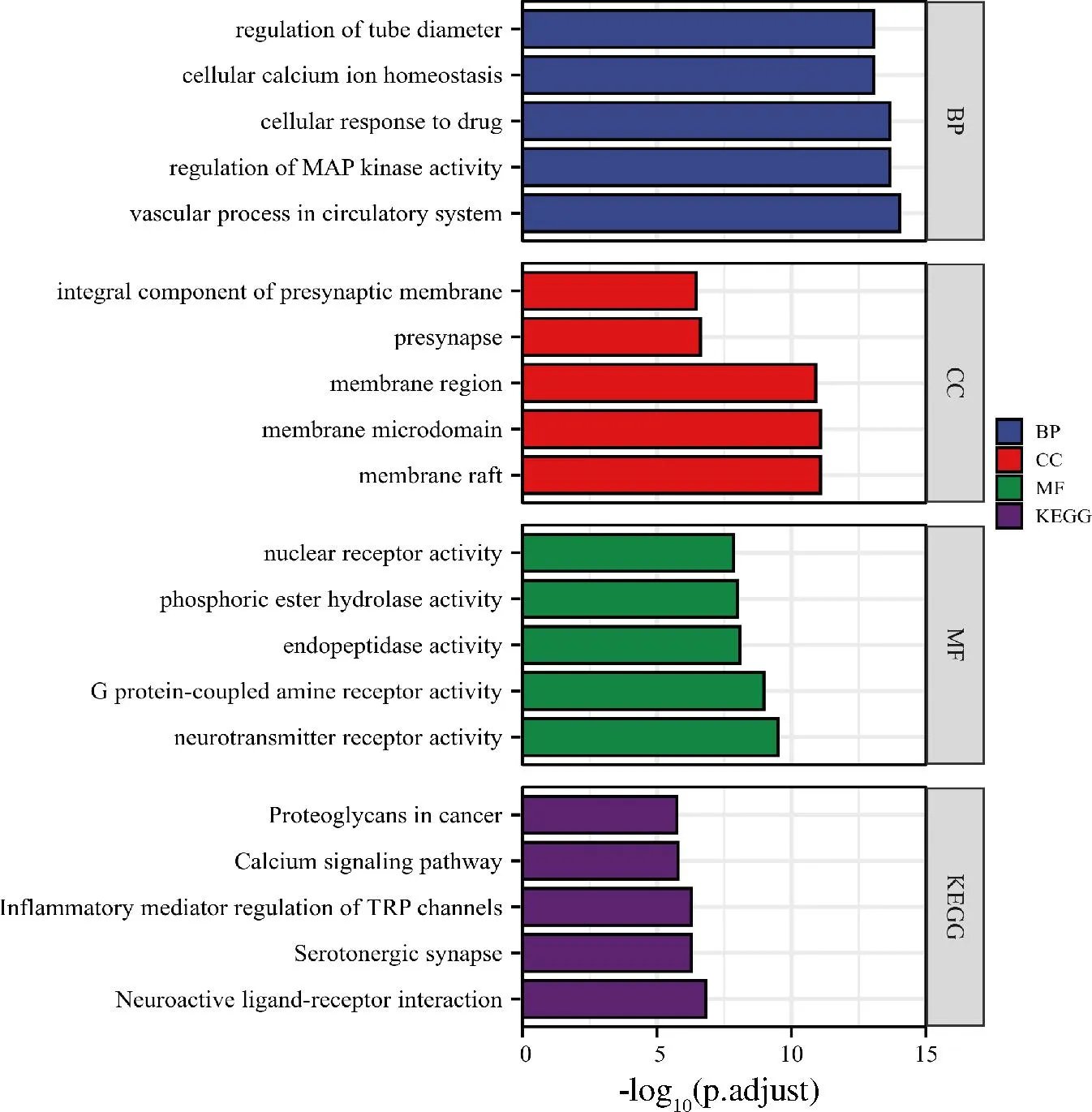
圖7 竹葉青組方發酵液關鍵靶點功能富集分析圖
網絡藥理學分析體現了中藥多成分、多靶點、多途徑的作用特點。研究首次發現了竹葉青藥食同源組方可能在調節神經遞質受體活性的作用,對于抒解抑郁人群有一定正向調理作用。
3 結論
本研究采用UPLC-HRMS高分辨液質聯用技術,對竹葉青組方經乳酸發酵后樣本的主要化學成分進行了鑒定,獲得46個主要化學成分,表明了其成分多樣性的特點。通過高分辨非靶代謝組學技術比較了竹葉青組方發酵液發酵前后的化學成分,各類成分種類及含量均發生不同程度的變化,獲得91個在發酵前后顯著變化的差異成分,其中以黃酮類成分的變化最為顯著。進一步從提高活性成分含量、經過生物轉化產生新的活性物質、減輕藥物毒性、風味提升等方面進行成分分類評價。研究初步闡明竹葉青組方發酵液的化學成分與藥理作用,為其進一步開發利用提供了科學依據,并為現代中藥微生物發酵研究提供了參考和借鑒。

