Toll樣受體2對兒童肺炎支原體肺炎肺部炎癥表現和腫瘤壞死因子-α的調節作用
劉滿菊,王小穩,陳丹,邰亞輝,孫曉敏
作者單位:鄭州大學附屬兒童醫院西區門診部,河南 鄭州450000
肺炎支原體肺炎(MPP)占兒童社區獲得性肺炎的10%~40%[1],難治性肺炎支原體肺炎(RMPP)病兒臨床癥狀或影像學表現難以改善甚至繼續進展,可導致預后不良[2]。RMPP的發病機制尚不清楚,過度免疫反應是肺炎支原體(MP)感染引起的多系統癥狀和RMPP的重要因素[3]。Toll樣受體(TLR)是一種模式識別受體,激活后通過銜接蛋白MyD88發出信號,對促炎細胞因子表達發揮作用,并將免疫細胞募集到感染部位。研究表明,TLR是MP的重要受體,其中TLR2可能與MP感染引起的過度炎癥密切相關[4]。還有研究顯示,RMPP病兒血清腫瘤壞死因子-α(TNF-α)水平顯著高于非RMPP病兒[5]。本研究旨在探討TLR2對兒童肺炎支原體肺炎肺部炎癥表現和TNF-α的調節作用。
1 資料與方法
1.1 一般資料 選取2021年1月至2022年1月鄭州大學附屬兒童醫院診治的MPP病兒27例,其中RMPP病兒12例、非RMPP病兒15例。
納入標準:①入院時有肺炎的體征和癥狀;②胸片上有肺炎浸潤;③鼻咽抽吸物中檢測出MP陽性(≥1.0×104DNA copies)。排除標準:①年齡>14歲;②鼻咽分泌物經免疫熒光技術檢測為呼吸道合胞病毒、流感病毒、腺病毒、副流感病毒陰性,核酸檢測為沙眼衣原體等其他病原體;③鼻咽分泌物細菌培養和雙陰性血培養陽性。RMPP根據下列標準診斷[6]:①持續發熱7 d或更長時間,②持續高熱、頑固刺激性咳嗽,或出現肺外并發癥等多系統損害,③使用抗生素治療后咳嗽和胸片浸潤增加。選取非感染病兒12例作為對照。入院后收集外周血2 mL,半徑10 cm、1 000×g下離心10 min,血清保存在-80 ℃冰箱備用。本研究符合《世界醫學協會赫爾辛基宣言》相關要求,所有病兒監護人均簽署了知情同意書。
1.2 實驗方法
1.2.1 細菌菌株和培養條件 標準MP菌株來自中國典型培養物保藏中心(CCTCC),菌株在支原體肉湯培養基中培養,每2天刷新一次培養基,培養5~6 d后,培養基顏色從紅色變為黃色,表明MP處于對數生長階段。
1.2.2 細胞培養 A549細胞(CCTCC)在10%胎牛血清(FBS)的Duibeco改良eagIe培養基(DMEM)中培養。使用人中性粒細胞分離試劑盒在采集后2 h內從外周血樣中提取中性粒細胞。用含10% FBS的RPMI-1640培養基在37 ℃,5%二氧化碳培養箱中培養。
1.2.3 細胞治療 在顯微鏡下對每個非感染病兒的外周血中性粒細胞進行計數,并將其分為陰性對照(NC)組和MP刺激組。每份約106個細胞接種在6孔板中。MP通過肺炎支原體核酸檢測試劑盒進行定量。定量后用磷酸鹽緩沖液(PBS)懸浮洗滌2次,最后用RMPI-1640培養基重新懸浮至濃度108個細胞/mL。MP刺激組以100∶1的感染率向中性粒細胞添加1 mL MP混懸液,NC組向中性粒細胞中添加1 mL RMPI-1640培養基。然后在37 ℃,5%二氧化碳的細胞培養室中培養6 h。
將A549細胞接種在10%FBS的DMEM培養基6孔板中。增長到面積的50%時,MP刺激組添加1 mL 108/mL MP混懸液,NC組加入1 mL細胞培養液。NF-κB抑制組在培養基中補充100 μmol/L的NF-κB抑制劑吡咯烷二硫代氨基甲酸銨(PDTC)預處理1 h,同時加入1 mL 108/mL MP混懸液。MyD88抑制組用100 μmol/L的MyD88抑制劑NBP2-29328預處理24 h。當細胞生長至50%密度時,加入1 mL 108/mL MP混懸液培養12 h。
1.2.4 TNF-α表達測量 使用酶聯免疫吸附測定(ELISA)試劑盒,在450 nm處測量吸光度,并根據標準曲線計算血清TNF-α表達。
1.2.5 實時熒光定量聚合酶鏈反應(RT-qPCR)RT-qPCR方法如以往研究所述[7],用TRIzol試劑分離外周血中性粒細胞RNA,并使用隨機引物和逆轉錄酶將其反轉錄為cDNA。使用基因特異性引物和AceQ qPCR SYBR Green Master Mix預混液(低ROX)在AppliedBiosystems7500系統上運行RT-qPCR。使用人TLR基因的引物序列檢測靶基因表達水平,并將其標準化為甘油醛-3-磷酸脫氫酶(GAPDH)mRNA水平,并使用2-ΔΔCt方法測定相對表達。見表1。

表1 TLR基因的引物序列
1.2.6 蛋白質印跡法 為了檢測A549細胞中p-p65和Myd88的蛋白表達,使用總蛋白提取試劑盒提取A549細胞蛋白。用Bradford法測定蛋白質含量。在Tris/HCl緩沖系統中使用12%十二烷基硫酸鈉聚丙烯酰胺凝膠對等量的蛋白質(30 μg蛋白質/泳道)進行電泳,然后將電泳轉移至聚偏二氟乙烯微孔膜。隨后在室溫下用5%脫脂乳密封膜2 h,并與稀釋1/1 000的GAPDH、NF-κBp65和MyD88抗體在4 ℃下孵育過夜。再用含有TBST的Tris緩沖鹽洗滌5次后,使用合適的第二抗體和增強化學發光系統完成免疫檢測。使用Image Lab成像系統進行條帶的光密度掃描,確定每個條帶的積分光密度值(IOD),并進行光密度掃描分析。
1.2.7 流式細胞分析 A549細胞在6孔板中生長至接近匯合,并用MP(MOI 1∶100)培養12 h,然后在胰蛋白酶孵育后收獲。將細胞懸浮液在300×g下離心10 min,并將顆粒細胞重新懸浮在PBS中(在80μL PBS中最多107個有核細胞)。向細胞懸浮液中加入20 μL FcR阻斷試劑,持續10 min。然后,加入2.5 μL APC標記的抗人TLR4抗體和2.5 μL PE標記的TLR2抗體,將混合物在2~8 ℃的黑暗環境中培養10 min。在1~2 mL PBS中洗滌細胞,并在半徑3 cm、300×g下離心10 min。將獲得的A549細胞重新懸浮在300 μL PBS中,通過流式細胞儀檢測。
1.2.8 siRNA介導的基因敲除 使用核糖體提取試劑盒將特異性人TLR2 siRNA或對照siRNA轉染匯合30%~50%的A549細胞48 h,然后在37 ℃,5%二氧化碳下感染MP(MOI=1∶100)24 h,通過ELISA試劑盒測定上清液中的細胞因子。
1.3 統計學方法 使用SPSS 24.0統計學軟件進行數據分析,計量資料以描述,兩組比較采用t檢驗,多組比較采用單因素方差分析(SNK-q檢驗),計數資料采用例(%)描述,采用χ2檢驗進行比較。所有檢驗均為雙尾,P<0.05為差異有統計學意義。
2 結果
2.1 病兒一般資料及MPP病兒臨床特征比較MPP組男11例、女4例,年齡(4.60±1.76)歲,RMPP組男8例、女4例,年齡(5.35±1.11)歲,NC組男6例、女6例,年齡(5.18±1.54)歲,三組病兒性別年齡差異無統計學意義(P>0.05)。RMPP病兒胸腔積液和肺不張發病率高于MPP(P<0.05),其他臨床特征兩組差異無統計學意義(P>0.05),見表2。
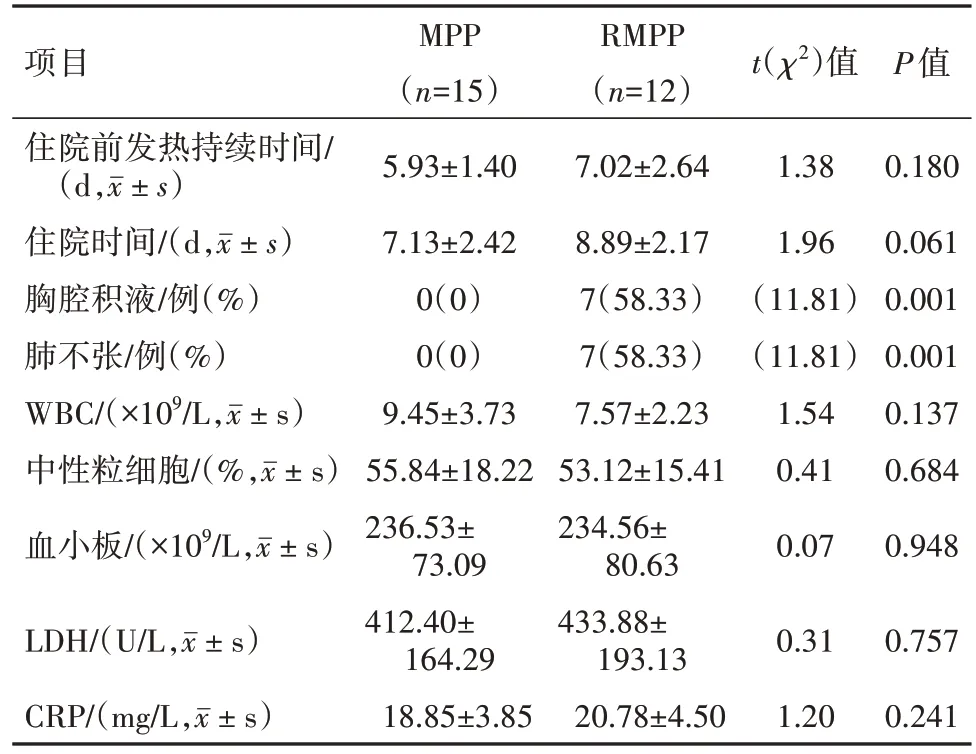
表2 MPP病兒15例與RMPP12例臨床特征比較
2.2 MPP病兒血清TNF-α和中性粒細胞TLR mRNA水平 MPP病兒血清TNF-α水平高于NC組,且RMPP組高于MPP組(P<0.05)。RMPP組外周血中性粒細胞TLR1和TLR2mRNA高于MPP組(P<0.05)。MPP組TLR2 mRNA高于NC組(P<0.05)。TLR4和TLR6 mRNA表達三組間差異無統計學意義(P>0.05),見表3。
表3 RMPP、MPP和NC組病兒TNF-α和TLR mRNA水平比較/
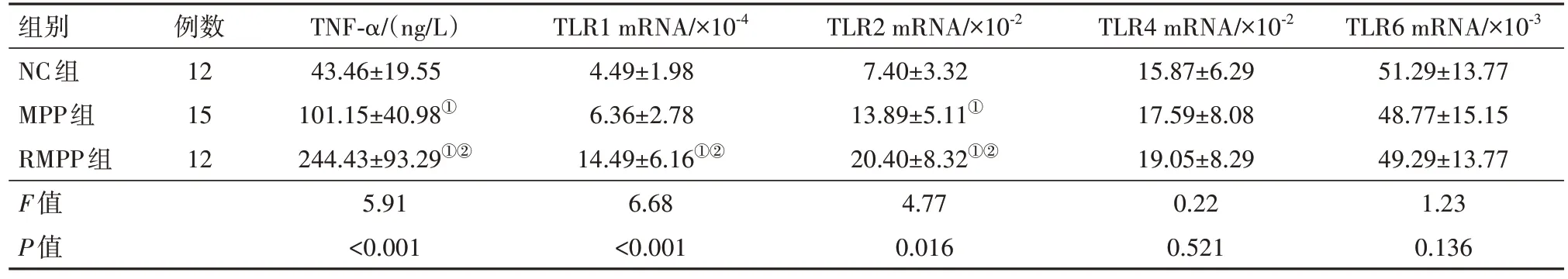
表3 RMPP、MPP和NC組病兒TNF-α和TLR mRNA水平比較/
注:NC為對照,MP為肺炎支原體,RMPP為難治性肺炎支原體,TNF-α為腫瘤壞死因子-α,TLR為Toll樣受體。①與NC組比較,P<0.05。②與MPP組比較,P<0.05。
組別NC組MPP組RMPP組F值P值TLR6 mRNA/×10-3 51.29±13.77 48.77±15.15 49.29±13.77 1.23 0.136例數12 15 12 TNF-α/(ng/L)43.46±19.55 101.15±40.98①244.43±93.29①②5.91<0.001 TLR1 mRNA/×10-4 4.49±1.98 6.36±2.78 14.49±6.16①②6.68<0.001 TLR2 mRNA/×10-2 7.40±3.32 13.89±5.11①20.40±8.32①②4.77 0.016 TLR4 mRNA/×10-2 15.87±6.29 17.59±8.08 19.05±8.29 0.22 0.521
2.3 MP刺激增強TNF-α和TLR2表達 MP刺激組的TNF-α和TLR2表達在中性粒細胞和A549細胞中顯著增加(P<0.05)。見表4。
表4 中性粒細胞和A549細胞中兩組TNF-α、TLR2和TLR4表達/
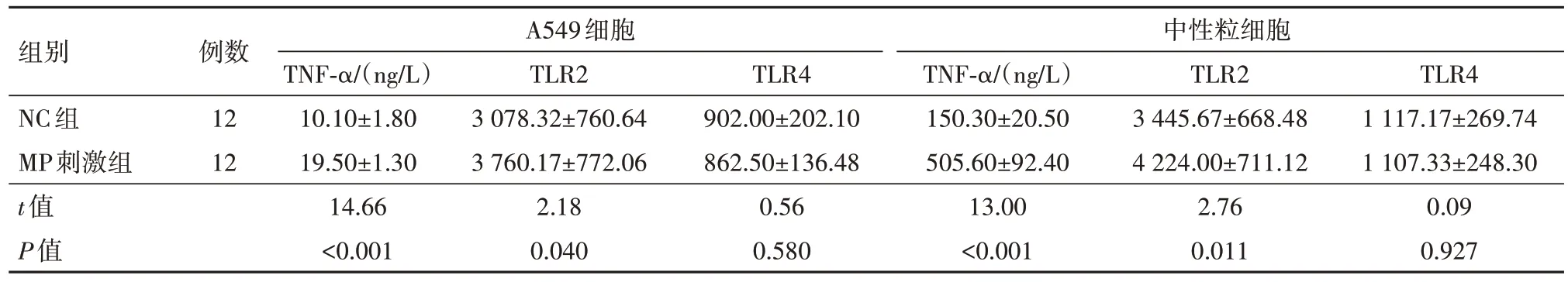
表4 中性粒細胞和A549細胞中兩組TNF-α、TLR2和TLR4表達/
注:NC為對照,MP為肺炎支原體,TNF-α為腫瘤壞死因子-α,TLR為Toll樣受體。
組別NC組MP刺激組t值P值A549細胞中性粒細胞TLR4 1 117.17±269.74 1 107.33±248.30 0.09 0.927例數12 12 TNF-α/(ng/L)10.10±1.80 19.50±1.30 14.66<0.001 TLR2 3 078.32±760.64 3 760.17±772.06 2.18 0.040 TLR4 902.00±202.10 862.50±136.48 0.56 0.580 TNF-α/(ng/L)150.30±20.50 505.60±92.40 13.00<0.001 TLR2 3 445.67±668.48 4 224.00±711.12 2.76 0.011
2.4 TLR2敲除抑制TNF-α表達 用靶向TLR2的siRNA轉染A549細胞后,與siNC組相比,在TLR2沉默的細胞中MP刺激誘導的TNF-α表達受到顯著抑制(P<0.05),見表5。
表5 ELISA測定對照組或MP感染的A549細胞中TNF-α的分泌/(ng/L,)
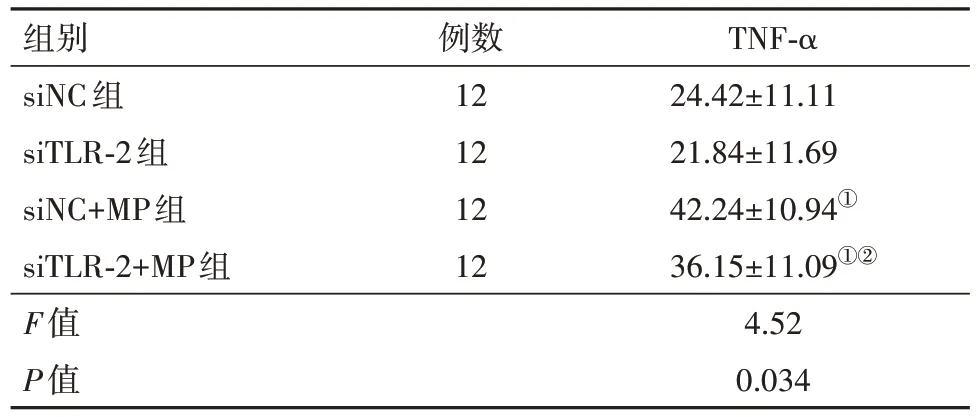
表5 ELISA測定對照組或MP感染的A549細胞中TNF-α的分泌/(ng/L,)
注:siNC為靶向TLR2的siRNA轉染的對照,siTLR-2為靶向TLR2的siRNA轉染的Toll樣受體2,MP為肺炎支原體。①與siNC組比較,P<0.05。②與siNC+MP組比較,P<0.05。
例數12 12 12 12 TNF-α 24.42±11.11 21.84±11.69 42.24±10.94①36.15±11.09①②4.52 0.034組別siNC組siTLR-2組siNC+MP組siTLR-2+MP組F值P值
2.5 MP刺激增強TLR相關信號分子的表達Western blotting結果顯示,MP刺激后A549細胞中MyD88和NF-κB p65表達均明顯增加(P<0.05),見圖1,表6。
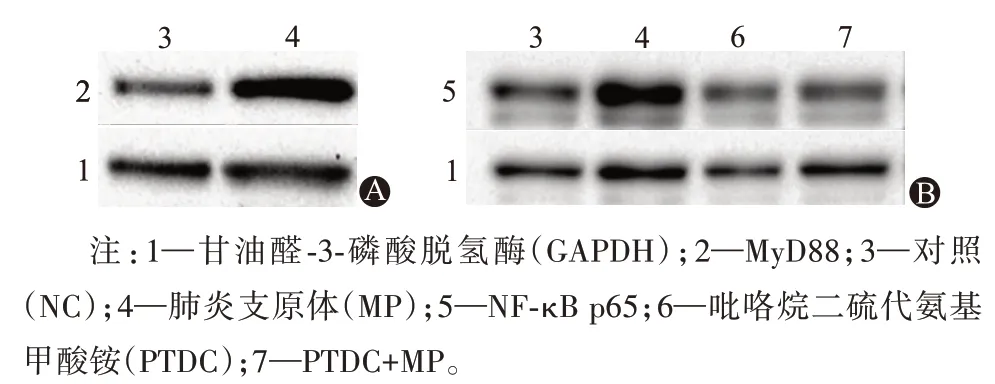
圖1 肺炎支原體刺激的A549細胞中MyD88(A)和NF-κB p65(B)的蛋白質印跡圖像
表6 肺炎支原體刺激的A549細胞中MyD88和NF-κB p65的表達變化/
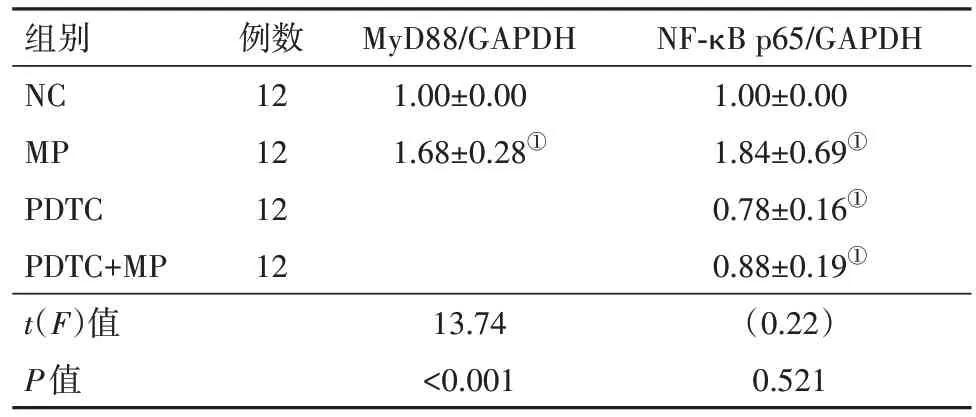
表6 肺炎支原體刺激的A549細胞中MyD88和NF-κB p65的表達變化/
注:NC為對照,MP為肺炎支原體,PTDC為吡咯烷二硫代氨基甲酸銨,GAPDH為甘油醛-3-磷酸脫氫酶。①與NC組比較,P<0.05。
NF-κB p65/GAPDH 1.00±0.00 1.84±0.69①0.78±0.16①0.88±0.19①(0.22)0.521組別NC MP PDTC PDTC+MP t(F)值P值例數12 12 12 12 MyD88/GAPDH 1.00±0.00 1.68±0.28①13.74<0.001
2.6 阻斷Myd88或NF-κB減弱MP刺激TNF-α表達 抑制MyD88或NF-κB后用MP刺激A549細胞顯示,PDTC和NBP2-29328均可顯著抑制MP誘導的TNF-α表達增加,見表7。
表7 阻斷Myd88或NF-κB減弱MP刺激TNF-α表達/(ng/L,)
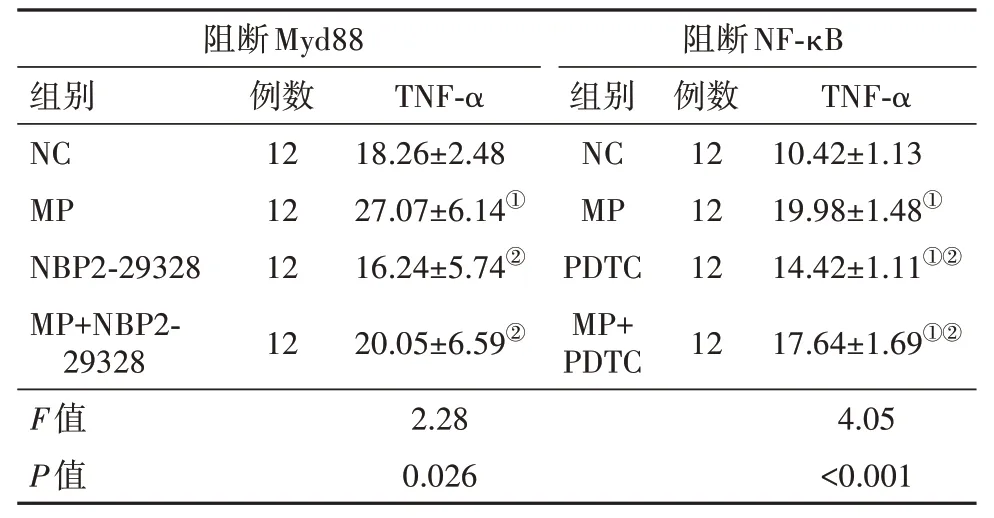
表7 阻斷Myd88或NF-κB減弱MP刺激TNF-α表達/(ng/L,)
注:NC為對照,MP為肺炎支原體。①與NC組比較,P<0.05。②與MP組比較,P<0.05。
阻斷Myd88阻斷NF-κB組別TNF-α例數TNF-α組別例數NC MP NBP2-29328 MP+NBP2-29328 F值P值10.42±1.13 19.98±1.48①14.42±1.11①②17.64±1.69①②4.05<0.001 12 12 12 12 18.26±2.48 27.07±6.14①16.24±5.74②20.05±6.59②2.28 0.026 NC MP PDTC MP+PDTC 12 12 12 12
3 討論
近年來,我國MPP發病率不斷上升,5歲以上兒童的感染率高達70%,MPP可導致急性呼吸道炎癥以及肺外綜合征,過度炎癥反應易引起不良臨床結果[8],了解炎癥介導的組織損傷的作用機制對預防和治療該病導致的嚴重并發癥具有重要意義。
上皮細胞具有分泌TNF-α的功能,黏附上皮細胞是MP致病的第一步,肺部炎癥和全身過度炎癥的發生可能是由MP和TNF-α共同刺激引發的中性粒細胞炎癥級聯反應介導的[9]。本研究顯示,MPP病兒血清TNF-α水平明顯高于NC組,RMPP組明顯高于MPP組(P<0.05)。中性粒細胞是重要的炎癥細胞,多形核中性粒細胞在MPP病兒的支氣管肺泡灌洗液和外周血中顯著增加[10]。在毒素誘導的肺損傷模型中,肺泡巨噬細胞可通過分泌TNF-α調節中性粒細胞募集[11]。之前的研究證實,MPP病兒外周血中性粒細胞顯著升高,尤其是RMPP病兒,因此中性粒細胞可能參與MPP的過度炎癥、肺炎和肺損傷[12]。本研究中,中性粒細胞TLR1、TLR2、TLR4和TLR6的mRNA水平在MPP病兒中顯著增加,且RMPP組高于MPP組(P<0.05),此外中性粒細胞和A549細胞經MP刺激后TNF-α和TLR2表達顯著增加(P<0.05)。TLR2在感染后氣道高反應性和慢性氣道炎癥的發展中起關鍵作用,Ju等[13]發現缺乏或抑制TLR2不僅可以防止博萊霉素誘導的炎癥,還能通過逆轉博萊霉素誘導的纖維化組織中的免疫抑制微環境來防止和逆轉進行性肺纖維化。Jung等[14]確定TLR-2可通過激活細胞內信號通路導致NF-κB易位及TNF-α和IL-1β分泌,是介導博萊霉素刺激的肺部炎癥和纖維化的關鍵受體。NF-κB位于TLR信號下游的關鍵位置,參與炎癥分子的調節、細胞凋亡、應激反應和腫瘤生長抑制等多種生理和病理過程,活化的NF-κB調節IL-4、IL-6、IL-8和TNF-α等炎癥因子的表達,并引發炎癥反應[15]。MyD88是TLR激活NF-κB的重要途徑,研究表明,TLR2-MyD88-NF-κB途徑與急性肺損傷、慢性阻塞性肺炎、哮喘、肺癌等肺部疾病的發生密切相關[16-17]。MP是一種無細胞壁微生物,細胞膜上的脂蛋白暴露于免疫細胞,因此TLR2是參與MP識別的最重要的TLR[18-19]。本研究側重于TLR2在MPP疾病中的作用,結果顯示,MP刺激后A549細胞中TLR2、MyD88和NF-κBp65水平明顯升高,而在抑制TLR2、MyD88或NF-κB后,MP誘導的TNF-α表達明顯降低。表明TLR2-MyD88-NF-κB途徑在MP誘導TNF-α產生中起重要作用。
綜上所述,TLR2可能通過TLR2-MyD88-NF-κB途徑介導TNF-α的表達并參與了肺部炎癥反應。TLR2的表達水平可作為潛在的MPP嚴重程度的判斷指標。

