不同水稻品種OsVDAC8的表達(dá)模式比較與亞細(xì)胞定位分析
蔣曉涵 覃永華 劉學(xué)群 李開 王春臺


摘要? [目的]研究OsVDAC8的理化性質(zhì)和表達(dá)模式,為探究OsVDAC8的功能提供基礎(chǔ)。[方法]用生物信息學(xué)分析OsVDAC8的結(jié)構(gòu)特征及表達(dá)譜,然后通過定量PCR對3個(gè)不同水稻品種日本晴(NIP)、粵泰A(YTA)、粵泰B(YTB)不同發(fā)育時(shí)期的不同組織中OsVDAC8的表達(dá)模式進(jìn)行分析,并通過BiFC對亞細(xì)胞定位進(jìn)行驗(yàn)證。[結(jié)果]OsVDAC8編碼區(qū)全長1 014 bp,編碼337 aa,生物信息學(xué)分析結(jié)果顯示,OsVDAC8是具有1個(gè)結(jié)構(gòu)域的穩(wěn)定的定位于線粒體的親水蛋白,通過11次跨膜形成特異的桶狀結(jié)構(gòu)。在ATG上游含有13個(gè)與水稻生長發(fā)育及脅迫應(yīng)答相關(guān)的順式作用元件。RiceXPro和 MSU Rice Genome Annotation Project水稻基因表達(dá)數(shù)據(jù)庫分析結(jié)果表明,NIP中OsVDAC8在生殖生長期的莖和花序出現(xiàn)前后幼穗中表達(dá)水平最高,在胚乳和根中的表達(dá)量較低。對NIP、YTA、YTB 3個(gè)水稻品種中OsVDAC8的表達(dá)譜分析結(jié)果顯示,OsVDAC8在3個(gè)水稻品種四葉期的葉鞘表達(dá)水平都非常高,在花粉內(nèi)容物充實(shí)期都很低,但幼穗發(fā)育的不同時(shí)期3個(gè)品種中表達(dá)水平差異很大,NIP中幼穗發(fā)育的整個(gè)時(shí)期表達(dá)量比較穩(wěn)定,YTB中表達(dá)量較低,而在YTA幼穗發(fā)育的中后期表達(dá)水平逐漸下降。亞細(xì)胞定位結(jié)果顯示,OsVDAC8定位于線粒體,與預(yù)測結(jié)果一致。[結(jié)論]OsVDAC8在3個(gè)水稻品種中表達(dá)模式不同,YTB中整個(gè)幼穗發(fā)育過程中表達(dá)量較低,YTA幼穗發(fā)育的中后期表達(dá)水平逐漸下降,而NIP中幼穗發(fā)育的整個(gè)時(shí)期表達(dá)量都比較穩(wěn)定。OsVDAC8定位于線粒體。
關(guān)鍵詞? 水稻;OsVDAC8;表達(dá)模式;亞細(xì)胞定位
中圖分類號? S511? 文獻(xiàn)標(biāo)識碼 ?A
文章編號? 0517-6611(2024)04-0081-06
doi:10.3969/j.issn.0517-6611.2024.04.017
開放科學(xué)(資源服務(wù))標(biāo)識碼(OSID):
Comparison of Expression Patterns in Different Rice Varieties and Subcellular Localization Analysis of OsVDAC8
JIANG Xiao.han,QIN Yong.hua,LIU Xue.qun et al
(Hubei Provincial Key Laboratory for Protection and Application of Special Plants in Wuling Area of China,Key Lab for Biotechnology of State Ethnic Affairs Commission,College of Life Science,South.Central University for Nationalities,Wuhan,Hubei 430074)
Abstract? [Objective]To study the physical and chemical properties and expression patterns of OsVDAC8 for providing a basis for further investigation of the function of OsVDAC8.[Method]The structural characteristics and expression profile of OsVDAC8 were analyzed by bioinformatics.The expression patterns of OsVDAC8 in different tissues of three rice varieties,Nipponbare (NIP),Yuetai A (YTA) and Yuetai B (YTB) at different developmental stages were analyzed by quantitative PCR,and the subcellular localization was verified through BiFC.[Result]There were 1 014 bp and encodes 337 aa in the OsVDAC8 coding region.The results of bioinformatics analysis showed that OsVDAC8 is a stable hydrophilic protein with one domain localized to mitochondria,and forms a specific barrel.like structure through 11 transmembrane.There are 13 cis.acting elements related to rice growth and development and stress response in the upstream of ATG.Analysis via rice XPro and MSU Rice Genome Annotation Project rice gene expression database showed that? OsVDAC8 was expressed in the stem and panicle before and after the appearance of inflorescences during the reproductive growth period,and the expression was low in the endosperm and root in NIP.The expression profile analysis of OsVDAC8 in three rice varieties NIP,YTA and YTB? showed that the leaf sheath expression level of OsVDAC8 was very high in the four.leaf stage of the three rice varieties and very low in the pollen content enrichment stage,but very different in the three rice varieties at different stages of young panicle development.In NIP,the expression level was relatively stable during the whole stage of young panicle development,while in YTB,the expression level was low,and in YTA,the expression level decreased gradually during the middle and late stage of young panicle development.The subcellular localization results showed that OsVDAC8 was localized to mitochondria,which was consistent with the prediction results.[Conclution]The expression patterns of OsVDAC8 were different in different rice varieties.OsVDAC8 was localized to mitochondria.
Key words? Rice;OsVDAC8;Expression pattern;Subcellular localization
基金項(xiàng)目? 國家自然科學(xué)基金項(xiàng)目(31170226 )。
作者簡介? 蔣曉涵(1999—),女,湖北荊門人,碩士研究生,研究方向:分子遺傳學(xué)。*通信作者,教授,博士,碩士生導(dǎo)師,從事分子遺傳學(xué)研究。
收稿日期? 2023-03-19
電壓依賴性陰離子通道 (VDAC)是定位于線粒體外膜的主要轉(zhuǎn)運(yùn)蛋白,最初從酵母中分離出來,存在于從真菌到動物和植物的所有生物體中[1]。哺乳動物和昆蟲 VDAC是一個(gè)由19條反向平行反向鏈組成的桶狀結(jié)構(gòu),其中N端螺旋折疊到孔中[2]。所有生物體的VDAC具有相似的基本電生理特性(電導(dǎo)、選擇性和電壓依賴性)[3]。線粒體和細(xì)胞質(zhì)之間的無機(jī)離子和代謝物的交換對于許多線粒體功能是必不可少的。多種轉(zhuǎn)運(yùn)蛋白(離子通道、載體和ABC轉(zhuǎn)運(yùn)蛋白)介導(dǎo)通過線粒體內(nèi)膜(MIM)的選擇性轉(zhuǎn)運(yùn)[4]。相比之下, VDAC是線粒體外膜(MOM)中多種化合物的主要轉(zhuǎn)運(yùn)途徑,如無機(jī)離子(如K+、Na+和Cl-)、代謝物(如ATP和AMP)和大分子(如tRNA)等[5]。VDAC的開放狀態(tài)對多價(jià)陰離子代謝物(如ATP)具有陰離子選擇性和滲透性。而VDAC的關(guān)閉狀態(tài)使通道有陽離子選擇性。然而,通道仍然具有足夠的電導(dǎo)性,可以傳輸小離子[6]。VDAC的開放/關(guān)閉對機(jī)體的細(xì)胞器代謝具有重要的調(diào)節(jié)作用。除了調(diào)節(jié)代謝物轉(zhuǎn)運(yùn)的功能外,VDACs還參與了細(xì)胞的程序性死亡[7]。
植物VDAC不僅參與植物發(fā)育過程,還參與環(huán)境應(yīng)激反應(yīng)[8]。擬南芥 AtVDAC2和AtVDAC4中的T-DNA插入敲除突變導(dǎo)致成熟葉片的生長嚴(yán)重遲緩。除atvdac3外,所有敲除突變體的花粉粒數(shù)、花粉發(fā)芽率和發(fā)芽花粉管長度均顯著降低[9]。AtVDAC1 能調(diào)節(jié)擬南芥對農(nóng)桿菌感染的能力[10],AtVDAC2參與鹽脅迫反應(yīng)途徑[11]。小麥TaVDAC1 的過表達(dá)(OE)增強(qiáng)了轉(zhuǎn)基因擬南芥對鹽脅迫的耐受性并降低了對干旱的抗性[12]。AtVDAC3 和硫氧還蛋白m2(AtTrx m2)之間存在相互作用均調(diào)節(jié)ROS的積累,且 AtVDAC3 的過表達(dá)增加了H2O2的積累,而AtTrx m2的過表達(dá)減少了NaCl處理中H2O2的積累[13]。因此,植物VDACs在調(diào)節(jié)植物生長及應(yīng)對壓力方面發(fā)揮關(guān)鍵作用[14]。
通過水稻全基因組掃描鑒定出了8個(gè)OsVDAC 基因[15],并利用生物信息學(xué)網(wǎng)站分析了OsVDAC1-8基因精細(xì)結(jié)構(gòu)[16]。OsVDAC3在生殖生長期的莖、花序出現(xiàn)前后幼穗及雄蕊成熟花粉中表達(dá)水平最高,OsVDAC3的表達(dá)可能與雄性的育性相關(guān)[17]。OsVDAC5在水稻各個(gè)部位不同時(shí)期均有高表達(dá)[18], OsVDAC6可能與水稻耐鹽和耐旱有關(guān)[19];osvdac4純合突變體幼苗對ABA脅迫具有更好的抗性[20]。OsVDAC家族中OsVDAC8鮮見報(bào)道。筆者通過生物信息學(xué)方法分析其表達(dá)譜、預(yù)測其順式作用元件,并以3個(gè)水稻品種(日本晴、紅蓮型不育系粵泰A和保持系粵泰B)不同發(fā)育時(shí)期幼穗以及四葉期幼苗根、鞘和葉為材料,對OsVDAC8基因表達(dá)模式進(jìn)行分析,旨在為研究OsVDAC8的功能提供參考。
1? 材料與方法
1.1? 材料
水稻品種日本晴(NIP)、紅蓮型不育系粵泰 A(YTA)及保持系粵泰 B(YTB)種子,HBT-GFP質(zhì)粒、DH5α菌株均來源于中南民族大學(xué)生物技術(shù)國家民委重點(diǎn)實(shí)驗(yàn)室。
1.2? 生物信息學(xué)分析
1.2.1? OsVDAC8蛋白的理化性質(zhì)。使用線上工具ExPASy-Protparam(https://web.expasy.org /protparam/)進(jìn)行理化性質(zhì)分析,Protscale線上軟件(https://web.expasy.org/protscale/)進(jìn)行親水性、疏水性分析,CDD軟件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)進(jìn)行蛋白保守功能區(qū)分析,SOPMA(https://npsa.prabi.ibcp.fr/cgi.bin/npsa_automat.pl?page=npsa_sopma.html)進(jìn)行蛋白二級結(jié)構(gòu)分析,Swissmodel(https://www.expasy.org/resources/swiss-model)進(jìn)行蛋白三級結(jié)構(gòu)預(yù)測,Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)行蛋白亞細(xì)胞定位分析。
1.2.2? 順式作用元件預(yù)測。
在 NCBI數(shù)據(jù)庫下載 OsVDAC8(Chr3 LOC_Os03g20750)起始ATG前5 000 bp的DNA序列,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在線分析預(yù)測順式作用元件。
1.2.3? 表達(dá)模式分析預(yù)測。
從水稻 4-44K基因表達(dá)芯片RAPDB中提取NIP OsVDAC8(Chr3 LOC_Os03g20750)在不同生長發(fā)育階段不同組織中的表達(dá)譜(RiceXPro,http://ricexpro.dna.affrc.go.jp/)[21],通過Hierarchical cluster分析[22]使用MeV (MultiExperiment Viewer)表示基因的表達(dá)模式。在MSU Rice Genome Annotation Project水稻基因表達(dá)數(shù)據(jù)庫中 (http://rice.plantbiology.msu.edu/expression.shtml)下載基因的表達(dá)數(shù)據(jù),用omega作圖軟件繪圖分析基因的表達(dá)模式。
1.3? 不同水稻品種表達(dá)模式分析
1.3.1? RNA提取與反轉(zhuǎn)錄。
水稻種子按常規(guī)方法萌發(fā)及種植。分別取NIP、YTA和YTB四葉期根、葉鞘和葉, 5個(gè)不同發(fā)育時(shí)期的幼穗[23](穗生長期 I:小穗長度小于0.4 cm;穗生長期 Ⅱ:小穗長度0.5~1.0 cm;穗生長期Ⅲ:小穗長度1.5~4.0 cm;穗生長期 IV:小穗長度5.0~<10.0 cm;穗生長期V:小穗長度大于10.0 cm),加液氮磨碎成粉末狀,用TriZOL法提取總RNA并反轉(zhuǎn)。利用CorYeabio公司反轉(zhuǎn)試劑盒反轉(zhuǎn)得到cDNA(體系:All-in-One First-Strand Synthesis MasterMix 4 μL,dsDNase 1 μL,Total RNA 3 μg,加Nuclease-Free Water up to 20 μL),將反應(yīng)體系放置于 PCR儀,50 ℃,15 min;85 ℃,5 s;處理完后立即置于冰上。將cDNA原液稀釋5倍,混勻,吸取1 μL作為模板,用actin引物檢測cDNA質(zhì)量(15 μL體系:ddH2O 5.7 μL, Fast Mix 1.5 μL,引物各 0.4 μL,cDNA 1.3 μL),PCR反應(yīng)程序:96 ℃預(yù)變性4 min,96 ℃變性30 s,59 ℃退火30 s,72 ℃延伸30 s,34個(gè)循環(huán),72 ℃延伸6 min。反應(yīng)結(jié)束后,取6 μL產(chǎn)物進(jìn)行電泳檢測。引物序列見表1。
1.3.2? 熒光定量PCR。
用水稻actin為內(nèi)參基因 ,每個(gè)樣品3個(gè)重復(fù),15 μL反應(yīng)體系:水4.7 μL,2× qPCR SYBR Green Master Mix 7.5 μL,引物各0.4 μL,cDNA 2.0 μL。反應(yīng)程序:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40個(gè)循環(huán);95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s;0 ℃保存。根據(jù)儀器生成的數(shù)據(jù)計(jì)算該基因在 3種水稻材料不同組織中的表達(dá)量。
1.4? OsVDAC8的亞細(xì)胞定位
1.4.1? HBT-GFP-OsVDAC8載體構(gòu)建。
以NIP cDNA為模板,用設(shè)計(jì)好的HBT-VDAC8-F和HBT-VDAC8-R進(jìn)行擴(kuò)增,PCR體系同cDNA檢測,反應(yīng)程序:97 ℃預(yù)變性5 min,97 ℃變性30 s,68 ℃退火30 s,72 ℃延伸1 min,35個(gè)循環(huán),72 ℃延伸8 min。用Axygen切膠回收試劑盒回收后得到目的片段,用BamHI酶切HBT-GFP載體和目的片段,將酶切產(chǎn)物進(jìn)行回收,用CorYeabio公司同源重組試劑盒重組后再轉(zhuǎn)化至DH5α感受態(tài)細(xì)胞中,涂布含有氨芐青霉素(100 μg/mL)的LB固體培養(yǎng)基,并挑取飽滿的單克隆,擴(kuò)大培養(yǎng)后提取質(zhì)粒DNA進(jìn)行PCR及酶切鑒定,將陽性克隆測序。
1.4.2? 水稻原生質(zhì)體的轉(zhuǎn)化和亞細(xì)胞定位分析。
通過聚乙二醇介導(dǎo)法將質(zhì)粒導(dǎo)入水稻原生質(zhì)體。使用暗培養(yǎng) 10~13 d NIP的黃化苗浸泡于0.6 mol/L Mannitol 溶液中,在培養(yǎng)皿中用新刀片將黃化苗快速切割成2 mm左右的小片段,靜置8 min 后過濾,加入酶解液(10 mL 酶解液含 7.5 mL 0.8 mol/L Mannitol,1.0 mL 0.1 mol/L MES,0.150 g Cellulose 和0.075 g Macerozyme),置于28 ℃搖床50 r/min振蕩酶解6 h,加入 10 mL W5(50 mL W5 溶液含 5.00 mL 1.54 mol/L NaCl,6.25 mL 1 mol/L CaCl2,1.25 mL 0.2 mol/L KCl 和 1.00 mL 0.1 mol/L MES,加入 ddH2O 定容至 50 mL)后放置10 min,用W5溶液將裁剪好的6層紗布潤濕,通過紗布將酶解液過濾到新的潔凈離心管中,1 000 r/min加減速度均為1,室溫離心5 min,棄上清。加入1 mL W5溶液輕搖重懸原生質(zhì)體,冰上靜置30 min,取20 μL懸液鏡檢觀察原生質(zhì)體質(zhì)量。1 000 r/min加減速度均為1,離心5 min,棄上清,加入預(yù)冷的400 μL MMG溶液(10.0 mL MMG 溶液含7.5 mL 0.8 mol/L Mannitol,0.3 mL 0.5 mol/L MgCl2和 0.4 mL 0.1 mol/L MES,加ddH2O 至 10 mL),重懸原生質(zhì)體后置于冰上。將質(zhì)粒加入2 mL EP管底,吸取200 μL原生質(zhì)體懸液加入離心管中,將質(zhì)粒和原生質(zhì)體混勻,加入等體積的PEG-CaCl2溶液(1 mL PEG-CaCl2 含 0.55 mL 0.8 mol/L Mannitol,0.4 g PEG 4 000,置于55 ℃孵育3 h,加入 100 μL CaCl2 和50 μL ddH2O),混勻后避光靜置20 min進(jìn)行轉(zhuǎn)化。加入4倍體積W5溶液,輕搖混勻以停止轉(zhuǎn)化,1 000 r/min加減速度均為1,離心5 min。棄上清,加入3倍體積的W5溶液清洗原生質(zhì)體去除殘留的PEG-CaCl2,1 000 r/min加減速度均為1,室溫離心5 min。重復(fù)該步驟1次。棄上清,加入500 μL W1溶液重懸原生質(zhì)體,25 ℃避光過夜培養(yǎng),制片及染色處理后置于CLSM下觀察熒光情況。
2? 結(jié)果與分析
2.1? OsVDAC8蛋白生物信息學(xué)分析
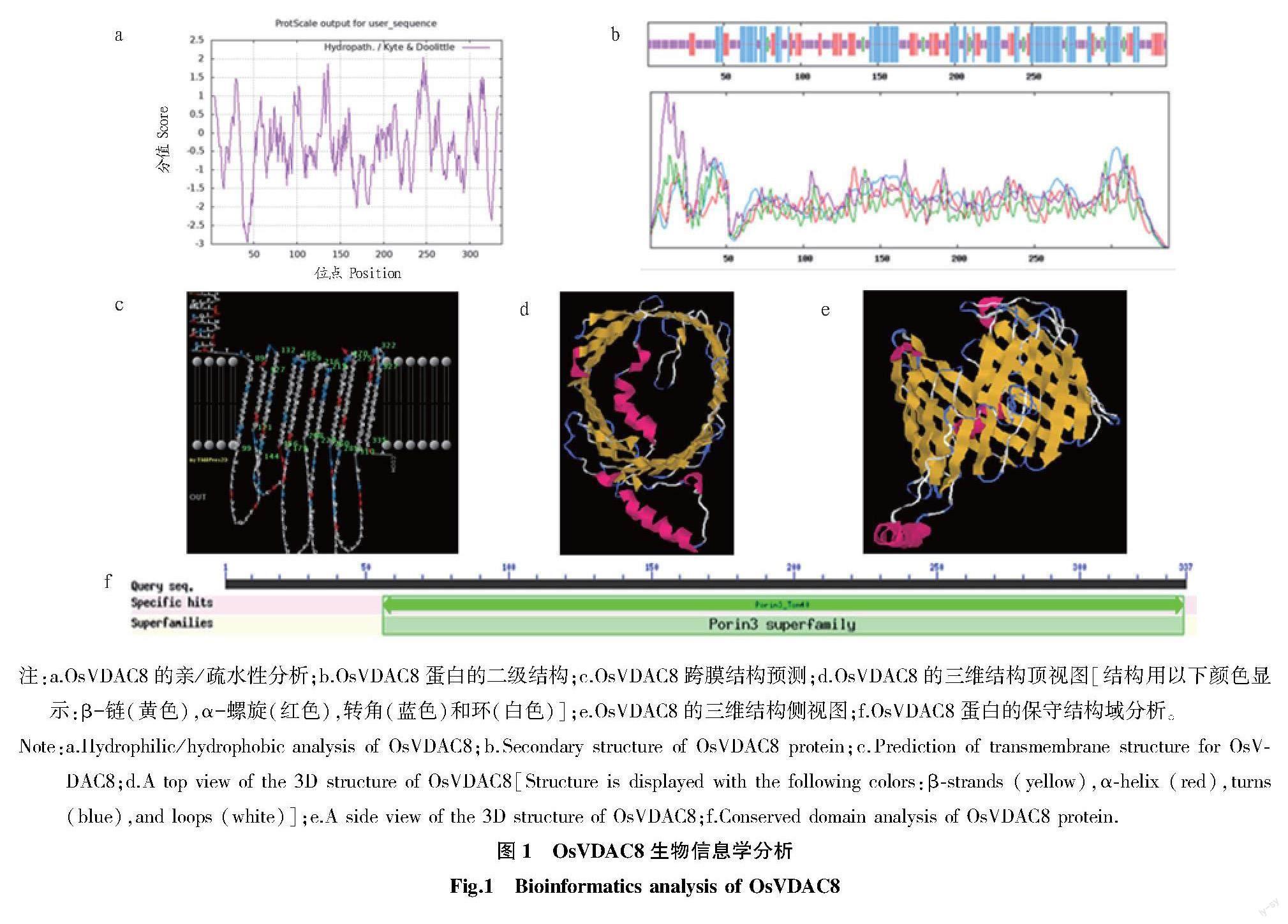
ExPASy-Protparam線上軟件的分析結(jié)果表明,OsVDAC8是1個(gè)由337 aa構(gòu)成,分子式為C1617H2577N443O497S16,相對分子量為37 337.47,理論等電點(diǎn)為6.46的蛋白質(zhì)(圖1)。該蛋白的不穩(wěn)定指數(shù)為36.40,表現(xiàn)出穩(wěn)定性,其脂肪系數(shù)為72.64,總平均親水系數(shù)為-0.316。用Protscale線上網(wǎng)站對OsVDAC8蛋白的親水性進(jìn)行預(yù)測,結(jié)果顯示,信號圖中峰值散布于負(fù)值的信號明顯大于正值部分(圖1a),OsVDAC8蛋白是一個(gè)穩(wěn)定的具有親水性的蛋白。SOPMA結(jié)果表明,OsVDAC8蛋白的空間構(gòu)象可能主要由無規(guī)則卷曲結(jié)構(gòu)構(gòu)成(圖1b)。Swissmodel結(jié)果顯示,OsVDAC8蛋白含有1個(gè)Porin3_Tom40結(jié)構(gòu)域,11次跨膜(圖1c),且折疊形成特異的桶狀結(jié)構(gòu)(圖1d和圖1e)。CDD結(jié)果表明,該蛋白屬于Porin3超家族(圖1f)。Cell-PLoc2.0結(jié)果顯示其定位于線粒體。
2.2? 順式作用元件預(yù)測
用PlantCARE (http:∥bioinformatics.psb.ugent.be/webtools/plantcare/html/) 對OsVDAC8 起始ATG前5 000 bp的序列進(jìn)行生物信息學(xué)分析,發(fā)現(xiàn)了13種可信度較高的順式作用元件(表2)。該啟動子含有多種與植物發(fā)育相關(guān)順式作用元件,推測這個(gè)基因在水稻的生長發(fā)育過程中可能具有重要作用。基因含有與發(fā)育相關(guān)的順式作用元件為ABRE、ARE、CAT-box、CGTCA-motif、P-box、LTR、MBS、TC-rich repeats、GATA-motif、TCA-element、TGA-element等。
2.3? 表達(dá)譜的生物信息學(xué)分析
利用RiceXpro(http:∥ricexpro.dna.affrc.go.jp/GGEP/sample.list.php)分析了OsVDAC8在水稻品種NIP中48個(gè)發(fā)育階段的表達(dá)譜。該基因平均信號值對數(shù)的層次聚類結(jié)果(圖2)表明,其在不同生長發(fā)育階段表達(dá)差異顯著,OsVDAC8在所有組織和時(shí)期都表達(dá),在胚乳中表達(dá)水平最低,OsVDAC8在花序出現(xiàn)前后及子房中表達(dá)量較高。
2.4? OsVDAC8在3個(gè)水稻品種中表達(dá)模式比較
分別取NIP、不育系 YTA和保持系 YTB四葉期根、葉鞘和葉片, 5個(gè)不同發(fā)育時(shí)期幼穗,用 TriZOL法提取總 RNA,反轉(zhuǎn)后的cDNA用actin引物檢測,結(jié)果顯示,cDNA不含基因組DNA,且能擴(kuò)增出特異條帶(圖3)。圖4顯示,OsVDAC8在這3個(gè)水稻品種的表達(dá)模式差異顯著,不育系YTA中OsVDAC8在四葉期葉、葉鞘和幼穗發(fā)育的前期表達(dá)水平都較高,根及幼穗發(fā)育花粉內(nèi)容物充實(shí)期表達(dá)水平最低;保持系YTB中在四葉期葉鞘表達(dá)水平非常高,根、葉及幼穗發(fā)育過程中都是低水平表達(dá); NIP的四葉期葉鞘和枝梗原基分化期中都有非常高的表達(dá),其他時(shí)期的表達(dá)差異不大,幼穗發(fā)育的整個(gè)時(shí)期表達(dá)量都比較穩(wěn)定。
2.5? OsVDAC8的亞細(xì)胞定位分析
用BamHI酶切HBT-GFP質(zhì)粒DNA并回收,通過同源重組技術(shù)將OsVDAC8全長CDS整合到HBT-GFP線性化載體上轉(zhuǎn)化大腸桿菌,涂布含有氨芐青霉素(100 μg/mL)的LB 固體培養(yǎng)基,挑取單克隆擴(kuò)大培養(yǎng)后提取質(zhì)粒 DNA,進(jìn)行 PCR 及酶切鑒定,將陽性克隆測序(圖 5),結(jié)果顯示,HBT-OsVDAC8-GFP 載體構(gòu)建成功。HBT-OsVDAC8-GFP 轉(zhuǎn)化水稻黃化幼苗原生質(zhì)體,培養(yǎng) 10 h 后用線粒體染料染色 15 min,制片后在激光共聚焦顯微鏡下觀察熒光分布,結(jié)果顯示,OsVDAC8 定位于線粒體(圖 6)。
3? 討論與結(jié)論
擬南芥中有4個(gè)VDAC基因,AtVDAC1、AtVDAC2和AtVDAC4在植物生長、葉片和花粉發(fā)育及維持線粒體膜電位的穩(wěn)定狀態(tài)方面發(fā)揮了重要作用。多項(xiàng)證據(jù)表明,線粒體深度參與雄性配子體發(fā)育,許多線粒體基因突變影響雄性配子體發(fā)育,甚至導(dǎo)致細(xì)胞質(zhì)雄性不育。AtVDAC1突變影響雌配子發(fā)育。AtVDAC1普遍存在于擬南芥的根、莖、葉、花序、角果、幼苗和種子中,且表達(dá)水平都很高[24]。筆者前期研究了OsVDAC4和OsVDAC6的表達(dá)譜,發(fā)現(xiàn)OsVDAC6在幼穗早期發(fā)育時(shí)期,Nip 與YTB 中OsVDAC6維持較低的表達(dá),而YTA 中OsVDAC6表達(dá)水平出現(xiàn)高峰,OsVDAC4在Nip、YTB和YTA中均在花粉粒充實(shí)成熟期時(shí)OsVDAC4表達(dá)量達(dá)到最高,推測其可能參與調(diào)控水稻花粉粒的成熟過程。OsVDACs在調(diào)控水稻育性中的作用尚不清楚,有待深入研究其作用機(jī)理。
為了研究OsVDAC8的功能,首先對其進(jìn)行了生物信息學(xué)分析,OsVDAC8是一個(gè)穩(wěn)定的親水蛋白,二級結(jié)構(gòu)主要由
無規(guī)則卷曲構(gòu)成,可能定位在線粒體上;預(yù)測的啟動子序列含有與植物生長發(fā)育、繁殖及脅迫應(yīng)答等密切相關(guān)的元件,推測其在水稻生長發(fā)育的不同時(shí)期及組織的表達(dá)模式可能有差異。RiceXpro結(jié)果表明,OsVDAC8在NIP不同生長發(fā)育階段表達(dá)差異顯著,在生殖生長期的葉鞘、花序出現(xiàn)前后幼穗中表達(dá)水平最高,在胚乳和根中的表達(dá)量較低。
分析了OsVDAC8在3個(gè)不同品種 NIP、YTA和 YTB幼穗發(fā)育的不同時(shí)期和組織中的表達(dá),結(jié)果表明,在3個(gè)水稻品種中表達(dá)模式不同。在NIP中OsVDAC8在根中的表達(dá)量最低,在葉鞘到枝梗分化期的表達(dá)量較高,在雌雄蕊開始分化到花粉充實(shí)完熟期的表達(dá)量差別不大;OsVDAC8在YTB與NIP的幼穗發(fā)育時(shí)期的表達(dá)模式大同小異,而在YTA中隨著雌雄蕊的形成和穎花的發(fā)育OsVDAC8的表達(dá)量逐漸降低,YTB和NIP都是雄性可育品種,而YTA是細(xì)胞質(zhì)雄性不育品種,這些結(jié)果可能說明OsVDAC8的表達(dá)可能與水稻的育性有關(guān)聯(lián)。亞細(xì)胞定位結(jié)果顯示,OsVDAC8定位于線粒體,與預(yù)測結(jié)果一致。該研究初步分析了OsVDAC8的特性,為深入研究OsVDAC8基因的功能提供基礎(chǔ)。
參考文獻(xiàn)
[1]LI Z Y,XU Z S,HE G Y,et al.The voltage.dependent anion channel 1 (AtVDAC1) negatively regulates plant cold responses during? germination and seedling development in Arabidopsis? and interacts with calcium sensor CBL1[J].Int J Mol Sci,2013,14(1):701-713.
[2]ZINGHIRINO F,PAPPALARDO X G,MESSINA A,et al.VDAC genes expression and regulation in mammals[J].Front Physiol,2021,12:1-14.
[3]NAJBAUER E E,BECKER S,GILLER K,et al.Structure,gating and interactions of the voltage.dependent anion channel[J].Eur Biophys J,2021,50(2):159-172.
[4]ASHRAF M,MAO Q L,HONG J,et al.HSP70.16 and VDAC3 jointly inhibit seed germination under cold stress in Arabidopsis[J].Plant Cell Environ,2021,44(11):3616-3627.
[5]SRIVASTAVA S R,MAHALAKSHMI R.Evolutionary selection of a 19-stranded mitochondrial β.barrel scaffold bears structural and functional significance[J].J Biol Chem,2020,295(43):14653-14665.
[6]TAKAHASHI Y,TATEDA C.The functions of voltage.dependent anion channels in plants[J].Apoptosis,2013,18(8):917-924.
[7]RAVI B,KANWAR P,SANYAL S K,et al.VDACs:An outlook on biochemical regulation and function in animal and plant systems[J].Front Physiol,2021,12:1-15.
[8]KARACHITOS A,GRABIN′SKI W,BARANEK M,et al.Redox.sensitive VDAC:A possible function as an environmental stress sensor revealed by bioinformatic analysis[J].Front Physiol,2021,12:1-10.
[9]HEMONO M,UBRIG ,AZEREDO K,et al.Arabidopsis voltage.dependent anion channels (VDACs):Overlapping and specific functions in mitochondria[J].Cells,2020,9(4):1-14.
[10]KWON T.Mitochondrial porin isoform AtVDAC1 regulates the competence of Arabidopsis thaliana to Agrobacterium.mediated genetic transformation[J].Mol Cells,2016,39(9):705-713.
[11]LIU Z,LUO Q H,WEN G Q,et al.VDAC2 involvement in the stress response pathway in Arabidopsis thaliana[J].Genet Mol Res,2015,14(4):15511-15519.
[12]YU M,YU Y,SONG T Q,et al.Characterization of the voltage-dependent anion channel (VDAC) gene family in wheat (Triticum aestivum L.) and its potential mechanism in response to drought and salinity stresses[J].Gene,2022,809:1-11.
[13]KANWAR P,SAMTANI H,SANYAL S K,et al.VDAC and its interacting partners in plant and animal systems:An overview[J].Crit Rev Biotechnol,2020,40(5):715-732.
[14]KANWAR P,SANYAL S K,MAHIWAL S,et al.CIPK9 targets VDAC3 and modulates oxidative stress responses in Arabidopsis[J].Plant J,2022,109(1):241-260.
[15]夏春皎,劉學(xué)群,王春臺.水稻線粒體滲透性轉(zhuǎn)換孔相關(guān)基因家族的系統(tǒng)發(fā)育研究[C]//湖北省植物生理學(xué)會第十五次學(xué)術(shù)研討會論文集.黃岡:湖北省植物生理學(xué)會,黃岡師范學(xué)院,2007:60.
[16]羅鳳燕.水稻 vdac、ant及 HL-SP1 基因的表達(dá)研究[D].武漢:中南民族大學(xué),2010.
[17]王亞楠.水稻OsVDAC3及其互作蛋白亞細(xì)胞定位和功能初步分析[D].武漢:中南民族大學(xué),2019.
[18]XU X,TAN Y P,CHENG G,et al.Genomic survey and gene expression analysis of the VDAC gene family in rice[J].Genet Mol Res,2015,14(4):15683-15696.
[19]龔秋涵.水稻OsVDAC6功能及調(diào)控機(jī)制的初步研究[D].武漢:中南民族大學(xué),2020.
[20]馬明月.水稻OsVDAC4與其互作蛋白功能的初步研究[D].武漢:中南民族大學(xué),2022.
[21]SATO Y,TAKEHISA H,KAMATSUKI K,et al.RiceXPro version 3.0:Expanding the informatics resource for rice transcriptome[J].Nucleic Acids Res,2013,41:D1206-D1213.
[22]EISEN M B,SPELLMAN P T,BROWN P O,et al.Cluster analysis and display of genome.wide expression patterns[J].Proc Natl Acad Sci USA,1998,95(25):4863-14868.
[23]廣東省德慶縣永豐中學(xué)農(nóng)科組.利用倒五葉觀察水稻幼穗分化[J].農(nóng)業(yè)科技通訊,1977(7):6.
[24]潘曉迪.擬南芥電壓依賴性陰離子通道基因AtVDACs功能分析[D].北京:中國農(nóng)業(yè)大學(xué),2014.

