綿羊支原體肺炎病原巢式PCR檢測方法的建立與應用
楊華 周華倩 黃新 齊宇 余乾 張文喆 楊永林 侯扶琴

摘要? [目的]建立一種診斷綿羊支原體肺炎病原的巢式PCR方法,確定肺炎支原體感染的靶器官。[方法]根據GenBank網站上登錄的綿羊支原體16S rRNA基因序列,設計并合成2對引物,以肺炎支原體菌株基因組DNA為模板,經過PCR反應條件的優化,通過測序驗證擴增產物的正確性,建立了綿羊支原體肺炎病原的巢式PCR檢測方法,進而應用建立的方法完成臨床陽性病料肺臟、肺淋巴、心臟、腎臟、肝臟、脾臟、皮膚、小腸和外周血檢測以及疑似樣本肺臟組織的檢測。[結果]建立的巢式PCR方法可擴增出864 bp的特異性目的片段,肺臟和肺淋巴為綿羊肺炎支原體感染的靶器官,臨床樣本巢式PCR檢出率與支原體培養鑒定結果的符合率為100%。 [結論]建立的綿羊支原體肺炎病原巢式PCR檢測方法可用于臨床樣本的實驗室診斷。
關鍵詞? 綿羊肺炎支原體;巢式PCR;檢測方法
中圖分類號? S852.62? 文獻標識碼? A? 文章編號? 0517-6611(2024)04-0074-04
doi:10.3969/j.issn.0517-6611.2024.04.015
開放科學(資源服務)標識碼(OSID):
Establishment and Application of Nested PCR Detection Method of Pathogens of Mycoplasma ovipneumonia
YANG Hua1,2,ZHOU Hua.qian1,2,HUANG Xin1 et al
(1.State Key Laboratory of Sheep Genetic Improvement and Healthy Production, Xinjiang Academy of Agricultural and Reclamation Science, Shihezi, Xinjiang 832000;2.College of Animal Science and Technology, Shihezi University, Shihezi,Xinjiang 832000)
Abstract? [Objective]In order to establish a nested polymerase chain reaction (PCR) for detecting the pathogens of Mycoplasma ovipneumonia, and determine the target organs of mycoplasma infection. [Method]According to the 16S rRNA sequence of sheep mycoplasma in GenBank website, two pairs of specific primers were designed and synthesized. PCR reaction conditions were optimized by using the genome DNA of M. ovipneumonia as templates. The nested PCR products were verified by sequencing. A nested PCR method for detecting the pathogens of M. ovipneumonia was established. The established method was used to detect the? lung, lung lymph, heart, kidney, liver, spleen, skin, small intestine and peripheral blood of clinical positive samples, and the lung tissue from clinical suspected samples. [Result]864 bp specific gene fragment was amplified by using nested PCR method. The lung and lung lymph of sheep were the target organs of mycoplasma infection. The coincidence rate between the detection rate of clinical samples by the nested PCR and pathogen culture and identification results was 100%. [Conclusion]The nested PCR method for detection of M. ovipneumonia could be applied for the laboratory diagnosis of clinical samples.
Key words? Mycoplasma ovipneumonia;Nested PCR;Detection method
基金項目? 新疆維吾爾自治區肉毛兼用絨毛用羊品種選育提升計劃項目(2022XJRMY-03);新疆生產建設兵團農業科技創新工程專項(NCG202211);新疆生產建設兵團重大科技項目(2017AA006);國家肉羊產業技術體系項目(CARS-38)。
作者簡介? 楊華(1977—),男,湖南長沙人,研究員,博士,從事動物遺傳育種與繁殖研究。
收稿日期? 2023-03-05
羊支原體肺炎又稱羊傳染性胸膜肺炎,是危害世界養羊業的主要傳染病之一。綿羊肺炎支原體(Mycoplasma ovipneumoniae,MO)是引起綿羊增生性、間質性支原體肺炎的主要病原[1],可通過空氣、飛沫、飲水等途徑傳播,具有高度接觸傳染性,主要臨床癥狀有喘氣、咳嗽、高熱、精神萎靡、漸進性消瘦和慢性增生性間質性肺炎等[2]。綿羊在每個季節均可感染肺炎支原體,但春季和冬季的感染率最高,1—3月齡羔羊最易感染發病,感染率髙達95.3%,病死率達到27.5%[1]。綿羊肺炎支原體的感染范圍十分廣泛,呈全世界范圍分布和流行,尤其在養羊業比重較大的不發達國家發病率較高,造成了一定的經濟損失,嚴重影響養羊業的發展。
綿羊肺炎支原體主要引起肺臟的病變,還可以造成心臟、肝臟、脾臟、腎臟、腦、淋巴結的損害。一般認為綿羊肺炎支原體的靶器官是肺臟,臨床上主要表現為呼吸道癥狀,通過病原分離培養和PCR檢測,在包括肺臟在內的多個器官中檢測到支原體。因此,研究人員認為肺臟不是肺炎支原體感染的唯一靶器官[3]。目前,用于綿羊肺炎支原體常規診斷的方法包括病原分離培養鑒定、血清學檢測、免疫組織化學檢測、酶聯免疫吸附試驗(ELISA)檢測,近些年也出現了核酸探針和PCR等較為先進的檢測方法[4]。但是,核酸探針需要放射性同位素標記,不易普及。巢式PCR是在常規PCR的基礎上,以第1輪PCR擴增產物為模板進行第2輪PCR擴增,經2輪PCR得到目的基因片段。與常規PCR相比,巢式PCR的特異性和靈敏度更高[5]。巢式PCR已被用于牛肺炎支原體[6]、豬肺炎支原體[7]、細胞支原體[8]和惡性瘧原蟲培養中支原體[9]的檢測,但未見到用于綿羊肺炎支原體的檢測報道。筆者針對綿羊支原體16S rRNA序列設計引物,建立肺炎支原體巢式PCR診斷方法,進而檢測分析臨床病料肺臟和肺淋巴等9種組織中的肺炎支原體,明確肺炎支原體感染的靶器官,旨在為綿羊支原體感染的診斷、預防和流行病學調查提供參考。
1? 材料與方法
1.1? 材料
1.1.1? 主要試劑。細菌基因組DNA提取試劑盒、血液/細胞/組織基因組DNA提取試劑盒、瓊脂糖凝膠DNA回收試劑盒、DL2000 DNA Marker(天根生化科技(北京)有限公司)、Ex Taq酶(寶日醫生物技術(北京)有限公司)、瓊脂糖(Biowest公司)。
1.1.2? 主要儀器。高速離心機(生工生物工程(上海)股份有限公司,中國);PCR儀(杭州朗基科學儀器有限公司,中國);電泳儀(北京六一生物科技有限公司,中國);凝膠成像儀(UVP公司,美國)。
1.1.3? 菌株。綿羊肺炎支原體菌株由省部共建綿羊遺傳改良與健康養殖國家重點實驗室分離、鑒定,-80 ℃下保存。
1.2? 方法
1.2.1? 臨床病料與病原分離。在試驗區周邊4個羊場采集53只疑似肺炎支原體病死綿羊的肺臟組織,3只健康綿羊屠宰后取肺臟組織。另外,采集經病原分離培養,確診感染肺炎支原體病死綿羊的肺臟、肺淋巴、心臟、腎臟、肝臟、脾臟、皮膚、小腸和外周血,制備EDTA-Na2抗凝血。支原體分離培養參考文獻[10]的方法,以確定臨床病例感染的病原。
1.2.2? 引物設計。根據 GenBank 網站發表的綿羊支原體16S rRNA基因序列(GenBank登錄號為EU265780.1),應用Primer Premier 5軟件設計引物,引物序列見表1,引物由生工生物工程(上海)有限公司合成。
1.2.3? DNA提取。????? 應用細菌基因組DNA提取試劑盒提取綿羊肺炎支原體菌株的基因組DNA,血液/細胞/組織基因組DNA提取試劑盒提取外周血、肺淋巴、肺臟、心臟、腎臟、肝臟、脾臟、皮膚、小腸組織的基因組DNA,以上均按照試劑盒說明書操作,提取的DNA經1%瓊脂糖凝膠電泳檢測。
1.2.4? PCR反應體系和程序的建立。分別以提取的肺炎支原體菌株和陰性健康綿羊肺臟組織的基因組DNA為模板,進行巢式PCR擴增體系和擴增條件的優化。優化的第1輪擴增PCR反應體系(25 μL)如下:10×Ex Taq buffer(含Mg2+)2.50 μL,dNTP Mixture(各2.5 mmol/L)2.00 μL,ovi1F(10 μmol/L)0.50 μL,ovi1R(10 μmol/L)0.50 μL,Ex Taq(5 U/μL)0.25 μL,去離子水18.25 μL,基因組DNA(50 ng/μL)1.00 μL。將上述溶液混合,按以下程序進行PCR反應:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35個循環;72 ℃ 5 min。第2輪擴增PCR反應體系(25 μL)如下:取1 μL第1次擴增產物,引物使用ovi2F和ovi2R,其余成分和使用量同第1次PCR。PCR反應程序同第1次PCR。PCR反應結束后,使用1.5%瓊脂糖凝膠對5 μL PCR產物進行電泳檢測。
1.2.5? PCR產物的測序驗證。PCR擴增產物經瓊脂糖凝膠DNA回收試劑盒純化,與pMD18-T載體在25 ℃以下連接,轉化到感受態細胞DH5α 中,在氨芐抗性平板上篩選出陽性克隆,提取質粒,經PCR鑒定為陽性的克隆質粒送交生工生物工程(上海)有限公司測序,序列用GenBank數據庫BLASTN在線比對分析。
1.2.6
肺炎支原體感染的靶器官鑒定。以確診感染肺炎支原體病死綿羊的肺淋巴、肺臟、心臟、腎臟、肝臟、脾臟、皮膚、小腸和外周血組織的基因組DNA為模板,應用建立的巢式PCR方法檢測綿羊支原體,PCR產物使用1.5%瓊脂糖凝膠電泳檢測。
1.2.7? 臨床樣本的檢測。以53份疑似肺炎支原體感染的臨床病例肺臟組織DNA為模板,應用建立的巢式PCR方法檢測綿羊支原體肺炎病原。使用分離、鑒定的菌株作為對照,與每一個臨床樣本PCR檢測結果進行對照,計算二者的符合率。
2? 結果與分析
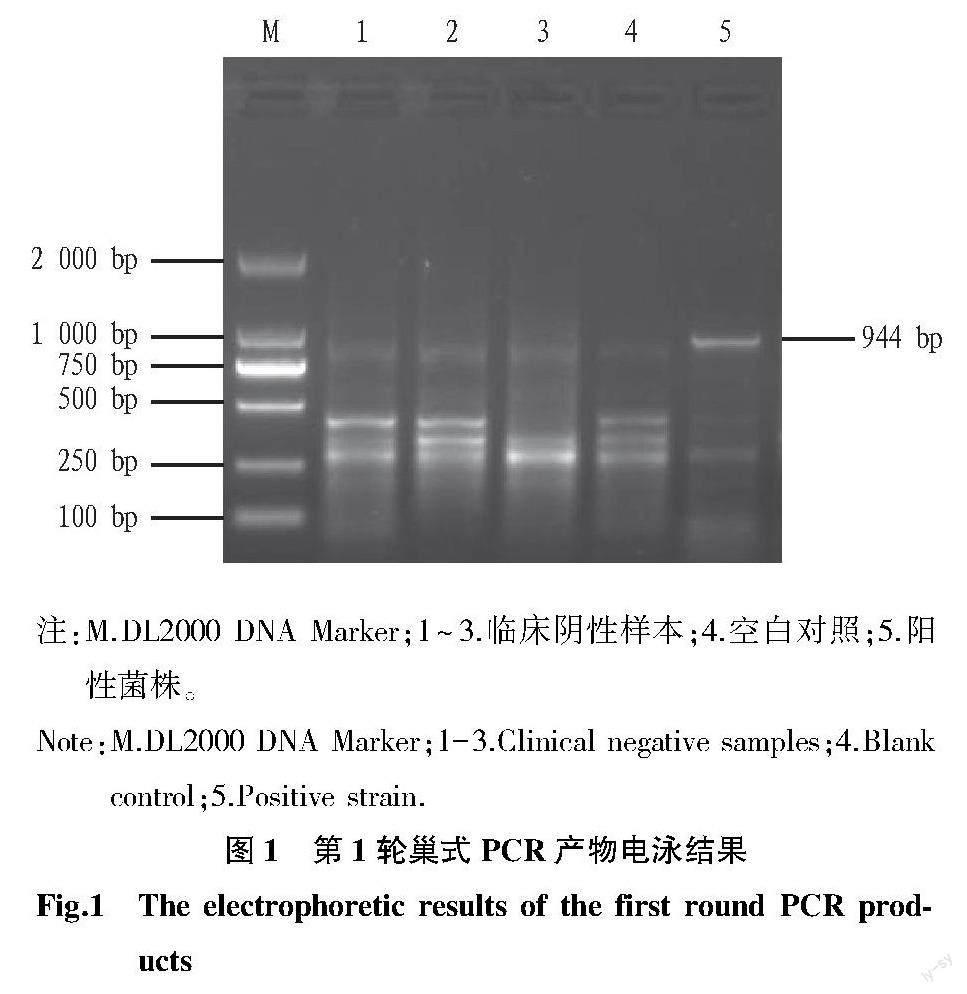
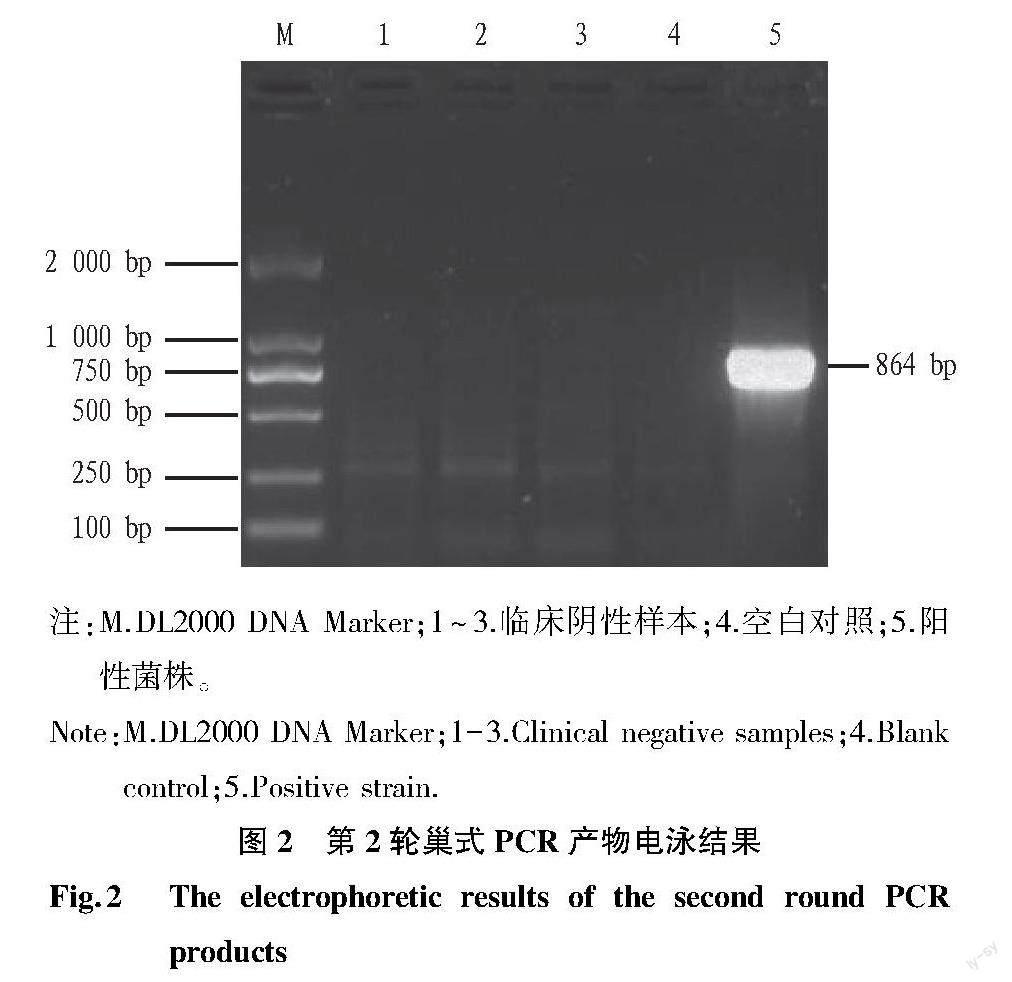
2.1? PCR檢測結果? 第1輪和第2輪PCR擴增產物經1.5%瓊脂糖凝膠電泳檢測,第1輪巢式PCR產物的電泳結果見圖1。從圖1可以看出,陽性菌株、空白對照和陰性樣本的PCR產物均存在非特異性擴增,陽性菌株存在944 bp的目的條帶。圖2為第2輪巢式PCR產物電泳結果。從圖2可以看出,陽性菌株擴增出864 bp的特異性條帶,空白對照和陰性樣本的PCR產物未見特異性條帶。
2.2? PCR產物測序
PCR產物的克隆質粒經測序和序列分析,結果表明擴增產物序列與綿羊肺炎支原體16S核糖體RNA基因序列匹配(GenBank登錄號為EU265780.1),序列一致性為99%,證明擴增產物為綿羊肺炎支原體的基因片段。
2.3 ?肺炎支原體感染的靶器官鑒定結果
應用建立的巢式
PCR方法對確診感染肺炎支原體病死綿羊的肺臟等9個組織DNA進行擴增,PCR產物經瓊脂糖凝膠電泳檢測發現,在肺臟和肺淋巴DNA中擴增出目的基因,其他組織無目的基因擴增(圖3),說明綿羊的肺臟和肺淋巴為肺炎支原體感染的靶器官。
2.4? 臨床樣品的檢測
應用建立的巢式PCR方法對采集的53例疑似肺炎支原體感染的臨床病例肺臟組織DNA進行檢測,結果發現A羊場的12個樣本沒有擴增出目的基因,另3個羊場(B、C、D羊場)均擴增出特異性目的基因片段,與支原體病原分離培養結果一致。由表2可知,二者的符合率達到100%,說明建立的巢式PCR方法可用于綿羊肺炎支原體感染的臨床樣本診斷。
3? 討論
綿羊肺炎支原體(MO)是羊群中常見的病原菌之一,其傳播范圍廣,感染的羊只病程呈慢性,康復后可長期帶菌,很難預防和控制,MO是嚴重危害養羊業的一種致病性支原體。環境誘因和其他病原因素使羊體免疫力下降,MO可趁勢侵入機體。感染MO的羔羊死亡率增加,羊只出現慢性營養消耗、生長緩慢、繁殖率下降、出欄延后、飼養成本大幅度提高,給養殖場帶來巨大的經濟損失[11]。然而,感染MO的臨床癥狀和病理變化特征不明顯,且容易與巴氏桿菌、肺炎鏈球菌和化膿桿菌等混合感染或繼發感染,導致臨床診斷較難。檢測取樣中,病料極易受到其他支原體和細菌的污染,因此病料的選擇也非常關鍵。Mackay等[12]于1963年在英格蘭首次從綿羊體內分離到MO,隨后在世界上不同國家和地區均有發現。Manlove等[13]對美國農業部國家健康檢測系統中453只綿羊進行檢測,發現MO檢出率為88%。黃秀君等[14]對攀枝花不同地區山羊MO感染進行血清學調查,結果顯示陽性率為46%。韓林梅等[15]對廣西6個主要牛、羊養殖場24 000份羊血清進行MO抗體檢測,發現MO個體陽性率為40.66%,群體陽性率為77.14%。由此可見,MO在世界范圍內廣泛流行,造成巨大的經濟損失,已成為制約養羊業健康發展的主要疾病之一。因此,有必要建立準確的MO診斷方法,開展綿羊支原體肺炎病原的檢測,提高群體健康水平。
目前用于綿羊肺炎支原體的檢測方法主要有病原學檢測、免疫學檢測及分子生物學檢測。病原分離培養鑒定雖然是金標準,但因為MO基因組小,自身合成能力有限,對培養條件要求苛刻,實際操作耗時、煩瑣[16]。血清學檢測相較于分離培養方法速度快、檢測量大、檢出率高,但該方法容易發生血清學交叉反應,在實際應用中存在一定的局限性[17]。免疫組化檢測中,由于MO感染引起的羊支原體肺炎為慢性傳染病,菌體量的積累相對較少,且支原體附著于細胞表面或者存在胞質中,導致免疫組化檢測陽性信號不明顯,檢測結果不易判定[18]。隨著分子生物學技術的發展,PCR已成為檢測綿羊肺炎支原體的一個重要方法。屈勇剛等[19]應用綿羊臨床鼻拭子標本建立了肺炎支原體PCR檢測方法。李媛等[20]應用PCR方法檢測了湖羊肺臟病料中的支原體。馮旭飛等[21]應用綿羊肺臟組織建立肺炎支原體和溶血性曼氏桿菌雙重 PCR檢測方法。儲岳峰等[22]建立了絲狀支原體山羊亞種和綿羊肺炎支原體的雙重PCR方法。筆者以GenBank網站上發表的綿羊支原體16S rRNA基因部分序列為參考序列,設計用于巢式PCR檢測的2對引物,經過PCR反應體系和反應條件的優化,建立了檢測綿羊支原體肺炎病原的巢式PCR方法,在肺炎支原體菌株中擴增出864 bp特異性目的條帶,測序結果表明PCR產物為目的基因片段。臨床陽性綿羊9個組織樣品的巢式PCR結果證明肺炎支原體感染的靶器官為肺臟和肺淋巴,說明針對肺炎支原體的檢測,病料要采集肺臟或肺淋巴才能確保檢測的準確性。該試驗進一步應用建立的巢式PCR方法對4個羊場53份疑似樣品進行了檢測,結果在6份經支原體病原培養鑒定確診的肺臟組織中擴增出目的條帶,其余均未擴增出特異性條帶,且巢式PCR檢測結果與支原體分離培養的病原學診斷結果一致,說明所建立的巢式PCR方法作為綿羊肺炎支原體PCR檢測方法的補充,可用于支原體感染的臨床樣品診斷,為綿羊肺炎支原體病原的快速檢測及早期預防提供技術支持。
參考文獻
[1]王旭,張曉宇,張建華,等.綿羊肺炎支原體P130蛋白主要抗原域原核表達及其間接ELISA檢測方法的建立[J].中國獸醫科學,2018,48(3):281-287.
[2]鄭佳琪,黃海碧,王曉暉,等.綿羊肺炎支原體、絲狀支原體山羊亞種和精氨酸支原體多重PCR檢測方法的建立及應用[J].中國獸醫學報,2016,36(7):1131-1134.
[3]陶岳,李新萍,林為民,等.綿羊肺炎支原體對肺及肺外臟器影響的研究[J].中國畜牧獸醫,2007,34(2):98-99.
[4]江錦秀,林裕勝,張靖鵬,等.綿羊肺炎支原體感染的診斷和防治技術研究進展[J].福建農業學報,2019,34(12):1463-1470.
[5]白方方,武昱孜,靳蒙蒙,等.巢式PCR檢測豬鼻支原體方法的建立及應用[J].中國獸醫學報,2013,33(7):1007-1010.
[6]李大偉,張彥明,黃燦平,等.應用巢式PCR方法檢測牛支原體肺炎[J].中國動物檢疫,2010,27(4):28-29.
[7]吉瑪,娘洛,張淑云.豬肺炎支原體巢式PCR診斷方法的建立及應用[J].家畜生態學報,2014,35(3):53-57.
[8]黃海軍,高其雙,彭霞,等.細胞支原體巢式PCR檢測方法的建立及應用[J].湖北農業科學,2014,53(3):690-693.
[9]胡東偉,丁帥,胡守鋒,等.應用巢式PCR對惡性瘧原蟲培養中支原體污染的檢測[J].中國病原生物學雜志,2012,7(1):32-33,29.
[10]何衛新,康立超,楊華,等.羔羊肺炎病原分離鑒定[J].中國獸醫雜志,2013,49(4):37-39.
[11]黃海碧.綿羊肺炎支原體檢測方法的建立及黏附蛋白的研究[D].呼和浩特:內蒙古農業大學,2016.
[12]MACKAY J,NISBET D,FOGGIE A.Isolation of pleuropneumonia.like organisms(Genus Mycoplasma)from case of sheep pulmonary adenomatosis(SPA)[J].Vet Rec,1963,75(21):550-551.
[13]MANLOVE K,BRANAN M,BAKER K,et al.Risk factors and productivity losses associated with Mycoplasma ovipneumoniae infection in United States domestic sheep operations[J].Prev Vet Med,2019,168:30-38.
[14]黃秀君,童俊青,萬潔,等.攀枝花山羊的綿羊肺炎支原體感染血清學調查[J].畜牧與獸醫,2015,47(8):154.
[15]韓林梅,吳翠蘭,李軍,等.廣西牛羊主要呼吸道疫病的血清學調查[J].今日畜牧獸醫,2018,34(10):17-19.
[16]梁小軍,沈志鵬,許斌,等.泰妙菌素治療綿羊肺炎霉形體病的效果觀察[J].寧夏農林科技,2002,43(6):17-36.
[17]THIRKELL D,SPOONER R K,JONES G E,et al.Cross.reacting antigens between Mycoplasma ovipneumoniae and other species of mycoplasma of animal origin,shown by ELISA and immunoblotting with reference antisera[J].Vet Microbiol,1991,26(3):249-261.
[18]SEN A,GUPTA D,JAGANI R.Rapid in.situ hybridization and immunohistochemistry:A pilot comparative study of two rapid diagnostic techniques for establishing monoclonality in plasma cell dyscrasias[J].Med J Armed Forces India,2020,76(1):103-108.
[19]屈勇剛,剡根強,陳宏偉,等.綿羊肺炎支原體PCR檢測方法的建立[J].石河子大學學報(自然科學版),2005,23(6):687-689.
[20]李媛,陶岳,阿依吐拉·肉孜,等.從湖羊肺臟中分離綿羊肺炎支原體的鑒定[J].中國預防獸醫學報,2006,28(4):375-379.
[21]馮旭飛,王遠微,李定霏,等.綿羊肺炎支原體和溶血性曼氏桿菌雙重PCR檢測方法的建立及應用[J].中國預防獸醫學報,2014,36(10):788-791.
[22]儲岳峰,高鵬程,趙萍,等.應用雙重PCR方法檢測羊支原體肺炎病原[J].畜牧與獸醫,2009,41(12):23-26.

