大別班達病毒的遺傳進化機制研究
張宇涵,李 超,王玉昊,韋雪敏,許一菲,2
大別班達病毒(Dabie bandavirus, DBV)是一種新型的布尼亞病毒,2009年由于學杰等人在中國首次發現并分離鑒定[1]。DBV主要通過蜱蟲叮咬傳播給人類,引起發熱伴血小板減少綜合征(SFTS),臨床表現為高熱、血小板和白細胞計數減少等癥狀,并伴有中樞神經癥狀、胃腸道癥狀等[1]。SFTS的地方性散發流行期為4-10月。2011-2021年,SFTS年平均病死率為5.11%[2]。SFTS在中國主要流行于河南、湖北、山東、浙江、遼寧等省份[3-4]。
DBV屬于Bunyavirales目,Phenuiviridae科,Bandavirus屬。DBV是單股負鏈分節段的RNA病毒,包含L、M、S 3個片段,分別編碼RNA依賴的RNA聚合酶(RdRp)、糖蛋白(Gp)、非結構蛋白(NSs)和核蛋白(NP)[5]。參與病毒的復制與轉錄的L基因編碼的RdRp蛋白,是最保守的蛋白,進化速率也較慢;S基因編碼的NSs蛋白主要參與宿主的免疫調節,其系統發育最為多樣,是保守性最低的蛋白,進化速率也較快[6]。可根據地理位置和系統發育關系,將DBV劃分為主要包括中國毒株的中國譜系(C1-C5),主要包括日本和韓國毒株的日本譜系(J1-J3)[6,8]。此外,兩個潛在的亞譜系C6和J4在2017年的一項研究中得到了鑒定[9]。此前有研究表明,雖然中國和日本地區的DBV毒株可能源自同一祖先,但他們的親緣關系較遠,這暗示著很早以前,兩個地區的毒株就已開始各自獨立進化[8]。重配是分節段病毒特有的遺傳進化事件,當多株不同型別的病毒感染同一宿主時,其RNA片段會進行混合,從而產生新特性的病毒。重組和重配事件會對病毒的傳播力和致病性產生影響,是病毒進化的潛在動力[6,10]。選擇壓力指的是外界環境在生物進化過程中對其進化方向產生影響的作用力。病毒的進化選擇壓力來自于宿主的免疫壓力和生態環境的變化。病毒容易通過自身的突變來逃避宿主免疫壓力或適應新的環境,繼而發生適應性變化,導致免疫防治或者藥物治療效果不佳。
本研究對截至2023年7月已發布的數據庫全部的DBV各片段全長基因序列進行系統發育分析、基因重組和重配分析以及選擇壓力分析,闡明DBV的基因型流行分布特征,探究DBV進化機制的動態變化,為DBV的預防控制提供科學依據。
1 材料與方法
1.1 數據來源 在VIPR數據庫和GenBank數據庫下載DBV全長序列(下載于2023年7月),并記錄序列分離時間、地點,以及樣本類型。其中,L片段序列1 407條,M片段序列1 424條,S片段序列1 598條,構建以上3個數據集。在Refseq(https://www.ncbi.nlm.nih.gov/refseq/)下載毒株HB29為參考株(基因序列登錄號:NC_018136.1-018138.1)。
1.2 方法
1.2.1 系統發育分析 對3個數據集的序列分別進行系統發育分析。使用MAFFT軟件進行多序列比對,使用Iqtree軟件以最大似然法分別構建基于L、M、S片段的系統發育樹(bootstraP=1000)[11],并利用R軟件包ggtree對獲得的最大似然樹進行可視化和修飾[12]。
1.2.2 重組和重配分析 本研究運用RDP4(Recombination Detection Program4)軟件對1.1提及的3個數據集包含的所有序列中的重組事件進行檢測。經RDP4內置的7種算法(RDP[13]、Bootscan[14]、himaera[15]、Seq[16]、GENECONV[17]、Lard、SiScan)檢測,序列被4種以上方法檢測為重組陽性且P< 0.05時,即被認為是潛在重組事件。
基于L、M、S 3個片段的系統發育分析結果,在含有DBV全長基因組的1 025株毒株中,篩選含有不同基因型的節段的潛在重配毒株。
1.2.3 選擇壓力分析 使用Bioedit進行L、M、S片段的核苷酸和氨基酸同源性分析,使用Mega11.0軟件的Pairwise distance功能,選擇p-distance模型,分別計算3個片段的遺傳距離區間。
使用Mega11.0軟件的Nei-Gojobori method(No.of Differences)模型分別計算L、M、S 3個片段的dN和dS的值。當dN/dS> 1時,認為發生正向選擇作用;當dN/dS< 1時,認為發生負向選擇作用。
2 結 果
2.1 DBV系統發育分析 L、M、S 3個片段的進化樹結果顯示,DBV可分為9種基因型別:C1-C6和J1-J3。L、M片段比S片段多出C6型。3個片段中屬于C2、C4型的序列數量最多,C2、C3型涵蓋的地域范圍最廣,J1、J2型包含的宿主類型最豐富。中國的DBV序列主要分布在C譜系,其中河南省和湖北省的優勢基因型是C2,其次是C4型,山東省的優勢基因型為C3型。日本、韓國的DBV序列以J譜系為主,且優勢基因型均為J1型。同時,J1型的浙江部分毒株和日本毒株在同一個支系,J2型的河南部分毒株和韓國毒株在同一支系。
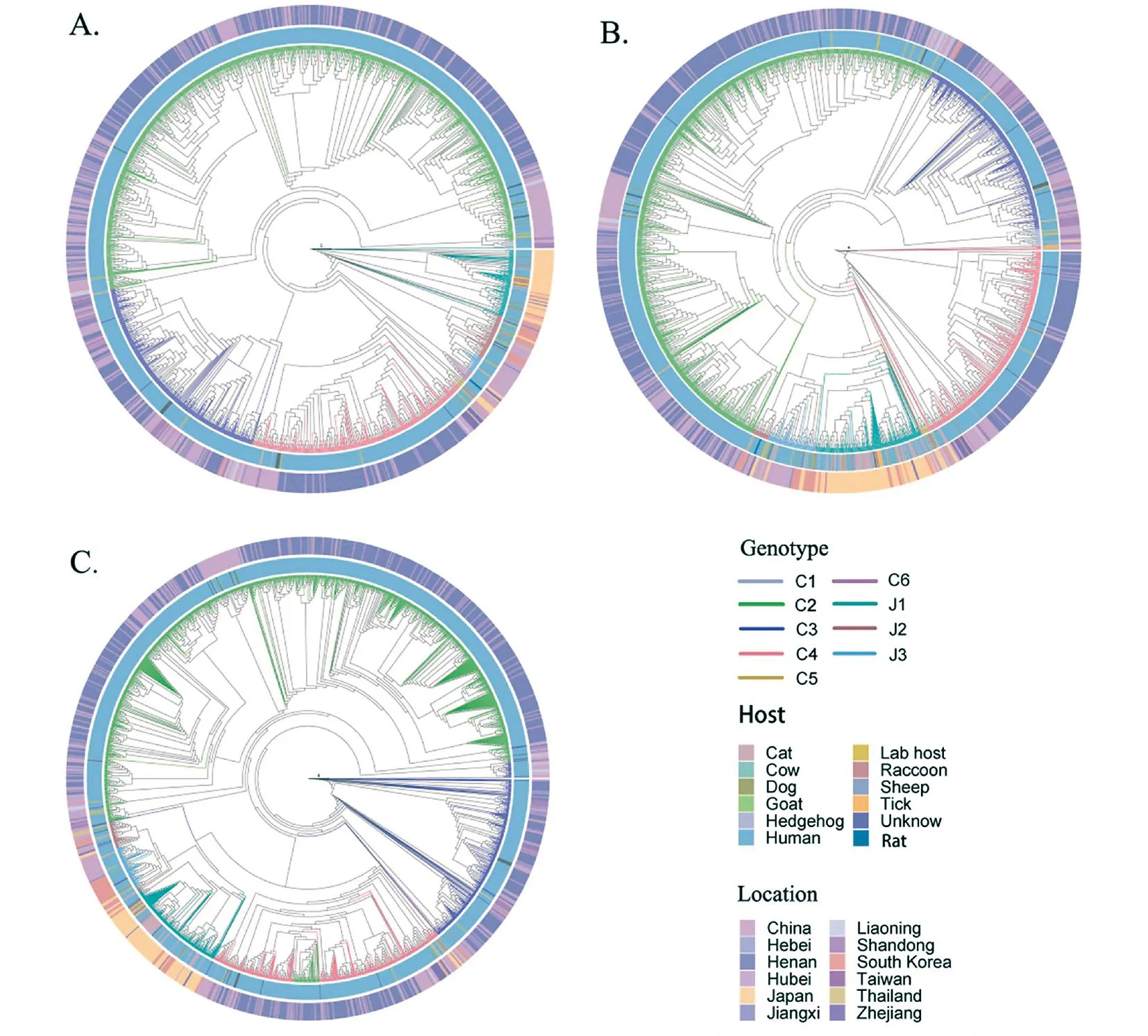
注:ABC分別代表系統發育進化樹的L、M、S片段。
2.2 DBV重組和重配結果 經RDP4軟件篩選后,在本研究數據集中發現88株毒株中存在98個潛在重組事件(表1),L、M、S片段分別發現49、41、28個重組事件。其中,L片段的重組率最高,為3.48%(49/1 407),M片段的重組率為2.88%(41/1 424),S片段重組率最低,為1.75%(28/1 598)。毒株2011YXX9的3個片段均發生了重組,另有11株毒株的兩個片段發生了重組,如毒株13-China_Henan-275、毒株HNXY_31、毒株NB32/CHN/2013等。此外,在10株毒株中發現了存在多次重組事件的節段,例如毒株2011YSC60、毒株HB2012-171、毒株2011YXX9等。上述結果表明L片段發生重組的概率較高,S片段發生重組的概率較低。人類樣本發生重組事件的數量較多(74/88),蜱蟲和家畜樣本較少(10/88)。L、M、S片段中,人類宿主檢測到重組的概率分別為2.5%、2.9%、1.8%,動物(蜱蟲和家畜)宿主檢測到重組的概率分別為5.9%、3.0%、5.1%。在非人類宿主中檢測到重組事件的比例高于人類宿主,且相較之前的研究(各片段均0.99%)[18]有所增加。

表1 DBV發生重組的毒株統計
根據L、M、S三個片段的系統發育分析結果,在148株重配株中發現了36種重配基因型(圖2),其中20種類型已被先前的研究報道過[6-9]。主要的重配類型為C4C4C2 (32/148)、J2J3J3 (16/148)和C2C1C2(10/148)。絕大部分重配毒株發現于人源樣本(133/148),有9株來源于家畜(5/148)、蜱蟲(3/148)和小型哺乳動物(1/148),此外還有5株來源于實驗室宿主。同時,大部分動物宿主來源的重配株均來自日本(3/9)。

圖2 DBV 36種重配株的組合圖Fig.2 Genetic constellation of the 36 potential DBV reassortants
同時,我們發現24株同時發生重組和重配的毒株(表1)。其中有兩株毒株(SFTSV/Dog/1/Thailand/2022、TNB1590)分離自動物宿主。
2.3 DBV基因同源性及遺傳距離分析 DBV毒株間表現出較高的同源性,L、M、S片段的核苷酸同源性分別為94.8%~99.9%,91.8%~99.9%,88.8%~99.9%;RdRp基因、Gp基因、NS基因、NP基因的氨基酸同源性分別為97.9%~100%,92.7%~100%,79.6%~99.6%,86.9%~100%(表2)。

表2 DBV基因核苷酸和氨基酸同源性結果
DBV 3個基因的總體遺傳距離分別為0.005、0.015和0.047,L片段的遺傳距離區間為0.00~0.02,M片段的遺傳距離區間為0.00~0.06,S片段的遺傳距離區間為0.00~0.11(表3)。
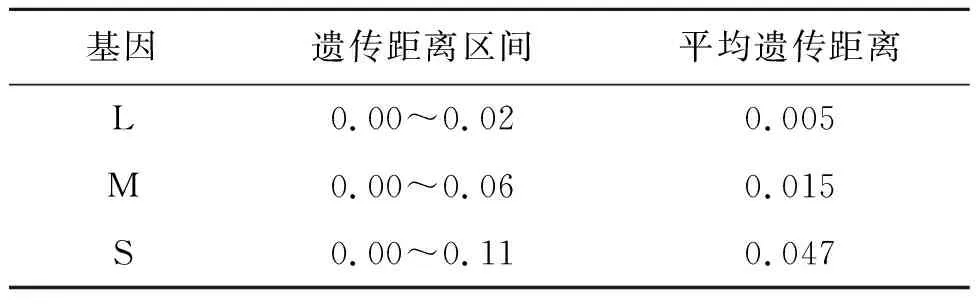
表3 DBV毒株遺傳進化距離分析結果
結果表明S片段的核苷酸和氨基酸同源性均低于L、M片段,與其他兩者相比,遺傳距離也較大。
2.4 DBV選擇壓力分析 通過Mega 11.0軟件對DBV編碼的4個蛋白進行了全局dN/dS分析(如表4所示),結果顯示,4個蛋白的dN/dS值均小于1,表明在進化過程中,4個蛋白均受到負選擇壓力的作用。而與L基因、M基因和NP蛋白相比,NS蛋白的dN/dS值最高為0.18。

表4 DBV蛋白的dN/dS比值結果
3 討 論
由DBV感染引發的SFTS是我國目前急需解決的公共衛生問題,它是一種易誘發多種臨床病癥且病死率較高的蜱媒傳染病,目前尚無獲得臨床批準的SFTS特效抗病毒藥物,支持治療是SFTS患者的主要臨床治療方式[19-21]。自最初發現以來,DBV已在中國、日本[22]、韓國[23]等超過25個國家被發現,在美國[24]和澳大利亞[25]也相繼發現了一些新白蛉病毒與DBV存在著密切進化關系。2017年,DBV被世界衛生組織(WHO)列為十大最受關注的病原之一[26]。該研究通過測定公共數據庫的全部DBV基因組序列,對DBV的遺傳進化從全序角度進行了深入系統的研究。
本研究驗證了絕大多數DBV型別的分布具有地域性,在DBV的兩大譜系中,C譜系主要包括中國毒株,J譜系主要包括韓國和日本毒株[27]。小部分毒株的基因型存在跨地域分布,Yun Y等將中日韓間的DBV基因型分布與候鳥遷徙路線結合分析,認為候鳥可能在DBV的跨地域傳播中發揮著重要作用[6,28]。
本研究進一步證實了先前研究報道過的重組情況[28-29],并在人類宿主與動物宿主分離出的DBV毒株中均發現重組的現象,且動物宿主的重組率高于人類宿主。大部分重組DBV毒株是來自人源樣本,而小部分動物宿主來源的毒株也作為親本序列促進或參與了重組的發生,說明動物宿主也提供了進行重組的場所。在蜱蟲、狗、貓、刺猬等不同動物宿主來源的毒株中都發現DBV重組現象,并且近年來動物宿主發生重組的比例在增加,這表明DBV可以發生廣泛的跨物種傳播和感染。本研究發現了16種未被報道過的重配型別,提示DBV的毒力和流行傳播能力正在發生改變,此發現對疾病的控制具有重要意義。重配事件所涉及的不同的地域,表明DBV可能在不同的地域之間進行遷移。蜱蟲曾被認為可能是適合DBV重配株的來源[26],本研究中重配株的宿主多樣性提示,除蜱蟲外,家畜或伴侶動物也可能會加強DBV重配現象的產生。越來越多的動物宿主如狗、貓、牛等參與DBV的重組、重配事件中,使其進化機制的豐富度不斷提高,這對DBV疫苗的設計和SFTS的預防產生了更大的挑戰。
基因組全編碼區的選擇壓力分析對其疫苗和藥物的開發具有較大的指導意義。本研究結果表明影響DBV進化的主要選擇壓力是負選擇壓力,這一結論與以往的研究一致[30]。4個基因的dN/dS值均小于1,其中NS基因的dN/dS值高于其他3個基因,這可能與NS基因編碼的蛋白有關。NSs能夠通過拮抗干擾素而影響毒力,進而幫助病毒逃避宿主的抗病毒反應,從而參與宿主的免疫調節[9]。NSs為保守性最低的蛋白,其進化速率也較快。相比于其他兩個片段,NS基因較低的同源性和較遠的平均遺傳距離進一步驗證了NSs基因片段具有較高突變能力。由于蛋白中的氨基酸變化可能影響其功能,進而影響DBV的感染性和致病力[6],基因型特異性的突變位點是否存在還需要進一步被探索。
利益沖突:無
引用本文格式:張宇涵,李超,王玉昊,等.大別班達病毒的遺傳進化機制研究[J].中國人獸共患病學報,2024,40(2):171-178. DOI:10.3969/j.issn.1002-2694.2024.00.027

