一氧化氮供體型藥物對牙齦卟啉單胞菌體外抗菌活性的影響
江玉梅 張紫薇 王吉天 楊 宇*
(1.京東口腔醫院綜合科,北京 101200;2.首都醫科大學附屬北京朝陽醫院口腔科,北京 100043)
近年來,隨著口腔種植學的迅猛發展,種植體修復已經被越來越多地應用于臨床。種植體周圍炎是導致種植體失敗的主要原因之一,其患病率高達11%~47%[1-2]。牙齦卟啉單胞菌(Porphyromonasgingivalis,P.g)是種植體周圍炎的主要致病菌,并主要以菌斑生物膜形式附著在種植體表面。如何有效抑制或清除P.g附著以控制感染已經成為維護種植體周圍組織健康、減少種植體周圍骨吸收、降低種植體周圍炎發生率的重要策略[3]。
目前科研工作者針對P.g的抗抑菌做了大量的研究工作,概括起來主要有兩種主流方法:一是通過金屬離子(銀離子、銅離子等)殺滅P.g,但銅、銀等金屬離子對人體同樣存在較大危害[4];二是通過抗生素藥物殺滅P.g,然而,抗生素的長期和不正當使用容易導致P.g產生耐藥性[5]。因此,尋找一種不僅能有效殺滅P.g而又不會令P.g產生耐藥的藥物是目前種植體周圍炎的一個熱點研究方向。
一氧化氮(nitric oxide,NO)是一種半衰期短的多效分子,廣泛存在于人體各種組織和細胞中,參與調節各種生理過程[6]。NO具有高度的生物活性,可通過細胞膜快速擴散,在體內半衰期只有3~6 s,作用過程中不易產生耐藥性和不良反應[7]。基于NO的以上特點,近期針對NO抗菌性能的研究受到了廣泛的關注。研究[8]表明,NO與牙周病、口腔黏膜病、口腔癌以及唾液腺疾病等口腔疾病的發生發展密切相關,與NO有關的生物學途徑研究將有望成為治療口腔疾病的新靶點。本研究旨在探究不同濃度NO對P.g的體外抗菌活性及其可能的抗菌機制,為臨床應用NO供體型藥物預防和治療種植體周圍炎提供新的理論依據。
1 材料與方法
1.1 菌種準備
P.g(ATCC33277)購于美國典型菌種收藏中心。厭氧環境下培養P.g(ATCC33277)至對數生長期,將生長良好的P.g挑一個單克隆在腦心浸液(brian heart infusion,BHI)培養基中培養12 h后,用酶標儀檢測菌液A600值大約為1.0左右,然后用新鮮的BHI培養基將A600為1.0的菌液稀釋為A600為0.1左右,此時的細菌濃度大約為1.5×108CFU/mL用于后續實驗。
1.2 S-亞硝基-N-乙酰基-DL-青霉胺(S nitroso N acetylpenicillamine,SNAP)、乙酰青霉胺(N-acetylpenicillamine,NAP)、佐劑溶液的制備和分組
用0.9%(質量分數)的氯化鈉注射液(以下簡稱生理鹽水)將SNAP稀釋,配制為10、30、50 mmol/L 3 個濃度,分別加入佐劑,標記為SNAP-10、SNAP-30、SNAP-50。經過濾器除菌后,放于37 ℃ 培養箱放置5 h,備用。
1.3 NO供體處理P.g實驗
(1)將狀態良好的P.gATCC33277(A值為0.1左右),分別取1 mL菌液放置于5支滅菌后的15 mL離心管中。
(2)將SNAP-10、SNAP-30、SNAP-50、NAP、佐劑分別取4 mL加入到步驟1)中的5支無菌離心管中,并做好標記分別為SNAP-10組、SNAP-30組、SNAP-50組、NAP組、佐劑組。
(3)以上溶液在37 ℃厭氧環境下分別孵育1.5 h和3 h,離心、緩慢洗滌3遍后,加入1 mL BHI液體培養基,將菌團塊吹打均勻。
(4)將菌懸液按照梯度稀釋法處理后,分別涂布在固體培養基上,放在厭氧環境37 ℃恒溫培養箱中孵育5 d,取出統計菌落數。每組至少涂布3個培養皿,實驗至少重復3次。
存活率=(實驗組CFU/對照組CFU) × 100%
1.4 NO供體對P.g的抗菌活性研究
1.4.1 NO供體處理P.g細菌懸液后總NO定量分析
(1)將A600值為0.1左右的P.g菌液與SNAP按照1∶4的比例混合后,在37 ℃厭氧環境下孵育3 h,離心、洗滌后備用。
(2)根據實驗結果確定好最佳的稀釋濃度后,加約1 mL去離子水至 5 mg 還原型輔酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH) 中,顛倒混勻溶解后,再用去離子水定容至3 mL,配制成 2 mmol/L NADPH。
(3)取出試劑盒中的Griess ReagentⅠ和Ⅱ溶液,按照表1加入標準品、樣品和各種檢測試劑,進行相應的檢測。

表1 總一氧化氮定量分析實驗過程
(4)通過酶標儀對細菌懸液中的總NO進行定量試驗分析。實驗重復3次,每次獨立實驗中每個檢測組至少保證有3個平行樣品。
1.4.2 NO處理P.g后胞內活性含氧基團(reactive oxygen species,ROS)濃度的變化
(1) 裝載ROS熒光探針:分別將對照組(NAP、佐劑組)、SNAP-10組、SNAP-30組、SNAP-50組與菌液進行反應30 min,比例按照細菌∶SNAP=1∶4進行反應。
(2)按照1∶1 000的比例稀釋ROS活性氧檢測試劑盒-2′,7′-二氯熒光素二乙酸酯(2′,7′-Dichlorodihydrofluorescein diacetate DCFH-DA,S0033,碧云天生物技術公司),使其終濃度為10 μmol/L。加入1 mL DCFH-DA到各個實驗組,在37 ℃恒溫箱中厭氧培養20 min。每隔5 min搖動一下細菌,讓探針充分與細菌接觸。
(3)ROS上機檢測將上述樣品分別放在激光共聚焦顯微鏡上直接觀察,顯微鏡的工作檢測參數為488 nm激發波長,525 nm發射波長。
1.4.3 NO供體處理P.g后胞內鈣離子(Ca2+)的變化
(1)取適量的Ca2+熒光探針(Fluo-4 AM,S1060,碧云天生物技術公司)母液,用PBS稀釋至4 μmol/L當作工作液,吸取大約200 μL左右Fluo-4 AM工作液分別與對照組(NAP、佐劑組)、SNAP-10、SNAP-30、SNAP-50組和菌液進行反應30 min,比例按照細菌∶SNAP=1∶4進行反應。在37 ℃厭氧環境下孵育20 min進行熒光探針的裝載,這個過程需要進行避光處理。
(2) 探針裝載結束后加入500 μL PBS溶液將細菌覆蓋,在37 ℃厭氧環境下孵育20 min,確保AM基團在胞內的完全去脂化作用。
(3) 用流式細胞儀(CytoFLEX,Beckmancoulter公司,美國)進行定量檢測,激發波長494 nm,發射波長516 nm。
1.5 統計學方法
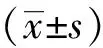
2 結果
2.1 NO供體對P.g的抗菌性能
在SNAP與P.g反應比例控制在4∶1的體系下,經過不同SNAP組處理1.5 h后,SNAP-10組、SNAP-30組、SNAP-50組細菌的存活率分別為(99.60±0.28)%、(77.03±3.66)%、(66.95±3.82)%,表明其對P.g有微弱的抗菌活性。5 mol/L佐劑、50 mol/L NAP對P.g無抗菌作用。檢驗結果顯示,SNAP-10組與佐劑組及NAP組比較差異無統計學意義(P>0.05),SNAP-30、SNAP-50與佐劑和NAP組比較差異有統計學意義(P<0.01)。且SNAP-10、SNAP-30、SNAP-50兩兩比較差異均有統計學意義(P<0.01,圖1A)。

圖1 NO供體處理P.g實驗結果
經過不同濃度的SNAP處理3 h后。SNAP-10組、SNAP-30組、SNAP-50組細菌的存活率分別為(78.30±1.15)%、(47.35±2.20)%、(36.40±3.10)%,表明其對P.g有較強的抗菌作用。5 mol/L佐劑、50 mol/L NAP對P.g無作用。檢驗結果顯示,SNAP-10、SNAP-30、SNAP-50與佐劑和NAP組比較差異有統計學意義(P<0.01)。且SNAP-10、SNAP-30、SNAP-50兩兩比較差異均有統計學意義(P<0.01,圖1B)。
經過SNAP-10、SNAP-30、SNAP-50處理P.g3 h后,細菌的存活率與處理1.5 h相比,差異均有統計學意義(P<0.01,圖1C)。
2.2 NO供體處理P.g細菌懸液后總NO定量分析結果
SNAP處理P.g后細菌懸液含有大量的總NO,而且總NO的濃度隨著SNAP濃度加大逐漸升高。檢驗結果顯示SNAP-10組[(87.51 ±2.04)μmol/L]、SNAP-30組[(110.37±3.10)μmol/L]、SNAP-50組[(130.58±2.86)μmol/L]與佐劑組[(4.48±0.70)μmol/L]和NAP組[(5.01±0.81)μmol/L]差異均有統計學意義(P<0.01)。且SNAP-10、SNAP-30、SNAP-50兩兩比較差異均有統計學意義(P<0.01)(圖2)。

圖2 NO供體處理P.g細菌懸液后總NO定量分析結果
2.3 NO處理P.g后胞內ROS濃度的變化
SNAP-50組熒光強度相較于對照組而言明顯上升。隨著SNAP濃度逐漸加大,細菌內部的ROS含量呈現升高趨勢(圖3)。

圖3 SNAP處理P.g胞內ROS濃度的變化情況
2.4 NO供體處理P.g后胞內Ca2+的變化結果
SNAP處理P.g后,胞內Ca2+濃度隨著SNAP濃度的增加,明顯升高。SNAP-10與對照組的Ca2+濃度差異無統計學意義,SNAP-30和SNAP-50與對照組相比,差異均有統計學意義(P<0.05,圖4)。

圖4 NO供體處理P.g后胞內鈣離子的變化
3 討論
種植體周圍炎是導致種植體松動失敗的主要原因,及時有效抑制或清除P.g菌斑黏附可有效控制種植體周圍炎的發展,提高種植體成功率[9]。目前對種植體周圍炎的治療方法主要包括手術治療、藥物治療和激光治療等。但這些方法在臨床應用中都存在不少問題,比如,手術治療程序復雜、創傷較大,增加了患者的治療費用及治療痛苦;抗生素的頻繁使用容易導致P.g等致病菌產生耐藥性,增大治療難度;激光治療可能導致鄰近組織熱損傷等[10-11]。
NO作為信使物質或效應分子,生物學效應廣泛,在腫瘤、心血管、神經和免疫等諸多系統都發揮了重要作用[12]。近年來,NO供體型藥物研究和設計逐漸得到重視。目前,已有十多種NO供體型藥物處于不同臨床研究階段,在抗腫瘤、抗血栓、抗肝硬化以及抗菌等領域都展現出廣泛的應用前景[13]。此類藥物具有不良反應小、便于新陳代謝、不易產生耐藥性等優點[14]。2019年,Yang等[15]在小鼠模型上完成了可釋放NO聚合物材料的體內抗菌活性研究,發現可釋放NO聚合物材料實現了對P.g菌的完全殺滅,進一步提示NO在口腔疾病治療中的潛在臨床應用價值。基于以上考慮,本研究使用SNAP作為NO供體,依次分別通過菌落計數法、總NO檢測試劑盒、ROS檢測試劑盒、Ca2+熒光探針Fluo-4 AM等技術手段研究不同濃度的NO(10、30、50 mmol/L)對P.g的體外抗菌性能,以及對P.g胞內活性氧水平和Ca2+濃度的影響。
NO對P.g的體外抗菌活性實驗結果提示NO濃度越大,對P.g的抗菌活性越高。進一步延長NO處理P.g作用時間至3 h后,結果表明NO的處理時間越長,對P.g的抗菌活性越高(P<0.01)。綜上實驗結果不難發現,NO對P.g有顯著的體外抗菌活性,并且其抗菌性能與NO藥物濃度和作用時間呈現明顯的正相關性(P<0.05)。筆者的這一研究結果與之前研究的結論一致,如劉曉宇等[16]同樣發現SNAP對表皮葡萄球菌、大腸桿菌等致病菌都具有抑制作用,其抑菌作用與SNAP呈濃度依賴性。此外,Estes等[17]研究證實SNAP對金黃色葡萄球菌也具有顯著的抗菌活性。由此可見,NO對包括P.g在內的眾多致病菌都有較好的廣譜抗菌活性。
在NO生成量的實驗中,筆者利用Griess reagent定量分析了不同濃度SNAP作用下P.g菌懸液總NO的變化情況。結果顯示,SNAP處理P.g后菌懸液內有大量的NO產生,而且NO的生成濃度隨著SNAP濃度的增高而增加(P<0.01)。一般情況下,種植體表面沒有抗菌能力,種植體周圍炎患者的病變區隱藏著大量的革蘭陰性厭氧桿菌,容易引起P.g致病菌的大量黏附從而導致種植體周圍炎的產生。筆者在本研究中發現SNAP可以定量生成濃度可控的NO,對抑制P.g的黏附和治療種植體周圍炎都具有深遠意義。在實驗中筆者通過改變SNAP濃度和NO作用時間,均可以顯著提高SNAP對P.g的抗菌活性。de Farias 等[18]的研究同樣指出,NO在不同的病理生理過程中扮演著重要的角色,包括在體內參與內環境穩定、骨的形成和吸收、抑制細菌和腫瘤的生長等,筆者的實驗結果與該研究一致。
為了進一步探究SNAP產生的NO的可能抗菌機制,筆者分別檢測了NO對P.g胞內ROS和Ca2+的濃度影響情況。結果顯示,SNAP處理后顯著提高了P.g胞內ROS水平和Ca2+濃度(P<0.05)。目前國際上有研究[19]表明,NO主要通過直接毒性和間接免疫反應來發揮抗菌作用。結合本文獲得的實驗結果和國內外的相關研究,筆者猜測NO對P.g的抗菌活性可能主要通過以下幾種相互聯系的非特異路徑來實現:①高濃度的NO能顯著提高P.g胞內Ca2+濃度,最終觸發鈣信號,破壞DNA,從而導致致病菌死亡[20]。②高濃度的NO產生多種活性基團進入P.g體內,胞內ROS水平迅速升高,進而引起一系列的氧化應激反應,導致P.g活性下降[21]。③在滅活P.g生物膜的過程中Ca2+與ROS相互促進,起到協同增效作用。大量的ROS和NO最后導致P.g結構改變和細胞內鈣升高,使細菌發生凋亡樣改變,與細胞死亡關系密切[22]。④NO可能與P.g體內某些關鍵酶結合,使其失活從而抑制P.g生長[23]。
綜上研究表明,NO供體型藥物對P.g具有高效的體外抗菌活性。隨著NO濃度和作用時間的不斷增加,抑菌能力逐漸增強(P<0.05)。并且,NO處理后顯著提高了P.g胞內ROS水平和Ca2+濃度(P<0.05)。簡言之,NO能夠高效抑制P.g的活性和生長能力,并通過引起P.g胞內ROS和Ca2+代謝紊亂,以實現抗抑菌功能。NO供體型藥物對種植體周圍炎具有潛在的治療作用和臨床應用價值。但具體的作用機制仍需進一步深入研究。
利益沖突所有作者均聲明不存在利益沖突。
作者貢獻聲明江玉梅:提出研究思路,設計研究方案,撰寫論文;張紫薇、王吉天:實施試驗過程,把控方案可行性,獲取數據;張紫薇:分析數據;楊宇:總體把關,審定論文。

