乳腺癌患者保乳術中放療與術后全乳放療的療效、安全性及美容效果比較
趙 陽 楊紅杰 孔舒欣 韓 倩
在女性婦科腫瘤中,以乳腺癌較為常見。據調查顯示,全球每年乳腺癌新發病例達226萬人,在婦科腫瘤中的占比約為1/4,已成為女性的首要健康殺手[1]。該病主要表現為乳房脹痛、乳頭溢液,如未及早施治,致使病灶轉移,可增加預后不良風險。近年來,隨著診斷效力的不斷提升,早期乳腺癌檢出率愈來愈高[2]。目前,對于本病早期患者已由既往的根治性手術轉向保乳手術。保乳術結合放療為保乳的重要前提,已成為專家的統一共識。保乳術后全乳放療為一種常規的放療方法,可提高病灶控制效果,降低術后復發的可能性[3]。但此方法治療時間長達5周,費用較高,且放療后患者可能出現患側乳腺萎縮、皮膚色澤改變等問題,使乳房的美觀度受到影響,部分患者較難接受,尤其是青年女性[4]。近年來,加速部分乳腺放射治療(accelerated partial breast irradiation,APBI)受到腫瘤科治療領域關注。APBI優勢在于一次性小范圍照射,可在縮短治療總時長的同時,減少正常組織的受照射劑量[5]。術中放療為一項新的APBI方法,可在術中直接對瘤床予以一次性的大劑量照射,因術野暴露充分,可實現精準照射治療,并對周圍組織進行最大化的保護[6]。為了解不同放療方式的應用優劣,本研究對比分析乳腺癌患者保乳術中放療與術后全乳的效果,現報告如下。
1 資料與方法
1.1 一般資料
本研究為非同期對照研究,選擇2019年5月至2021年8月在本院行保乳術的98例乳腺癌患者為研究對象,按入院順序將2019年5月至2020年6月、2022年7月至2021年8月收治的各49例乳腺癌患者分別設為A組、B組,兩組一般資料比較,差異無統計學意義(P>0.05),見表1。
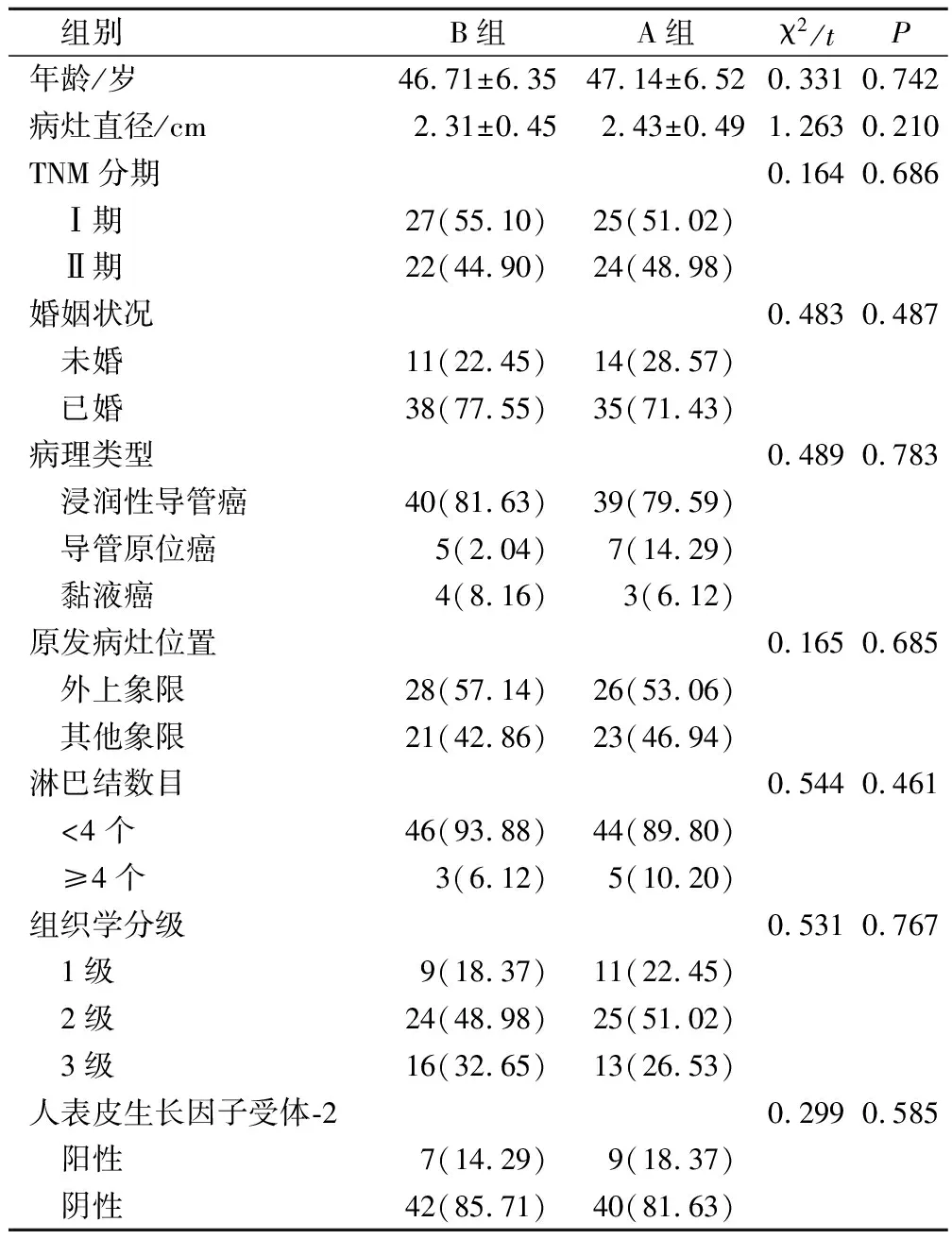
表1 兩組一般資料比較
1.2 納入標準
①符合有關乳腺癌的診斷標準[7];②單發病灶,且病灶直徑不超過3 cm;③乳腺癌腫瘤淋巴結轉移(tumor lymph node metastasis,TNM)分期Ⅰ或Ⅱ期;④均為女性,有保乳需求;⑤病灶切緣陰性;⑥診療及隨訪數據完整。
1.3 排除標準
①復治者;②存在其他腫瘤;③因器質性病變或患有其他重癥疾病而無法耐受手術及放療;④病灶侵犯或接近乳頭;⑤乳房發育異常;⑥處于妊娠期。
1.4 方法
所有患者均行保乳術,患者處于平臥姿勢,全麻后結合冰凍病理結果明確病灶邊緣,實施腋窩淋巴結清掃。依據病灶所在位置確定切口,如對于病灶處于中上象限者,可做和乳暈平行的弧狀切口。對于病灶處于中下象限者,可做放射狀切口。在病灶外2 cm左右開展腫瘤切除術,結合實際情況行乳腺葉切除,確保無病灶殘余。于腋下4 cm做斜切口并實施淋巴結清掃,直至達到LevelⅡ水平,最后在腋窩與胸壁下留置引流管,關閉切口并妥善包扎。A組術后實施全乳放療,術后2周開展,放療時由鎖骨上部照射到乳腺褶皺下3 cm,結合患者情況設定參數,選用8 MeV電子線,照射劑量50 Gy,2 Gy/次,5次/周。B組實施術中放療,照射范圍為病灶及其附近2 cm、下部1 cm 正常組織,治療劑量為18~21 Gy,選用9 MeV或12 MeV的電子線。放療過程中結合瘤床大小選用適宜的限光筒,將其由切口置入,使其覆蓋病灶前后1 cm與附近2 cm,照射所用劑量率為10 Gy/min,單次照射,時間持續3~5 min。
1.5 觀察指標
①并發癥。觀察兩組術后有無脂肪液化、創面水腫、放射性皮炎、急性血液毒性、肺損傷等并發癥;②美容效果。術后6個月,判定兩組美容效果。優:雙側乳房的外形、色澤基本無差異,乳頭水平間距的差異不足2.0 cm;良:雙側乳房的外形、色澤存在輕微差異,乳頭水平間距的差異為2~3 cm;雙側乳房的外形、色澤的差異明顯,但仍在可接受范圍內,乳頭水平間距的差異超過3 cm;差:未達到上述標準[8]。計算優良率;③腫瘤標志物水平。采集術前及術后8周患者空腹靜脈血,采血量為4 ml。對血液進行常規離心后。采用酶免法(試劑盒均購自上海瑞番生物科技有限公司)測定血清糖類抗原(carbohydrate antigen,CA)125、癌胚抗原(carcinoembryonic antigen,CEA)水平;④遠期預后。觀察2組術后2年內局部復發、轉移、生存情況。
1.6 統計學方法
2 結果
2.1 兩組并發癥情況比較
B組并發癥發生率為8.16%,顯著低于A組的24.49%(P<0.05),見表2。

表2 兩組并發癥情況比較(例,%)
2.2 兩組美容效果比較
B組美容優良率為89.80%,顯著高于A組的65.31%(P<0.05),見表3。
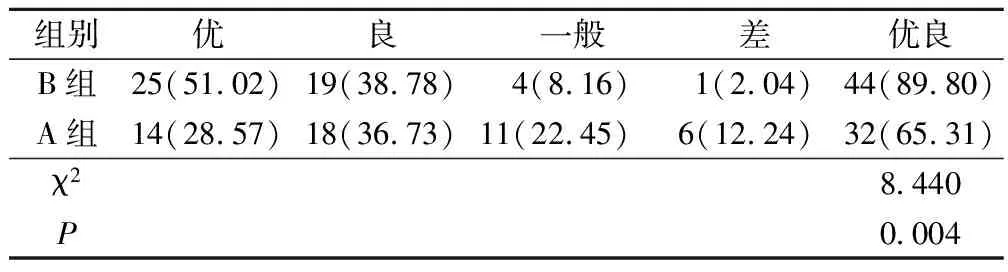
表3 兩組美容效果比較(例,%)
2.3 兩組術前后腫瘤標志物水平
術后8周,兩組血清CA125、CEA水平均較術前降低(P<0.05),組間比較無差異(P>0.05),見表4。
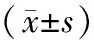
表4 兩組術前后腫瘤標志物水平比較
2.4 兩組遠期預后比較
兩組局部復發、轉移及生存率比較無差異(P>0.05),見表5。
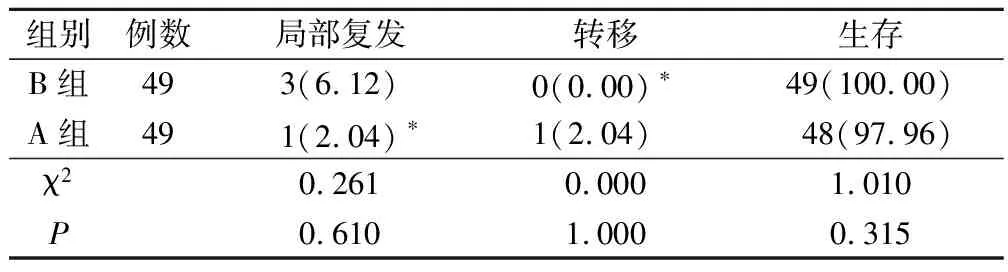
表5 兩組遠期預后比較(例,%)
3 討論
保乳術僅做局部切除,手術范圍小,可最大化保留乳房,與傳統的根治術相比,其更能滿足女性對乳房美觀的要求[9]。故此術式成為早期乳腺癌治療的首選。但保乳術后可能有癌細胞殘留,故為充分清除病灶,達到根治疾病的目的,臨床常輔助應用放療。常規的放療模式為于保乳術后以切線野的方式對整個乳房實施照射,單次照射劑量為2.0 Gy,每周5 d,總照射劑量為50 Gy,這意味著術后整個放療時間長達5周。部分患者可能因無法較好地依從放療而導致預后受到影響[10]。且術后放療需于創面愈合后方可開展,這種放療時間上的滯后可能增加局部復發的概率[11]。此外,此放療模式易導致照射部位皮膚紅腫、色澤改變及發生纖維化,繼而損害乳房的外形,部分患者可能為此而于術后拒絕開展放療。
Bernstein等[12]研究發現,保乳術后復發主要發生于術區。故為預防腫瘤復發并縮短放療總時長,APBI逐漸受到關注并成為研究焦點。現階段常用的APBI方法主要有三維適形放療、調強放療及術中放療,前兩種治療可減輕常規放療中大范圍照射所造成的不必要損傷,但呼吸及體位等因素可對患者照射產生影響[13]。術中放療為一種創新性的APBI方法,區別于其他APBI方法,其可實現和保乳術同步開展,且可避免呼吸及體位對照射的干擾,能提高放療的精準度[14]。研究顯示,術中放療中以一定劑量對病灶區予以一次性照射,可有效殺死殘余病灶,且患者術后無需因放療而再度入院,能明顯縮短治療用時,緩解患者經濟壓力[15]。
本研究以術后常規放療為對照,分析了保乳術中放療的應用效果及安全性,結果顯示,B組放射性皮炎、急性血液毒性、肺損傷等并發癥的總發生為8.16%,和A組的24.49%相比明顯更低,提示保乳術中放療可減少放射性并發癥的發生。究其原因,在術中將病灶切除后立即對病灶與附近可能受到侵犯的部位實施大劑量的照射,在精準作用于靶組織的同時可減少正常組織的受照射量,避免附近器官受到損害,故能降低放射性并發癥的發生概率[16]。在美容效果上,B組的美容優良率為89.80%,和A組的65.31%相比明顯更高,徐曉帆等[17]研究亦顯示,術中放療對乳房的美容效果較術后常規放療佳。這是由于術中放療僅照射乳房局部,與全乳放療相比,可避免出現患側乳腺萎縮、皮膚色澤改變等現象,患者術后乳房美觀度基本不受影響。作為常見的腫瘤標志物,CA125、CEA含量在正常組織內極低,而在乳腺癌組織內處于高表達狀態,且表達水平越高,惡化程度越高。研究顯示,其水平和TNM分期、遠期預后關系密切[18]。在本研究中,術后8周,兩組血清CA125、CEA水平均降低,組間比較無差異;兩組術后2年內局部復發(6.12%比2.04%)、轉移(0.00%比2.04%)及生存率(100%比97.96%)比較均無差異,亦有研究指出,術中一次性放療劑量20 Gy等效于術后常規分割放療的50 Gy[19]。原因可能為術中放療開展中靶區定位準確且劑量分布均勻;通過提前放療時間,可降低術后癌細胞擴增的可能性,且一次性大劑量放療可避免分次照射中殘余病灶的增殖,繼而可獲得較佳的生物學效應[20]。
綜上所述,保乳術中放療可獲得和術后全乳放療相當的遠期效果,但術中放療可減少放射性并發癥的發生,并使患者術后乳房獲得更好的美觀度。本研究納入病例僅來自一所醫院,有著一定的同質性,可能導致統計結果出現偏倚。故未來計劃和其他醫院合作開展多中心研究,以確保研究更加可信。

