多發性骨髓瘤組織中miR-29c、miR-195表達水平變化及其與臨床病理特征及預后的關系
石瑞平 陳興華 李 真
多發性骨髓瘤(multiple myeloma,MM)是一種惡性漿細胞病,其腫瘤細胞起源于骨髓中的漿細胞,而漿細胞是B淋巴細胞發育到最終功能階段的細胞[1]。骨髓中惡性漿細胞發生過度克隆增殖,伴隨有單克隆免疫球蛋白,或者是輕鏈過度生成,導致患者正常的造血功能受到抑制,從而出現多發性溶骨性損害、高鈣血癥、貧血、腎臟損害等一系列的臨床表現[2-3]。近年來隨著免疫調節藥物以及蛋白酶抑制劑的廣泛使用,MM患者的預后已有所改善,但仍有部分患者出現耐藥性及多種并發癥,嚴重者可導致患者死亡[4]。因此,尋找更有效、可靠的分子標志物進行個體化分型以指導臨床精準治療對改善MM患者臨床病理特征及預后意義重大。微小RNA(miRNA)是一類長度在12~21個核苷酸之間的內源性非編碼RNA,具有調節基因表達功能,參與細胞增殖、分化及凋亡等過程,其在造血干細胞自我更新、衰老及向惡性肝細胞轉變等過程中參與調控細胞信號傳導途徑及表觀遺傳機制[5]。研究發現,miRNAs的表達水平與腫瘤的發生發展有關,可能參與MM疾病的發生發展,并發揮致癌及抑癌作用[5]。越來越多的研究證實,miRNAs在MM中的異常表達與患者耐藥性、腫瘤復發、造血微環境、并發癥發生等密切相關,miRNAs有望成為MM患者早期診斷、預測預后的分子標志物[6]。因此,本研究通過檢測MM患者骨髓組織中miR-29c、miR-195表達水平,分析其與患者臨床病理特征及預后的關系,旨在探討miR-29c、miR-195在MM進展中的臨床意義。
1 材料與方法
1.1 一般資料
選取2017年12月至2020年6月在本院就診的MM患者75例作為病例組,另選取同期就診的75例骨髓象檢查為正常的非血液系統疾病患者作為對照組。病例組男性45例,女性30例;年齡35~75歲,平均(57.82±4.78)歲;對照組男性42例,女性33例;年齡34~78歲,平均(48.14±4.2)歲。2組年齡、性別比較無顯著差異(P>0.05),具有可比性。
納入標準:MM患者均符合2003年國際骨髓瘤工作組制定的MM診斷標準[7];臨床資料完整;患者及家屬均簽署本研究知情同意書。
排除標準:合并感染性疾病,合并其他血液系統疾病,如溶血性貧血、特發性血小板減少性紫癜等;曾有骨髓穿透史者;合并其他惡性腫瘤者,如宮頸癌、子宮肌瘤等;妊娠及哺乳期者。
1.2 方法
1.2.1 治療方法及隨訪 MM患者均給予以硼替佐米為基礎的聯合化療,BAD方案(硼替佐米、多柔比星、地塞米松),BADT方案(硼替佐米、多柔比星、地塞米松、沙利度胺),維持治療方案為沙利度胺。自患者出院之日開始進行隨訪2年,截止至2022年6月,1次/月,若患者發生死亡事件則隨訪結束。
1.2.2 骨髓組織miR-29c、miR-195表達水平檢測 分別于患者入院第2天無菌采集骨髓細胞2 ml,置于肝素抗凝管中,按照Trizol試劑盒說明書進行操作,提取骨髓組織總RNA,將其溶于20 μl DEPC水;按照反轉錄試劑盒說明書進行逆轉錄,反應體系:M-MLV,Olig(dT)及dNTPs各1 μl,0.5 μl RNA酶抑制劑,H2O補足至15 μl。以cDNA為模板進行qPCR擴增,反應體系:緩沖液2.5 μl,dNTPs、上下游引物各1 μl,Taq DNA 0.5 μl,ddH2O補足至25 μl,反應程序:94 ℃ 1 min,94 ℃ 15 s、60 ℃ 20 s,40個循環。以U6為內參,采用2-△△Ct法計算miR-29c、miR-195相對表達量。miR-29c上游引物序列:CTCGAGCTGTGGTCCTCTTAGCCAG;下游引物序列:GAATTCGACTCCTAGCAGCCATCACC;miR-195上游引物序列:CCTAGCAGCACAGAAA;下游引物序列:GAGCAGGGTCCGAGT;U6上游引物序列:CTCGCTTCGGCAGCACA,下游引物序列:AACGCTTCACGAATTTGCGT。
1.2.3 血清因子檢測 抽取受試者空腹靜脈血5 ml,離心獲取血清,采用酶聯免疫吸附法檢測血清血紅蛋白、白蛋白、乳酸脫氫酶、肌酐、鈣、β2微球蛋白及白蛋白水平,操作步驟嚴格按照說明書進行,試劑盒由上海恒遠生物科技有限公司。
1.2.4 分組 根據miR-29c、miR-195檢測水平的平均值將MM患者分為高水平組和低水平組。
1.3 觀察指標
(1)比較病例組與對照組的骨髓組織miR-29c、miR-195表達水平;(2)比較MM患者miR-29c高水平組和低水平組的臨床病理特征;(3)比較MM患者miR-195高水平組和低水平組的臨床病理特征;(4)分析miR-29c、miR-195與預后的關系,隨訪2年,統計MM患者出院后的生存時間;(5)分析miR-29c、miR-195與病理特征及預后的相關性。
1.4 統計學方法
2 結果
2.1 比較病例組與對照組骨髓組織中miR-29c、miR-195表達水平
病例組組織miR-29c、miR-195表達水平低于對照組(P<0.05),見表1。
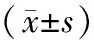
表1 病例組與對照組骨髓瘤組織中miR-29c、miR-195表達水平
2.2 比較miR-29c、miR-195高水平組和低水平組的臨床病理特征
2組年齡、性別、免疫分型以及血清血紅蛋白、白蛋白、乳酸脫氫酶、肌酐、鈣及β2微球蛋白水平比較無顯著差異(P>0.05),miR-29c、miR-195低水平組中ISS分期Ⅲ期及血清白蛋白水平<35 g/L的患者占比高于各自高水平組(P<0.05),見表2。
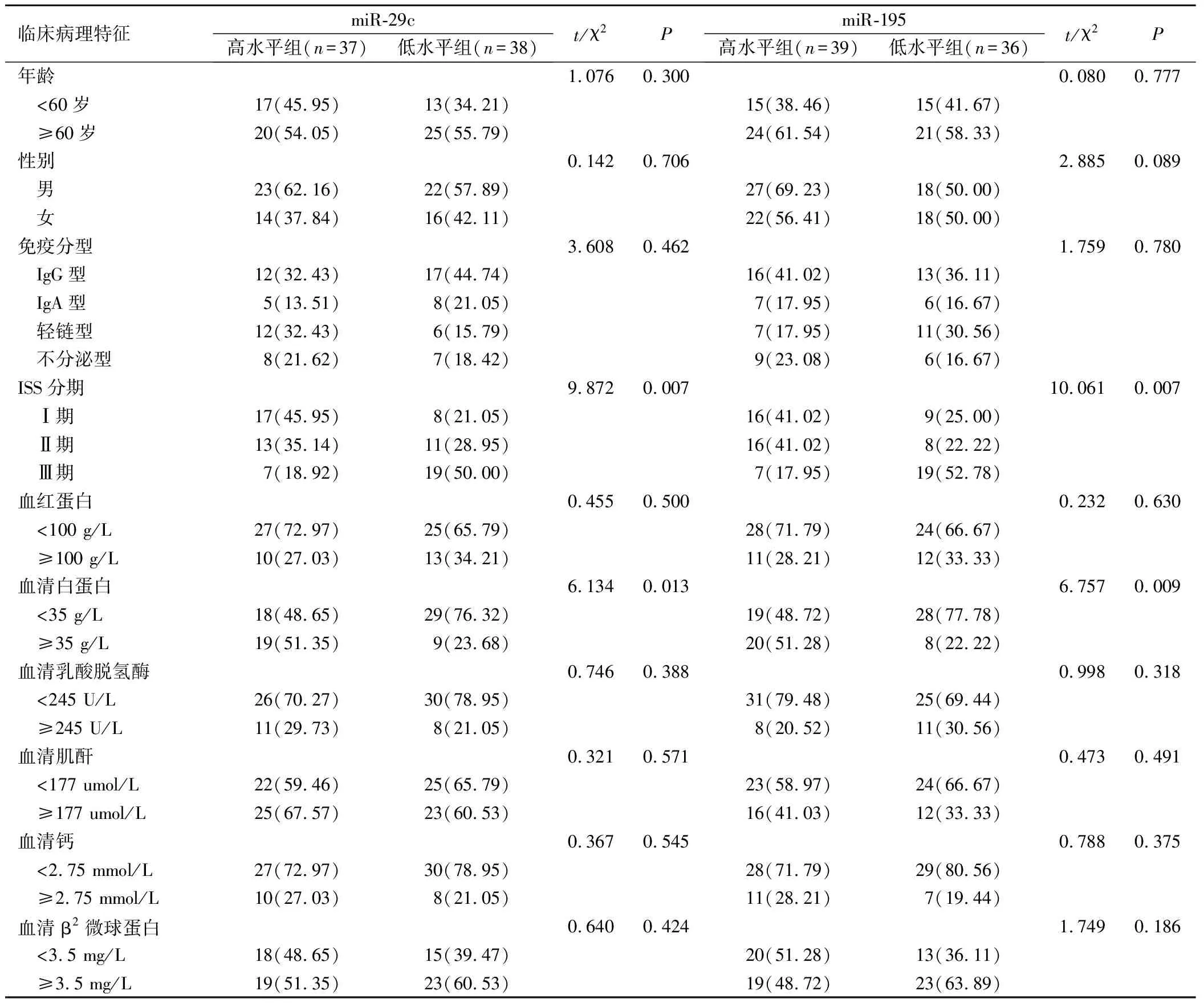
表2 miR-29c、miR-195高水平組和低水平組的臨床病理特征對比(例 ,%)
2.3 比較miR-29c、miR-195高水平組和低水平組的預后情況
miR-29c低水平組的生存期低于高水平組(P<0.05),miR-195低水平組的生存期低于高水平組(P<0.05),見表3。
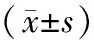
表3 miR-29c、miR-195高水平組和低水平組生存期比較
2.4 miR-29c、miR-195表達水平與臨床病理特征及預后的相關性
組織miR-29c、miR-195表達水平與ISS分期呈負相關(P<0.05),與血清白蛋白水平、生存期呈正相關(P<0.05),見表4。
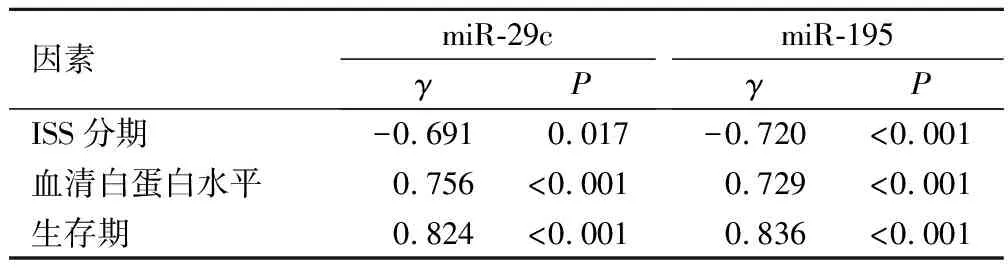
表4 miR-29c、miR-195表達水平與臨床病理特征及預后的相關性
3 討論
MM是分泌產生M蛋白的漿細胞惡性增殖性疾病,MM細胞無限增殖,導致患者出現腎損傷、神經癥狀、貧血等癥狀[8]。近年來,MM的發病率逐年遞增,發病人數已高達12萬人,約占血液系統惡性腫瘤的12%,嚴重威脅人們身心健康[9]。目前,臨床常采用免疫調節因子、自體造血干細胞移植、化療等方式治療MM,雖然能夠在一定程度上延長患者生存時間,但無法徹底治愈,且預后較差[10]。分子學研究發現,miRNA具有多種生物學調控功能,能夠影響漿細胞的分化、增殖、凋亡等生物學過程,在MM的發生發展中發揮重要作用,是MM進展的重要調控分子[11]。
miR-29c是miR-29家族成員之一,作為抑癌基因,參與了細胞分化、凋亡、增殖多種生物學過程,影響多種惡性腫瘤的發生、發展及預后[12]。有研究發現,miR-29c是骨髓分化的調控因子,在多種血液系統疾病中發揮抑制腫瘤生長的作用[13]。miR-195是miR-15家族成員之一,與家族成員miR-497具有高度同源性,在乳腺癌、肺癌、結直腸癌等多種惡性腫瘤組織中異常表達,能夠通過抑制調控miRNA活性誘導惡性腫瘤細胞凋亡、分化[14]。有研究顯示,部分預后較差的卵巢癌患者存在17號染色體缺失現象,而miR-195基因定位于17號染色體[15]。本研究結果顯示,MM患者骨髓組織中miR-29c及miR-195均低表達,MM患者ISS Ⅲ期患者組織中miR-29c及miR-195低表達率均高于ISS Ⅰ、Ⅱ期患者,MM患者骨髓組織中miR-29c、miR-195表達下調可能與MM發生、發展密切相關。
研究發現,miR-29c在卵巢癌組織中表達下調,其可通過激活PI3K/AKT信號通路調控腫瘤細胞的惡性增殖行為,進而參與宮頸癌的發生發展過程[16]。另有研究表明,miR-29c在乳腺癌組織中表達下調,能夠通過與DNMT3A3'端非編碼區結合抑制DNMT3A的表達,進而抑制乳腺癌細胞的生長[17]。miR-195表達下調可促進促癌基因S6K1的表達,提高癌細胞的生物學活性,促進卵巢癌疾病的發生發展[18]。在胃癌中,miR-195表達下調能夠促進腫瘤細胞生長因子及腫瘤血管生成因子的生成,侵襲MMP3因子,導致結腸癌細胞增殖、分化及轉移,進一步使病情惡化[19]。另有研究發現,miR-195能夠通過抑制CDK6、E2F3、細胞周期蛋白D1的信號抑制肝癌細胞的G1/S的轉換,從而抑制肝癌細胞的增殖[20]。本研究進一步分析發現,miR-29c低水平組及miR-195低水平組平均生存時間明顯短于高水平組,提示組織miR-29c及miR-195水平能夠作為臨床判斷MM患者生存預后的標志物分子。研究發現,miR-195在膽管癌患者中表達下調與其患者術后生存期具有關聯性,可作為臨床評估宮頸癌患者病情和預測預后的生物學分子指標[21]。另外孫生安等研究顯示,miR-29c在胃癌組織中表達下調,參與胃癌的發生發展過程,且與患者臨床病理特征和預后密切相關,可作為胃癌診斷及預測預后的標志物[22]。結合本研究結果,miR-29c、miR-195可能參與MM疾病的發生發展,其水平變化與患者病理特征及預后密切相關,有望成為臨床治療MM的新靶點。
綜上所述,MM患者骨髓組織miR-29c、miR-195水平降低,其表達變化與血清白蛋白水平及ISS分期有關,miR-29c及miR-195低表達的MM患者預后較差。因此,組織miR-29c及miR-195水平可作為臨床評估MM預后的指標。

