紫外可見光譜法測定抗體偶聯(lián)藥物藥物-抗體偶聯(lián)比的方法建立和驗證
白露,陳苗苗,王遠(yuǎn)芝,黃銘蕊,趙永新
目的 建立基于紫外可見光譜檢測抗體偶聯(lián)藥物(ADC)藥物-抗體偶聯(lián)比(DAR)的檢測方法并進(jìn)行驗證。
方法 使用鹽酸胍作為變性劑,修正基于氨基酸組成推算的抗體在 280 nm 處消光系數(shù)。利用比爾-朗伯定律測定抗體和小分子藥物在 252 nm 處的消光系數(shù)及小分子藥物在280 nm 處的消光系數(shù)。確定基于紫外可見光譜檢測 ADC的 DAR 公式參數(shù)和檢測方法。根據(jù)《中華人民共和國藥典》(2020)指導(dǎo)原則,對方法進(jìn)行驗證。
結(jié)果 抗體在 252 nm 和 280 nm 處的摩爾消光系數(shù)分別為 91258 和 228913 L/(mol·cm);tubulysin 衍生物小分子藥物在 252 和 280 nm 處的摩爾消光系數(shù)分別為 12798和 3186 L/(mol·cm)。DAR =(A280-ADC × 91258 - A252-ADC ×228913)/(A252-ADC × 3186 - A280-ADC × 12798)。方法專屬性符合要求。模擬 DAR 值為 1.881 ~ 15.045 的 ADC 藥物進(jìn)行準(zhǔn)確性驗證,回收率為 79.38% ~ 99.13%。重復(fù)性相對標(biāo)準(zhǔn)偏差(RSD%)為 1.93%,中間精密度 RSD% 為2.36%。以 252 nm 處吸光值與 280 nm 處吸光值的比值為縱坐標(biāo),以模擬 DAR 值為橫坐標(biāo)進(jìn)行線性回歸的方程為y = 0.0408x + 0.414,相關(guān)系數(shù) r2 為 0.9954。根據(jù) DAR 測定公式推算該方法的檢測范圍為 0.60 ~ 82.56。不同檢測波長[(280 ± 1)或(252 ± 1)nm]、不同放置時間(0 ~ 60 min)、不同批次的比色皿條件下,DAR 值檢測結(jié)果的 RSD% 均< 5.0%。
結(jié)論 基于紫外可見光譜法進(jìn)行抗體偶聯(lián)藥物 DAR 測定的方法簡單、可操作性強,專屬性、準(zhǔn)確度、精密度、耐用性滿足檢測需求,該方法可以用于抗體偶聯(lián)藥物的質(zhì)量分析和質(zhì)量控制。
自 Paul Ehrlich 百年前提出特異性殺傷癌細(xì)胞的“魔術(shù)子彈”概念,特別是近 40 年,伴隨著單克隆抗體創(chuàng)新技術(shù)進(jìn)步,單克隆抗體偶聯(lián)藥物(ADC)也日臻成熟和加速迭代發(fā)展[1]。由于結(jié)合了抗體的特異性和小分子藥物的殺傷性,ADC 藥物相比傳統(tǒng)化療或放療療法具有更高的療效和更低的副作用。因此自 2000 年首款 ADC 藥物上市以來,至今已經(jīng)有 15 款 ADC 藥物上市,尤其是在過去 5 年內(nèi)有 10 款 ADC 藥物獲批上市。
藥物-抗體的平均偶聯(lián)比(drug-antibody ratio,DAR)表示每個抗體上平均偶聯(lián)的小分子數(shù)量。低DAR 值的 ADC 藥物療效弱,高 DAR 值的ADC 藥物毒性增加的同時清除率也會增加[2]。同時,偶聯(lián)疏水性毒素分子或連接體時,高 DAR 的ADC 藥物容易產(chǎn)生沉淀[3]。因此,DAR 值直接與ADC 藥物的安全性和療效相關(guān),是其重要的質(zhì)量屬性之一[4]。
檢測 ADC 藥物 DAR 值的方法主要有高效液相色譜法、質(zhì)譜分析法和紫外可見光譜法。三種方法的檢測原理各不相同、各有優(yōu)缺點。液相色譜法主要包括疏水色譜(HIC-HPLC)和反相色譜(RP-HPLC)法。疏水色譜法根據(jù)偶聯(lián)藥物后疏水性的不同進(jìn)行分離,通常偶聯(lián)的小分子藥物為疏水性分子,偶聯(lián)越多疏水性越強,保留時間也越長。各峰面積的百分比也代表偶聯(lián)不同數(shù)量小分子藥物的 ADC 分布。通過對分離物峰面積百分比的計算獲得 DAR 值[5]。相比疏水色譜,反相色譜法需要使用變性劑對 ADC 藥物進(jìn)行還原,然后分離重、輕鏈和偶聯(lián)不同數(shù)量小分子的重、輕鏈,通過不同組分的面積百分比計算獲得 DAR 值[5-6]。質(zhì)譜法作為強大的分析工具,不僅可以進(jìn)行 DAR 值的測定,還可進(jìn)行藥物偶聯(lián)分布的分析[7-8]。除此之外,也有學(xué)者利用雙波長的分子排阻色譜法在檢測藥物分子大小變異體的同時測定藥物的 DAR 值[9]。
雖然上述 DAR 值測定方法精度高,但其設(shè)備昂貴,對操作人員要求高,方法開發(fā)參數(shù)多、周期長、數(shù)據(jù)處理量大。相比之下紫外可見光譜法操作簡單、成本低、檢測時間短,是目前常用的 DAR 值檢測方法。尤其是在 ADC 生產(chǎn)過程中的產(chǎn)品放行和質(zhì)量控制方面具有廣泛應(yīng)用性。紫外可見光譜法利用比爾-朗伯定律,將 ADC 藥物作為多組分溶液,利用抗體消光系數(shù)和小分子消光系數(shù)分別測定抗體和小分子藥物的摩爾濃度,進(jìn)而計算出 ADC藥物的 DAR 值。但在該方法建立和驗證的過程中存在諸多問題和困難,誤差較大,如:利用抗體氨基酸組成預(yù)測消光系數(shù)[10]時,未考慮抗體高級空間結(jié)構(gòu)(折疊、螺旋)對消光系數(shù)的影響[11];未對小分子藥物進(jìn)行消光系數(shù)測定;或者引用類似結(jié)構(gòu)小分子的消光系數(shù)時未考慮結(jié)構(gòu)差異對消光系數(shù)的影響;由于 ADC 藥物制備工藝的復(fù)雜性和不同檢測方法測定 DAR 值的差異,不易獲得 DAR 的理論值用于準(zhǔn)確度的驗證。基于此,本研究利用鹽酸胍對抗體進(jìn)行變性,通過變性前后吸光值的變化修正推算的理論消光系數(shù),獲得抗體的實際消光系數(shù)。同時,利用不同濃度的小分子溶液,消除濃度對小分子藥物消光系數(shù)測定的影響。最后,通過模擬摩爾比作為準(zhǔn)確度驗證的理論值優(yōu)化該方法的驗證過程。
1 材料與方法
1.1 材料
IgG1 抗體、微管抑制劑類 tubulysin 衍生物小分子藥物和通過半胱氨酸隨機偶聯(lián)的抗體藥物偶聯(lián)物由本實驗室制備和保存;Cary 3500 型紫外可見光分光光度計為美國 Agilent 公司產(chǎn)品;磷酸二氫鈉、氫氧化鈉、鹽酸胍購自上海阿拉丁生化科技股份有限公司。
1.2 方法
1.2.1 抗體消光系數(shù)的測定 根據(jù)抗體的氨基酸組成,計算組成抗體的酪氨酸、色氨酸以及胱氨酸(半胱氨酸個數(shù)的一半)數(shù)目(N)。根據(jù)公式① 計算抗體在 280 nm 處的理論摩爾消光系數(shù)(εAb-280理論)。
其中:ε酪氨酸= 1490,ε色氨酸= 5500,ε胱氨酸=125[11]
分別用天然緩沖液(pH 6.0 的磷酸鹽緩沖溶液,PBS)和變性緩沖液(6 mol/L 鹽酸胍緩沖液,GH)稀釋抗體,分別測定抗體溶液在 280 和 320 nm處的吸光值(A280-Ab、A320-Ab),根據(jù)公式 ②[11]計算抗體在 280 nm 處的實際消光系數(shù)(εAb-280)。依據(jù)公式 ③、④ 計算抗體摩爾濃度(CAb)及抗體在 252 nm 處的摩爾消光系數(shù)εAb-252。
式中,L 是通過含分析物的比色皿的路徑長度(通常為 1 cm)。
1.2.2 藥物消光系數(shù)的測定 測定不同濃度tubulysin 小分子藥物在 252 和 280 nm 的吸光值。根據(jù)公式 ⑤、⑥ 計算小分子藥物在 252 和280 nm 的消光系數(shù)。
式中,CD是藥物的摩爾濃度;εD-252是藥物在252 nm 處的消光系數(shù)。
1.2.3 ADC 藥物 DAR 值的測定公式 抗體偶聯(lián)藥物在 280 和 252 nm 處的吸光值A(chǔ)280-ADC和A252-ADC分別為[12]:
將公式 ⑦、⑧ 代入公式 ⑨,可得 DAR 測定公式 ⑩:
1.2.4 方法驗證
1.2.4.1 專屬性實驗 分別使用 ADC 偶聯(lián)工藝中間產(chǎn)品的空白溶液(S1)、凍干成品制劑的空白溶液(S2)、純水(S3)和磷酸鹽緩沖液(S4)作為稀釋液稀釋樣品,進(jìn)行 DAR 值檢測。平行測定3 次。各種不同稀釋液稀釋樣品在 280 和 252 nm處的吸光值和 DAR 值檢測結(jié)果的 RSD 作為驗證指標(biāo)。
1.2.4.2 準(zhǔn)確度實驗 線性溶液配制:準(zhǔn)確度溶液 1(記為 A1):取抗體藥物偶聯(lián)物,平行制備3 份,測定 DAR 值。準(zhǔn)確度溶液 2(記為 A2):取 A1 與等摩爾量裸抗標(biāo)準(zhǔn)品母液等體積混合,平行制備 3 份。準(zhǔn)確度溶液 3(記為 A3):取 A1與等摩爾量小分子標(biāo)準(zhǔn)品母液等體積混合,平行制備 3 份。準(zhǔn)確度溶液 4(記為 A4):取 A1 與2 倍摩爾量小分子標(biāo)準(zhǔn)品母液等體積混合,平行制備 3 份。準(zhǔn)確度溶液 5(記為 A5):取 A1 與3 倍摩爾量小分子標(biāo)準(zhǔn)品母液等體積混合,平行制備 3 份。分別用上述不同小分子藥物和抗體摩爾比的準(zhǔn)確度溶液模擬不同 DAR 值的 ADC 藥物。以回收率作為驗證指標(biāo)。
1.2.4.3 精密度實驗 同一樣品(記為 P1)平行配制 6 份樣品進(jìn)行 DAR 值檢測,6 份樣品 DAR值檢測結(jié)果的 RSD 值作為重復(fù)性驗證結(jié)果。A、B兩位分析人員分別在不同日期取同一樣品(P1)平行配制 6 份,12 份樣品 DAR 值檢測結(jié)果的RSD 值作為中間精密度驗證結(jié)果。
1.2.4.4 線性 以準(zhǔn)確度溶液中模擬 DAR 值為橫坐標(biāo),252 nm 處吸光值與 280 nm 吸光值的比值為縱坐標(biāo)進(jìn)行擬合,以r2作為驗證指標(biāo)。
1.2.4.5 檢測范圍 DAR 值與A252和A280的比值成正比。當(dāng)A252越大且A280越小時,DAR 值最大;當(dāng)A252越小且A280越大時,DAR 值最小。當(dāng)A252和A280均在 0.3 ~ 0.7 范圍內(nèi)時,根據(jù)公式 ⑩,計算 DAR 值的檢測范圍。
1.2.4.6 耐用性 考察不同檢測條件對檢測結(jié)果的影響。驗證方案:①分別在 279、280、281 和252 nm 處檢測 DAR 值,平行測定 3 次;②分別在 251、252、253 和 280 nm 處檢測 DAR 值,平行測定3 次;③分別在供試品配制后 1 小時內(nèi),每隔 10 min 檢測 DAR 值;④分別使用 3 個不同批次的比色皿檢測 DAR 值。以 DAR 值檢測RSD 作為各耐用性條件驗證指標(biāo)。
2 結(jié)果
2.1 抗體的消光系數(shù)測定
根據(jù)抗體的理論氨基酸組成,可得酪氨酸、色氨酸、半胱氨酸的個數(shù)分別為 56、24、32。根據(jù)公式 ① 計算出抗體的理論消光系數(shù)為217440 L/(mol·cm)。分別用 pH 6.0 的磷酸鹽緩沖溶液和 6 mol/L 鹽酸胍緩沖液稀釋抗體,記為Ab-1、Ab-2、Ab-3,測定 Ab-1、Ab-2、Ab-3 在280 nm 和 320 nm 處的吸光值,根據(jù)公式②計算抗體實際消光系數(shù)(εAb-280)為 228913 L/(mol·cm)(表 1)。
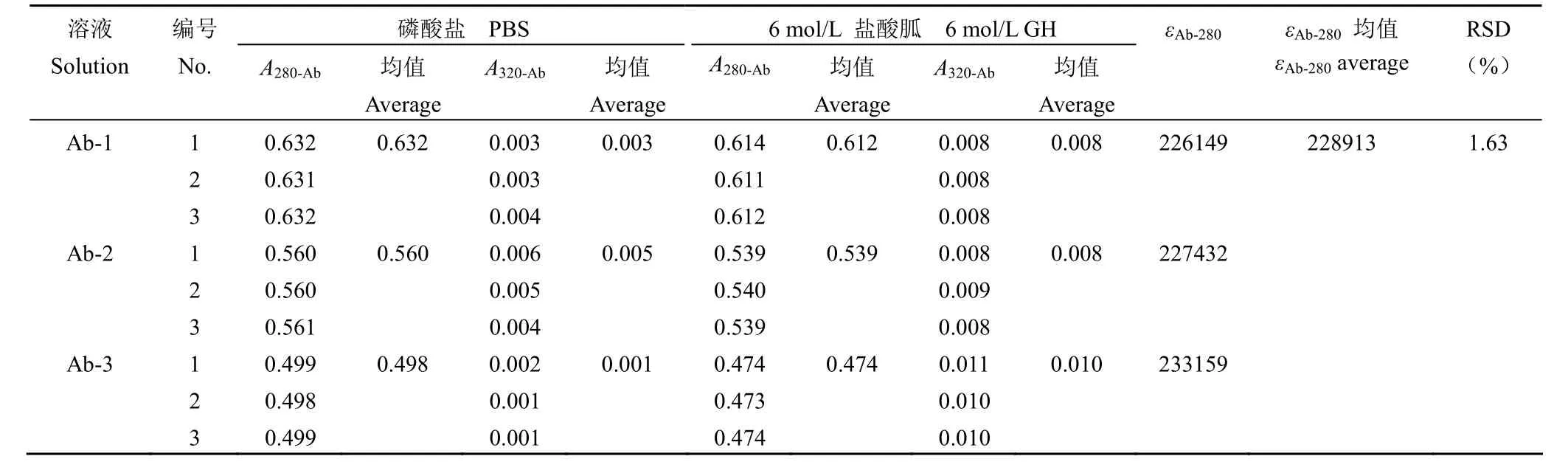
表1 抗體在 280 nm 處摩爾消光系數(shù)(L/(mol·cm))Table 1 The molar extinction coefficient of the antibody at 280 nm [L/(mol·cm)]
根據(jù)公式 ③ 計算抗體的摩爾濃度。用 pH 6.0的磷酸鹽緩沖溶液將已知濃度的抗體稀釋,分別記為 Ab-4、Ab-5、Ab-6。檢測抗體在 252 nm 處的吸光值,根據(jù)公式 ④ 計算抗體在 252 nm 處的摩爾消光系數(shù)εAb-252為 91258 L/(mol·cm)(表 2)。

表2 抗體在 252 nm 處摩爾消光系數(shù)(L/(mol·cm))Table 2 The molar extinction coefficient of the antibody at 252 nm [L/(mol·cm)]
2.2 藥物的消光系數(shù)測定
分別制備 6 個不同摩爾濃度的小分子藥物溶液,分別記為 Drug-1、Drug-2、Drug-3、Drug-4、Drug-5、Drug-6,測定各溶液在 252 和 280 nm的吸光值,根據(jù)公式 ⑤、⑥,計算小分子藥物在280 和 252 nm 的εD-252和εD-280分別為 12798和 3186 L/(mol·cm)(表 3 和表 4)。

表4 小分子在 280 nm 處摩爾消光系數(shù)(L/(mol·cm))Table 4 The molar extinction coefficient of the small molecule at 280 nm [L/(mol·cm)]
2.3 ADC 藥物 DAR 值公式的確定
抗體在 280 和 252 nm 處的消光系數(shù)和藥物小分子在280 和 252 nm 處的消光系數(shù)分別代入公式 ⑩ 可得 DAR 值計算公式如下:
2.4 方法驗證
按照驗證方案,從表 5 可知,使用磷酸鹽緩沖液、中間產(chǎn)品空白溶液、成品制劑空白溶液、純水稀釋的樣品在 280 和 252 nm 處的吸光值和 DAR值檢測結(jié)果的 RSD 為 1.99%。說明使用不同稀釋液對 DAR 值測定結(jié)果影響較小。中間產(chǎn)品溶液中的其他成分、成品制劑中的輔料等均不會影響該方法的檢測,同時易獲得的純水可以作為日常檢測的稀釋液使用。準(zhǔn)確性實驗時,當(dāng)使用裸抗添加的方法降低模擬 DAR 值時,其回收率相比通過添加小分子藥物提高模擬 DAR 的回收率低。推測是由于裸抗?jié)舛扔捎嬎惬@得,而非像小分子藥物一樣通過稱量獲得,導(dǎo)致回收率誤差稍大。盡管如此,準(zhǔn)確度溶液的 DAR 值檢測結(jié)果與模擬摩爾比的回收率均在 75% ~ 100% 范圍內(nèi)(表 6),說明檢測方法準(zhǔn)確度好。同一樣品的 6 份平行樣品 DAR 檢測結(jié)果 RSD 為 1.93%(表 7),說明方法重復(fù)性好;不同分析人員在不同時間檢測同一樣品的 12 個DAR 檢測結(jié)果 RSD 為 2.36%(表 8),說明該方法在不同人員和不同時間的中間精密度良好。

表5 專屬性驗證結(jié)果Table 5 The validation results of specificity

表6 準(zhǔn)確性驗證結(jié)果Table 6 The validation results of accuracy
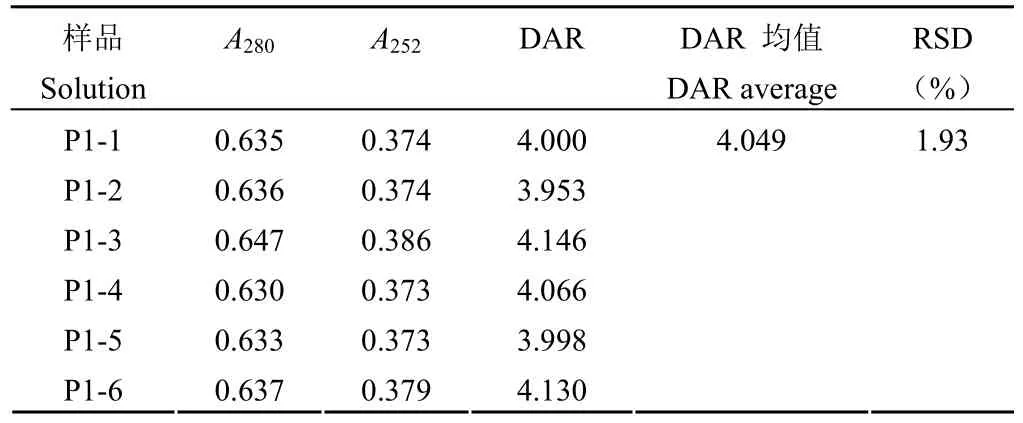
表7 重復(fù)性驗證結(jié)果Table 7 The validation results of repeatability

表8 中間精密度驗證結(jié)果Table 8 The validation results of intermediate precision
根據(jù)公式 ⑩,當(dāng)A280固定時,A252與 DAR值呈正相關(guān),A252越大 DAR 值越大。為了控制不同樣品檢測時A280之間的差異,以A252和A280的比值作為縱坐標(biāo),以 DAR 值為橫坐標(biāo)進(jìn)行線性回歸檢測方法的線性,結(jié)果顯示擬合后線性回歸方程為 y = 0.0408x + 0.414,r2= 0.9954,說明檢測方法具有良好的線性(圖 1)。根據(jù)公式 ⑩,當(dāng)A280為 0.7,A252為 0.3 時,DAR 最小,為0.60;當(dāng)A280為 0.3,A252為 0.7 時,DAR 最大,為 82.56。故使用該方法進(jìn)行 DAR 值的檢測范圍為 0.60 ~ 82.56。當(dāng)檢測波長為(280 ± 1)nm 或(252 ± 1)nm 時,DAR 值檢測結(jié)果的 RSD 分別為 2.09% 和 4.76%(表 9);當(dāng)溶液配制后放置0 ~ 60 min,每隔 10 分鐘檢測的 DAR 值結(jié)果RSD% 為 2.73%(表 10);當(dāng)采用不同批次的比色皿進(jìn)行檢測,DAR 值 RSD% 為 4.94%(表 11)。綜上,說明方法具有良好的耐用性。

圖1 線性驗證結(jié)果Figure 1 The results of linear regression
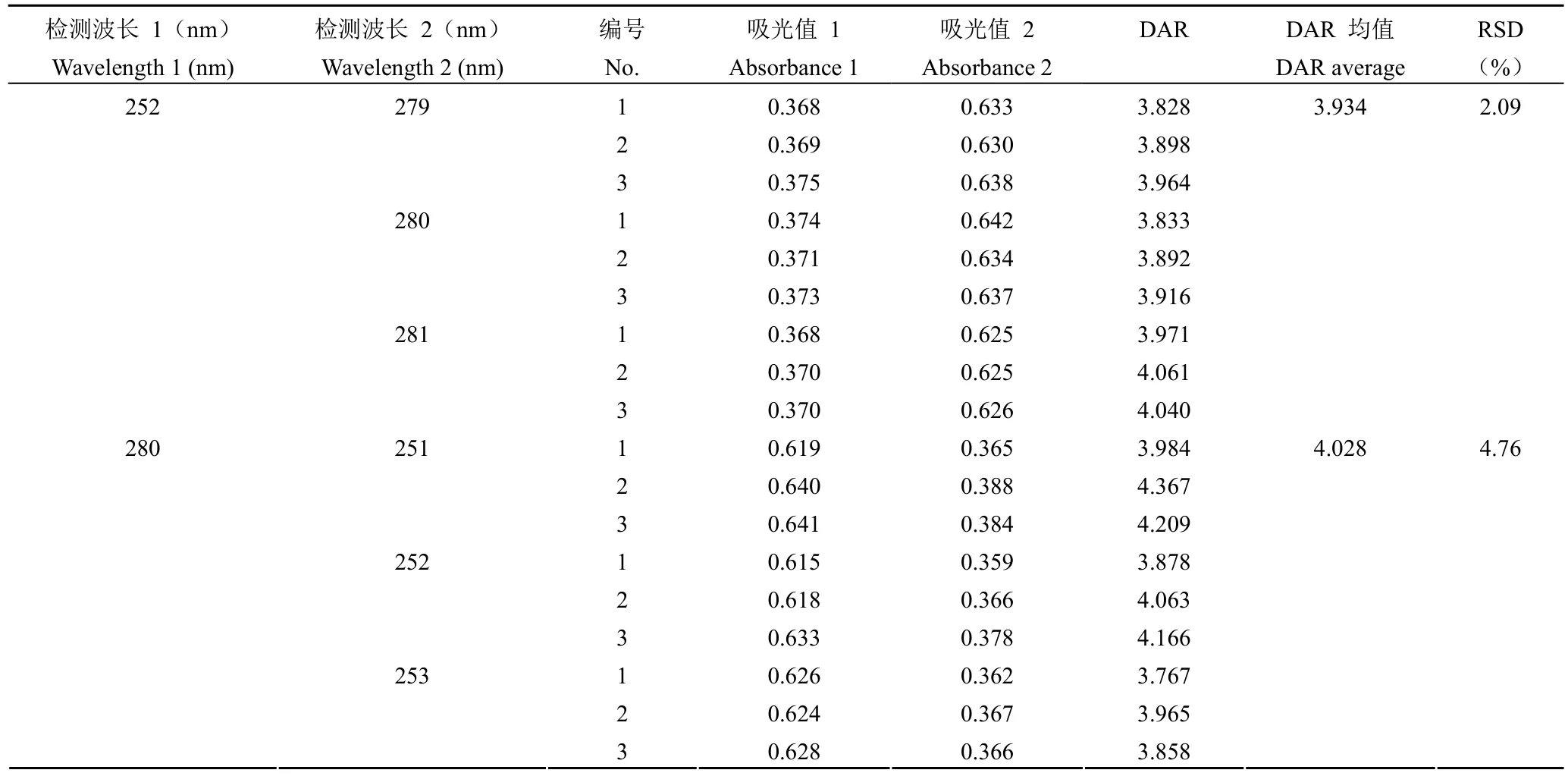
表9 耐用性(檢測波長)驗證結(jié)果Table 9 The validation results of robustness (detection wavelengths)

表10 耐用性(放置時間)驗證結(jié)果Table 10 The validation results of robustness(solution storage times)

表11 耐用性(比色皿批次)驗證結(jié)果Table 11 The validation results of robustness(cuvette batches)
3 討論
紫外可見光譜法檢測抗體偶聯(lián)藥物具有簡單、快捷、成本低的特點。采用該方法進(jìn)行抗體偶聯(lián)藥物的 DAR 值檢測已經(jīng)廣泛用于研發(fā)階段的 ADC藥物[5]和已上市 ADC 藥物[13]。相比色譜法或者質(zhì)譜法等其他檢測方法,紫外可見光譜法適用于不同偶聯(lián)方式的 ADC 藥物,無論是隨機偶聯(lián)或者定點偶聯(lián)。當(dāng)小分子藥物和抗體未發(fā)生變化,僅偶聯(lián)方式調(diào)整時,采用該方法進(jìn)行 DAR 值檢測可有效減少檢測方法開發(fā)的時間,加快藥物研發(fā)進(jìn)程。
抗體的高級結(jié)構(gòu),如折疊或螺旋,可能會影響部分氨基酸的吸收光譜,因此基于氨基酸組成計算的消光系數(shù)可能和實際消光系數(shù)存在差異[14]。加入鹽酸胍改變抗體的高級結(jié)構(gòu),減少高級結(jié)構(gòu)對消光系數(shù)的影響[15]。不同類型小分子藥物的最大吸收波長不同,如美登素 DM1、DM4 等細(xì)胞毒素分子通常在 252 nm 處檢測 DAR 值[16-17];Duocarmycin、CC-1065 分子在約 325 nm 處檢測[18];Camptothecin(CPT)類小分子(Exatecan、Dxd)在約 370 nm 處檢測 DAR 值[19];MMAE、MMAF 分子則在約248 nm 處檢測 DAR 值[20]。在實際使用時需要根據(jù)不同的小分子藥物選擇合適的檢測波長。不同溶液環(huán)境對氨基酸吸收光譜存在影響,不同溶劑也可能影響小分子藥物的消光系數(shù),因此在使用該方法進(jìn)行藥物生產(chǎn)過程控制時,需要考慮不同工藝階段溶液對抗體和小分子藥物的影響。
雖然紫外可見光譜法優(yōu)點眾多,但相比其他方法仍然存在一定的局限性。首先,該方法不能區(qū)分偶聯(lián)的小分子藥物和游離的小分子藥物。當(dāng)樣品中游離小分子藥物較多時,該方法的檢測可能存在虛高。針對此類樣品,可以利用 ADC 藥物和小分子藥物親和性的不同或分子大小的不同進(jìn)行分離純化,去除游離小分子后再進(jìn)行檢測。其次,該方法無法分析 ADC 藥物的偶聯(lián)分布。當(dāng) DAR 值相同時,但偶聯(lián)方式或偶聯(lián)位點不同時,需要結(jié)合其他方法進(jìn)行偶聯(lián)分布的分析。
藥物抗體偶聯(lián)比作為 ADC 藥物的重要質(zhì)量屬性,尚缺少關(guān)于方法建立和方法驗證的法規(guī)指導(dǎo)原則及系統(tǒng)性描述紫外可見光譜法檢測 DAR 值方法建立和驗證過程的研究資料。基于此,本研究將紫外可見光譜法檢測 DAR 值方法建立過程進(jìn)行優(yōu)化,使其簡單、系統(tǒng)、可操作性強,可應(yīng)用于不同抗體和不同小分子藥物偶聯(lián)物的方法建立過程,為業(yè)內(nèi)人士提供參考。此外,本研究結(jié)合方法的理論基礎(chǔ),對方法的專屬性、準(zhǔn)確性、精密度、線性、范圍和耐用性進(jìn)行驗證,結(jié)果表明方法可用于藥物的質(zhì)量控制檢測。

