慢性內臟痛及誘發負性情緒的神經回路研究進展 *
常曉麗 張海燕 張麗麗 陳少宗△
(1 山東中醫藥大學針灸推拿學院,濟南 250355;2 山東中醫藥大學針灸研究院,濟南 250355)
內臟痛是指內臟器官障礙所引起的疼痛,其發生率高達20%。腸易激綜合征(irritable bowel syndrome, IBS)所導致的腹部疼痛是臨床IBS 病人就醫的首要原因。疼痛是一種有意識的主觀體驗,包含了疼痛感覺和情感體驗兩個維度[1]。流行病學研究顯示,IBS 病人普遍伴有負性情緒[2]。焦慮抑郁等心身癥狀會導致IBS 病人病情更加嚴重、療效更為不佳,嚴重威脅人民的身體健康。據估計,與IBS相關的年度直接和間接成本在中國高達1230 億人民幣。因此,IBS 內臟痛及其負性情緒發病機制的研究及防治,具有極大的醫學和社會意義。
《2020 年中國腸易激綜合征專家共識意見》與國際共識一致明確指出IBS 是多因素共同引起的腸-腦互動異常的結果。IBS 病人感覺傳入通路對各種刺激的敏感性異常增高,然而對其機制的研究大多集中于外周和脊髓,對腦回路機制認識相對不足。特定的大腦功能,如疼痛感覺加工和調控、情緒或認知調節,是腦區之間動態交互的結果。探究內臟疼痛信號在大腦中的傳導通路,將有助于慢性內臟痛的靶向治療。光遺傳學和化學遺傳學這兩種高度特異性的神經元干預技術的出現,為確定特定神經元活動和意識行為之間的因果關系提供了強有力的工具。最近的研究開始揭示慢性內臟痛及其誘發負性情緒的復雜神經回路,并證實疼痛的閾值和幅度可以通過記憶、注意和情感腦回路之間的相互作用來調節。
前扣帶回(anterior cingulate cortex, ACC)和杏仁核在認知、情緒和疼痛等方面的功能受到越來越多研究者的關注。因此,本文將主要圍繞上述核團,從神經回路水平,總結并分析IBS 嚙齒類動物模型內臟痛及誘發負性情緒腦回路的最新發現,以期為內臟痛神經回路機制方面的研究提供新方向,為臨床IBS 及其他內臟痛的治療提供新思路。
一、IBS 內臟痛動物模型
建立典型、穩定、可重復的動物疾病模型是進一步研究內臟痛的重要基礎。目前常用的構建IBS嚙齒類動物模型的方法主要包括應激刺激、物理刺激和化學刺激。生命早期的應激事件是成年期身心疾病的重要危險因素。新生期母愛剝奪和新生期結直腸刺激是常用的模擬早期應激/童年創傷的應激模型。研究表明,當幼崽達到成年后表現出內臟高敏感,對壓力的反應性增加,以及焦慮和抑郁樣行為[3,4]。在成年期,急性或慢性心理應激,軀體應激(如感染、炎癥)和威脅生命應激(如強奸、戰爭、環境災害等)是觸發IBS 發生發展的重要因素。目前,應用最廣泛的急性心理應激模型是避水應激和部分束縛應激;慢性避水應激,慢性束縛應激和慢性不可預知的溫和刺激是常用的慢性心理應激模型。急性應激誘發的內臟疼痛持續時間較短,不適合IBS 內臟痛的長期觀察和研究。慢性應激刺激影響實驗動物的心理和生理狀態,導致胃腸功能紊亂,內臟高敏感以及焦慮抑郁樣行為的出現。感染后IBS 模型包括寄生蟲感染(如急性原發線蟲、巴西日本曲霉和小隱孢子蟲)和細菌感染(如空腸彎曲桿菌、腸沙門氏菌和彎曲桿菌)兩類。2, 4, 6-三硝基苯磺酸、乙酸或芥子油是常用的制備炎癥后IBS 模型的化學物質。新生期母愛剝奪和新生期結直腸刺激可以模擬生命早期應激對成年大鼠和小鼠內臟痛、情緒和社會行為的影響,因此,目前研究者主要通過以上方法建立IBS 模型探討內臟痛及負性情緒的神經回路機制。然而,在IBS 模型應用中存在以下問題:絕大多數的IBS 實驗研究采用與人類種屬差異較大的大小鼠為研究對象,尚未發現應用高級靈長類動物的研究,可傳遞性可能較差;另外,大多數研究以雄性動物為研究對象,而臨床女性IBS 的發病率約為男性的2 倍,因此建議釆用雌雄各半的實驗動物更為符合臨床特點。
結直腸擴張是實驗室和臨床評估腸道感覺最廣泛使用的刺激方法,結直腸擴張刺激引起的腹部肌肉收縮通常稱為內臟運動反應,是檢測內臟痛應用最廣的參數。目前,腹部撤回反射和腹部肌電記錄是評估內臟運動反應的主要方法。神經元細胞電生理記錄、離體腸管神經肌肉的收縮反應、心血管反射等也是驗證內臟高敏感性的手段。另外,IBS 內臟痛引起的負性情緒常用條件位置偏好/厭惡來評估。曠場、高架十字迷宮、糖水偏好、強迫游泳等測試也常用于評估疼痛引起的焦慮抑郁癥狀。
二、內臟痛及誘發負性情緒的神經回路
1.ACC
ACC 是處理嚙齒類動物和人類慢性疼痛感覺和情緒成分的核心。大量研究結果表明慢性疼痛或重度抑郁癥病人ACC 神經元活動發生重大變化。功能磁共振成像結果顯示,IBS 病人ACC 激活[5]。同樣,動物實驗也發現內臟高敏感大鼠的ACC 對結直腸擴張的反應增強。進一步研究發現,ACC谷氨酸能神經元直接參與內臟敏感性的調節[6,7]。ACC 與眾多腦區存在廣泛的功能連接,共同構成ACC 的神經回路。這些復雜的神經回路聯系為ACC 調控IBS 的內臟痛和負性情緒提供了良好的結構基礎(見圖1A)。
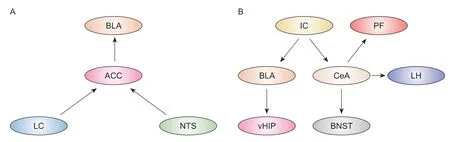
圖1 調控慢性內臟痛及誘發負性情緒的神經回路
(1)藍斑 (locus coeruleus, LC)-ACC:LC 去甲腎上腺素能系統是中樞神經系統中去甲腎上腺素的主要來源,主要參與調節疼痛、注意力、覺醒、學習和記憶等過程[8]。急性疼痛觸發LC 神經元強烈的應激反應,經脊髓介導產生內源性鎮痛,同時通過其上行傳出神經促進厭惡、警覺和威脅覺察。ACC接受來自LC 的廣泛投射,LC-ACC 連接的改變與抑郁嚴重程度呈負相關[9]。化學遺傳學阻斷投射到ACC 的LC 去甲腎上腺素能神經元可完全逆轉抑郁樣行為[10]。將結直腸擴張與條件位置回避實驗相結合可以將習得內臟疼痛與特定位置的記憶聯系,對接受結直腸擴張訓練的場所產生厭惡并予以回避,直接反映了內臟刺激引起疼痛的情感成分,并產生了相當大的厭惡聯想學習和記憶[11]。選擇性損毀LC 去甲腎上腺素能神經元會破壞內臟傷害性厭惡記憶的形成。進一步研究發現,光遺傳學激活或沉默LC 投射到ACC 的神經元可增強或減弱學習記憶的形成,以及LC 和ACC 中原癌基因蛋白c-Fos 的表達[12]。這些數據表明,自下而上的LC 到ACC神經元通路產生的去甲腎上腺素是內臟痛誘發厭惡行為的原因。Iqbal 等[13]進一步指出ACC 星形膠質細胞糖原無氧酵解產生的L-乳酸,是疼痛厭惡記憶形成不可或缺的因素。通過去甲腎上腺素β2受體,結合LC投射至ACC神經元所釋放的去甲腎上腺素,調控ACC 神經元突觸可塑性,從而影響內臟疼痛厭惡記憶的形成和鞏固[12]。雖然該研究提供了一些關于內臟痛覺記憶形成的新機制,但這些機制的臨床應用可能需要進一步的研究,比如如何通過調控去甲腎上腺素信號來改善內臟疼痛癥狀或相關疾病。
(2)孤束核 (nucleus tractus solitarii, NTS)-ACC:NTS 位于迷走神經背核的背外側,是內臟感覺初級中樞。內臟信息通過雙側迷走神經傳遞到NTS,進而傳遞到更高級的腦中樞,這些腦中樞被認為介導了疼痛的情緒方面[14,15]。越來越多的證據表明胃腸道和胰腺傷害性刺激誘導NTS c-Fos的過度表達[16,17]。本實驗室觀察到IBS 大鼠NTS 存在異常升高的theta振蕩。在傷害性結直腸擴張刺激期間,theta 振蕩相對能量顯著提高,且在結直腸擴張刺激結束后,中樞反應后效應較長(數據未發表)。
NTS 神經元可以投射到ACC,為皮層疼痛中心可以直接被NTS 處理的內臟傳入激活提供了證據。此外,來自NTS 的上行纖維更多地支配ACC中表達鈣/鈣調蛋白依賴性蛋白激酶II-的神經元,而不是表達谷氨酸脫羧酶67-的神經元[16,17]。在慢性胰腺炎小鼠中,激活的NTS-ACC 回路加重內臟疼痛和焦慮樣行為,抑制該回路能夠減輕內臟疼痛和焦慮樣行為[17],表明該神經回路參與慢性內臟痛的痛覺過敏及其誘發的焦慮情緒。以上結果為內臟痛在大腦皮質的調節提出了新見解,并找到ACC 可作為神經調節干預治療內臟痛及誘發負性情緒的潛在靶點。
(3)基底外側杏仁核(basolateral nucleus of the amygdala, BLA)-ACC:在IBS 病人中,內臟刺激改變了杏仁核的活性[18]。BLA 是杏仁核中最大的核團,參與疼痛信息的接收、整合和編碼,是邊緣系統和皮層區域之間疼痛信號處理的中樞。大量動物實驗表明IBS 大鼠BLA 谷氨酸能神經元突觸活性增強[19]。
BLA 的前部與ACC 區域顯示出密集、直接和相互的連接[20]。許多證據表明theta 節律(4~10 Hz)參與促進腦區之間的信息傳遞,并且在疼痛感知和認知功能中的作用也得到了認可。內臟高敏感的大鼠BLA-ACC 突觸長時程增強減弱,ACC 鋒電位與BLA theta 振蕩之間的相位關系受損[21]。交叉相關分析顯示,內臟高敏感導致BLA 和ACC 之間theta振蕩的同步化受到抑制,表明它們之間動態信息傳遞松散,進而可能破壞神經網絡組裝并影響突觸可塑性,導致認知功能受損[21]。該研究有一個潛在的混雜問題,即所獲得的電生理記錄不是在內臟痛動物的決策任務中進行的。直接評估內臟痛動物決策相關的電生理變化,能夠為未來的研究提供強有力的證據。此外,化學遺傳或光遺傳激活BLA-ACC投射緩解了MK-801 小鼠(精神分裂癥動物模型)的社交缺陷,并增強了其在新物體識別測試中的認知能力,而化學遺傳或光遺傳抑制BLA-ACC 投射則在一定程度上惡化了其精神分裂癥表型。
最新文獻報道,慢性神經病理性疼痛導致投射到ACC 的BLA 神經元過度活躍,并增加了ACC和BLA 之間的功能連接,這對慢性疼痛誘導的抑郁樣行為是十分必要的。不僅如此,BLA-ACC 通路的反復激活足以激活ACC 中的谷氨酸能神經元和γ-氨基丁酸(γ-aminobutyric acid, GABA)能神經元,使動物逐漸出現抑郁樣表型[20]。然而,在該模型中,BLA-ACC 通路并不是機械超敏反應和驅動持續性疼痛行為所必需的。ACC 對慢性神經病理性疼痛的調節可能依賴于BLA 以外的腦區[20]。綜上所述,我們推測軀體和內臟信息可匯聚到BLAACC 同一神經元,其突觸可塑性發生改變可能是BLA-ACC 通路同時參與軀體痛和內臟痛及其負性情緒調控的機制。
2.杏仁核
杏仁核是大腦邊緣系統的重要腦區,主要包括BLA 和中央杏仁核(central amygdala, CeA),在負性情緒處理(如焦慮、抑郁和恐懼)、獎賞、學習記憶及認知功能中發揮重要作用。在IBS 病人和焦慮癥病人中杏仁核都被持續激活[22,23],因此,杏仁核與其上下游腦區所形成的神經網絡在調控內臟疼痛及其誘發的負性情緒中具有關鍵作用(見圖1B)。
(1)BLA-腹側海馬 (ventral hippocampus, vHPC):BLA 是負責接收和整合外部信息的樞紐,由谷氨酸能神經元(約占85%)和GABA 能神經元組成。嚙齒類動物研究顯示,BLA 對vHPC 產生了致密的單突觸谷氨酸能投射,這種功能連接與焦慮情緒的產生密切相關。激活BLA-vHPC 投射能夠增加小鼠焦慮樣行為,而抑制BLA-vHPC 投射可改善小鼠的焦慮樣行為[24]。慢性應激選擇性增加投射至vHPC 的BLA 神經元c-Fos 的表達,減弱小電導鈣激活的鉀離子通道功能,下調含δ 亞基的GABA 受體介導的緊張性抑制電流,導致BLA-vHPC 神經元興奮性顯著升高,增加小鼠焦慮樣行為[25,26]。另一項研究顯示,慢性束縛應激顯著增加了BLA-vHPC 神經元微小興奮性突觸后電流,即興奮性突觸傳遞增強,同時還伴隨著神經元樹突分枝增多,樹突棘密度增加,且這種變化與應激所致的過度焦慮顯著正相關[19]。
不同空間位置的杏仁核對海馬的支配在焦慮行為的調控中具有截然不同的作用。BLA 和vHPC CA1 (vCA1) 沿其頭、尾和淺深軸具有細胞和功能多樣性。頭側BLA (aBLA) 和尾側BLA (pBLA)分別支配vCA1 的深層鈣結合蛋白1 陰性 (Calb1-) 和淺層鈣結合蛋白1 陽性神經元 (Calb1+)[27]。光刺激pBLA-vCA1Calb1+對小鼠具有抗焦慮作用,改善阿爾茨海默病模型小鼠的焦慮癥狀;激活aBLA-vCA1Calb1-會誘發小鼠的焦慮樣行為[27]。此外,最新文獻報道BLA-vHPC 神經回路對于形成恐懼消退記憶是必不可少的,恐懼消退記憶依賴于BLA 投射vHPC 形成場景和刺激安全表征,BLA-vHPC 回路促進恐懼消退記憶的提取,而不是強化恐懼記憶[28]。vHPC 對BLA 同樣具有單突觸谷氨酸能投射,但研究發現,vHPC-BLA 在生理狀態下并不參與焦慮樣行為的調控,而主要參與恐懼及恐懼共情相關行為的調控[29]。因此,杏仁核和海馬之間相互作用功能失調,則可能損傷恐懼記憶消退學習過程,導致持續性恐懼,繼而誘發焦慮癥等精神疾病。然而,該回路在IBS誘發的焦慮、恐懼消退記憶等行為中的作用目前尚未報道,是未來值得研究的一個方向。
(2)島葉 (insular cortex, IC)-杏仁核:IC 是整合內臟自主活動的高級中樞,被稱為“內臟腦”。影像學研究表明,IBS 病人IC 的厚度減少和灰質體積降低,與IBS 較長的病程和內臟高敏感有關[30]。在IBS 病人或嚙齒類動物中,IC 在靜息狀態和結直腸擴張刺激時持續激活[30]。特異性抑制IC 錐體細胞的興奮性可同時降低腹部痛覺過敏和疼痛誘發的焦慮行為[31]。除此之外,IC 對于處理厭惡性和獎賞性刺激以及協調適應性行為反應也是至關重要,是恐懼記憶和消退記憶的潛在調控中樞[32]。IC 通過整合來自身體的信息,對恐懼情緒進行雙向調節,從而保持恐懼情緒的平衡[33]。Wang 等[34]進一步觀察到IC-CeA 和IC-伏隔核投射神經元分別在恐懼記憶和消退記憶中發揮關鍵作用,這些神經元集群之間存在記憶行為依賴的交互抑制,可能構成機體切換正負情緒的神經回路機制。
此外,IC 谷氨酸能神經元向BLA 發出纖維投射,該投射以同側為主,并參與調節BLA 內興奮性/抑制性神經元的活性。選擇性抑制IC 向BLA 投射的谷氨酸能神經元活性,或者條件性凋亡IC-BLA通路突觸后的谷氨酸能神經元均能夠顯著緩解與慢性神經病理性疼痛小鼠同窩小鼠的共情痛,反之則會加劇該小鼠共情痛的發生和維持。利用磷酸化核糖體親和沉淀測序方法篩選到突觸結合蛋白2 和Rab 相互作用分子3 是共情狀態下控制IC-BLA 通路突觸活性的關鍵分子[35]。總之,IC-杏仁核回路可能在內臟痛誘發的負性情緒調控中具有重要作用,需要未來的研究進一步證實。
(3)CeA:CeA 被認為是杏仁核信號的輸出核團,與下丘腦外側區(lateral hypothalamus, LH),終紋床核(bed nucleus of stria terminalis, BNST),丘腦束旁核(parafascicularnucleus, PF)等核團形成廣泛的纖維聯系,對疼痛和相關情緒反應(例如恐懼和焦慮)的整合起重要作用。臨床研究顯示,IBS 病人的下丘腦和杏仁核被顯著激活。CeA GABA 能神經元投射到LH 促食欲素神經元。化學遺傳學激活正常小鼠的LH 和CeA 的GABA 能神經元后,該小鼠表現出與IBS 小鼠相似的行為學缺陷(胃腸道功能障礙和抑郁樣行為),給予GABA 受體拮抗劑后可以緩解這些癥狀。CeA-LH GABA 神經元的激活抑制了LH 促食欲素神經元的激活[22]。這些結果提示CeA-LH 回路中的GABA 能神經元通過釋放GABA 神經遞質調控下游促食欲素神經元的活動,進一步調控小鼠的抑郁樣表型和胃腸道功能。BNST 和CeA 起源相同,屬于泛杏仁核,包含許多亞區和特定的神經細胞。BNST 與自主神經和神經內分泌功能有關,對情緒和心境有顯著影響。在焦慮癥病人和IBS 病人中,BNST 和CeA 神經元活動發生改變。CeA 接受來自外界環境的感覺信息,并直接投射到BNST,激活CeA-BNST 促進雄性大鼠內臟痛[36]和焦慮、抑郁樣行為的發生[37]。眾所周知,BNST 是調節性別差異行為的關鍵腦區。因此,上述結果是否適用于雌性大鼠或者CeA-BNST 是否是IBS 性別差異行為的關鍵神經回路仍有待研究。此外,CeA GABA 能神經元與PF 谷氨酸能神經元存在單突觸的直接連接。張智教授團隊在慢性束縛應激誘導的疼痛抑郁共病模型中進一步觀察到CeA GABA 能神經元活性增加,對PF 谷氨酸能神經元的輸入增加,使得PF 中谷氨酸能神經元活性降低,并且對次級軀體感覺皮質(second somatosensory cortex, S2) 傳遞減弱,即CeA-PF-S2 三級神經回路參與調控疼痛抑郁共病的形成[38]。在該研究中,研究者運用慢性束縛應激法制備疼痛抑郁共病模型,關注軀體痛與抑郁共病的神經回路。值得注意的是,慢性束縛應激也是制備IBS 的常用方法,雖然該研究未能評估內臟痛,但我們推測CeA-PF 參與慢性內臟痛及其抑郁的調控。綜上所述,CeA 相關投射形成神經網絡在慢性內臟痛及誘發負性情緒中具有重要作用,這些復雜的神經回路之間如何精密協作值得進一步研究。
三、展望
綜上所述,慢性內臟痛及誘發負性情緒神經回路的研究加深了我們對慢性內臟痛與負性情緒交互惡化的理解。隨著更多高端科研工具的發展和各種神經科學技術的聯合應用,相信研究者們在慢性內臟痛及誘發負性情緒方面能夠取得更大的進展。針對目前該研究領域存在的問題,我們對未來研究提出以下幾點建議:①女性患IBS 和焦慮抑郁的風險較男性高。然而,目前關于內臟痛及誘發負性情緒神經回路的實驗結果是在雄性嚙齒類動物中獲得的,這可能并不完全適用于雌性嚙齒類動物,上述神經回路對IBS 內臟痛及負性情緒的調控是否存在性別差異值得探討,同時研究者應采用雌雄各半的研究方案,加大對雌性動物的研究力度;②科學研究轉化臨床的過程,是每個科研團隊最終的研究目的,這同樣也是疼痛和腦科學的重要研究方向。因此,釆用與人類種屬差異較小的動物構建IBS 模型,進行跨物種比較,增強可傳遞性是至關重要的;③不同的神經元群體混雜在同一腦區,但它們通過投射到不同的下游靶點來調節內臟痛的疼痛感知和情緒方面。核團介導內臟痛痛覺和負性情緒的神經元是否是同種神經元,將是未來有趣的研究方向。單細胞測序聯合空間轉錄組測序對神經元細胞類型進行分類將促進該研究的發展;④腦區之間形成復雜的神經回路調控內臟痛及其負性情緒,在同種動物模型中這些神經回路是否同時發生變化,是否有優先及主次之分是未知的。探討神經回路之間的精細協作將為內臟痛的治療提供新思路。
利益沖突聲明:作者聲明本文無利益沖突。

