例析“平行反應”和“連續反應”的模型構建
□李海霞
2021年高考河北化學卷第13題和2022年河北化學卷第13題,分別以“平行反應”和“連續反應”為情境,考查了化學反應原理的相關知識,題目難度較大。考慮到近些年各省多以“平行反應”和“連續反應”的平衡體系為情境,筆者整理了“平行反應”和“連續反應”與高中所學密切相關的知識,并對河北卷的這兩道題進行了解析,以期幫助大家形成解答這類題的思維模型。
一、平行反應
1.平行反應的概念及特點
平行反應是反應物同時平行地進行兩個或兩個以上不同的反應。
平行反應是同時開始、獨立進行的,且每個反應的速率由各自的速率常數決定,而速率常數和溫度有關,所以相同條件下,兩個反應的速率之比等于速率常數的比,是定值。
2.平行反應各反應的選擇性問題分析
反應的選擇性即在多平衡體系中,某反應中原料反應的量占總反應量的百分比,比值越大則該反應的選擇性越大。以2021年河北卷13題中兩個平行反應為例:
反應①:M+N=X+Y 活化能為Ea1速率常數為k1
反應②:M+N=X+Z 活化能為Ea2速率常數為k2
如果Ea1<Ea2,則反應①的速率快,如想獲得更多的Y,應縮短反應的時間,因為反應①速率快,相同時間內相比Z會生成更多的Y,使反應①的選擇性更高。
如想獲得更多的Z,由于反應②的活化能比較高,根據阿倫尼烏斯公式:,升高溫度,活化能較大的反應速率升高更快,所以可以升高體系溫度,使其速率更快,以獲得更多的Z。以上只是從速率角度考慮,如果該反應為放熱反應,升高溫度使平衡逆向移動,反而降低了Z的量,所以應該縮短反應的時間,在反應達到平衡之前停止反應。
當然,選擇合適的催化劑,降低反應②的活化能,使其反應速率更快,且達平衡之前結束反應,也可以獲得更多的Z。
3.平行反應知識的應用
2021年河北卷13題,以平行反應為情境,考查了反應速率、濃度、轉化率、活化能的比較等知識。
室溫下, 某溶液初始時僅溶有M 和N且濃度相等, 同時發生以下兩個反應:①M+N=X+Y;②M+N=X+Z,反應①的速率可表示為v1=k1c2(M),反應②的速率可表示為v2=k2c2(M)(k1、k2為速率常數)。反應體系中組分M、Z的濃度隨時間變化情況如圖1,下列說法錯誤的是( )
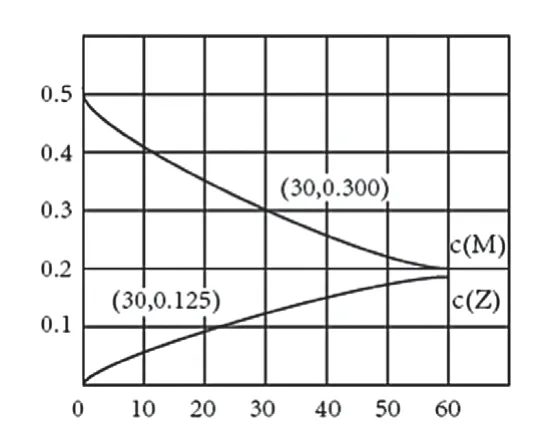
圖1
A.0~30min時間段內,Y的平均反應速率為6.67×10-8mol·L-1·min-1
B.反應開始后,體系中Y和Z的濃度之比保持不變
C.如果反應能進行到底,反應結束時62.5%的M轉化為Z
D.反應①的活化能比反應②的活化能大
結合上述平行反應相關知識,解析如下:A項:0~30min內,c(M)下降0.2mol/L,因為M消耗生成Y和Z,且計量數之比為1。0~30min內生成Z:0.125mol/L,則生成Y:0.075mol/L,其反應速率為0.075/30=2.5×10-3mol/(L·min),A錯誤;B項:反應①和反應②的速率均由各自的速率常數決定,溫度不變速率常數不變,所以相同時間內生成Y和Z的量的比值保持不變,即二者濃度比保持不變,B正確;C項:由圖中數據可知,當有0.2mol/L M發生反應時,生成Z 0.125mol/L,因為溫度不變速率常數不變,即生成Y和Z的速率比一定,所以無論反應進行中還是反應結束,生成Z所占原料的比例不變,為:0.125/0.2=0.0625,C正確;D項:由圖像數據可知,相同時間內生成Z的量更多,即反應速率快,所以反應②的活化能小,D正確。
二、連續反應
1.連續反應的概念及特點
連續反應是經過連續幾步完成的,前一步的生成物是下一步的反應物,連續進行的反應。表示形式為:①A=B ②B=C
各物質濃度隨時間的變化曲線為:
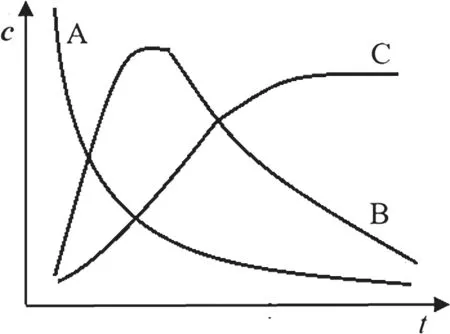
中間產物B的濃度在反應過程中有一個極大值,是連續反應的典型特征。
2.連續反應不同階段分析
若:①A=B 活化能Ea1速率常數k1
②B=C 活化能Ea2速率常數k2
在反應開始進行的前期,A的濃度較大,生成B的速率較快,同時第二步反應因為c(B)<c(A),則反應速率比較慢,所以生成B的速率大于消耗B的速率,此階段c(B)增大;隨著反應進行,A的濃度減小,生成B的速率減慢,由于c(B)增大,所以生成C的速率增大,此階段B的生成速率小于消耗速率,B的濃度降低;當B的消耗速率等于生成速率時,B濃度達到最大值。
兩步反應速率常數大小關系不同(活化能不同),其曲線有所不同,如下圖所示:
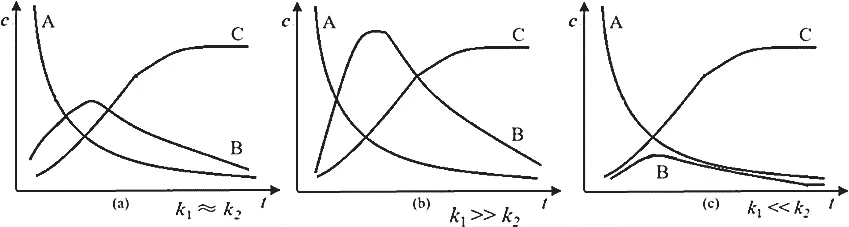
以上圖像的曲線變化趨勢相同,但中間產物最大值和中間產物在增大過程中的反應速率不同。這與兩個反應的速率常數大小不同(活化能不同)有關。
如果Ea1<<Ea2,則k1>k2,則A 生成B 的速率快,B生成C的速率較慢,B可以在短時間內積累到較大量,所以想獲得更多的B應縮短反應時間,短時間內結束反應;若想獲得更多的C則需延長反應時間。
如果Ea1>>Ea2,則k1<k2,第二個反應比較快,生成的B快速轉化為C,第一個反應生成B的速率與第二個反應消耗B的速率相差不大,即B還沒來得及積累太多就被消耗,那么B的最大濃度值比較小,峰較低。
3.連續反應知識的應用
2022年河北卷13題,以連續反應為情境,考查了反應速率及產率影響因素、活化能等知識。
恒溫恒容條件下,向密閉容器中加入一定量X,發生反應的方程式為①X=Y;②Y=Z。反應①的速率v1=k1c(X),反應②的速率v2=k2c(Y),式中k1、k2為速率常數。圖a為該體系中X、Y、Z濃度隨時間變化的曲線,圖b為反應①和②的lnk~曲線。下列說法錯誤的是( )
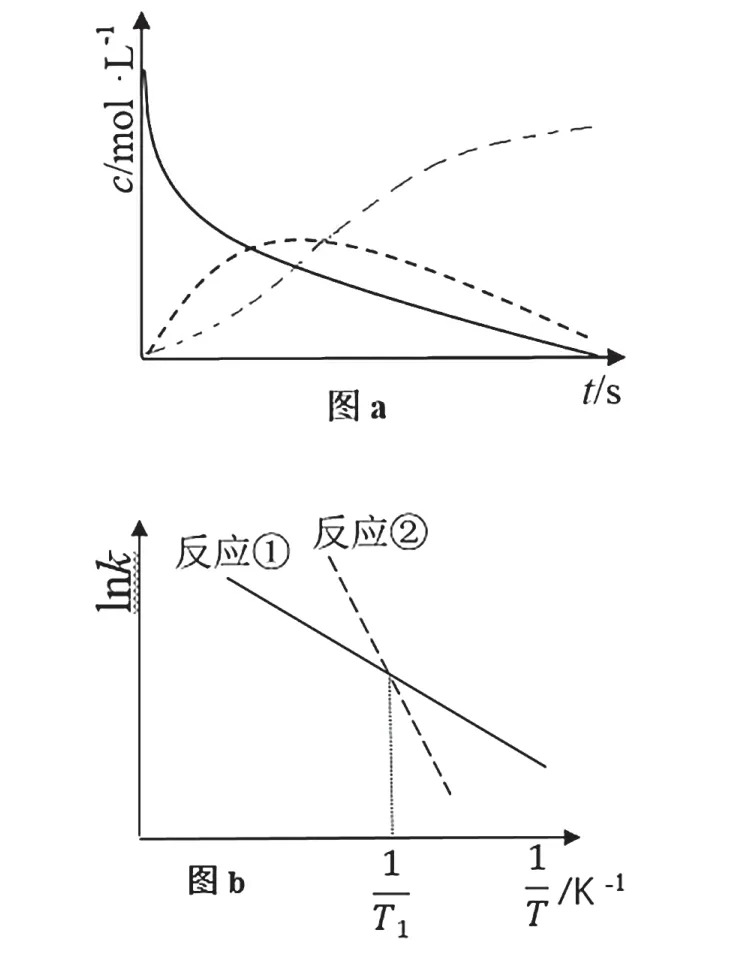
A.隨c(X)的減小,反應①、②的速率均降低
B.體系中v(X)=v(Y)+v(Z)
C.欲提高Y的產率,需提高反應溫度且控制反應時間
D.溫度低于T1時,總反應速率由反應②決定
結合上述連續反應的知識,解析如下:A項:c(X)下降的過程中,反應①的速率降低,反應②在c(X)下降的過程中有一段時間c(Y)上升,所以反應②速率增大,A錯誤;B項:反應計量數都為1,一段時間內X消耗的量等于生成Y和Z量的和,所以v(X)=v(Y)+v(Z),B正確;C項:由圖b可知隨溫度的變化反應②的lnk變化較大,所以反應②的活化能大,升高溫度反應②速率增大的更多,所以想獲得更多的Y,應縮短反應時間,且不宜升溫,C錯誤;D項:反應②的活化能較大,反應速率慢,為決速步驟,D正確。
無論是“平行反應”還是“連續反應”,都須具備分析復雜反應體系的“動力學”視角(反應進行的快慢)和“熱力學”視角(反應進行的程度)。如果是速率問題,需結合溫度、濃度、壓強、催化劑、活化能等具體條件分析;如果是反應程度問題,則需結合平衡移動的影響因素溫度、壓強、濃度分析。而實際生產中追求的是提高主反應的選擇性,往往以提高反應速率為主要途徑。
通過對上述知識和解題過程的梳理,可以更深入地剖析其他類似試題,高屋建瓴,形成思維模型。