安徽甜瓜和栝樓蔓枯病的病原菌鑒定及其有效藥劑篩選
夏智杰,張 雷,宋江華,傅 敏,張立新,*
(1.安徽農業大學 植物保護學院,植物病蟲害生物學與綠色防控安徽普通高校重點實驗室,安徽 合肥 230036; 2.安徽農業大學 園藝學院,安徽 合肥 230036)
瓜類蔓枯病(gummy stem blight)是一種典型的世界性土傳病害[1],可危害甜瓜、黃瓜等瓜類蔬菜莖蔓,致其產生褐色油漬狀斑點,嚴重時造成莖蔓分叉處開裂枯死,植株死亡率高達60%~80%,減產30%以上[2-4]。該病害于1869年在德國首次被發現,隨后在美國、瑞典、加拿大、日本、印度、中國新疆等地區相繼報道了甜瓜、西瓜、黃瓜等瓜類作物的發生和危害[5]。目前引起瓜類蔓枯病的病原菌主要有Stagonosporopsiscitrull,Stagonosporopsiscucurbitacearum和Stagonosporopsiscaricae[6]。據報道,S.citrulli引起的黃瓜蔓枯病在美國北卡州是僅次于根結線蟲的黃瓜第二大病害[7];在我國,S.cucurbitacearum引起廣東省苦瓜蔓枯病暴發流行,部分設施大棚中苦瓜蔓枯病發病率超過80%[8];在吉林省S.citrulli引起西瓜主產區暴發蔓枯病,導致大面積失收,嚴重影響了西瓜生產[9]。該病害具有發病早、危害重、損失大等特點[10],對瓜類作物的安全生產造成了嚴重威脅。
蔓枯病在瓜類植株整個生育期均可發生,苗期蔓枯病的發病率較低,孕蕾期植株開始表現癥狀,生長中后期發病最為嚴重。葉片和莖蔓是最主要的發病部位,葉片發病初期可出現水漬狀小斑點,后期逐漸發展為輪紋狀的黃褐色斑點或呈“V”形病斑,嚴重時可在發病部位觀察到黑色點狀的分生孢子器。莖蔓部發病初期可出現水漬狀褐色病斑,隨著病情發展,病斑可沿莖蔓拓展幾厘米到幾十厘米,后期病斑上可出現散生黑色顆粒物[11-12]。近年來,隨著安徽省瓜類蔬菜種植面積不斷擴大,瓜類蔓枯病的發生也呈加重趨勢。2021—2022年在舒城和巢湖地區的甜瓜和栝樓田間出現了嚴重的蔓枯病,為明確這些瓜類蔓枯病的病原菌類型,本研究對該地區的病樣進行了采集、病原菌分離和鑒定,以及室內藥劑篩選工作,以期為農業生產中瓜類蔓枯病防控提供科學依據。
1 材料與方法
1.1 供試材料
供試樣品:2021—2022年分別從安徽舒城縣、巢湖市的甜瓜和栝樓田塊,采集蔓枯癥狀的莖蔓組織,放于自封袋內,帶回實驗室用于病原菌的分離;金香玉甜瓜種子(武漢金陽紅種苗農業有限公司)、皖蔞9號栝樓種子(安徽有余跨越瓜蔞食品開發有限公司)催芽育苗后用于病原菌致病性測定。
培養基:馬鈴薯葡萄糖瓊脂(potato dextrose agar, PDA)培養基;燕麥培養基(oat meal agar, OA);誘導產孢培養基:原PDA培養基配方中加入酵母提取物2 g。
試劑及儀器:DL2000 DNA Marker、2×TaqMaster Mix,北京康為世紀生物科技有限公司;其他試劑均為國產分析純。RLD-500C-4 人工氣候箱,寧波樂電儀器制造有限公司;C1000 Touch PCR儀,美國Bio-Rad公司;CKX53倒置顯微鏡,日本Olympus株式會社。
供試藥劑:98%啶酰菌胺原藥,武漢曙歐科技有限公司;97%咪鮮胺原藥,江蘇輝豐生物農業股份有限公司;95%苯醚甲環唑原藥,深圳諾普信農化股份有限公司;98%戊唑醇原藥,97%多菌靈原藥,98%吡唑醚菌酯原藥,先正達作物保護有限公司;97%異菌脲原藥,湖北成豐化工有限公司。
1.2 病原菌的分離和純化
采用組織分離法[13]對病原菌進行分離和純化。將采集得到的具有蔓枯癥狀的莖蔓用滅菌剪刀在病健交界處剪取2~3 mm的病組織,先后浸入0.1%HgCl290 s、75%乙醇45 s 進行表面消毒,無菌水沖洗3次后,用滅菌的濾紙吸干病組織表面水分,最后轉移至PDA平板上,置于25 ℃黑暗條件下培養,待長出菌落后挑取菌落邊緣的菌絲進行純化培養。待長出菌落后轉接到另一平板上純化培養。在新鮮的PDA中進行單孢分離,獲得純化的后代,并對分離所得的菌株進行編號,于PDA斜面保存。
1.3 病原菌的形態學觀察
將純化后的菌株接種于PDA培養基上,26 ℃黑暗條件下培養7 d,觀察并記錄菌落形態特征;參照李英等[14]誘導蔓枯病菌產孢的方法, 將純化后的菌株接種于誘導產孢培養基上,26 ℃黑暗條件下培養7 d后,在40 W紫外燈下(20 h黑暗/4 h紫外)下30 cm照射4 d,在倒置熒光顯微鏡下觀察菌株的分生孢子形態,并測量分生孢子大小;同時將純化后的菌株接種于燕麥培養基上,26 ℃黑暗條件培養7 d后,在40 W紫外燈下(20 h黑暗/4 h紫外)下30 cm照射4 d,在倒置熒光顯微鏡下觀察菌株的子囊孢子形態,并測量子囊孢子大小。
1.4 目的位點的序列分析和構建系統發育樹
根據分離地點及寄主植物的不同,隨機選擇5個代表性菌株,其中安徽舒城3株(SC1-1、SC2-1、SC3-1),巢湖市2株(CH1-1、CH2-1)進行分子鑒定。采用CTAB法提取各菌株的基因組DNA,利用3個目的位點的引物對測試菌株進行PCR擴增,包括ITS(ITS-1: 5′-TCCGTAGGTGAACCTGCGG-3′, ITS-4: 5′-TCCTCCGCTTATTGATA-3′)[15]、TUB2基因(T1: 5′-AACATGCGTGAGATTG-3′, Bt2b: 5′-ACCCTCAGTGTAGTGA-3′)[16]和LSU(LROR: 5′-GTACCCGCTGAACTTAAGC-3′, LR7: 5′-TACTACCACCAAGATCT-3′)[17], 以上引物均由南京擎科生物科技有限公司合成。
25 μL PCR擴增體系:10 μmol·L-1上下游引物各1.0 μL、2×TaqPCR Master Mix 12.5 μL、基因組DNA 1.0 μL,ddH2O補足至25.0 μL。ITS、TUB2基因擴增反應程序為94 ℃預變性2 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸1 min,35個循環;72 ℃再次延伸5 min。LSU位點擴增程序為95 ℃預變性5 min;95 ℃變性45 s,48 ℃退火45 s,72 ℃延伸2 min,35個循環;72 ℃再延伸5 min。PCR擴增產物經1%瓊脂糖凝膠電泳檢測,純化后送至南京擎科生物科技有限公司進行測序。
將測序獲得的序列在NCBI數據庫中進行BLAST序列比對和校對后,將獲得的測試菌株目的基因序列遞交GenBank,各菌株目的片段的序列登錄號見表1。同時下載Stagonosporopsis屬內各近緣種模式菌株及參考菌株的目的序列,經Clustal X 1.83序列比對,并手動截齊兩端,按LSU-ITS-TUB2順序連接成多基因聯合序列。基于最大似然法(maximum likelihood, ML),設置自展值(boot straps)為1 000,用MEGA 7.0軟件構建系統發育樹。
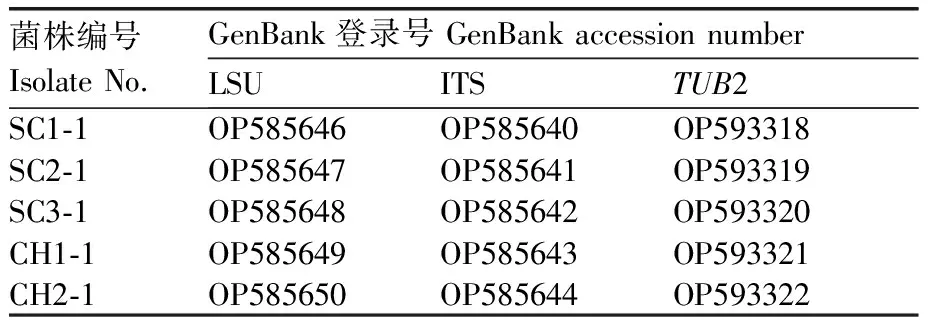
表1 菌株信息及目的位點序列
1.5 致病性測定
采用分生孢子懸浮液進行致病性測定。收集誘導產孢培養基上的分生孢子,無菌水漂洗后調節分生孢子懸浮液濃度約為107mL-1。將甜瓜及栝樓種子消毒、催芽,出苗后長至4片真葉時,取大小相近的健康幼苗,用75%乙醇擦拭消毒、無菌水清洗后,晾干。將配制好的孢子懸浮液噴灑幼苗葉片及莖部至有水滴流下,另設無菌水處理為對照組,每次處理重復3次,置于25 ℃人工氣候箱內保濕培養(相對濕度85%,12 h光照/12 h黑暗),逐日觀察記錄幼苗發病情況。待接種的幼苗發病后,從病組織處再分離病原菌,經形態學和分子生物學方法鑒定后,驗證是否與原接種病原菌相同,從而完成柯赫氏法則。
1.6 病原菌室內藥劑篩選
采用生長速率法測定7種藥劑對瓜類蔓枯病病原菌的毒力。供試藥劑母液用無菌水溶解稀釋,設置5個質量濃度梯度。97%異菌脲、95%苯醚甲環唑濃度梯度為5、1、0.5、0.1、0.05 μg·mL-1,98%啶酰菌胺、97%咪鮮胺濃度梯度為1、0.5、0.1、0.05、0.01 μg·mL-1,98%吡唑醚菌酯、98%戊唑醇濃度梯度為25、5、1、0.5、0.1 μg·mL-1,97%多菌靈濃度梯度為200、100、50、25、5 μg·mL-1。
無菌操作條件下,將不同濃度的藥劑以1∶9等比例分別加入到滅菌的PDA培養基中,充分搖勻后等量倒入培養皿中,制成含有相應濃度藥劑的平板,以加入等量無菌水的PDA培養基為對照。將供試菌株在PDA平板26 ℃培養5 d后,用打孔器在菌落邊緣打取直徑6 mm的菌碟,接種到含藥培養基中央和對照PDA平板中,每個濃度為1組處理,每組處理重復3次。培養至對照組菌落直徑為培養皿直徑的2/3時,采用十字交叉法測量各處理的菌落直徑,計算菌絲生長抑制率。菌絲生長抑制率=(對照菌落直徑-藥劑處理菌落直徑)/(對照菌落直徑-6 mm)×100%。按最小二乘法作毒力回歸方程、EC50值。
2 結果與分析
2.1 甜瓜和栝樓蔓枯病田間癥狀
甜瓜和栝樓蔓枯病主要侵染其莖蔓,初期癥狀為在近節處產生褐色油浸狀斑點,略凹陷(圖1-a),嚴重時,莖蔓近節處開裂,同時伴有黃白色流膠,干燥后呈紅褐色或黑色(圖1-b);發病后期病節處干枯,凹陷,呈灰白色,表面散生黑色小點(圖1-c)。

a, c, 甜瓜蔓枯病田間發病癥狀;b, 栝樓蔓枯病田間發病癥狀。a, c, Diseased symptoms of C. melo in the field; b, Diseased symptoms of T. kirilowii in the field.圖1 甜瓜和栝樓蔓枯病田間發病癥狀Fig.1 Field sympthoms of gummy stem blight on Cucumis melo and Trichosanthes kirilowii
2.2 病原菌的形態學特征
對采集的6份甜瓜及4份栝樓病樣進行組織分離,從甜瓜病樣中分離得到22個純化菌株,從栝樓病樣中得到12個純化菌株。從甜瓜和栝樓莖蔓處分離得到蔓枯病的病原菌菌株形態無明顯差異。各分離菌株在PDA培養基培養7 d后呈現白色菌落,氣生菌絲發達、棉絮狀,中間稠密, 略隆起(圖2-a),初白色, 老化后灰白色,菌落背面初白色, 后期變為墨綠色, 基生菌絲深褐色(圖2-b);分生孢子短圓形至圓柱形,兩端鈍圓,無色,平均大小為5.6 μm×3.0 μm,單胞(圖2-c);假囊殼內子囊呈棍棒狀,無色透明,頂端鈍圓,內含8個子囊孢子(圖2-d);子囊孢子為無色透明雙胞,橢圓形,孢子橫向有一個分隔膜,隔膜處明顯縊縮將孢子分為兩部分細胞,上細胞較寬,頂端較鈍,下細胞較窄,子囊孢子平均大小為12.85 μm×5.7 μm(圖2-e)。
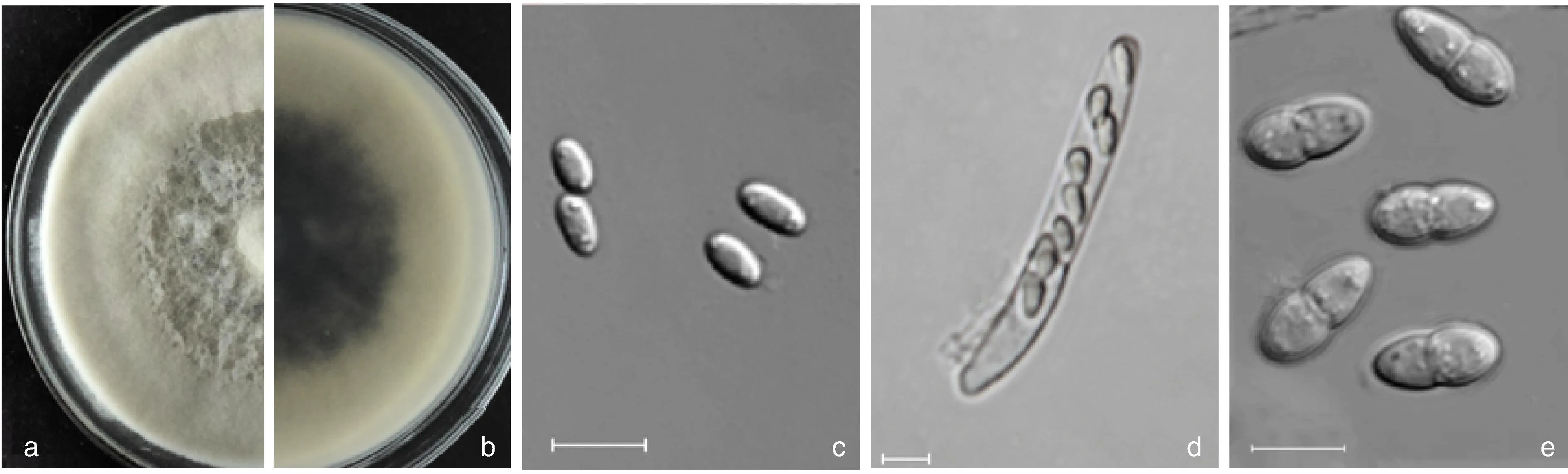
a, b,菌株在PDA培養基上培養7 d的菌落形態;c,分生孢子,標尺為10 μm;d,子囊,標尺為10 μm;e,子囊孢子,標尺為10 μm。a, b,Colony characters of isolates on PDA medium for 7 d; c,Conidia, scale bar=10 μm; d,Asci, scale bar=10 μm; e,Ascospores, scale bar=10 μm.圖2 病菌分離物的形態學特征Fig.2 Morphological characteristics of the isolates
2.3 多位點序列分析
為明確甜瓜和栝樓蔓枯病的病原菌種類,根據分離地點、寄主植物以及分離頻率,選取5個代表性菌株進行分子鑒定。對其3個位點 (ITS、TUB2、LSU) 進行PCR擴增,測序后進行序列同源性比對及多位點序列聚類分析。BLAST序列同源性搜索結果顯示,菌株SC1-1、SC2-1、SC3-1、CH1-1、CH2-1的rDNA-ITS、rDNA-LSU序列與GenBank中參考菌株S.citrulli(MT040723和MN943656)的同源性為100%;測試菌株的β-tublin基因序列與參考菌株S.citrulli(MH853667)的同源性為99.06%。基于LSU、ITS、TUB2的多位點序列聚類分析結果,測試菌株與參考菌株S.citrulliCBS 214.65以90%的自舉置信值緊密地聚在一起(圖3)。結合形態學特征及多位點序列分析,確定引起安徽省甜瓜和栝樓蔓枯病的病原菌為S.citrulli。測試菌株目的位點序列的GenBank登錄號見表1。
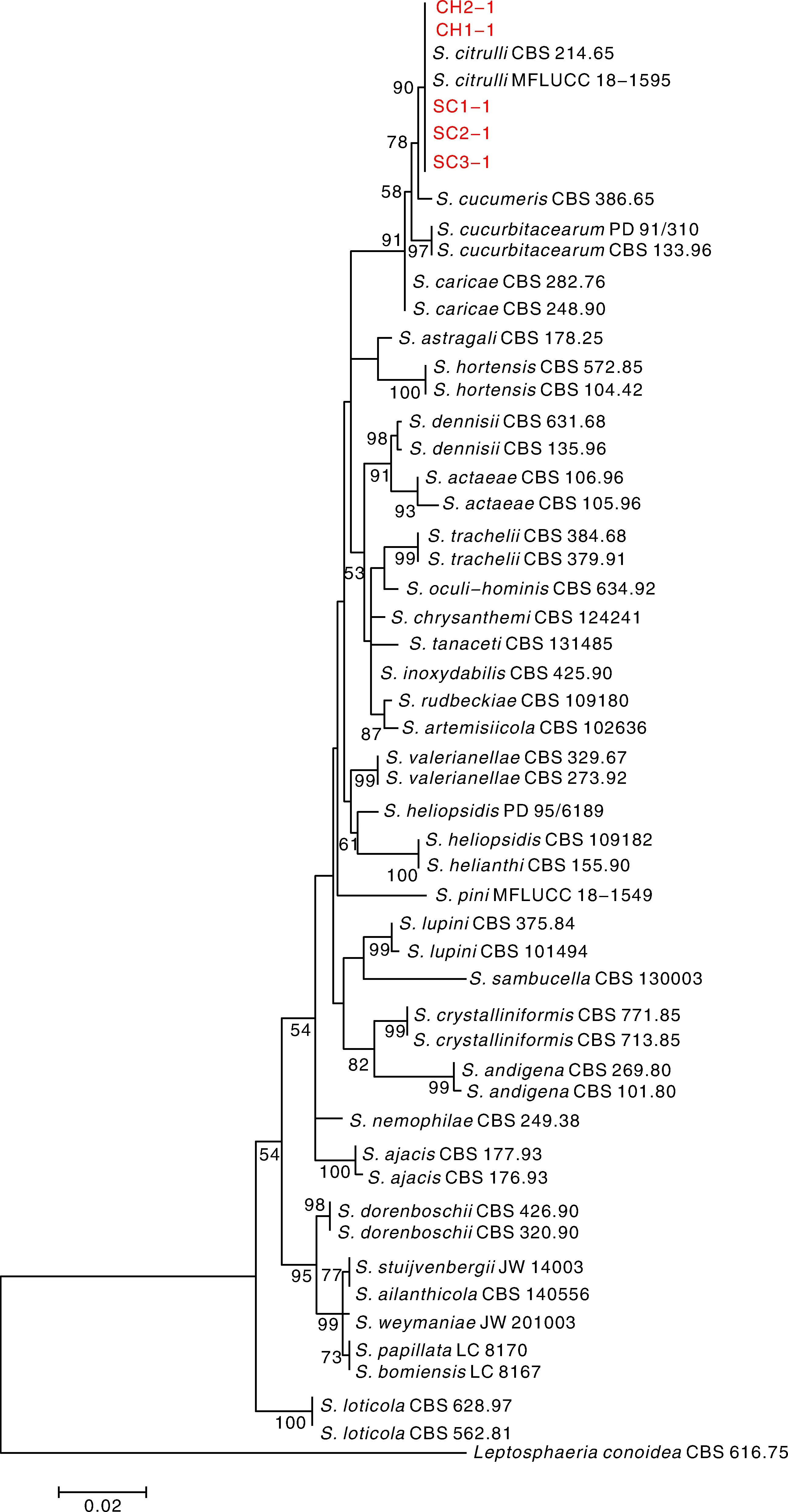
圖3 基于LSU、ITS、TUB2的位點序列構建的系統發育樹Fig.3 Phylogenetic tree inferred from concatenated sequences of partial LSU, ITS and TUB2
2.4 病原菌致病性測定
將代表性菌株的分生孢子懸浮液噴霧接種進行致病性測定,結果表明,供試菌株對甜瓜和栝樓幼苗均具有致病性。甜瓜幼苗接種2 d后,葉片失綠呈淡黃色,莖蔓處呈油浸狀,整株猝倒,且從病斑上均能再次分離純化出相同的病原菌;栝樓幼苗接種3 d后,栝樓葉片失綠干枯出現不規則黃褐色病斑,莖蔓干枯脫水變為黃褐色;5 d后栝樓葉片完全干枯,莖蔓表面分布大量黑色分散小點,與田間瓜類蔓枯病發病癥狀相似,對照組未發病。將發病組織重新進行病原菌的分離和鑒定,確定與原接種的菌株一致(圖4)。

a,甜瓜幼苗對照;b,接種菌株S.citrulli SC1-1的甜瓜幼苗;c,栝樓幼苗對照;d,接種菌株S.citrulli CH1-1的栝樓幼苗。a, Control(C. melo seedlings); b, C. melo seedlings inoculated with S. citrulli SC1-1; c, Control (T. kirilowii seedlings); d, T. kirilowii seedlings inoculated with S. citrulli CH1-1.圖4 蔓枯病菌在甜瓜(2 d)和栝樓(5 d)幼苗上的致病性Fig.4 Pathogenicity of S. citrulli isolates on C. melo(2 d) and T. kirilowii (5 d) seedlings
2.5 七種藥劑對病原菌的室內毒力測定
通過菌絲生長速率法測定了7種藥劑對甜瓜和栝樓蔓枯病的病原菌S.citrulli(SC1-1、SC2-1、SC3-1、CH1-1、CH2-1)的毒力(表2、表3)。結果表明,啶酰菌胺、咪鮮胺的EC50值在0.010 6~0.043 8 μg·mL-1,這2種殺菌劑抑菌效果最好;其次為異菌脲和苯醚甲環唑,EC50值在0.867 5~1.767 5 μg·mL-1;多菌靈的抑菌效果最差,其EC50值最高,為40.677 7 μg·mL-1。
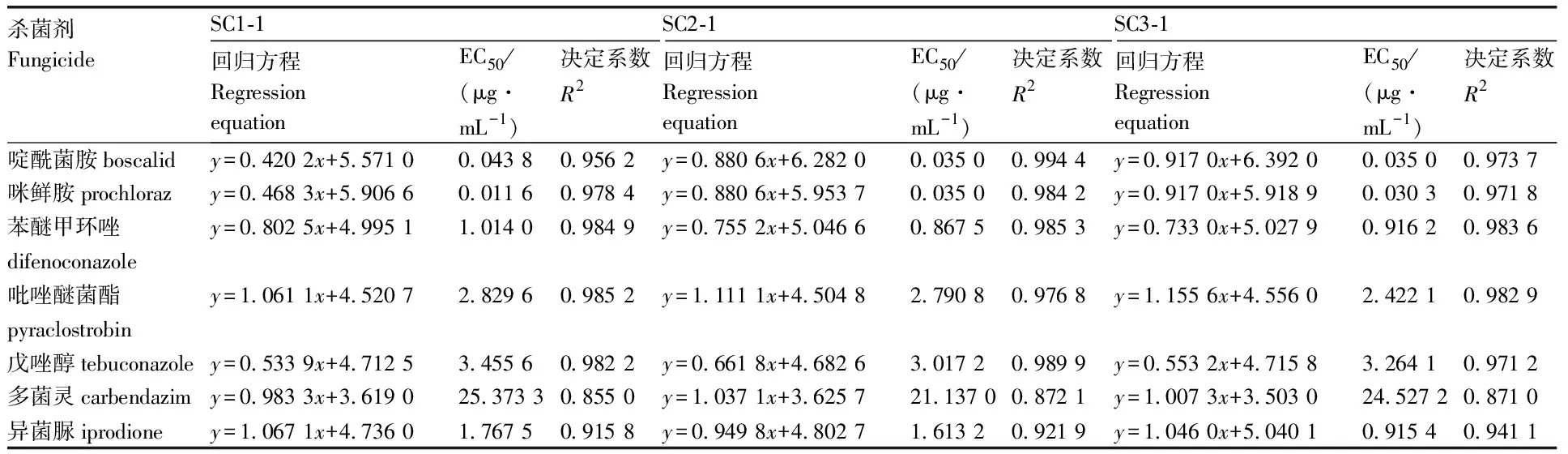
表2 七種殺菌劑對安徽舒城菌株的室內毒力測定
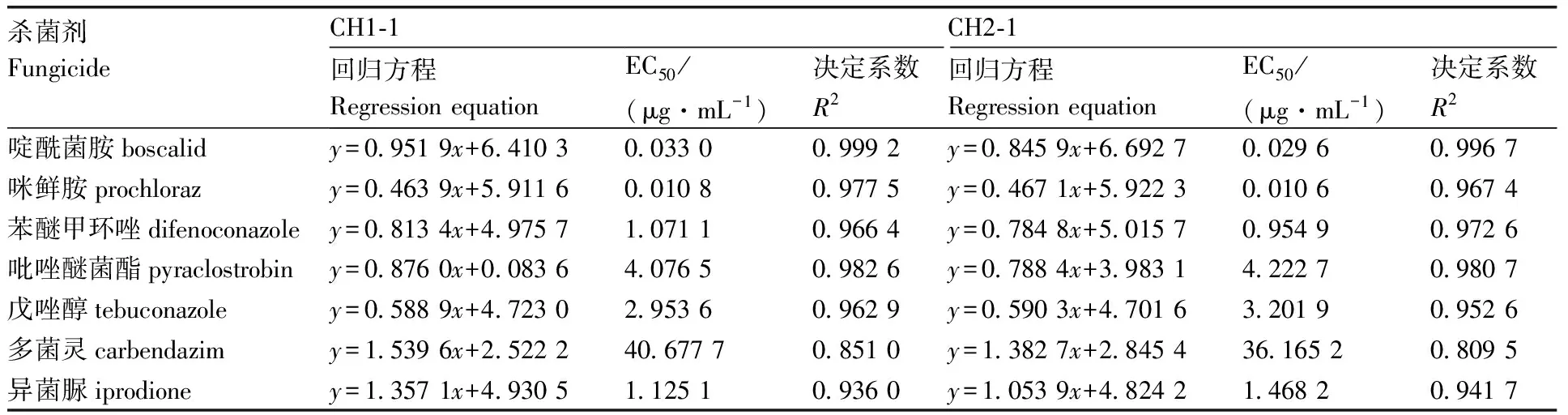
表3 七種殺菌劑對安徽巢湖菌株的室內毒力測定
3 討論
蔓枯病是世界范圍內葫蘆科植物的主要病害,該病害于1823年在瑞典首次被報道[18]。S.caricae、S.citrulli和S.cucurbitacearum是引起蔓枯病的病原菌,3種病原菌具有相同的形態特征和重疊的地理、寄主范圍[6,18-19]。瓜類蔓枯病病原菌以前的鑒定方法主要是基于形態學,以及部分大亞基(LSU)和小亞基(SSU)的核苷酸序列,但由于 LSU和 SSU 序列數據不能提供足夠的系統發育信息,無法區分密切相關的屬或種[20-22]。學者們利用LSU、ITS與TUB2多位點序列分析,為亞隔孢殼科的分類鑒定提供了強大的系統發育主干,可清楚區分該科中各屬內的近緣種[23-25]。
本研究對安徽省引起甜瓜和栝樓蔓枯病的病原菌進行鑒定,通過組織分離法從病樣組織中分離獲得菌落形態一致的分離物,通過致病性測定、形態學特征和多位點序列分析,將獲得的5株代表性菌株確定為S.citrulli。目前,在21個不同屬 37種瓜類上發現蔓枯病[26],其中,甜瓜和西瓜是最為易感的品種[27]。Huang等[28]將采集于臺灣地區的西瓜蔓枯病的病原菌鑒定為S.citrulli,但譚蕊[29]將來自于西南地區的西瓜蔓枯病的病原菌鑒定為S.cucurbitacearum和S.caricae;秦健等[8]鑒定廣東省苦瓜蔓枯病的病原為S.cucurbitacearum。結合前人研究報道,筆者認為我國瓜類蔓枯病的病原菌存在3個種,且可侵染多種葫蘆科作物,但不同地理區域瓜類作物蔓枯病的病原菌種類是否存在明顯差異,這有待進一步開展廣泛的調查和研究。
目前,化學防治仍為防治瓜類蔓枯病的主要手段。本研究測定了7種殺菌劑對蔓枯病病原菌的毒力,其中咪唑類殺菌劑咪鮮胺和煙酰胺類殺菌劑啶酰菌胺對瓜類蔓枯病菌S.citrulli的抑制效果最佳,這與前人報道的咪鮮胺和啶酰菌胺對瓜類蔓枯病病原菌的室內抑菌效果一致[30]。但煙酰胺類殺菌劑作用位點單一, 病原菌極易產生抗性。Thomas等[31]和Keinath等[32]報道美國部分地區西瓜蔓枯病菌S.citrulli已對啶酰菌胺產生抗藥性。建議在農業生產中啶酰菌胺與其他殺菌劑混合使用或交替使用,以提高防治效果和避免產生抗藥性。此外,有研究表明,播種感染的種子,即使是低水平的種傳接種也會導致溫室和大田蔓枯病的嚴重發生[33]。同時研究發現,在感染蔓枯病死亡植株附近11%~15%的幼苗可表現出蔓枯病癥狀[34]。因此,播種無菌種子和及時清理田間蔓枯病植株也十分必要。

