150例次腹膜透析相關腹膜炎病原菌耐藥性及預后分析*
吳月圓,戴小花,徐杰,張險峰,徐德宇,胡坤,沈蕾,盧國元,韓強,杭永付
(1.蘇州大學附屬第一醫院臨床檢測中心,蘇州 215006;2.廣東省肇慶市第一人民醫院藥學部,肇慶 526000;3.蘇州大學附屬第一醫院腎內科,蘇州 215006;4.蘇州大學附屬第一醫院藥學部,蘇州 215006)
血液透析和腹膜透析(peritoneal dialysis,PD)是目前治療終末期腎病的常用方法,其中PD具有較好地保護殘余腎功能、易于操作、可自行家中操作等優勢[1]。腹膜透析相關腹膜炎(peritoneal dialysis-associated peritonitis,PDAP)是PD的嚴重并發癥,是導致PD失敗最主要的原因,也是患者死亡的主要原因之一[2]。國際腹膜透析學會(International Society for Peritoneal Dialysis,ISPD)發布的2022年版腹膜炎指南推薦PD中心應監測腹膜炎的病原菌及耐藥情況,根據藥敏結果使用抗菌藥物。筆者在本文對蘇州大學附屬第一醫院PD中心2015年7月1日—2021年12月30日PDAP的病原菌、敏感性及其預后進行回顧性分析,為臨床合理選藥,提高PDAP的治愈率提供依據。
1 資料與方法
1.1臨床資料 納入標準:①2015年7月1日—2021年12月30日在蘇州大學附屬第一醫院PD中心就診的PD患者;②發生PDAP≥1次者。排除標準:資料不全者。倫理批件號為(2022)倫研批第490號。
1.2PDAP診斷及治療 PDAP參照ISPD診斷標準[3]:①腹痛、透析流出液渾濁,伴或不伴發熱;②PD流出液白細胞計數>100×106·L-1(至少留腹2 h后),多形核白細胞(polymorphonuclear neutrophil,PMN)占比>50%;③PD流出液培養陽性。以上3項至少符合2項即可診斷PDAP。
所有腹膜炎均按照本中心基于ISPD及中國腹膜透析相關感染預防專家組發布的最新診療指南所制定的標準方案進行治療。經驗性用藥使用第3代頭孢菌素(頭孢他啶等)覆蓋革蘭陰性(G-)菌,萬古霉素覆蓋革蘭陽性(G+)菌,間斷腹腔內給藥(推薦劑量藥物夜間留腹),待培養和藥敏結果回報后進行調整,療程為2~3周。治愈標準:腹膜炎癥狀完全緩解,腹透液轉清,透出液白細胞下降至正常水平。治療失敗:表現為難治性腹膜炎(即合理的抗菌藥物治療5 d腹膜炎未能緩解),或出現嚴重合并癥,需臨時或永久性轉血液透析治療,或需要拔除透析管,或死亡[4]。
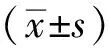
2 結果
2.1臨床資料 本研究共納入92例共150例次PDAP。其中男56例,女36例。年齡29~79歲,平均(53.46±12.53)歲。平均透析齡(42.96±38.32)個月。54例發生腹膜炎1次,38例發生腹膜炎≥2次。
2.2PDAP患者病原菌分布 患者腹透液培養陽性92例次(61.33%),陰性58例次(38.67%)。其中G+菌65例(70.65%);G-菌16例(17.39%)。多重感染患者11例(11.96%),其中合并真菌感染患者5例。具體培養結果見表1。

表1 PDAP的病原菌分布表
92例培養陽性中共檢出病原菌115株,其中G+菌80株(69.57%)。以表皮葡萄球菌最多見,其次為緩癥鏈球菌、溶血葡萄球菌、金黃色葡萄球菌和唾液鏈球菌。G-菌26株(22.61%),以大腸埃希菌多見,其次為陰溝腸桿菌。真菌9株。
2016—2021年,G+菌相關PDAP分別發生14,16,5,9,1,8例次,多重感染相關PDAP分別為4,3,1,0,0,1例次,逐年下降;而G-菌相關PDAP分別發生4,5,0,2,1,2例次,下降不明顯。
2.3PDAP病原菌敏感性分析
2.3.1G+菌對抗菌藥物敏感性分析 G+菌對頭孢曲松、氨芐青霉素、慶大霉素、四環素、克林霉素的敏感性較好,敏感率分別為94.44%、92.31%、86.11%、83.33%、77.59%。暫時未發現對利奈唑胺、替考拉寧、替加環素和利福平耐藥的菌株。26株G+菌對甲氧西林/苯唑西林耐藥,耐藥率65%。其中,16株表皮葡萄球菌中有12株對苯唑西林耐藥。所有鏈球菌(28株)對青霉素敏感率為100%,其中1株唾液鏈球菌對萬古霉素耐藥。見表2。

表2 G+菌藥物敏感性結果
2.3.2G-菌對抗菌藥物敏感性分析 G-菌對頭孢他啶、頭孢唑肟、哌拉西林/他唑巴坦、頭孢哌酮/舒巴坦、慶大霉素的敏感性較好,敏感率分別為86.36%、88.89%、90.48%、90.00%、88.89%。研究發現1株陰溝腸桿菌和1株粘質沙雷菌對亞胺培南耐藥,1株霍氏腸桿菌對替加環素敏感性為中介,暫未發現對阿米卡星、美羅培南耐藥的菌株。4株大腸埃希菌對左氧氟沙星均敏感。結果見表3。

表3 G-菌藥物敏感性結果
2.4萬古霉素對葡萄球菌屬最低抑菌濃度(MIC)值變化趨勢 2019—2021年葡萄球菌屬感染的PDAP分別為1、2和4例次。研究發現萬古霉素對葡萄球菌屬的MIC均值分別為0.5,0.75,1.625 μg·mL-1,呈上升趨勢,但因數量較少,未做統計分析。
2.5PDAP患者預后情況 150例次PDAP患者經過治療后,治愈122例次(81.33%),拔管重置6例次(4.00%),拔管轉HD22例次(14.67%)。G+菌感染的65例患者中,治愈58例(89.23%),拔管重置4例(6.15%),拔管轉HD3例(4.62%)。G-菌感染的16例患者中,治愈12例(75.00%),拔管重置1例,拔管轉HD3例。多重感染的11例患者中,治愈4例(36.36%),拔管轉HD7例。合并真菌感染的5例次多重感染PDAP患者中,拔管轉為HD4例,治愈1例。3組治愈率比較中,G+菌治愈率高于多重感染組,差異有統計學意義(P<0.01),G+菌組與G-菌組比較差異無統計學意義(P=0.214),G-菌組與多重感染比較均差異無統計學意義(P=0.061)。
3 討論
PD是終末期腎臟病主要的替代治療療法之一,而PDAP是導致PD技術失敗和轉為長期HD的主要原因[5]。既往研究表明PDAP主要以G+菌為主,但隨著抗菌藥物的廣泛使用,病原菌耐藥率逐年增高。病原菌的種類與治療失敗有一定相關性[6]。因此,及時了解病原菌的分布和耐藥性極其重要。ISPD指南建議PD中心腹膜炎患者腹透液培養陰性率應<15%[3]。本PD中心透出液培養陽性率為61.33%,與國內一些大型PD中心的培養陽性率相近[7-8]。可能與患者入院前已接受抗菌藥物治療、透出液中病原菌濃度太低等有關[9-10],也可能與留取樣本不規范有關。
本中心150例次PDAP患者中G+菌為主要病原菌,以表皮葡萄球菌為多見(17.39%),與國內外其他報道相似[2,9]。表皮葡萄球菌主要為人體皮膚黏膜定植菌,接觸污染是引起表皮葡萄球菌相關腹膜炎的一個主要原因[8,11]。本研究中G+菌引起PDAP次數隨時間推移整體呈現下降趨勢。G-菌以大腸埃希菌/陰溝腸桿菌(4.35%)為主。PD患者發生便秘或腹瀉時,腸道黏膜屏障損傷后細菌容易移位進入腹腔,從而引起腹膜炎[12]。應積極治療急性胃腸炎、便秘等誘因[8]。研究提示高齡、高糖腹透液、肥胖、殘余腎功能減退、低鉀血癥、低白蛋白血癥、營養不良、長期使用糖皮質激素等為腹透相關腹膜炎的危險因素[4]。平時宣教需要注意積極減少可改變的危險因素。
ISPD指南推薦PD中心應結合自身中心情況,經驗性選擇第1代頭孢菌素或萬古霉素,聯合第3代頭孢菌素或氨基苷類藥物作為腹膜炎的初始治療方案[12]。近年來有研究報道G+菌對第1代頭孢菌素敏感性下降,KITTERER等[13]研究結果顯示1979—2014年G+菌對第1代頭孢菌素的敏感性由93%降至58%;佟怡婧等[8]研究發現與2004—2009年相比,2010—2015年G+菌對第1代頭孢菌素敏感率由88.2%降至61.3%。本研究結果顯示,本中心G+菌對甲氧西林的敏感率由2016年[14]的60%下降至35%,這提示我中心PDAP經驗性治療應選用萬古霉素。G-菌對阿米卡星和美羅培南的敏感性均為100%,頭孢他啶和頭孢唑肟的敏感率為86.36%和88.89%,但1 g頭孢他啶(集采)與1 g頭孢唑肟(集采)相比具有明顯的藥物經濟學優勢。提示第3代頭孢菌素如頭孢他啶或阿米卡星仍可作為我院覆蓋G-菌的首選經驗用藥,但需要注意的是阿米卡星因其腎毒性不宜長期使用。
葡萄球菌是導致醫院感染的主要病原菌之一,耐甲氧西林葡萄球菌治療愈加困難,糖肽類抗菌藥物是最后手段之一[15]。萬古霉素MIC漂移是指萬古霉素治療效果隨著敏感范圍內MIC的上升而下降[16]。已有研究表明隨著萬古霉素MIC值的升高,其療效會下降[17]。國內縱帥等[18]研究發現徐州地區2015—2019年萬古霉素的MIC值存在漂移現象,且萬古霉素對MRSA的敏感性呈現下降趨勢。我院 2019—2021年萬古霉素對葡萄球菌屬的MIC值由0.5 μg·mL-1上升至1.625 μg·mL-1,也存在漂移趨勢。但因數量少,差異無統計學意義。這種現象警示臨床要個體化使用萬古霉素,對敏感的G+菌應及時調整方案,加強濃度測定并及時調整方案,制定用藥規范。
本研究中,G+菌治愈率高于G-菌。真菌感染的PDAP患者死亡風險很高,ISPD指南建議一旦確診為真菌感染性腹膜炎應立即拔管。本研究多重感染11例次,拔管轉HD高達72.73%。其中5例合并真菌感染拔管轉HD 4例次(80%),與ISPD指南相似[3]。多重感染的PDAP患者預后往往較差[1],故對PDAP患者應加強抗菌治療,同時教育患者發生腹膜炎應及時就診,不可擅自使用抗菌藥物,避免多重感染的發生。

