基于流式量子點微球技術(shù)的甲乙型流感病毒抗原檢測方法的建立和初步應(yīng)用分析
夏成靜,李寶花,郭燕妳,周小合,張潤玲,牛英波[.深圳光明區(qū)人民醫(yī)院(西)檢驗科,廣東深圳 5806;.南京諾唯贊醫(yī)療科技有限公司,南京 0033]
呼吸道病毒引起的感染和防治是全世界普遍面臨的公共衛(wèi)生挑戰(zhàn)。近幾年發(fā)生的新型冠狀病毒肺炎(Corona Virus Disease 2019,COVID-19)大流行,讓全世界的公眾和公共衛(wèi)生機構(gòu)、政策制定者更加重視呼吸道病毒引起的傳染病[1-2]。由于不同呼吸道病毒及同一病毒不同亞型的治療方式和防控措施可能不同,快速精確地鑒定這些病毒及其亞型不僅可以為疾病診斷、治療提供充足的依據(jù),也可為流行病學(xué)調(diào)查、疫情防控提供堅實的基礎(chǔ)[3-4]。因此,尋找一種快速、靈敏、多重檢測呼吸道病毒的方法是非常必要的。而液相蛋白芯片由于可以快速、高通量、平行化的檢測多個病毒蛋白(抗原或抗體),在多重檢測領(lǐng)域有著獨特的優(yōu)勢[5-7]。液相蛋白芯片的核心原理是利用不同標(biāo)記微球上聯(lián)接的特異性分子去識別對應(yīng)的檢測物,因此如何制備信息種類豐富的編碼微球成為此技術(shù)能否實現(xiàn)高通量、高靈敏、多重性檢測的關(guān)鍵所在。目前,市場上的編碼微球主要由Luminex,Bangs Laboratories 等歐美公司壟斷生產(chǎn),不僅售價高,而且需要昂貴的多通道檢測儀器進行檢測。而與傳統(tǒng)染料相比,具有吸收光譜范圍寬、激發(fā)熒光光譜窄、發(fā)光效率高、發(fā)光譜隨粒徑大小可調(diào)、光穩(wěn)定性好等優(yōu)點的量子點(quantum dot,QD)逐漸成為了液相芯片中研究最熱的熒光編碼粒子[8-12]。本研究擬開發(fā)一種針對甲型流感病毒(FluA)及乙型流感病毒(FluB)抗原的多重流式檢測方法,利用量子點編碼微球作為反應(yīng)載體,建立基于流式量子點微球技術(shù)的甲乙型流感病毒抗原聯(lián)檢方法,為常見呼吸道病毒多重檢測打下基礎(chǔ)。
1 材料與方法
1.1 研究對象 隨機收集中國科學(xué)院大學(xué)深圳醫(yī)院(光明)西院區(qū)2022年5~8月門診就診的疑似甲乙型流感病毒感染咽拭子,隨機選取81 例,其中男性43 例,女性38 例,年齡1~63 歲。患者樣本均使用甲型/乙型抗原檢測試劑盒(膠體金法)進行了流感病毒感染的臨床診斷,并將剩余咽拭子樣本凍存于-80℃。納入標(biāo)準(zhǔn):具有呼吸道病毒感染臨床癥狀表現(xiàn)的患者。排除標(biāo)準(zhǔn):采樣前一個月內(nèi)服用過抗流感藥物者。本研究已通過中國科學(xué)院大學(xué)深圳醫(yī)院(光明)倫理委員會評審?fù)ㄟ^。
1.2 儀器與試劑 流式細胞儀(Beckman 公司);實時熒光定量PCR 儀(Life Technologies 公司);酶標(biāo)儀(BioTek 公司)。FluA/FluB 核蛋白(nucleoprotein,NP)抗原及其配對抗體對(南京諾唯贊醫(yī)療科技有限公司)。熒光編碼微球(Bangslabs 公司);聚苯乙烯微球(蘇州納微科技股份有限公司);N-羥基硫代琥珀酰亞胺(N-hydroxysulfosuccinimide,sulfo-NHS),1-乙基-(3-二甲基氨基丙基)碳二亞胺鹽酸鹽[N-(3-Dimethylaminopropyl)-N’-ethylcarbodiimide hydrochloride,EDC],2-嗎啉乙磺酸(MES)均購自Sigma 公司;樣本稀釋液及清洗液由磷酸緩沖液、Tween-20 和牛血清清蛋白配制而成,所用試劑均購自上海阿拉丁生化科技股份有限公司;生物素標(biāo)記試劑盒(Thermo fisher 公司);CdSe/ZnS 量子點納米晶體(武漢珈源量子點技術(shù)開發(fā)有限責(zé)任公司);FITC donkey anti-mouse IgG(Jackson 公司);鏈霉親和素-藻紅蛋白染料(SA-PE,BD 公司);96 孔過濾板(Millipore 公司);qPCR 試劑及配套耗材(廣州達安基因股份有限公司);甲/乙型流感病毒抗原檢測試劑盒(膠體金法,廣州萬孚生物技術(shù)股份有限公司)。
1.3 方法
1.3.1 量子點編碼微球檢測體系構(gòu)建
1.3.1.1 量子點編碼微球制備:首先對聚苯乙烯微球進行溶脹,然后在溶脹體系中加入不同濃度的CdSe/ZnS 量子點對其進行熒光染色,染色完成后將微球從有機相溶脹體系中轉(zhuǎn)移到水相保存體系中。通過調(diào)整量子點和聚苯乙烯微球的濃度比例,獲得不同亮度的多峰量子點編碼微球。由于聚苯乙烯微球表面具有羧基修飾,因而可以用于后續(xù)的抗體偶聯(lián)。
1.3.1.2 抗體與微球的偶聯(lián):采用EDC/Sulfo-NHS方法活化羧基微球后再與FluA/FluB-NP 配對單抗進行偶聯(lián)。具體步驟為:將106個微球使用50 mmol/L MES 緩沖液洗滌數(shù)次后,加入0.2mg sulfo-NHS,0.2mg EDC,迅速渦旋混勻,室溫翻轉(zhuǎn)孵育20min。對活化后的微球進行洗滌后,加入包被抗體,迅速渦旋混勻,室溫翻轉(zhuǎn)孵育2h。對偶聯(lián)后的微球進行洗滌、濃度測定、產(chǎn)率計算、偶聯(lián)確認。為了后續(xù)最優(yōu)抗體對組合的篩選測試,將不同克隆號的FluA/FluB-NP 單抗(Clone:FluA6,F(xiàn)luA8,F(xiàn)luB15,F(xiàn)luB66,F(xiàn)luB79)均進行偶聯(lián)。
1.3.1.3 生物素標(biāo)記抗體的制備:按照Thermo fisher生物素標(biāo)記試劑盒說明書進行抗體標(biāo)記,使用酶標(biāo)儀對生物素標(biāo)記抗體進行濃度測定并通過HABA 分析法(harmonic analysis based on approximation,基于諧波分析的近似方法)測定結(jié)合在抗體上的生物素的濃度,計算生物素與抗體蛋白摩爾比(Biotin/Protein,B/P)。
1.3.2 FluA 和FluB 抗原單檢的性能測試:基于量子點編碼微球的FluA 和FluB 抗原多重檢測方法的開發(fā),需要先進行FluA 和FluB 單檢方法的建立和驗證,然后將該單檢方法進行聯(lián)檢測試。單檢測試主要包括以下步驟:①校準(zhǔn)品的制備:將FluA/FluB 的NP 抗原母液以等比稀釋的方式稀釋為一系列濃度:1 000 000,250 000,62 500,15 625,3 906.3,976.6,244.1,61.0 和15.3pg/ml;②免疫反應(yīng):在96 孔過濾板中依次加入稀釋液、校準(zhǔn)品/樣本、生物素標(biāo)記的檢測抗體、包被抗體偶聯(lián)的捕獲微球,避光震蕩孵育2.5h 后,加入鏈霉親和素-藻紅蛋白(SA-PE),避光震蕩孵育0.5h 后,使用真空抽濾裝置進行抽濾,使用清洗液進行清洗后再次抽濾,使用清洗液將微球重懸收集等待上機測試;③上機與數(shù)據(jù)處理:使用流式細胞儀對各收集管進行上機采集數(shù)據(jù),將獲得的中值熒光強度(median fluorescence intensity,MFI)數(shù)據(jù)導(dǎo)入到Graphpad Prism 9.0 軟件中進行分析;④以校準(zhǔn)品的一系列MFI 值與校準(zhǔn)品的濃度繪制校準(zhǔn)曲線,利用校準(zhǔn)曲線方程計算樣本的濃度。單檢方法的初步性能評估主要包括測量范圍和交叉反應(yīng)。通過觀察不同濃度校準(zhǔn)品在校準(zhǔn)曲線上的分布,確定該方法針對FluA和FluB 抗原濃度的測量范圍。
1.3.3 FluA 和FluB 抗原聯(lián)檢的性能測試:甲乙型流感病毒抗原聯(lián)檢測試,是在單檢測試的基礎(chǔ)上,在同一個反應(yīng)體系中,直接加入FluA 和FluB 抗原的兩種捕獲微球以及FluA 和FluB 抗原的兩種生物素標(biāo)記的檢測抗體,以同時促成FluA 和FluB 抗原檢測夾心的分別形成,并最終通過編碼微球作為信號傳遞媒介,在流式細胞儀上輸出FluA 和FluB 微球的檢測熒光信號,進而獲得校準(zhǔn)曲線和樣本濃度的結(jié)果,見圖1。參照相關(guān)文獻的描述[12-13],對量子點微球的聯(lián)檢方法進行性能評估,包括檢出限、測量范圍、交叉反應(yīng)。

圖1 基于量子點編碼微球的甲乙型流感病毒抗原多重檢測的原理示意圖
1.3.4 基于流式量子點微球技術(shù)的FluA 和FluB 聯(lián)檢平臺對臨床樣本的驗證和方法學(xué)比對:將-80℃保存的臨床咽拭子樣本放置在室溫下解凍30min后,置入500μl 提取液中沿管壁旋轉(zhuǎn)約10 次,使標(biāo)本盡可能溶解入提取液中。將提取好的樣本液一分為二,一份用于本方法進行抗原檢測,另一份使用qPCR 進行核酸檢測(具體操作嚴(yán)格按照儀器廠家和試劑說明書進行)。本方法以FluA 和FluB抗原檢測的檢出限作為陰陽性判斷的臨界值,與qPCR 檢測的陰陽性結(jié)果進行對比,分析其臨床靈敏度和特異度。
1.4 統(tǒng)計學(xué)分析 應(yīng)用SPSS17.0 統(tǒng)計軟件進行配對計數(shù)資料的Kappa 系數(shù)檢驗,P<0.05 為差異有統(tǒng)計學(xué)意義。當(dāng)Kappa>0.75,表示一致性較強;0.75>Kappa >0.4 表示一致性一般;Kappa ≤0.4,表示一致性較弱。使用GraphPad Prism 9.0 軟件繪制標(biāo)準(zhǔn)曲線,均使用五參數(shù)logistic 模型{Y=d+(a-d)/[1+(X/c)b]g}。兩種方法的比對采用四格表形式進行統(tǒng)計,計算靈敏度和特異度。
2 結(jié)果
2.1 試劑原料制備 通過溶脹嵌入法,本研究制備了一組基于量子點編碼的熒光微球。流式細胞儀分析結(jié)果表明熒光微球分群性能良好,見圖2。理論上可以實現(xiàn)6 種分析物的同時檢測。為了證明抗體偶聯(lián)的可行性,使用上述制備的量子點編碼微球分別與FluA-NP 和FluB-NP 單抗進行偶聯(lián),同時使用種屬特異性的熒光標(biāo)記抗體(FITC Donkey antimouse IgG)對偶聯(lián)后的微球進行標(biāo)記,對相關(guān)表征參數(shù)進行了測定,抗體偶聯(lián)后的微球回收率>80%,和抗體偶聯(lián)均勻度CV<25%,與以往報道的偶聯(lián)結(jié)果一致[14-15]。生物素標(biāo)記抗體的標(biāo)記前后總體回收率為55%~70%,B/P 為4~6,這與文獻報道的理想標(biāo)效果相一致[16],證明這些試劑可以基本滿足后續(xù)測試的需求。
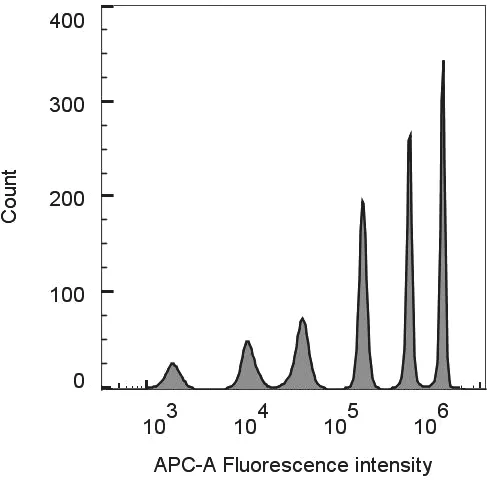
圖2 6 種亮度的量子點編碼微球的熒光強度直方圖
2.2 FluA 和FluB 抗原單檢的初步性能評估 在研究早期,為了探索FluA 和FluB 抗原單檢技術(shù)可行性,先進行了量子點編碼微球FluA/FluB 單檢系統(tǒng)初步的性能建立,對抗體濃度、SA-PE 染料用量、孵育時間、孵育步驟等參數(shù)進行了優(yōu)化,并對其測量范圍、交叉反應(yīng)等分析性能進行了初步研究。這些研究成果奠定了微球多重免疫檢測法的技術(shù)基礎(chǔ)。初步研究表明FluA 和FluB 的測量范圍為15.3~250 000pg/ml。FluB 捕獲微球在250 000pg/ml 的FluA-NP 抗原濃度下產(chǎn)生的交叉反應(yīng)率為0.022%。FluA 捕獲微球在250 000pg/ml 的IBVNP 抗原濃度下產(chǎn)生的交叉反應(yīng)率為0.006%。量子點編碼微球的單檢系統(tǒng)檢測FluA 抗原的空白限為10.5pg/ml,檢測FluB 抗原的空白限為2.9pg/ml。上述結(jié)果表明該方法可以用于對FluA 和FluB 抗原進行同時檢測。
2.3 FluA 和FluB 抗原聯(lián)檢的分析性能 在上述初步研究基礎(chǔ)上,本研究建立了基于量子點編碼微球的甲乙流病毒抗原的聯(lián)檢方法,并進行了系統(tǒng)的靈敏度、測量范圍研究。圖3所示為FluA 和FluB 抗原聯(lián)檢的校準(zhǔn)曲線圖。使用量子點編碼微球的多重檢測系統(tǒng),檢測FluA 抗原的檢出限為26.1pg/ml,驗證后的測量范圍為15.3~250 000 pg/ml。檢測FluB 抗原的檢出限為10.7 pg/ml,驗證后的測量范圍為15.3~250 000 pg/ml。

圖3 甲乙型流感病毒抗原流式熒光檢測校準(zhǔn)曲線
2.4 量子點編碼微球的多重檢測方法與qPCR 法結(jié)果比對 在上述分析性能研究的基礎(chǔ)上,本研究開展了與qPCR 的FluA 和FluB 核酸檢測結(jié)果的比對。收集的81 例樣本中,qPCR 結(jié)果為54 例FluA陽性,Ct值在25.59~39.12 范圍,27 例FluA 陰性,Ct值>40。基于量子點編碼微球的FluA 抗原檢測結(jié)果顯示,31 例FluA 抗原陽性,濃度分布在33.8~83 019.1 pg/ml 區(qū)間,50 例樣本FluA 抗原陰性,檢出濃度小于26.1pg/ml。根據(jù)以上結(jié)果,兩種方法一致性一般(Kppa 值為0.47,P<0.05)。以qPCR 結(jié)果為金標(biāo)準(zhǔn),計算得到陽性符合率(靈敏度)57.4%,陰性符合率(特異度)100%,總符合率71.6%。優(yōu)于目前臨床常用的膠體金抗原檢測試劑,如萬孚的陽性符合率56.49%,陰性符合率99.75%(摘自試劑說明書)。在81 例樣本檢測中,qPCR 的FluB 陽性1 例,Ct值為36.5,此樣本的多重方法檢測結(jié)果也為陽性,F(xiàn)luB 抗原濃度為261.2 pg/ml,qPCR 檢測其余80 例樣本均為 FluB 陰性與多重方法結(jié)果一致,靈敏度和特異度均為100%。
3 討論
本研究開發(fā)了針對甲型、乙型流感病毒抗原的量子點編碼微球流式免疫檢測方法,成功制備了多峰量子點編碼微球、抗體偶聯(lián)的編碼微球、生物素標(biāo)記抗體,對甲乙型流感病毒抗原檢測的靈敏度、測量范圍、交叉反應(yīng)等分析性能進行了研究,確認了該聯(lián)檢方法可用于臨床樣本的測試,經(jīng)與qPCR比較雖然靈敏度有所欠缺,但特異度好,并可以定量檢測,最重要的是可以用于呼吸道病毒的多重檢測,可以提高臨床檢測的效率和節(jié)約成本,同時也可以利用此平臺對其他目標(biāo)物進行多重檢測,不僅可以為臨床診斷、治療應(yīng)用提供依據(jù),而且也可以為流行病學(xué)調(diào)查提供及時的數(shù)據(jù)。針對開發(fā)和測試過程中遇到的量子點滲漏、熒光強度波動等問題,通過對溶劑體系、保存條件、表面修飾的優(yōu)化,獲得了具有長期穩(wěn)定性的量子點編碼微球,這些問題也是長期以來困擾量子點臨床使用的技術(shù)瓶頸,通過對這些技術(shù)的優(yōu)化,有希望打開量子點作為熒光標(biāo)記的臨床應(yīng)用之路。
在對81 例臨床樣本的測試中,利用此方法測得FluA 陽性樣本31 例,陰性樣本50 例。與qPCR結(jié)果比對,陰性符合率為100%,陽性符合率為57.4%。表明本方法可以有效避免假陽性結(jié)果的出現(xiàn),但是對于假陰性結(jié)果,提示免疫檢測方法與核酸檢測方法在檢測靈敏度上存在的固有差別[3,17-18],這得益于qPCR 擴增檢出極低量的核酸序列的能力,也可能與此方法還需要不斷進行條件優(yōu)化以提高靈敏度有關(guān)。后續(xù)的條件優(yōu)化可參考Luminex 多重微球的方案[19],通過減少微球和樣品的初始孵育體積、增加初始孵育時間、減少與微球偶聯(lián)的捕獲抗體量來提高靈敏度,也可篩選具有更高親和力的抗體作為捕獲抗體或檢測抗體來達到靈敏度提高的目的。另一方面,qPCR 是對病毒核酸序列的測定,對無活性病毒也可能產(chǎn)生陽性檢測結(jié)果,也存在一定比例的假陽性。本研究建立的定量免疫學(xué)檢測方法通過標(biāo)準(zhǔn)曲線的建立,可以定量的對活性病毒進行檢測,可以更加有效地評估病毒的活性狀態(tài)與病毒量的變化,并且有更少的假陽性結(jié)果,因而不僅在診斷,而且在判斷病情嚴(yán)重程度和預(yù)后方面都有重要價值。此項研究的另一個背景是,采用的臨床樣本是已經(jīng)進行了一次提取液洗脫的咽拭子樣本進行的二次洗脫液,因而其檢測結(jié)果相對于qPCR 可能存在更大可能的假陰性,與第一次洗脫后用膠體金免疫法檢測相比,此方法也超過了膠體金免疫法的靈敏度和特異度,也證明了此方法的優(yōu)越性,后續(xù)的研究工作中,需要對真實的咽拭子樣本的抗原濃度進行評價,以獲得更加完整的性能研究數(shù)據(jù)。同時由于FluB 陽性樣本數(shù)量過少,此方法對FluB 的靈敏度評價有待獲取更多陽性標(biāo)本進行驗證,但特異度與PCR 比較也達到100%,與FluA 一致,證明了此方法在多重檢測方面的可行性。此方法最大的優(yōu)勢是可以利用流式檢測平臺對呼吸道病毒進行多重檢測,也是我們下一步研究的方向。
總之,本研究證明了使用量子點納米晶體嵌入的編碼微球進行甲乙型流感病毒聯(lián)檢的可行性,此后將繼續(xù)致力于多種呼吸道病毒的多重免疫檢測方法的開發(fā),并借助量子點納米晶體編碼微球的獨特優(yōu)勢,開發(fā)成可以用于即時檢測的快速診斷技術(shù)平臺,不僅用于即時檢驗(POCT)的臨床診斷,甚至可以使家庭使用場景成為現(xiàn)實,讓呼吸道病毒快速檢測更加經(jīng)濟、易用、普及。
 現(xiàn)代檢驗醫(yī)學(xué)雜志2024年1期
現(xiàn)代檢驗醫(yī)學(xué)雜志2024年1期
- 現(xiàn)代檢驗醫(yī)學(xué)雜志的其它文章
- 噬菌體抗細菌生物膜機制及應(yīng)用策略的研究進展
- 健康獻血者血漿可溶性糖蛋白A(GPA)在抗-M與抗-“Mia”抗體陽性及陰性中表達差異的分析研究
- 基于血液生物標(biāo)志物的外周免疫評分及在非小細胞肺癌應(yīng)用中的研究進展
- 內(nèi)源性因素對抗體夾心免疫法檢測血清心肌肌鈣蛋白I的干擾及解決方案研究進展
- 2020~2022年度上海及其他省市臨床實驗室HPV6與HPV11型核酸檢測室間質(zhì)量評價結(jié)果分析
- 臨床實驗室基于功效函數(shù)圖評價Westgard西格瑪規(guī)則中統(tǒng)計質(zhì)量控制程序性能
