膜蛋白原位成像研究進展
苗紫昀,李志豪,王 杰*
(1.蘇州大學 材料與化學化工學部,江蘇 蘇州 215006;2.武漢市農業科學院 環境與安全研究所,湖北 武漢 430345)
細胞膜是包裹在細胞質外層、平均厚度約10 nm 的一層質膜,在維持細胞胞內環境穩定、為基本生命活動提供反應場所等方面發揮著重要作用。細胞中,大約30%的蛋白質分子與細胞膜直接相連,這些蛋白參與細胞信號傳導、能量交換等重要生理活動,被稱為膜蛋白。根據功能的不同,膜蛋白可以分為受體蛋白、轉運蛋白、糖蛋白等[1-4]。其中,受體蛋白具有分子識別功能,可以結合特定的受體分子并將化學信號轉變為電學等信號[5-6],進一步調控細胞生命活動。轉運蛋白分為載體蛋白與通道蛋白,負責大分子、小分子和離子等的主動運輸和協助擴散。糖蛋白是一類含有寡糖鏈的蛋白質,主要參與生物識別過程。蛋白的表達量、空間分布、組織結構等與其生物學功能密切相關。例如血液中的紅細胞膜上會過表達整合素相關蛋白CD47,CD47 與巨噬細胞表面的信號調節蛋白α 結合后能夠激活下游信號通路,向巨噬細胞傳遞“別吃我”的信號從而阻止巨噬細胞對紅細胞的吞噬[7];蛋白酪氨酸激酶7(PTK7)等多種膜蛋白會以團簇的形式存在于細胞膜上,膜蛋白團簇能夠提高其與受體的結合能力[8]。膜蛋白表達量、組織結構等的異常往往與多種疾病密切相關[9-10],例如卵巢癌、結腸癌、白血病等多種病變細胞表面會過表達CD47來逃避免疫系統的監視,從而實現癌細胞的轉移和擴散。膜蛋白在生命活動過程中發揮著至關重要的作用,然而目前大部分膜蛋白的分子作用機制尚不明確。了解膜蛋白的空間分布、組織結構等信息對生命活動分子機制研究、疾病診斷治療等至關重要[11-12]。
目前膜蛋白的研究方法可以分為非原位方法和原位方法。蛋白質印跡法、質譜法是最常用的非原位膜蛋白定量分析方法,具有靈敏度高、特異性好等優勢[13]。然而,非原位膜蛋白分析方法需要將膜蛋白從細胞膜中提取出來,往往會損失膜蛋白在細胞上的結構信息和空間分布信息。近年來,隨著化學標記和成像技術的發展,研究者開發了多種基于不同原理和模式的化學探針用于膜蛋白的實時、原位分析。例如基于點擊化學反應能夠在糖蛋白上標記熒光分子,實現對糖蛋白空間分布和組織結構的原位觀測[14];利用核酸適體的選擇性識別功能能夠實現對目標蛋白的特異性標記,可對目標蛋白的表達量、分布、聚集狀態等進行原位研究[15]。膜蛋白原位成像探針與靶標膜蛋白結合后可產生熒光、拉曼等信號的變化,實現對膜蛋白分布和結構變化的原位觀測,具有可視化、設計靈活、易于操作等優勢。膜蛋白原位分析方法能夠保留生理狀態下膜蛋白的原始信息,在膜蛋白分子機制研究中具有廣闊的應用前景。
本文將介紹近年來發展的膜蛋白原位分析方法,總結常規熒光成像技術和超分辨熒光成像技術在膜蛋白成像中的應用進展情況,并介紹電化學發光成像、核磁共振成像和表面增強拉曼散射成像在膜蛋白原位分析中的最新應用進展。最后,對膜蛋白成像領域的發展進行總結,對存在的挑戰和發展趨勢進行討論,旨在為膜蛋白成像探針的設計提供參考,推動膜蛋白分子機制研究及膜蛋白在疾病診斷治療等領域的發展。
1 熒光成像
熒光成像具有靈敏度高、可視化、原位、無創等優勢,在膜蛋白成像中具有廣泛應用。近年來,研究人員對熒光成像探針進行不斷創新和優化,顯著提高了膜蛋白熒光成像的靈敏度和特異性。同時,突破了衍射極限的超分辨熒光成像技術不斷發展,有效提高了膜蛋白空間分布和組織結構的成像精度。這些成像探針和成像技術的發展,為膜蛋白的原位動態成像提供了強有力的工具。本小節將對常見的膜蛋白熒光成像探針進行概述,同時對超分辨熒光顯微技術在膜蛋白成像中的應用進行簡要介紹。
1.1 核酸探針
核酸適體是一類可以與離子、小分子、蛋白質、細胞等靶標物高選擇性結合的DNA 或RNA 序列[16],具有易于合成與修飾、分子量小、成本低等優勢,在膜蛋白標記與成像中吸引了廣泛關注。2019年,福州大學楊黃浩教授和李娟教授將代謝標記技術與DNA自組裝技術相結合[17],實現了膜蛋白糖基化修飾的成像分析。該方法首先利用糖代謝標記技術在細胞膜糖蛋白上標記疊氮基團,然后利用帶有炔基的DNA探針與疊氮基反應從而在糖蛋白上共價標記DNA片段,接著通過核酸適體探針識別糖蛋白并與糖蛋白上的DNA 片段雜交,引發雜交鏈式反應(HCR)產生熒光信號,實現對細胞膜上糖蛋白的原位成像。作者結合DNA 的精準距離控制優勢和HCR 的信號放大特點,實現了活細胞表面PTK7 以及上皮細胞粘附分子(EpCAM)的糖基化檢測,并能靈敏地檢測藥物作用下膜蛋白糖基化水平的變化。這一工作實現了活細胞特定蛋白糖基化的可視化分析,對在細胞生理環境下闡明蛋白糖基化過程具有重要意義。
大多數核酸適體的靶蛋白在細胞膜表面高表達,但膜蛋白較高的分布密度與較快的運動速度導致很難在單分子水平上利用核酸適體對其進行高精度的原位分析。針對這一問題,湖南大學譚蔚泓教授和呂一帆教授提出了一種全新的“配體稀釋”策略來提高膜蛋白成像的精度(圖1)[18]。該策略采用大量非熒光標記的核酸適體探針對熒光探針進行稀釋,使少量的膜蛋白標記上熒光探針,從而實現單分子水平的膜蛋白熒光成像。具體來說,由于熒光探針和非熒光探針具有相同的識別區域,兩者對靶標蛋白的識別呈現一個類似隨機取樣的過程,同時非熒光探針能夠“稀釋”熒光探針的成像效果。當稀釋倍數足夠大時,相鄰兩個熒光探針之間的標記信號即可被清晰地區分開來,實現對單個膜蛋白分子的成像。該研究團隊構建了可以計算細胞表面受體密度的回歸模型,并進一步通過分子動力學模擬確定了核酸適體與膜蛋白的準確結合位點和具體結合方式。此外,利用配體稀釋技術還可以實現膜蛋白的動態分析,從而得到膜蛋白隨時間變化的分布信息,實現對高表達膜蛋白在活細胞膜表面的二維以及三維運動狀況分析。該設計為表征單分子膜蛋白提供了全新的思路,對于深入了解膜蛋白的空間分布、運動和相互作用模式具有重要意義。
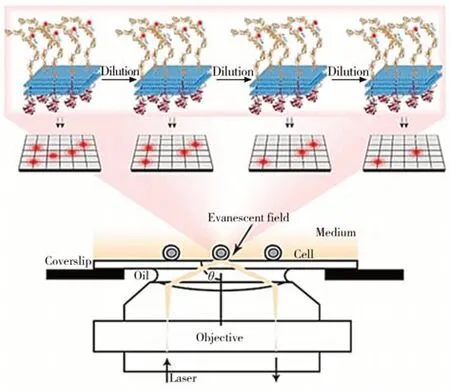
圖1 基于配體稀釋策略的單分子膜蛋白熒光成像[18]Fig.1 Fluorescence imaging of monomolecular membrane proteins based on ligand dilution strategy [18]
雖然研究者開發了大量熒光探針用于膜蛋白空間分布和運動行為的監測,但要區分膜蛋白在水平、垂直等不同方向的運動仍然存在巨大挑戰[19-21]。2019 年,中國科學院劉聰教授和李明教授基于DNA 分子設計了一種單分子LipoFRET 探針,實現了對脂質體膜上α-突觸核蛋白(α-syn)在垂直方向的實時動態觀測[22]。α-syn是路易小體的主要組分,其在細胞膜上的位置變化與帕金森病的發生密切相關[23]。作者將長度為10個核苷酸的單鏈DNA(ssDNA)錨定到脂質體上,并在脂質體內包封5 mmol/L 臺盼藍溶液,ssDNA 片段的兩端分別用四甲基羅丹明(TAMRA)和膽固醇標記。疏水性烷基部分可以自發地結合到脂質雙層中,從而將DNA 錨定在膜上。該團隊利用單分子熒光共振能量轉移(smFRET)技術,通過測量熒光強度與F0的比值得出垂直方向上的距離變化,證明了α-syn 在膜上的多種存在狀態,且方法不受α-syn 非結構化尾端水環境的影響[22]。2021 年他們又通過測量熒光標記分子的熒光強度或熒光壽命信號,實現了細胞膜標記位點在垂直方向上的動態監測[24](圖2)。該課題組將全內反射熒光顯微鏡和熒光壽命成像顯微鏡相結合對標記位點進行監測。當熒光團標記的分子從膜的外表面移動到膜的內表面時,熒光團和脂質體內猝滅劑之間的smFRET 過程會導致熒光的急劇變化。因此,熒光團標記的膜蛋白在細胞膜中的位置變化可以通過熒光強度或壽命變化來反映。該方法用于細胞膜上單個膜蛋白動態監測時的精度可達1 nm,約等于細胞膜總厚度的十分之一,是目前已報道的原位分析活細胞膜蛋白在垂直方向運動的最精密方法。
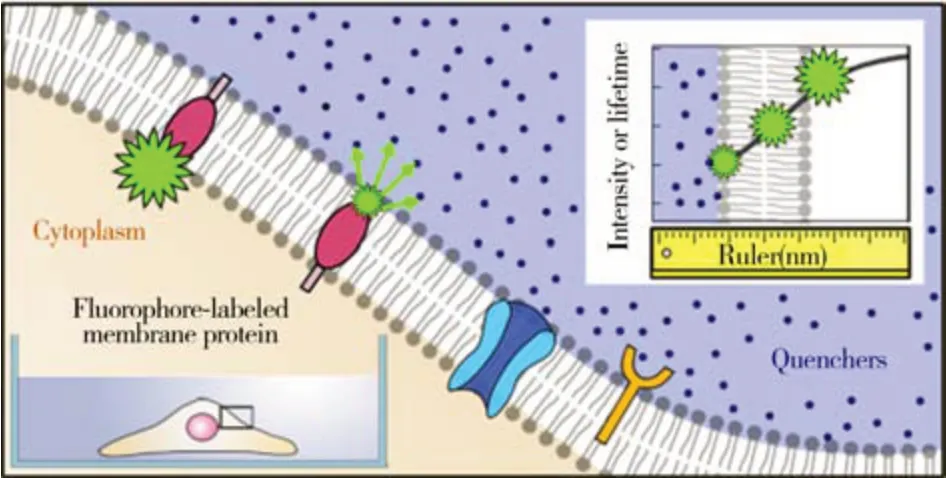
圖2 FRET探針用于垂直方向上膜蛋白位置成像的示意圖[24]Fig.2 Diagram of a FRET probe for the imaging position of a membrane protein in the vertical direction[24]
1.2 蛋白質探針
抗體具有良好的特異性識別功能,在膜蛋白的免疫熒光標記方面得到了廣泛應用。目前的膜蛋白免疫熒光分析技術已經非常成熟,本小節不再介紹傳統的免疫熒光成像方法。
熒光共振能量轉移(FRET)是一種發生于供體和受體分子之間的非輻射能量轉移過程[25]。在該過程中,受體分子的激發光譜和供體分子的發射光譜相互重疊且兩分子之間的距離在合適的范圍內時,供體的激發態能量能夠傳遞給受體分子并使受體分子發出熒光[26-27]。FRET效率與供體和受體之間的距離變化密切相關,通過對FRET 探針進行合理設計,使探針與靶標膜蛋白結合之后觸發供體和受體之間的距離變化,進而引起探針熒光信號的改變,即可實現對靶標膜蛋白的成像。湖南大學姚守拙院士課題組利用半合成綠色熒光蛋白(GFP)劈裂片段之間的高親和力和自發組裝能力設計了FRET探針來檢測細胞膜蛋白酶的活性[28]。該探針包括一個截短的GFP 片段和一個合成肽(P)兩個部分。其中,P 是由GFP11 鏈(GFP 的第11個β鏈)、蛋白酶底物序列和四甲基羅丹明(TAMRA)依次連接組成的結構,GFP1-10(GFP 的第1 到10 個β鏈)和肽P 可以自發組裝成一個完整的GFP(圖3)。由于TAMRA 的激發光譜與GFP 的發射光譜重疊,此時便形成了一對以重組GFP 為供體、TAMRA 為受體的FRET 對。為了達到原位檢測的效果,作者在探針GFP1-10的N端引入定位細胞膜的多肽序列蜂毒肽(MIP)。當細胞表面存在靶蛋白酶時,靶蛋白酶會對特定的底物位點進行識別并水解,使得TAMRA 遠離GFP 并導致FRET 效率下降。FGFP/FTAMRA比值的變化可以動態反映膜蛋白酶催化反應和酶活性,還能夠監測該酶在細胞膜上的表達水平。
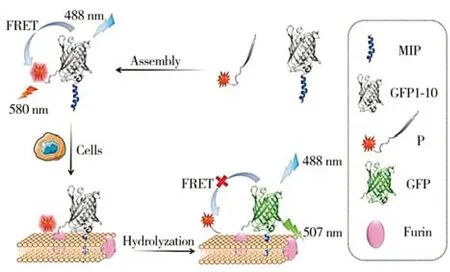
圖3 半合成熒光蛋白組裝的FRET探針用于膜蛋白分析的示意圖[28]Fig.3 Schematic diagram of FRET probe assembled with semi synthetic fluorescent protein for membrane protein analysis[28]
利用基因編輯技術使目標蛋白與熒光蛋白融合是在原生細胞環境中原位觀察目標蛋白的最常用技術之一,熒光蛋白融合技術在膜蛋白成像方面也得到了大量的應用。然而,并不是所有的蛋白質都能與熒光蛋白融合,而且熒光蛋白還可能導致目標蛋白表達量、表達位置和功能的異常。針對這個問題,愛丁堡大學Lynne 教授團隊基于非共價瞬時相互作用利用短肽將熒光蛋白短暫地結合到目標蛋白質上進行成像觀測,該方法可以應用于不能與熒光蛋白直接融合的蛋白質[29]。短肽標簽非共價標記技術比常規熒光蛋白融合技術對目標蛋白產生的干擾小,僅標記5 個殘基肽即可實現目標蛋白的成像,非常適用于對修飾特別敏感的蛋白質原位研究。該團隊選擇釀酒酵母中的3 種不能與熒光蛋白直接融合的膜轉運蛋白(Sit1、Agp1和Bap2)作為研究模型,將螺旋狀肽101B 融合到目標膜蛋白的C 端,膜蛋白上的螺旋狀肽101B 通過肽-肽相互作用與標記螺旋狀肽101A 的黃綠色熒光蛋白(101AmNG)相結合,即可實現對膜蛋白的原位成像研究。他們還將短肽標簽非共價標記技術與傳統的熒光蛋白融合技術進行了對比,發現膜蛋白Sit1 直接與mNG 融合時mNG 不能定位到膜上,膜蛋白Agp1 和Bap2 直接與mNG 融合同樣會干擾膜定位效果;而利用膜蛋白C 端的螺旋狀肽101B 與101A-mNG 的肽-肽相互作用進行膜蛋白成像時得到了良好的膜定位效果(圖4)。此外,通過改變螺旋狀肽的種類,該方法還可以實現細胞膜上多種膜蛋白的同時原位成像。
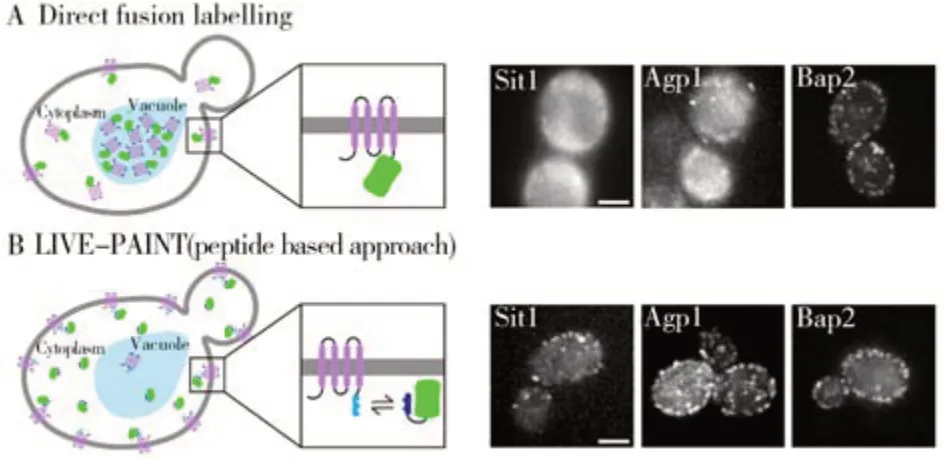
圖4 傳統的熒光蛋白融合技術示意圖(左圖)及其對膜蛋白的成像效果(右圖)(A);基于肽-肽相互作用的非共價熒光蛋白標記技術示意圖(左圖)及其對膜蛋白的成像效果(右圖)[29](B)Fig.4 Schematic diagram of traditional fluorescent protein fusion techniques(left) and the corresponding membrane protein imaging results(right)(A),schematic diagram of non-covalent fluorescent protein labeling technology based on peptide-peptide interaction(left)and the corresponding membrane protein imaging results(right) [29](B)
1.3 肽核酸探針
通常來說,抗體的分子量相對較大,在標記膜蛋白時會存在潛在的空間位阻與交聯現象,可能會對膜蛋白的成像精度和功能造成影響。為了避免這一問題,德國柏林洪堡大學Seitz 課題組利用肽核酸(Peptide nucleic acid,PNA)實現了高精度的多重膜蛋白成像[30]。PNA 是一種人工合成的化學分子,其結構與DNA 類似,但缺少磷酸基團。因此,PNA 與核酸、蛋白質等分子之間不會發生靜電排斥作用,且PNA 能夠與靶標分子高親和性結合[31]。此外,PNA的分子量較小,僅有2 kDa,對蛋白質的功能影響較小。在該工作中,研究者首先通過基因編輯技術在靶標膜蛋白上共表達受體多肽,肽核酸偶聯的多肽分子能夠與膜蛋白上的受體多肽特異性結合,從而在膜蛋白上特異性標記肽核酸分子。進一步,肽核酸分子能夠與熒光標記的DNA 分子結合,從而實現對靶標膜蛋白的原位成像。PNA 具有較高的抗核酸酶穩定性,膜蛋白上的PNA 探針能夠在生理環境下長期穩定存在。作者利用該方法對表皮生長因子受體(EGFR)和B型內皮素受體(ETBR)進行了PNA標記,整個反應可以在1 min之內完成。結果表明,PNA標簽探針用于膜蛋白成像時具有良好的分辨率。PNA 為膜蛋白成像提供了結合力強、標記簡單高效的標簽分子,可與多種染料分子聯合使用,在多種膜蛋白的同時成像中具有重要的應用前景。此外,該PNA 標簽技術為多模態成像提供了一個便利的平臺,通過在互補DNA 分子上標記拉曼分子、電化學發光分子等可以實現對膜蛋白的拉曼成像和電化學發光成像。
南京大學鄭鵬教授和李喆教授提出了一種利用工程蛋白連接酶OaAEP1 的催化作用將目標蛋白與PNA精確偶聯的方法[32]。在該方法中,目標蛋白的N末端修飾了氨基酸GL二肽,PNA 的C末端修飾氨基酸NGL三肽。OaAEP1催化目標蛋白上的GL二肽與PNA上的NGL三肽反應產生具有3-氨基酸連接體NGL 的目標蛋白-PNA 綴合物。這種方法可以準確地將PNA 修飾到目標蛋白的N 末端,能夠在對蛋白質功能干擾最小的情況下精確控制偶聯位點。該團隊選取EGFR 作為目標蛋白,首先,PNA 通過OaAEP1 的催化反應錨定在EGFR 上;然后在DNA 折紙納米結構的一側標記PNA,另一側標記單鏈DNA 分子,單鏈DNA 與熒光標記的短鏈互補DNA 片段相結合,即可使DNA 折紙納米結構標記上熒光分子。進一步,通過DNA折紙納米結構上的PNA與細胞膜EGFR上PNA之間的相互作用將DNA折紙納米結構與EGFR 相連接,實現對EGFR 的原位熒光成像(圖5)。此外,該團隊還證明對EGFR 的熒光標記可以利用DNA 鏈置換反應進行擦除,具體方法為用一段長鏈DNA 置換下DNA 折紙納米結構上熒光標記的短鏈DNA片段。
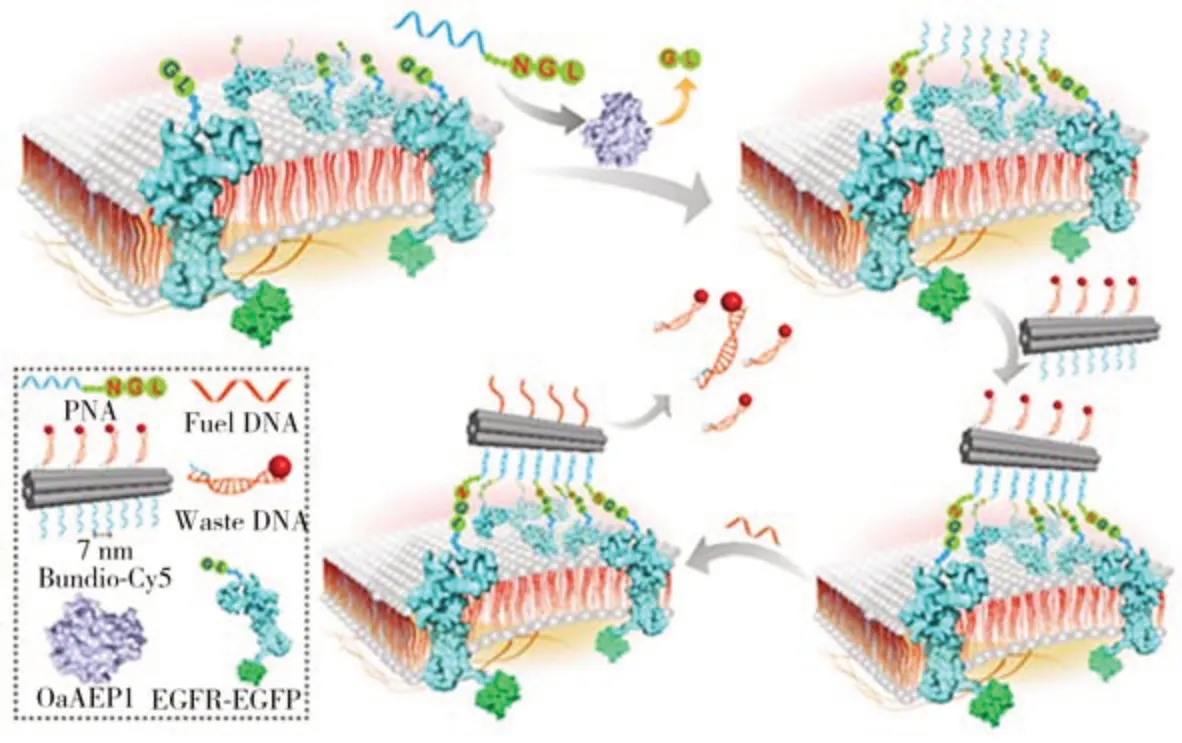
圖5 酶催化的PNA連接技術用于膜蛋白的可擦除熒光成像示意圖[32]Fig.5 Schematic illustration of enzymatic catalyzed PNA ligation technology for erasable fluorescence imaging of membrane proteins[32]
近年來,超分辨熒光成像技術在膜蛋白原位分析方面得到了大量應用。膜蛋白的尺寸較小,通常在10 nm 左右[33]。因此,常規的熒光顯微鏡無法精確地觀察膜蛋白的空間分布和組織結構。超分辨熒光顯微鏡具有非常高的空間分辨率,可以實現單分子定位和成像[34]。中國科學院長春應用化學研究所王宏達研究員發展了一種高特異性的小分子肽對細胞膜上EpCAM 進行標記,并利用直接隨機光學重構(dSTORM)超分辨熒光顯微鏡對其進行成像分析[35]。結果表明,EpCAM 蛋白以聚集形態分布于人乳腺癌細胞膜上(圖6)。基于成像結果,該團隊創新性地提出從膜系統結構的角度來研究細胞間有序相互作用機制的策略,并進一步推測膜的結構可能決定了細胞之間的相互作用方式。由于膜蛋白中存在底物結合位點,王宏達研究員團隊在保留底物特異性識別能力和生物活性的同時,用有機染料修飾小底物,形成小型熒光探針,用于膜蛋白的超分辨成像。基于類似的策略[36],該團隊以膜蛋白分泌起源作為切入點,利用超分辨顯微鏡對EGFR 從合成、分泌到轉移到細胞質膜上的整個過程進行了直接、高分辨率的成像觀測,實現了整個過程中亞細胞層面EGFR 的分布和組織結構分析。
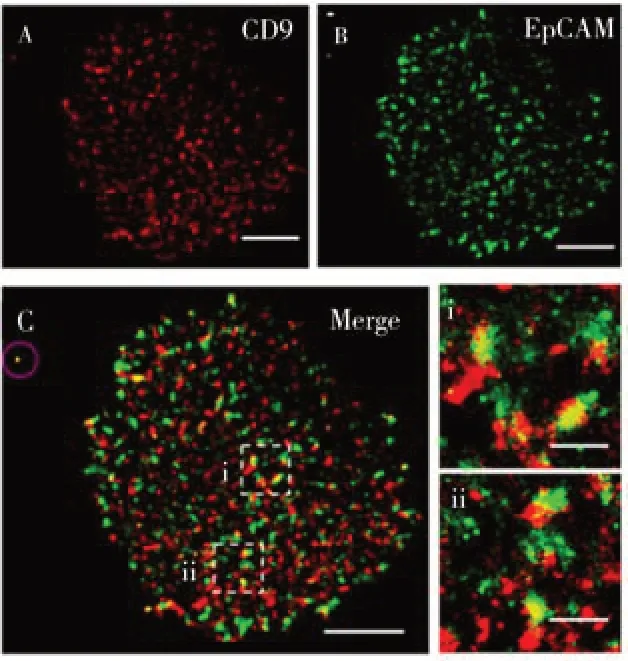
圖6 雙色dSTORM技術用于EpCAM和CD9的超分辨熒光成像[35]Fig.6 Dual-color-dSTORM technology for super-resolution imaging of EpCAM and CD9[35]
有機熒光小分子在細胞水平的膜蛋白成像中發揮了重要作用,極大推動了細胞生理活動分子機制相關研究的進展。在組織水平和活體水平進行膜蛋白成像是未來的發展趨勢,將有助于理解膜蛋白與腫瘤生長、轉移、惡化等的相關性,從而為腫瘤診斷和治療提供指導。但熒光小分子在組織和活體水平的膜蛋白成像中存在自發熒光干擾,導致成像靈敏度和分辨率降低。長余輝納米材料和上轉換納米材料則在消除組織自發熒光干擾方面具有獨特優勢[37]。長余輝納米材料能夠在激發光關閉后持續發光,而組織自發熒光壽命短、在激發光關閉后迅速消失,故在自發熒光消失后采集長余輝發光信號能夠有效避免自發熒光的干擾,顯著提高成像靈敏度和分辨率[38-39]。上轉換納米材料能夠被808 nm 或980 nm的近紅外光激發,而生物組織中的熒光團不能被激發,因此上轉換納米材料也能夠避免組織的自發熒光干擾[40]。此外,近年來開發的近紅外-近紅外稀土下轉換材料也能夠有效消除自發熒光干擾,在深層組織膜蛋白成像中具有獨特優勢[41]。長余輝納米材料、上轉換納米材料和近紅外-近紅外稀土下轉換材料能夠為組織水平和活體水平的膜蛋白成像提供強有力的工具。
2 電化學發光(ECL)成像
ECL是指電化學反應后發光分子激發態的能量弛豫和電子躍遷所引起的光輻射過程。與熒光相比,ECL 不依賴于外部光源,能夠有效避免背景熒光干擾和光漂白干擾。因此,ECL 成像顯著提高了膜蛋白分析的信噪比和靈敏度,在膜蛋白原位分析中具有廣泛的應用[42]。雖然ECL 成像具有靈敏度高等一系列優勢,但由于電化學發光分子信號微弱,使用ECL 顯微鏡觀察活細胞上的單個蛋白質仍然是一項具有挑戰性的任務。2021年,南京大學鞠熀先教授團隊基于雙分子內電子轉移策略設計了一種共反應劑內嵌的ECL 叔胺共軛聚合物點(TEA-Pdots),實現了人表皮生長因子受體2(HER2)的單分子ECL 成像(圖7)[43]。該團隊以TEA-Pdots 聚合物點作為標記材料,無需外加共反應劑即能實現ECL 成像。TEA-Pdots 聚合物點的ECL 強度是傳統分子間電子轉移體系的132 倍,其ECL 效率甚至高于經典的釕聯吡啶-共反應劑體系,為高靈敏度、無共反應劑的膜蛋白ECL成像提供了新的思路。另外,TEA-Pdots 較弱的細胞毒性和強的共反應劑嵌入ECL發射有利于成像系統在單個活細胞上進行膜蛋白的成像分析。這一工作為細胞上單個HER2蛋白的分析提供了強有力的工具。2022 年,復旦大學劉寶紅教授團隊設計了一種新型Ru(bpy)32+嵌入的金屬有機框架(MOF)材料作為ECL 納米發光單元,以提高ECL 成像的精度和靈敏度,從而實現單分子水平上的生物分子監測[44]。作為一種重要的多孔材料,MOF 具有可調節的孔隙率和可定制的化學性質,在分子存儲、藥物控釋和催化領域得到了廣泛研究。研究表明基于MOF的復合材料表現出優異的電化學性能。受電化學中限域效應的啟發,劉寶紅教授團隊將Ru(bpy)32+分子負載在具有多孔通道結構的Zr基MOF內部(圖8),以形成的RuMOFs 作為單個ECL 納米發射體;進一步將Sgc8 核酸適體修飾在RuMOFs 的表面構建ECL 納米探針,用于靶向細胞膜表面的PTK7 蛋白。該團隊使細胞在電極表面上生長,然后與RuMOFs-Sgc8 共孵育,通過Sgc8與PTK7膜蛋白的特異性結合實現對PTK7的標記。在犧牲劑三丙胺參與氧化還原反應并產生足夠的電勢后,通過ECL 顯微鏡收集RuMOFs-Sgc8 產生的ECL 信號即可實現對細胞膜表面PTK7 蛋白的成像,且單個ECL 點代表一個蛋白質分子。該團隊對CCRF-CEM 細胞、HeLa 細胞和Ramos細胞上的PTK7蛋白進行成像研究,在CCRF-CEM 細胞和HeLa細胞上觀察到了密集的ECL斑點,說明PTK7蛋白在這兩種細胞表面高表達。而在Ramos細胞上觀察到了稀疏的ECL斑點,斑點數量約為CCRF-CEM 細胞和HeLa細胞的五分之一,說明PTK7在Ramos細胞上低表達。該ECL方法測得的PTK7蛋白在不同細胞上表達量的趨勢與傳統免疫分析技術測試的結果一致,表明了該單分子ECL 策略在原位可視化分析膜蛋白分布和表達量中的有效性和準確性。
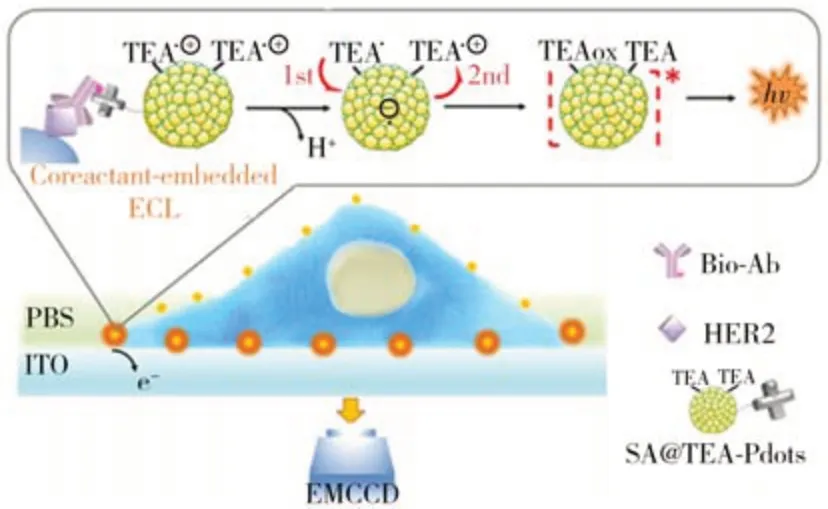
圖7 基于TEA-Pdots的細胞膜HER2 ECL成像示意圖[43]Fig.7 Schematic illustration of TEA-Pdots for ECL microimaging of HER2 on cell membrane[43]
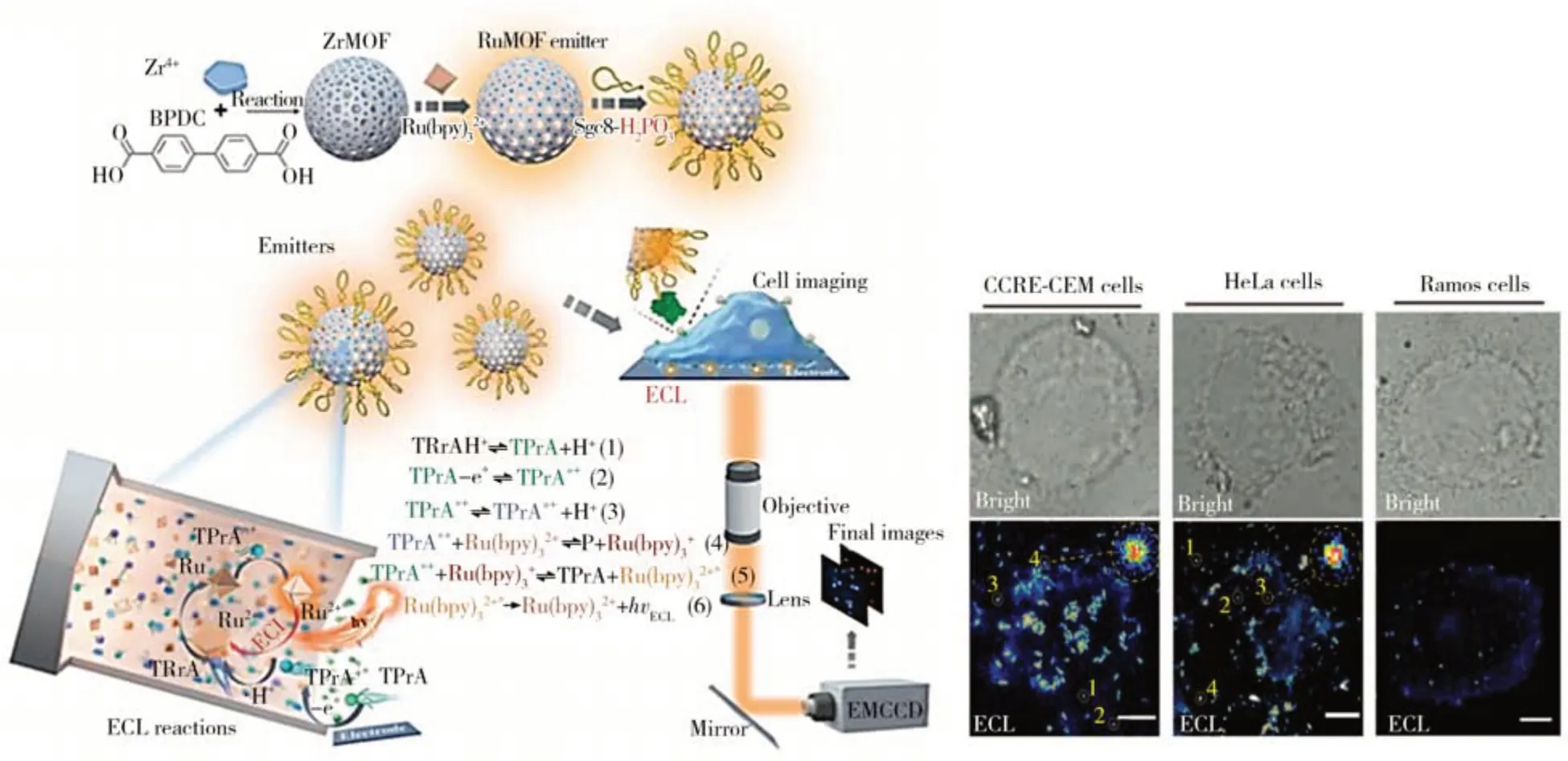
圖8 基于RuMOFs的細胞膜PTK7 ECL成像示意圖[44]Fig.8 Schematic illustration of ECL imaging of membrane protein based on RuMOFs[44]
3 核磁共振成像(MRI)
核磁共振譜是在原子級分辨率下分析蛋白質結構、相互作用和動力學的強有力方法[45]。核磁共振信號對蛋白質化學環境的細微變化非常敏感,這使其成為研究細胞內環境中蛋白質結構的強有力工具,在膜蛋白成像中具有重要的應用。動脈粥樣硬化可導致大多數心血管疾病,同濟大學劉中民教授、陳炳地研究員和復旦大學王鶴研究員提出利用巨噬細胞膜包裹的Fe3O4(Fe3O4@M)對動脈粥樣硬化斑塊進行早期診斷[46]。Fe3O4是一種典型的MRI造影劑,整合素α4β1在巨噬細胞膜上高度表達,將巨噬細胞膜包裹在Fe3O4納米顆粒表面能夠實現對內皮細胞表面血管粘附分子-1(VCAM-1)的特異性識別,從而實現對動脈粥樣硬化斑塊的成像。動脈粥樣硬化大鼠注射Fe3O4@M后24 h在主動脈根部觀察到明顯的MR信號。作者還制備了聚乙二醇改性的Fe3O4(Fe3O4@PEG)作為對照,注射了Fe3O4@PEG 的動脈粥樣硬化大鼠中觀察到的MR 信號無顯著變化。這些結果表明Fe3O4@M 可靶向細胞表面的VCAM-1 并實現體內的動脈粥樣硬化斑塊成像。
水通道蛋白4(AQP4)是中樞神經系統的主要水通道蛋白之一,是膠質瘤的重要生物標志物,在膠質瘤細胞的活動和功能中發揮著重要作用。由于AQP4 是一種大分子膜蛋白,難以通過常規磁共振波譜(MRS)等磁共振成像技術進行分析。浙江大學白瑞良及山東省立醫院劉英超團隊發現AQP4 能夠介導水分子跨膜運輸,且單個AQP4分子每秒能夠介導大量(~2.4 pL)水分子通過細胞膜(膠質瘤細胞體積約為10 pL)。基于這些特點,該團隊提出了一種AQP4 磁共振成像的新技術——跨膜水交換的動態對比增強MRI,即通過測量AQP4介導的水分子跨膜流出速率kio對AQP4分子進行特異性定位,改造動態對比增強磁共振成像技術,實現膠質瘤內AQP4 的無創、高分辨、定量成像[47]。這種非侵入性的成像技術為無創評估膠質瘤不同亞區域AQP4的生物活性提供了新的手段。
4 表面增強拉曼散射(SERS)成像
SERS 是指拉曼活性分子在特定基底表面時拉曼散射信號能夠顯著增強的現象。SERS 成像具有靈敏度高、易于操作、可實現多重分析等優勢,在膜蛋白研究中具有良好的應用前景[48]。南京郵電大學汪聯輝教授和宋春元教授利用SERS方法對癌細胞與基質細胞或干細胞結合時膜蛋白的二聚化過程進行了監測[49]。該團隊通過鄰近雜交介導催化發夾組裝(CHA)策略將基于AuNPs 的雙重識別探針和SERS標簽連接,同時對單個活細胞上膜蛋白的同源二聚體進行成像,提出了一種具有高靈敏度和特異性的單個活細胞膜蛋白二聚化SERS 成像策略。基于CHA 的網絡納米結構組裝可以形成大量表面增強拉曼散射熱點并產生強烈的表面拉曼散射增強效果,顯著提高蛋白成像靈敏度。如圖9 所示,適配體序列T-Met-1和T-Met-2可以特異性識別并獨立結合間充質上皮轉化因子(Met)二聚體中的兩個單體,同時兩條序列末端還能通過堿基互補配對進行雜交并觸發CHA 反應,進一步組裝得到網絡納米結構,顯著增強拉曼散射信號。該團隊選擇來源于人前列腺癌細胞的Met 陽性和TβRⅡ陽性細胞系DU145 作為細胞模型,肝細胞生長因子可以通過誘導Met二聚化來激活Met受體,在添加基于AuNPs的探針后,獲得SERS信號。該方法可以準確識別膜蛋白二聚化相關的單個或多個信號通路,在細胞間信號轉導機制研究中具有重要的應用前景。
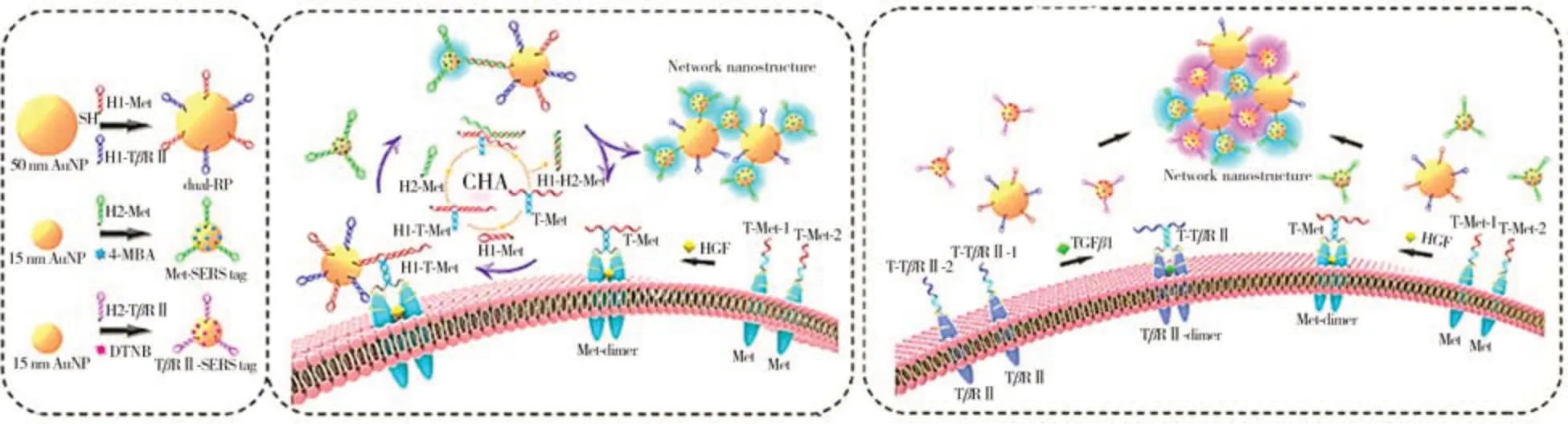
圖9 基于鄰近雜交介導催化發夾組裝的SERS探針用于膜蛋白二聚化成像的示意圖[49]Fig.9 Schematic diagram of membrane protein dimerization imaging based on proximity hybridization mediated catalytic hairpin assembly[49]
2023 年,南京師范大學王琛教授課題組開發了一種厚度可調的核殼結構Au@MOF 納米探針,在Au納米顆粒上構建的Cu(Ⅱ)苯-1,3,5-三羧酸鹽(Cu-BTC)多孔殼能夠有效負載拉曼信號分子,通過在納米探針表面修飾抗體即可用于膜蛋白識別。該納米探針具有良好的特異性和穩定性,可用于癌細胞表面蛋白質表達水平的精確成像[50]。SERS 的增強效果主要取決于兩個因素,其中電磁機制(EM)增強起主要作用,化學機制(CM)增強起次要作用。EM是指Ag、Au、Cu等貴金屬納米結構在特定波長下表現出局域表面等離子體共振,當探針分子與貴金屬納米結構直接接觸時,分子振動的弱拉曼信號得到顯著改善。EM 已被廣泛用于拉曼信號增強。CM 是指電子從半導體納米結構的費米能級到分析物最高占據分子軌道的轉移可以顯著提高拉曼信號的強度。該研究中,Cu-BTC 與拉曼報告分子之間的分子相互作用除EM 外,還有獨特的CM增強。Cu-BTC 殼還可以有效提高Au 納米顆粒在復雜生物環境中的分散性和穩定性。在激光照射下,Cu-BTC 和拉曼信號分子之間的電子轉移可以實現額外的化學SERS增強。該團隊將MCF-7 細胞與3 種SERS 納米探針(摩爾比為1∶1∶1)共孵育,3 種類型納米探針特征峰相對應的拉曼信號同時存在于細胞中且分布不同(圖10)。這些高性能SERS 納米探針被成功應用于細胞表面αvβ3、HER1 和HER2 蛋白的同時和特異性成像,展示了它們在多靶點檢測和SERS多通道成像方面的潛力。
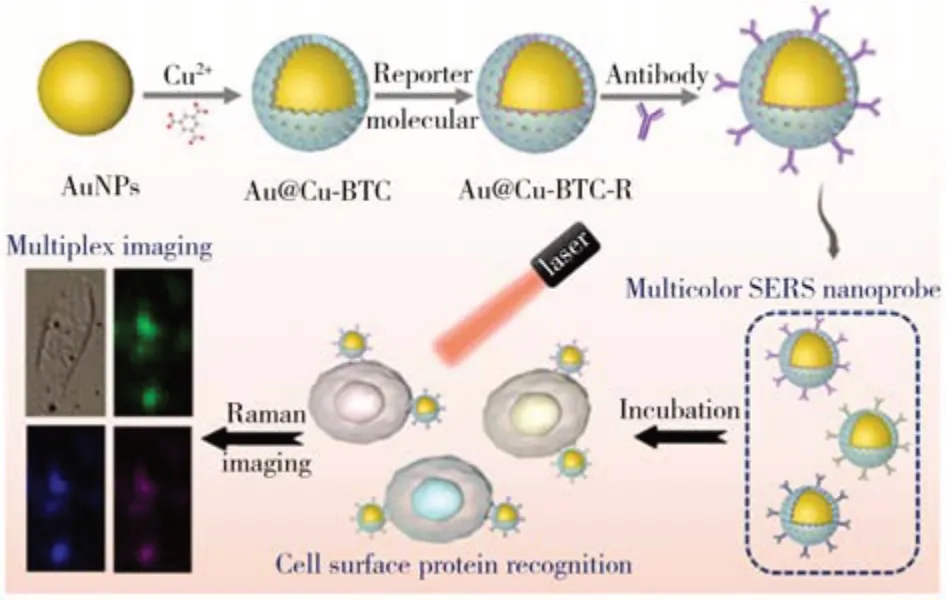
圖10 基于EM/CM增強的SERS探針用于癌細胞表面多種蛋白的成像示意圖[50]Fig.10 Schematic diagram of EM/CM-enhanced SERS probes for multiplexed imaging membrane proteins[50]
5 總結與展望
膜蛋白在生命活動中發揮了重要作用,是基礎生命科學研究和疾病診斷治療中至關重要的靶標分子。近年來,研究人員發展的多種成像方法實現了膜蛋白表達量、空間分布、組織結構的原位分析,對揭示膜蛋白的作用機制、發展有效的疾病診療方法等具有重要意義。本文主要介紹了熒光成像、電化學發光成像、磁共振成像和表面增強拉曼散射成像在膜蛋白原位分析中的應用。熒光成像靈敏度高、技術成熟、成本低,在膜蛋白成像中得到了廣泛的應用,尤其是近年來超分辨熒光成像技術的發展大大提高了膜蛋白空間分布和組織結構成像的精確度。然而熒光成像也面臨探針光漂白、自發熒光干擾、難以進行多種膜蛋白同時成像等問題的困擾。電化學發光無需激發光源,光學背景干擾小,然而大多數電化學發光分子信號較弱,一定程度上限制了電化學發光成像的靈敏度。核磁共振技術近幾年也被用于膜蛋白成像,具有空間分辨率高等優勢,其在膜蛋白成像中的應用仍處于起步階段。表面增強拉曼散射的突出特點是可實現多種目標蛋白的同時分析,然而貴金屬納米結構固有的尺寸會對目標蛋白的成像精度造成干擾。
雖然研究者開發了多種膜蛋白成像技術,但當前膜蛋白成像研究仍然存在一定的挑戰:(1)目前的成像技術往往只能進行膜蛋白的半定量分析,需要提高膜蛋白定量的準確性;(2)抗體、核酸適體、蛋白質和納米探針的尺寸會影響膜蛋白的定位和成像精度;(3)成像探針與膜蛋白結合后可能會影響膜蛋白的空間分布和組織結構。未來單分子定位超分辨成像技術、無標記成像技術等的快速發展有望解決上述問題,為膜蛋白的原位、定量、高靈敏、高分辨率成像帶來新的機遇。

