熒光納米探針的合成及其應用研究進展
侯可心,丁 晟,楊 焜,王在璽,李 釩
(軍事科學院系統工程研究院,天津 300171)
熒光探針作為一種熒光傳感器,以熒光物質為指示劑,可通過熒光信號變化用于對特定分子的檢測。熒光探針通常由三部分組成,分別為識別基團、連接基團以及信號報告基團[1]。識別基團用于對待測物質的識別,其決定了熒光探針的特異性和選擇性。信號報告基團用于將識別基團與待測物質反應所引起的化學環境變化轉化為熒光信號。連接基團則用于連接識別基團和信號報告基團。隨著熒光技術的不斷進步,熒光探針技術已廣泛應用于分析測試、生命科學、光學、化學等領域[2]。理想的熒光探針通常需滿足兩個條件:首先,熒光探針對于待測物質有較強的親和性;其次,熒光信號要盡量避免受外界環境因素的干擾,例如光漂白作用、待測物質的濃度以及周圍環境等因素[3]。目前常見的熒光探針包括有機類熒光探針及熒光納米探針兩大類。其中,有機小分子組裝形成的有機類熒光探針一般選擇有機小分子作為信號報告基團,例如蒽、香豆素、氟硼熒染料、萘酰亞胺以及羅丹明等,通過對其進行修飾可使發射波長范圍覆蓋達650~900 nm。有機小分子熒光探針種類多、資源豐富,近年來科研工作者也日益關注此類熒光探針的研究及應用。此外,量子點、上轉換納米材料、熒光蛋白等也可用作信號報告基團。熒光納米探針既具備熒光性質,也可用于標記納米材料。近年來涌現的熒光納米探針具備較高的熒光量子產率、較好的光穩定性以及生物相容性而引起了研究者極大的興趣。納米材料以其特殊的納米尺寸與結構,呈現與宏觀物質截然不同的性質,其具備量子限域效應、較高的熒光量子產率、較高的比表面積、易于吸附其他物質并產生相互作用的性質。隨著納米技術的不斷發展,納米材料的合成方法日益完善,人們更容易控制其尺寸、形貌及功能性等特征,為熒光納米探針滿足化學傳感器、生物探針等領域的技術要求奠定了基礎。熒光納米探針的熒光性質可隨著外界環境的微小變化而產生變化,具有靈敏度高以及響應時間短等優勢[4]。目前,常見的熒光納米探針包括量子點[5]、金屬-有機框架[6]、金屬納米簇[7]等。本文著重介紹其合成及應用,并對該領域的發展前景和存在的問題進行討論。
1 量子點
量子點(Quantum dots,QDs)又稱半導體納米晶,是由Ⅱ-Ⅵ或者Ⅲ-Ⅴ族元素組成的尺寸在1~100 nm 之間的“零維”新興半導體納米粒子。QDs 具有多種優異的熒光性質,如熒光壽命長、激發光譜寬、Stocks位移大、發射峰窄且對稱、光穩定性好等,可作為一種優異的熒光納米探針。QDs具備獨特的性質,主要考慮其自身的量子效應及尺寸效應影響。當其為納米尺度時,特殊的結構可引起量子限域效應、介電限域效應、表面效應、宏觀量子隧道效應,QDs表現出不同于宏觀物體的特殊光學性質,使得其在生物醫學、光電領域具有廣闊的應用前景[8]。 《Science》雜志將QDs列為2003年度十大科技突破之一。2006 年,《Nature》雜志將其列為最有可能實現大規模應用的4 種納米材料之一(圖1 所示QDs應用場景)。QDs 是一種核殼結構的納米材料,其內部為無機核,外部為配體分子。早在1983 年,科學家Brus 及其團隊首次報道合成了一種納米熒光半導體晶體—硫化鎘(CdS),并將其命名為量子點,由此拉開了熒光量子點研究的序幕[9]。1994 年,Alivisatos 教授及其團隊在《Nature》雜志報道了通過CdSe 構建發光二極管,QDs 得到了實際應用并成功用于光電轉換領域[10]。直到1998 年,Alivisatos 教授[11]以及Nie 教授[12]解決了QDs 的生物相容性問題,各自報道了可作為活細胞體系熒光探針的水溶性QDs,并證實其在生物醫學領域大有可為,為之后QDs研究的飛速發展奠定了基礎。QDs的熒光性質受多種因素影響,其存在空穴效應可被較大范圍的激發光激發[13]。另外其尺寸與發光性質密切相關,可通過調節QDs 的粒徑優化其發光性質[14]。QDs 的發光性質由電子、空穴以及周圍環境的相互作用決定(如圖2),其發光原理是在光照條件下,QDs吸收光子后其價帶上的電子則會躍遷至導帶,原來價帶的位置則產生空穴。而導帶上的電子有兩種可能,其可與價帶頂部的空穴復合從而發射光子,也可落入電子陷阱。當電子落入較深的電子陷阱,則大部分電子會以非輻射的形式產生猝滅,僅存在少數電子可以光子的形式重新躍遷至價帶或導帶。由于QDs 的紫外可見光譜存在多個能級態,其中由最低能級態激發產生的峰是量子限制峰,還有很多電子狀態存在于更高能級水平,因而單一波長的光可用于激發多種顏色的QDs[15]。根據QDs 的發光原理,通過在其連續的激發光譜中選擇適合的激發波長,使得生物樣本的自發熒光最低,從而提高QDs的靈敏度和分辨率[16]。

圖1 量子點的應用場景[8]Fig.1 The application scenarios for quantum dots[8]
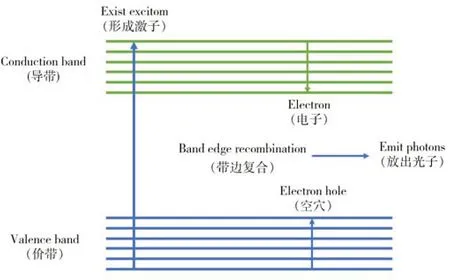
圖2 量子點熒光產生原理圖Fig.2 Schematic diagram of fluorescence generation of quantum dots
與眾多有機染料相比,QDs 具有更大的Stocks 位移以及較窄且對稱的熒光光譜峰,可應用具備不同光譜特征的QDs 進行不同組分的熒光標記,從而避免發射光譜與激發光譜的重疊或只產生很小程度的重疊,使得其可在低信號強度環境中進行熒光檢測,熒光光譜的區分、識別更容易[17]。此外,與常規有機染料羅丹明6G相比,QDs的熒光強度是其20倍,QDs具備更為優異的抗光漂白作用,光穩定性達到普通熒光染料的100 倍以上。有機熒光染料在光激發作用下易產生光致化學反應而具有很快的光漂白速率,QDs 的抗光漂白能力很強,幾乎不存在光褪色現象[18]。常規有機熒光染料的熒光壽命為幾納秒,而QDs 的熒光壽命可達到數十納秒且摩爾消光系數是常規有機熒光染料的10~50 倍。當光激發數納秒之后,自發熒光背景減弱,QDs 的熒光仍然存在,其可克服自發熒光背景的影響而清晰辨別到熒光檢測信號[19]。另外,經表面修飾后可使得QDs 具有優異的生物相容性,可作為理想的細胞體系熒光探針。
1.1 量子點的合成
經不斷探索,研究者發現QDs 較為常用的合成方法可分為有機相合成法及水相合成法。在早期研究中,QDs 的合成以有機相合成法為主。借助高沸點的有機溶劑,以有機金屬作為反應的前驅體熱解合成QDs。即于250~300 ℃的配體溶液中添加前驅體有機金屬,前驅體快速熱解并成核,晶核緩慢生長成為納米晶體QDs。在配體的吸附作用下,晶核不再繼續生長從而穩定存在于溶劑中[20]。早在1993年,Murray 等[21]以Cd(CH3)2及Se/Te 為金屬前驅體,以三正辛基氧化膦(TOPO)為有機溶劑,首次通過有機相合成法制備得到油溶性QDs。2001 年Talapin 等[22]將十二胺(DDA)替代TOPO 用作反應溶劑合成CdTe,熒光量子產率高達65%。然而,有機鎘等有機金屬前驅體具有毒性大、不穩定、易燃易爆、成本高、操作復雜且須控制整個過程無水無氧等缺點,極大限制了QDs的推廣和應用。Peng 等[23]繼續優化此合成體系,將金屬前驅體Cd(CH3)2更換為更環保的CdO或Cd(CH3COO)2,合成了粒徑均一的CdTe及CdSe。
通過有機相合成法制備得到的QDs 具有種類多、粒子分散性好、粒徑可控、熒光強度高以及量子產率高等優勢,然而,該方法操作較為復雜且需要較高的反應溫度,合成得到的QDs 不溶于水,生物相容性有待提高。通過有機合成法制備的QDs 表面可能包覆三辛基膦(TOP)/TOPO 層,可通過表面修飾小分子有機配體或者大分子聚合物的方式提高其親水性,降低毒性[24]。QDs 的表面修飾方法主要包括鏈交換法、聚合物包覆法以及表面硅烷化法(如圖3)[25]。鏈交換法通過親水性分子置換QDs 表面的TOP/TOPO 層從而得到具有良好水溶性的粒子[26],其成功與否取決于QDs 與配體結合的穩定程度。親水性分子一端帶有與金屬原子具有較強作用力的巰基等基團從而固定在QDs 表面,另一自由端的親水基團(羧基、胺基、羥基)賦予QDs 水溶性并可作為官能團進行后續生物偶聯。鏈交換法常見的含巰基配體主要有巰基十一酸、巰基乙酸、巰基丙酸等[12]。在此基礎上,二巰基的配體(如二巰基硫辛酸)可用于QDs 的修飾以提高配體與QDs 結合的穩定性[27]。然而,鏈交換法在合成過程中需超過量的前驅體進行反應,且所合成的水溶性QDs 表面結構易被破壞,可能影響穩定性及熒光強度[28]。通過聚合物包覆法利用兩親性聚合物(如聚乙烯亞胺、多肽、殼聚糖)的疏水端與QDs 的疏水配體相互作用將QDs 封裝在內部,而兩親性聚合物的親水端賦予QDs水溶性[29]。例如Park 等[13]通過合成聚乙烯亞胺衍生物并將其用于封裝數十個QDs,所合成的粒子水合粒徑為100 nm 且表面帶正電荷,適用于細胞內化。由于部分QDs含有重金屬元素,從而一定程度上限制其生物應用。聚合物包覆法可保護QDs 的內部結構,保留其特殊光學性質[30]。然而,與鏈交換法相比,聚合物包覆法顯著增加了粒子的水合粒徑[31]。表面硅烷化法通過將水解的硅烷化試劑置換QDs 表面的原有機配體,硅烷化試劑通過水解作用在QDs 表面形成SiO2殼層[32]。表面硅烷化修飾的QDs 具有良好的穩定性、水溶性和生物相容性,且引入的水溶性基團可用于負載其他功能性小分子[33]。此外,在QDs 表面構建SiO2殼層,可在一定程度上防止QDs 內部重金屬元素泄漏。然而,表面硅烷化修飾法操作步驟復雜、所合成的粒子粒徑不均,不利于大規模生產[34]。
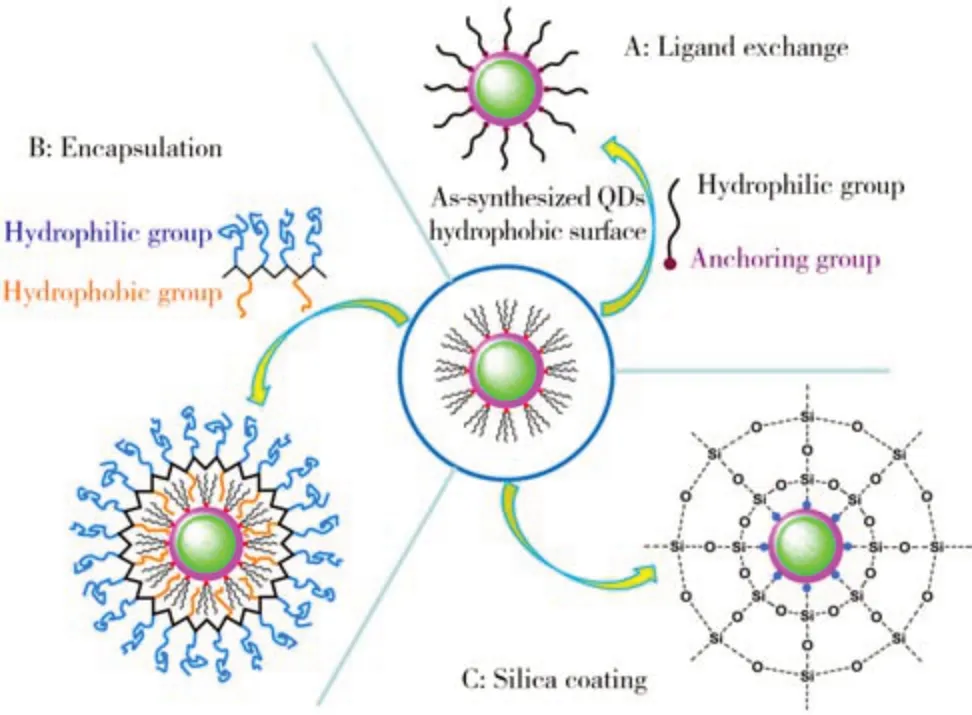
圖3 量子點的表面修飾方法:鏈交換法(A)、 聚合物包覆法(B)以及表面硅烷化法(C)[25]Fig.3 Methods for modifying the surface of quantum dots:ligand exchange(A),encapsulation(B) and silica coating chemistries(C)[25]
有機相合成法可制備得到高質量的QDs,然而所得到的QDs為油溶性,無法直接應用于生物體系。而經表面修飾后合成的QDs 表面難以鈍化且操作較為繁瑣,易發生熒光量子產率下降現象。水相合成法即在有機配體存在下,陰離子與陽離子前驅體在水相介質中直接反應合成得到QDs。與有機相合成法相比,水相合成法具有操作簡單、反應試劑無毒、成本低、表面電荷及表面性質易于控制等優勢。除此之外,通過水相合成法合成的QDs 解決了粒子的水溶性問題,具有更優異的生物相容性。早在1987年,Spanhel等[35]在水相體系中以多聚磷酸鹽為穩定劑,通過Cd離子與H2S反應合成了CdS。1993年Rajh 等[36]報道在水溶液中以硫代丙三醇為穩定劑,合成得到水溶性巰基甘油包覆的CdTe。1999 年Rogach等[37]以巰基丙三醇以及巰基乙酸為穩定劑,合成了CdTe并實現粒子表面的功能化。自此水溶性QDs 逐漸成為研究熱點。水相合成法通過離子型前驅體,以多官能團巰基小分子為配體,在水相介質中加熱回流前驅體溶液使得納米晶逐漸成核并生長。例如Liu 等[38]以CuCl2、InCl3以及CS(NH2)2為原料,3-巰基丙酸為配體合成得到了水溶性的CuInS2。Zhou等[39]以CuCl2、InCl3以及Na2S為原料,以巰基乙酸為配體合成得到了纖維鋅礦晶型的CuInS2。以巰基小分子為配體合成QDs具有操作簡單、成本低、易于大規模生產、可進一步復合與組裝等優勢,然而含有巰基的小分子具有一定毒性,且通過該方法制備的QDs 存在種類少、部分QDs 熒光量子產率低、熒光半峰較寬等不足。針對這些問題,科研人員致力于開發低毒或無毒的高效配體[40]。Gao 等[41]以L-谷氨酸為配體,以CuCl2、InCl3、CS(NH2)2為原料,通過水相合成法制備水溶性的CuInS2。CuInS2與具有熒光的抗癌藥物阿霉素結合得到可用于實時監控阿霉素釋放情況的功能化量子點。隨著研究的不斷深入,除了有機相合成法及水相合成法之外,電化學合成法也引起人們的廣泛關注。由于天然產物具有溫和的生物還原作用,可以多酚、水稻提取物等天然物質為還原劑,將金屬離子還原為金屬原子,進而以金屬原子為前驅體形成具有穩定熒光性質的QDs。此外,電化學合成法還可用于制備碳量子點(CQDs),主要是通過使用具有導電功能的含碳材料為工作電極,通過施加直流電壓,陽極氧化水分子,電解液中的離子進入工作電極從而在碳材料中剝離出碳納米粒子。電化學合成法制備成本低、能耗低、對于含碳前體的利用率高、所合成CQDs粒徑較為均勻,且有利于監測CQDs合成過程并實現較大規模生產。
1.2 量子點的應用
通過幾代科研人員不斷改進QDs 的合成方法并優化結構組成,QDs 的光學性質得到不斷提升,使得其成為一類性能優異的熒光探針在生物分析領域具有極大的發展潛力,尤其是在分析傳感與生物成像方面[15]。在基于光誘導電子轉移、熒光共振能量轉移等原理的基礎上,QDs 的生物傳感技術可用于體外對于生物樣品中特定物質的檢測。QDs 可與DNA、糖、酶、蛋白質、病毒、抗原及抗體等物質結合實現對其定性或定量檢測[42]。傳統對于體外生物標志物的識別具有一定局限性,例如常見的酶聯免疫吸附法中生物酶易受外界環境因素(如溫度、光照等)影響,且該法的顯色過程需要一定的時間從而限制了其在特定場景中的應用。基于QDs 的免疫吸附法可較好地規避上述問題,QDs 的穩定性較好且能與多種生物分子結合實現快速、精確的定量或者定性檢測。例如,Wu 等[43]合成苯硼酸修飾CdTe/ZnTe/ZnS 量子點用于對活細胞內葡萄糖的檢測,該熒光探針通過巰基苯硼酸與葡萄糖分子發生反應引發熒光猝滅從而對葡萄糖具有高靈敏度和選擇性。Wang 等[44]合成了基于QDs 的比色-熒光雙模式橫向流動免疫分析生物傳感器用于檢測新冠病毒,其可定量檢測生物樣本中SARS-CoV-2 特異性的IgM/IgG。該檢測方式具有兩種模式:首先,對于普通人群,通過比色法快速篩查出疑似感染者。其次,通過熒光法定量檢測生物樣本中的IgM/IgG 進一步確定早期感染者。之后,Wang 等[45]將QDs 吸附到SiO2納米粒子表面制得QDs 納米珠,基于雙通道熒光免疫色譜法可用于對SARS-CoV-2 以及甲型流感病毒的定量聯檢,檢測時間僅為15 min,對SARS-CoV-2抗原的檢測限為5 pg/mL,對甲型流感病毒的檢測限僅為50 pfu/mL。與傳統的金納米粒子相比,通過該方法可將檢測靈敏度提高約2 個數量級。由于QDs 表面可經過修飾與多種生物分子結合從而應用于多種腫瘤標志物的定量檢測。例如通過將甲胎蛋白抗體與QDs 偶聯,基于QDs 以及金納米粒子之間的熒光共振能量轉移現象從而實現對于生物樣本中甲胎蛋白的定量檢測。除對于肝癌相關的甲胎蛋白之外,以QDs 作為熒光信號,還可用于肺癌、卵巢癌腫瘤標志物的檢測。另外,以QDs 為熒光標記物也可用于對食品雜質的精確檢測。例如,單獨使用QDs或將QDs與其他熒光材料聯合用于對酪蛋白、鼠傷寒沙門氏菌等物質的定量檢測[34]。
與有機染料相比,QDs 不會對細胞膜產生明顯損傷,因此其可與生物大分子偶聯進入細胞體內實現對細胞、蛋白質、DNA 等物質的生物標記。1998 年,Bruchez 等[11]以及Chan 等[12]報道稱QDs 可應用于小鼠成纖維細胞熒光成像,證實QDs是實現生物成像的有力工具。He等[46]通過一步微波輔助法合成水溶性CdTe,實現對小鼠腫瘤的靶向成像。根據QDs具有優異熒光性能的優勢,還可將QDs作為載藥平臺應用于動態監測藥物在活體細胞內的分布和代謝行為,從而為設計和開發新型的藥物提供理論依據和技術支持。人們認為近紅外窗口為生物組織的光學“透明”窗口,與可見光相比,其具有更強的組織穿透能力,適合用作光激發源。在生物成像領域,可用于近紅外發射的非Cd 的QDs 材料還有CuInSe[47]、CuInS[48]、Ag2S[49]等。該類QDs 材料由于不含有重金屬元素,生物相容性更好。Kuo 等[50]合成氮摻雜石墨烯QDs 材料,其具備較高的光致發光量子產率以及雙光子性能,通過使用特異性抗體標記癌細胞細胞器及鑒定核抗原,從而能夠在雙光子波長下同時檢測細胞中的4 個靶標,可用作細胞成像的有效探針。由于QDs 粒徑可調且與有機熒光染料相比更不易生物降解,除了可用于細胞或生物體的成像之外,還可用于細胞中某個細胞器的靶向成像。近年來在線粒體熒光探針的研究中報道了較多的CQDs,其具有毒性低、來源廣、環境友好的優勢。Hua等[51]通過一步水熱法以殼聚糖、乙二胺以及巰基琥珀酸為原料首次合成了具備線粒體靶向功能的CQDs,其無需修飾其他線粒體配體即可實現線粒體成像以及線粒體靶向光動力治療。Geng 等[52]以羅丹明的親脂性陽離子作為CQDs 的發光中心合成了具備線粒體靶向功能的CQDs,其具有線粒體成像功能以及從綠色熒光到紅色熒光的可調長波長熒光。另外,根據CQDs 顏色的可調性,可實現對同一細胞的多色標記。例如,可使用5 種不同顏色的CQDs實現對人上皮細胞的多色成像[53]。Liu 等[54]以地塞米松以及1,2,4,5-四氨基苯為原料,通過微波水熱法合成活細胞中溶酶體靶向CQDs,其可作為比率熒光探針用于檢測甲醛。
然而在QDs應用過程中發現其對于水、氧氣、熱的耐受性較低,這可能是因為其為核殼結構材料,外部起保護作用的配體分子在受到外界因素影響時易發生脫落或在化學反應作用下失效。另外,在應用過程中QDs團聚導致其體積變大,影響發光穩定性甚至猝滅失效。
2 金屬納米簇
金屬納米簇(Metal nanoclusters,MNCs)是由幾個到上百個不等的Au、Ag、Pt 等原子組成的金屬核與配體殼的典型核殼結構,其尺寸在2 nm 左右且具有明確的組成及結構(如圖4)。此類超小的納米粒子表現特殊的行為,這種改變由電子共享以及量子限制引起,導致MNCs具有高比表面積、強光致熒光、量子尺寸效應、表面效應以及宏觀量子隧道效應等[55]。MNCs 介于金屬原子以及等離子體金屬納米粒子之間,由于其尺寸接近電子的費米波長,呈現出離散態能級,進而導致MNCs具有特殊的物理化學性質以及類分子性質,例如最高占據軌道和最低未占據軌道(HOMO-LUMO)躍遷、高催化活性、分子手性及固有的磁性、確定的分子公式以及分子結構等[56]。

圖4 MNCs示意圖(A)及尺寸與性質關系圖(B)[66]Fig.4 Schematic illustration of MNCs(A) and important properties of MNCs related to their ultrasmall size(B)[66]
MNCs 的物理化學性質取決于其金屬核以及殼體保護配體[57]。金屬核的原子結構對于MNCs的穩定性至關重要,高度對稱結構導致高結合能,MNCs從而具有較高的穩定性。MNCs表面的配體殼結構對于金屬核具有重要保護作用,當選擇的金屬核相同而保護配體不同時,MNCs 的熒光發射不同[58]。目前MNCs 常用的保護配體包括巰基化合物[59]、聚合物[60]、蛋白質[61]以及DNA[62]等,其中報道較多的是巰基化合物,特別是谷胱甘肽,由于其含有的巰基官能團可與金屬原子產生強烈的相互作用而達到修飾及穩定MNCs的作用[63]。谷胱甘肽保護的金銀納米簇已被廣泛應用于生物成像及生物傳感等領域。Zhou 等[64]合成谷胱甘肽保護的金納米簇,其可用于生物成像并具有較高的腎臟清除率。此外,一系列與硫醇有關的化合物(如巰基琥珀酸、苯乙基硫代、硫代α-環糊精等)被用于合成穩定的金納米簇[65]。盡管MNCs的研究已取得較快發展,然而仍存在多數水相MNCs的抗聚集穩定性以及對環境氧的抵抗力不足,有機相的MNCs 在生物醫學領域的應用受限制等問題[66]。在實際應用過程中,可通過MNCs 與MOFs、石墨烯、生物分子或者無機材料等物質結合從而達到增強MNCs性能的目的[67]。例如Ao等[68]通過在銅納米簇表面使用含有硫醇的三烷氧基硅烷原位生成硅殼的方法增強其熒光性質及光穩定性,且通過在硅殼表面水解及聚合具有不同官能團的三烷氧基烷烴衍生物為其提供多功能的表面官能團。近年來,金、銀納米簇在生物醫學領域得到廣泛應用,常被用作癌細胞的熒光探針[69]。此外,科研人員合成了眾多以Cu、Pt、Pd、Ir 為核的MNCs,雙金屬或者三金屬納米簇(如AuxAgy、AuxCuy、PtxAuyAgz)也得到了廣泛關注[70]。
不同類型的MNCs 可廣泛應用于多種領域,例如催化、生物分析及成像、電子器件制備、環境檢測等,是一種具有應用潛力的理想納米材料。其中,MNCs 以其優異的熒光性能而成為新一代的熒光材料。傳統熒光探針例如有機熒光小分子探針的抗光漂白性能一般[71],而QDs具有一定的細胞毒性[72],MNCs具備超小粒徑、更優異的光穩定性及生物相容性,因此MNCs可作為傳統熒光探針有前途的替補材料。科研人員對于具有優異熒光性能MNCs 的合成方法具有濃厚興趣,目前已有多種策略可以高度受控的方式合成MNCs,包括自下而上、自上而下的方式,其中應用最多的為自下而上合成法。
2.1 金屬納米簇的合成
一般來說,MNCs 的合成策略可分為:自下而上以及自上而下。自下而上的方法是在有保護配體或模板存在的情況下,將離子還原為原子進而形成原子團簇。自上而下的方法是利用配體(例如硫醇化合物)將較大的納米材料刻蝕成較小的MNCs。
在自下而上的合成過程中,常見的幾種方法包括化學還原法、光還原法、模板法、電化學法、超聲化學法等。化學還原法是封蓋劑以及還原劑起作用的方式,金屬前體(例如CuSO4、HAuCl4、AgNO3等)起基質作用,還原劑(例如NaBH4、抗壞血酸、H2等)將金屬離子還原為原子并最終聚集形成納米簇。在合成過程中由于納米簇表面積很高以及位于外層的原子價鍵不飽和導致其表面自由能較高,納米簇不穩定并可產生不可逆的聚集[73],因此,通常需要保護劑以降低表面自由能從而制得穩定的MNCs。與化學還原法相比,光還原法是MNCs的綠色合成方法,以光照作用代替使用有毒還原劑從而避免了沉淀反應的發生[74]。電化學法通過犧牲陽極得到金屬離子,之后其在陰極被還原為MNCs。例如González 等[75]通過電化學法在陽極溶解金電極,還原Au-PVP 配合物合成得到了只有2 個和3 個原子的金納米團簇。模板法作為一種簡單高效且無污染的MNCs 合成方法被廣泛關注,以金屬離子為前驅體,通過特定結構的模板可與金屬離子發生相互作用并使得MNCs 穩定分散而不易產生聚集。模板的性質可影響MNCs的尺寸及熒光發射[76]。近年來,用于合成MNCs的模板主要有硫醇分子[77]、高分子聚合物[78]、蛋白質[79]、核酸[80]等物質。超聲化學法利用超聲場中氣泡經歷形成、生長及破裂過程,可導致化學反應增強。超聲化學法具有綠色無污染、反應速度快、反應過程可控及所合成的納米粒子形狀規則、粒徑均一等優勢[81]。Wang等[82]通過超聲化學法以谷胱甘肽為還原劑和穩定劑采用一鍋法合成了具有熒光性質及磁性的銅納米團簇。自下而上合成法無需顆粒較大的前驅體,是合成MNCs 的一種簡單高效的方法。
自上而下合成法是在過量配體以及粒徑較大的非發光金屬納米粒子或者納米簇之間通過化學刻蝕作用形成MNCs的方法[83]。在化學刻蝕過程中,常見的刻蝕劑為氨及谷胱甘肽[84]。粒徑不同的MNCs穩定性不同,最終只有穩定性最好的MNCs可進一步形成粒徑最小的粒子。配體誘導刻蝕是合成MNCs的主要刻蝕方法,特別是以硫醇小分子、胺及高分子聚合物為配體時,配體與金屬核的相互作用引起科研工作者的關注。例如,Deng等[85]以銅納米粒子為前驅體,以氨為刻蝕劑通過化學刻蝕法合成了具有綠色熒光的銅納米簇并用于對尿素的檢測。Guével 等[86]以谷胱甘肽為刻蝕劑,以鉑納米粒子為前驅體合成了在570 nm 具有熒光的鉑納米簇,且隨著反應時間的延長,熒光發射峰逐漸藍移。自上而下的方法易于控制MNCs 形狀從而實現圖案化,可通過調節不同配體作為刻蝕劑合成具有不同熒光發射的MNCs。然而,該方法合成過程復雜、不利于實現多功能性且需要特定的設備以及技術支持。此外,所合成的MNCs粒徑不均一,較大的粒子在純化過程中易丟失從而造成浪費。
2.2 金屬納米簇的應用
MNCs 由金屬核以及配體組成,二者均可與靶標識別從而實現檢測的目的。其作用機理可能為基于MNCs與靶標物質之間的電荷或者能量轉移導致的動態熒光猝滅,基于靶標物質與MNCs構成不發光的絡合物而導致靜態熒光猝滅。MNCs 作為新型的熒光納米探針在生物分析檢測、環境監測、生物成像、分子傳感、抗菌、催化等領域得到廣泛關注及應用。對于離子的檢測始終是分析測試領域的重要研究內容,MNCs可與多種離子發生特異性響應導致其熒光強度發生改變。重金屬離子(如Pb、Cd、Hg及Fe)是危害環境及人體健康的劇毒污染源,因此對于重金屬檢測的重要性不言而喻。Bhamore等[87]通過一鍋法合成谷胱甘肽及組氨酸穩定的金納米簇熒光探針,其可應用于水溶液及血液中Pb2+的檢測(如圖5)。MNCs還可用于檢測部分有毒的陰離子,例如Cang等[88]研制一種用于NO-3及CN-檢測的雙傳感熒光探針硫代水楊酸為保護配體的銅納米團簇。在酸性條件下,NO-3離子通過HNO2和硫代水楊酸的氧化還原反應產生熒光猝滅,而CN-離子在堿性溶液中通過蝕刻過程產生熒光猝滅。除了對多種金屬離子及陰離子的檢測之外,MNCs 可用于多種具有重要生物功能的小分子檢測,通過小分子與金屬原子相互作用使得MNCs 的熒光猝滅或增強。Li等[89]提出一種可用于檢測Fe3+、NO-3及半胱氨酸的多功能熒光探針金納米團簇,其在H+的觸發下通過自組裝形成具有紅色熒光的生物探針。Wang等[90]利用硫醇誘導化學刻蝕法聚集發射活性金納米團簇用于快速、靈敏及選擇性地檢測半胱氨酸。Zhai 等[91]合成可用于高效檢測谷胱甘肽的金銀雙金屬納米團簇材料作為“Turn-off”熒光納米探針。在過硫酸鹽的作用下,熒光納米探針產生熒光猝滅,而谷胱甘肽可與其反應并誘導熒光恢復。

圖5 具有綠色熒光的谷胱甘肽及組氨酸穩定的金納米簇熒光探針應用于Pb2+的檢測[87]Fig.5 Glutathione and histidine stabled AuNCs fluorescence probe applying to Pb2+ detection[87]
蛋白質作為重要的生物大分子具有多種生理功能,是生命活動的基礎,因此,對蛋白質的準確檢測對于疾病診斷具有重要意義。蛋白質與MNCs 存在一定程度上的相互作用,基于該性質可合成用于蛋白質檢測的熒光納米探針。早在2006 年,Triulzi 等[92]首次報道基于MNCs 檢測蛋白質的方法,將PAMAM-金納米團簇與抗人免疫球蛋白抗體組裝,通過化學發光酶免疫測定法實現對蛋白質的檢測。生物酶的生物活性可直接或間接地影響MNCs 的熒光性質,基于這一特性設計了用于檢測生物酶的納米熒光探針。近年來,已有科學家設計了多種MNCs用于檢測生物酶(如乙酰膽堿酯酶、蛋白激酶、金屬蛋白酶、凝血酶等)。Liu 等[93]將金納米簇與熒光素結合合成了比率型熒光探針,用于檢測乙酰膽堿酯酶及其抑制劑對氧磷,并利用光子晶體的選擇性增強其熒光強度。核酸作為生物最重要的物質之一,Bonis-O'Donnell等[94]合成了銀納米簇用于對DNA濃度的比率熒光檢測,當添加目標序列時,該序列在銀離子及還原劑的作用下形成具有熒光的銀納米簇,反之則抑制其形成,且銀納米簇的合成數量取決于目標結合域的接近程度。
與其他成像方式相比,熒光成像在多種物質檢測、設備靈敏度及成本等方面具有顯著優勢。以生物分子為模板合成MNCs可賦予其優異的生物相容性。MNCs以較小的粒徑、優異的熒光性質、易于表面修飾、結構組成明確等優勢易應用于生物成像領域。Wu 等[95]以牛血清白蛋白為模板合成金納米簇,首次將其用于小鼠體內腫瘤活體成像分析。此后,多項研究報道MNCs 用于生物成像研究,例如Pan等[96]通過一鍋法合成甲硫氨酸保護的金納米簇,其可特異性識別癌細胞并顯示強熒光,而在正常細胞不顯示熒光。
此外,MNCs還可用作抗菌劑治療細菌感染引起的多種疾病,這是由于MNCs具有尺寸小、比表面積高的優勢,當其進入細胞內部時可誘導細胞代謝失衡,增加活性氧自由基,并最終發揮抗菌作用。科學家以桿菌肽為生物模板制備金、銀、銅納米簇,其可誘導產生大量活性氧自由基,呈現較強的抑菌作用。另外,也有多種具備廣譜抗菌作用的MNCs被成功合成[70]。由于MNCs具備較小的尺寸、獨特的電子結構、高比例的表面原子以及低配位數,因此MNCs 的化學性質可能更活潑,且結構可設計,從而在催化等領域具有應用潛力。研究發現,MNCs 除了在化學催化反應中具有應用價值外,還具備類酶活性,例如可能具有類過氧化物酶、類葡萄糖氧化酶活性,而關于具有類酶活性的MNCs 設計研究對相關生物醫學領域的應用具有重要指導意義。然而,在MNCs 應用過程中,由于MNCs 粒徑較小、比表面積較大,當其粒徑持續降低時,表面能增加,且MNCs 高度配位不飽和,使得其熱力學性能不穩定,在應用及儲存方面帶來困難。
3 金屬-有機框架
金屬-有機框架(Metal-organic frameworks,MOFs)通過金屬節點(金屬離子或金屬簇)與橋連的多齒有機配體以配位作用形成配位化合物,其具有高比表面積、高孔隙度、多功能、結構可調等優勢并成為新一代的多孔雜化材料[97]。上世紀90 年代,Yaghi 團隊在《Nature》雜志報道了具有熱穩定性的MOFs材料可用于選擇性地吸附芳香族分子[98]。MOFs是一類具備豐富發光中心的優秀的發光平臺,其熒光通常基于金屬離子發光、有機配體發光、電子轉移發光以及負載在MOFs 中的客體分子發光。因此,熒光傳感材料是MOFs 重要的應用方向之一。刺激響應型MOFs 材料在光照[99]、溫度[100]、電磁[101]、pH[102]、力[103]等作用下可改變自身理化性質,從而將光、熱等信號轉化為化學信號。在眾多外界刺激作用下,光刺激具有非接觸、成本低、環境友好、易于操作等優勢而成為刺激響應型材料的研究焦點。在外界光刺激作用下,MOFs的分子結構、孔隙結構等發生改變,同時伴隨著物理化學性質的變化從而呈現不同的形態。MOFs 通常以光響應基團為配體,與金屬節點構成配位鍵進而通過自組裝的方式形成[104]。MOFs 結構中的光響應基團作為配體可分為可逆型及不可逆型。其中,不可逆型光響應配體對于外界環境中的光刺激僅做出一次反應,額外的光刺激并不能促使其恢復至初始狀態。可逆光響應配體則可進行可逆調控操作,從而使得MOFs實現在不同狀態之間的可逆切換。
根據幾種常見的光致異構化合物,可逆光響應MOFs可分為螺吡喃類[105]、偶氮苯類[106]、二芳基乙烯類[107]等。螺吡喃是光致變色分子的重要代表性化合物之一,受到研究人員的廣泛關注。總體來說,螺吡喃在光刺激作用下,由無色的閉環型轉化為有色的開環部華菁構型,當再次經過光刺激時其可逆地回歸初始無色閉環狀態[108]。螺吡喃在金屬離子傳感器、分子光開關材料、分離材料等方面展現潛在的應用價值[109]。例如Fleming 等[110]合成了基于螺吡喃的分子光開關,其特點在于可顯示3 種不同的光響應性質,可控制同一光致變色骨架上的順-反或者螺-部花青異構化的激活。Liu 等[111]通過原位生長的方法合成由螺吡喃包埋的MOFs 材料用作可光開關離子門控亞納米通道。偶氮苯類化合物是以氮氮雙鍵連接兩個苯環作為基本結構的光響應性分子,具有順式和反式兩種構型。當偶氮苯類化合物經過紫外光照處理后,氮氮雙鍵產生結構的變化,偶氮苯分子將從熱力學穩定的反式異構體轉化為不穩定的順式異構體[112]。偶氮苯類化合物在分子結構變化過程中,其物理化學性質隨之發生改變,表現為孔徑、顏色、形狀、溶解度、折射率等變化[113]。根據其產生相應的變化,具有偶氮苯側基的MOFs 常可用于藥物運輸、氣體分離等領域。例如,多孔的MOFs 用于氣體分子的吸附、可控釋放以及混合物的連續可調膜分離[114],光響應性的超分子囊泡用于靶向細胞內藥物遞送并可實現光照條件下的可控藥物釋放[115]。二芳基乙烯類化合物同樣是基于順反異構的光響應性分子,具備良好的熱穩定性以及抗疲勞性而在近年來逐漸成為研究熱點之一。由于二芳基乙烯類化合物異構變化前后,分子的吸收光譜變化較小具有部分重疊,使得其部分性能并不突出[116]。為了提升其光響應性能,研究者們主要對其分子中的核心部位烯橋進行改性或對分子的側基做修飾,例如引入弱芳香性基團噻吩、呋喃等[117]。該類MOFs材料通常在數據存儲等領域展現出可觀的應用價值[118]。Xiong團隊以基于二芳乙烯的鐵晶體為材料,實現了非接觸式的數據寫-讀-擦除數據存儲操作[119]。
微米級孔徑的MOFs 材料廣泛應用于氣體分離等領域,而納米級的材料已被證明可應用于包括熒光探針、藥物遞送在內的生物醫學領域[120]。其中,MOFs 以其多種優勢而在熒光納米探針領域備受關注[121]。MOFs 具備可調節結構和多功能性,通過調節金屬離子、有機配體、客體分子可使其適用于大多數被分析物質(如圖6)。通過添加劑的使用可調節MOFs 的孔徑及晶體結構從而調節其發光性能[122]。MOFs具有多孔結構可富集被分析物,增加熒光探針周圍被分析物的濃度[123]。當MOFs與其他熒光物質結合,可增強電子轉移作用從而提高熒光強度。當MOFs 同時封裝兩種熒光物質時,其成為比率型熒光探針,熒光探針的檢測準確度得到提高[124]。另外,相比普通熒光探針,MOFs 具備更好的耐熱、耐酸及耐堿性能[125]。

圖6 裝載不同模塊的MOFs材料用于對特定分子的測定示意圖[122]Fig.6 MOFs loaded with different molecular building blocks realize the sensing of specific molecules[122]
3.1 光響應金屬-有機框架的合成
由于MOFs 具有豐富的發光中心,其熒光通常基于金屬離子發光、有機配體發光、電子轉移發光以及負載在MOFs 中的客體分子發光。因此,MOFs 熒光納米探針的合成策略可分為兩大類:單獨的MOFs 作為熒光探針,可根據有機配體及金屬離子對被檢測物質產生特定的反應。另外,MOFs 可用于負載其他熒光物質,例如熒光染料、MNCs、QDs 等實現與被檢測物質的特定反應。對于單獨的MOFs材料作為熒光探針,其熒光特性可基于金屬離子、配體,例如配體-金屬電荷轉移躍遷(LMCT)、配體-配體電荷轉移躍遷(LLCT)、金屬-配體電荷轉移躍遷(MLCT)。基于LMCT 熒光機理,Wang等[126]通過調節Eu3+、Tb3+、Dy3+金屬離子比例,以3,5-二羧基苯基硼酸(5-bop)作為有機配體得到lab-on-MOFs材料,其與金屬離子、陰離子、小分子、生物大分子等不同目標物質相互作用后產生獨特的顏色變化,可用于多目標物質檢測。根據LLCT 熒光機理,Cornelio等[127]通過改變有機配體得到了具有不同發射光的MOFs材料MUF-77。
MOFs 可用于封裝分子熒光染料合成熒光探針。分子熒光染料(如羅丹明、異硫氰酸鹽等)以成本低、靈敏度高及易操作而廣泛應用于熒光探針、熒光成像等領域,是最常用的熒光物質之一。然而,分子熒光染料具有聚集誘導猝滅現象、光穩定性差、生物相容性低等缺點從而限制了其應用。通過將分子熒光染料封裝于多孔的MOFs材料可增加其穩定性,提高熒光傳感能力[121]。Ye等[128]將5-氨基熒光素負載于MOFs 材料MOF-801,可阻斷大分子的干擾從而增強探針的選擇性及生物相容性,探針可用于體外檢測ClO-。對于本身具有熒光傳感能力的MOFs 材料,將其封裝分子染料可得到比率型納米熒光探針。Zhang等[129]將羅丹明B負載于鋯-萘基MOFs合成比率型熒光探針,其對于水中Fe3+及Cr2O72-的檢測分別具有更高的選擇性及靈敏度。聚集誘導發光(AIE)熒光分子具有良好的生物相容性及抗光漂白性,近年來已有越來越多的AIE 材料被研究及應用。據推測,AIE 的基本原理可能是分子處于聚集態,分子內部運動限制從而使得激發態的電子以輻射躍遷的方式回到基態而產生熒光。將AIE 熒光染料封裝進MOFs 材料內部空腔進一步限制AIE 分子運動可得到一種新的熒光探針。基于MOFs 材料及AIE熒光分子,Lu等[130]合成的新型熒光探針具有更強的熒光傳感能力,可用于檢測Cu2+。
碳量子點(CQDs)作為一種具有優異光學性質的零維碳納米材料,具有較好的水溶性、成本低、原料來源廣、生物相容性好等優勢而廣泛應用于分析檢測、生物成像、藥物遞送等領域[131]。然而,在具體應用過程中,CQDs 可能存在聚集沉淀等現象而影響作用效果。CQDs 與MOFs 材料的復合可在一定程度上抑制其聚集作用,賦予其pH及溫度耐受性從而提高穩定性。根據熒光內濾效應以及熒光共振能量轉移原理,Wang 等[132]合成了CQDs@Eu-MOF 材料用于溶液中Cr(Ⅵ)的檢測。CQDs也可與其他熒光分子共同負載于MOFs 材料合成比率型熒光探針,可用于檢測兩種或多種物質,從而降低了實驗失誤率。Qin等[133]以MIL-53為基本框架,引入CQDs以及Eu3+合成可用于檢測尿液中二氨基甲苯的MOFs材料。除了CQDs外,Chen等[134]將巰基乙酸修飾的碲化鎘量子點與CQDs共同負載于ZIF-8從而避免二者聚集沉淀造成的熒光猝滅,所合成的復合MOFs材料可用于檢測抗壞血酸以及脫氫抗壞血酸。與CQDs類似,鈣鈦礦量子點的穩定性問題也可通過負載于MOFs 材料解決。Zhang 等[135]成功將鈣鈦礦量子點CH3NH3BbBr3封裝于MOF-5 中,所合成的材料可在30~230 ℃范圍內用于檢測水溶液中的多種金屬離子。
MNCs 雖然具有優異的物理化學性質,然而其具有較高的表面自由能從而存在一定程度的不穩定性,易產生不可逆聚集從而限制其應用。當AuNCs負載于MOFs材料中時,由于MOFs材料中有限的空間可限制AuNCs 的分子運動,具有更強的熒光強度及光穩定性。Xia 等[136]將AuNCs 引入ZIF-8 中得到的復合材料的量子產率及熒光壽命大幅提高,當熒光探針檢測膽紅素時,MOFs材料降解導致熒光強度顯著降低。Hu 等[137]將PEI 穩定的CuNCs 負載于ZIF-8 合成得到可用于檢測血清樣品中H2O2的熒光探針,并證實其在檢測葡萄糖氧化酶活性方面具有潛力。
鑭系金屬作為一類重要的發光材料,其熒光發射峰位覆蓋從紫外光到紅外光的極寬光譜范圍,不僅具備長發光壽命、大Stokes 位移、窄帶發射等優勢,還表現出可調的配位行為,在光學材料、熒光探針、生物成像等領域得到了廣泛應用。當鑭系金屬封裝在MOFs 材料中,有機配體可作為天線吸收激發光能量,之后將能量傳遞給鑭系金屬離子從而實現高效熒光發射[138]。基于稀土元素構建的MOFs熒光納米探針具有獨特的發光機理,稱為“天線效應”:通過有機配體吸收能量至激發態,之后能量轉移至稀土元素發光。與其他配合物相比,基于鑭系金屬配位聚合物的MOFs 熒光納米探針的發光性能具有更好的可調控性。這可能是因為鑭系金屬MOFs 材料的熒光性能可通過多種途徑進行調節,例如中心離子的配位環境、主客體相互作用、主體框架孔結構等。自2004 年首次報道稀土MOFs 材料用于金屬離子(如Ag+、Zn2+等)的檢測后,基于稀土的MOFs熒光納米材料研究逐步成為熱點。Liu等[139]報道了首例瀾系金屬MOFs 材料用于檢測Ag+。Zhang 等[140]合成具有良好生物相容性的Eu3+/Ag+@UiO-66-(COOH)2用于檢測肺中H2S,通過負載稀土復合光敏劑Ag+后可有效增強Eu3+的發光性質。Li等[141]合成可測定ClO-以及DPA 的高效多功能熒光探針。首先合成的NH2-HPU-17 中功能氨基對于ClO-具有響應性,可使MOFs 材料由藍色轉化為黃綠色。另外,NH2-HPU-17可用于負載Tb3+并增強其在水溶液中的熒光特性,從而實現檢測DPA 的目的。Wang 等[142]合成了兩種鑭系Lu及Y 納米多孔MOFs材料,將Eu+以及Tb3+引入Lu-MOF 合成雙發射比率型熒光探針用于檢測抗生素奧硝唑以及羅硝唑,所合成的YMOF熒光探針用于檢測血清中阿米巴肝膿腫的生物標志物C反應蛋白自身抗體。
3.2 光響應金屬-有機框架的應用
MOFs材料在熒光納米探針領域已得到廣泛應用,常用于金屬離子、陰離子以及小分子的檢測。作為熒光納米探針使用的MOFs 材料主要通過兩種方式構建:以具有光響應性的金屬離子/簇構建單獨的熒光MOFs 或以MOFs 為原料封裝光學活性客體。由于MOFs 材料具有高孔隙率、大比表面積、孔徑可調節以及可剪裁等優勢,可用于精確識別、吸附目標分析物。對于部分有機物質,由于其分子較小且其含有的氨基、羥基等基團可與MOFs材料中的有機配體產生分子間作用力,因而MOFs材料對于目標物質具有較好的靈敏度和選擇性。MOFs材料的熒光性能受多種因素影響,如配位環境、溫度、主客體相互作用等,當主客體發生超分子相互作用時導致MOFs 材料的電荷分布發生改變,進而導致該熒光納米探針的發射光譜波長、熒光強度及壽命等發生改變,從而實現對目標物質的檢測。MOFs材料對于目標物質的檢測主要通過熒光猝滅及熒光增強的方式進行。對于熒光猝滅型MOFs,當其與客體分子相互作用后特征性熒光降低或消失,因此待測物質的濃度較高時則幾乎難以檢測到熒光變化,故檢測限相對較高,對檢測某些具有熒光猝滅性質的物質(Cu2+、Hg2+)具有良好的應用價值。增強型熒光探針則相反,其本身無熒光或只有很弱的熒光,當其與客體分子相互作用時熒光增強,熒光信號的變化更易有效檢測。
MOFs材料在金屬離子檢測領域已有廣泛應用,例如過渡金屬離子、堿金屬離子等。對于Hg2+以及CH3Hg+的選擇性檢測,Chen等[143]合成了配位聚合物[Zn(ppvppa)(1,4-NDC)]n,通過吡啶上的氮原子可實現對上述兩種離子的選擇性檢測。此外,Wang 等[144]合成了BA-Eu-MOF 增強型熒光探針實現對Hg2+以及CH3Hg+的高效檢測。對于堿金屬離子,Huang 等[145]合成了猝滅型熒光探針用于K+的檢測,由于金屬陽離子與N、O 原子配位能力降低從而產生分子內電荷轉移效應,導致MOFs材料的熒光性質降低。基于2-Eu的熒光增強作用,Wang等[146]合成了增強型熒光探針Ln-MOFs用于Mg2+的檢測。
陰離子在環境科學、生物醫藥等領域扮演重要角色,近年來,對于陰離子的檢測越來越受到研究人員的重視[147]。基于此,Yao等[148]合成了熒光猝滅型MOFs材料Zn-Ⅱ-MOF材料(即NUM-5),其對于水溶液中Cr2O72-以及CrO42-具有高選擇性、快速響應特征,檢測限分別為0.7、0.3 ppm。Li 等[149]在MOFs 腔內組裝熒光團以及識別基團(即蒽基基團和含半花菁的CN-連接體),CN-與半花菁的選擇性結合抑制了兩者之間的能量轉移,從而導致熒光增強,所合成的熒光探針對CN-的檢測限可達0.05 μmol/L(如圖7)。Yang等[150]報道通過硼酸調節鑭系金屬MOFs材料的光學性質制備比率型熒光探針并用于水溶液中F-檢測,檢測限為2 μmo/L。當F-離子濃度增加時,在275 nm光激發下Eu-MOF1在366 nm波長的熒光增強,而在625 nm 波長的熒光減弱,且熒光顏色由紅色轉變為藍色。Yang 等[151]將具有固有熒光的氨基衍生物用于選擇性地檢測水溶液中的PO43-,MOFs材料中的Zr-O 節點對于PO43-具備很強的捕獲能力。在UiO-66-NH2MOFs 材料中,Zr-O 以及BDC-NH2分別為PO43-識別位點及信號報告基團,且幾乎不受其他離子干擾,具有良好的選擇性。MOFs熒光納米材料除了可檢測水溶液中的陰離子外,還可用于含水量的檢測。傳統檢測固體或液體樣本中含水量的方法為Karl Fischer 滴定法,具有操作相對繁雜、成本高的不足。使用MOFs 材料可構建基于稀土元素的雙色比率熒光傳感器,通過熒光變化實現對含水量的快速檢測。

圖7 多組分MOFs材料“turn on”型熒光探針設計示意圖(A)以及含有蒽和半花菁基團的MOFs材料合成路線圖(B) [149]Fig.7 Schematic representation for the design of a turn-on fluorescence sensor in multicomponent MOFs(A) and synthetic routes of MOFs with anthracene and hemicyanine moieties(B) [149]
通過選擇合適的有機配體、金屬節點或修飾方式,MOFs 材料可廣泛用于有機小分子檢測。2007年Chen 等[152]采用發光MOFs 材料檢測有機小分子,稀土MOFs 材料EuBTC 可高效檢測水中的有機小分子DMF 及丙酮分子。Du 等[153]選擇PCN-224 為識別單元,AgNPs 同時作為猝滅劑及H2O2的識別單元合成了一種可用于檢測葡萄糖的熒光納米探針。AgNPs 與在GOx 催化氧化葡萄糖過程中產生的H2O2反應生成Ag+并從PCN-224中釋放出來,從而恢復PCN-224的熒光性質。Hao等[154]首次使用鑭系MOFs材料用于人類尿液樣本中1-羥基芘的檢測,其熒光性質可通過熒光共振能量轉移過程被1-羥基芘猝滅。Hu等[155]合成了多孔且可高效發射強藍光的猝滅型熒光探針LMOF-241 用于檢測黃曲霉毒素B-1,由于熒光探針的孔徑大于黃曲霉毒素B-1 且電子可轉移至被檢測物質,黃曲霉毒素B-1 可進入LMOF-241 發生反應并產生熒光猝滅效應。Dong 等[156]通過在銀硫簇基MOFs 材料的連接體中引入氨基基團實現了來自同一連接體發色團的雙熒光-磷光發射,并實現了超快雙功能熒光開關,由O2觸發熒光關閉,由揮發性有機化合物觸發熒光開啟。
由于MOFs 材料的熒光性質受到溫度、溶劑、客體分子等多方面因素影響,通過調節配體分子結構和中心離子的類型可設計具有不同熒光發射波長的探針,因此,MOFs材料可應用于多種物質、多領域的熒光檢測。然而,多數MOFs 材料是由非極性的芳環構成的配體,在水溶液中分散性不佳是導致其在水相中應用受限的重要原因。通過設計合成能穩定分散于水相的MOFs 材料將對拓展其在分析檢測領域的應用具有重要意義。
4 其他熒光納米探針
除上述熒光納米探針外,隨著納米材料科學的發展,也發展了其他熒光納米探針如稀土熒光納米探針、碳量子點(CQDs)等。其中,稀土摻雜熒光納米探針被稱為最具應用潛力的近紅外二區納米探針。稀土離子特殊的4?-4?電子層賦予其優異的光學性能,稀土熒光納米探針具有發射寬度窄、Stocks位移大、熒光壽命長、生物相容性較好等優勢,有利于實現高質量熒光成像。然而其仍面臨吸收截面小、發光效率低、表面缺陷會導致熒光猝滅等問題[157]。稀土熒光納米探針的熒光來源于稀土離子的4?電子發生能級躍遷,由于4?電子的組態分裂且能級結構豐富,使得其發射范圍可覆蓋紫外區到短波近紅外區(200 ~1 700 nm),且由于稀土離子的4?電子發生躍遷受到外層電子屏蔽作用,表現出較窄的發射譜線以及良好的正交性[158]。稀土熒光納米探針僅涉及離子能級的躍遷,因而其穩定性較好、抗光漂白能力優異[159]。此外,稀土離子(例如Yb3+及Nd3+)可吸收近紅外激發光能量并由于自身的輻射弛豫傳遞給其他離子發光。稀土熒光納米探針主要由基質材料(通常為光學惰性且晶格聲子能量低的物質)、敏化劑(需具備較大的吸收截面)及發光中心(正三價稀土離子)組成。該熒光納米探針的敏化主要通過摻雜合適濃度的稀土離子、與有機染料或量子點復合來實現。摻雜合適的稀土離子是提升熒光納米探針發光性能的核心要素。適當增加稀土離子濃度有助于增加吸收截面,然而由于稀土離子之間存在交叉弛豫現象,稀土離子濃度過大可能造成熒光猝滅。由于有機染料等材料具有吸收截面較大的優勢,因此可用于敏化稀土摻雜的熒光納米探針。另外,功能化的有機染料也便于賦予熒光納米探針額外的生物功能。有機染料作為敏化劑要解決光漂白、與稀土離子光重疊度不高等問題,且多數有機染料的激發波長低于1 000 nm 不利于實現深層組織的生物成像[160]。稀土摻雜的熒光納米探針常采用核殼結構,內部核結構常含有敏化劑及發光中心,外殼層為多層惰性或活性殼層,其中惰性殼層主要用于阻隔殼層之間的能量傳遞及鈍化表面缺陷,通過核殼結構設計可調節殼層之間的能量傳遞過程從而提升其發光性能、延長熒光壽命等。常用的稀土熒光納米探針合成方法主要包括共沉淀法、熱分解法以及水/溶劑熱法等。共沉淀法應用較早,具有制備成本低、工藝簡單、效率高、反應條件溫和等優勢,然而其制備的納米粒子存在較多表面缺陷。熱分解法制備條件相對復雜苛刻,需在氮氣保護下的300 ℃油酸/十八烯體系中進行反應,所制備的熒光納米探針不能直接應用于生物體系。而水/溶劑熱法操作簡單,可在相對溫和的反應條件下通過“一鍋法”制備得到結晶度較高的熒光納米探針。雖然稀土摻雜熒光納米探針具有上述諸多優勢,然而其仍面臨應用局限,未得到實際臨床應用。其存在的主要共性問題有水溶液中的分散穩定性差、量子產率和組織穿透深度不夠。由于稀土摻雜熒光納米探針尺寸較小且制備過程中反應體系多為有機溶劑,導致其易發生團聚。由于稀土摻雜熒光納米探針存在濃度猝滅效應,使得量子產率無法持續提升。而低量子產率導致熒光納米探針的組織穿透深度不足以達到臨床應用要求。
CQDs作為近些年新型的熒光納米材料引起科研工作者的廣泛關注。與上述傳統QDs相比,其粒徑較小有利于應用于細胞體系,而生物相容性則明顯優于QDs,可作為一種理想的熒光納米探針應用于分析檢測、生物成像以及生物傳感等領域。CQDs表面豐富的氨基以及羧基等親水性基團可賦予其優異的水溶性。此外,與其他熒光納米探針相比,CQDs 的熒光性質表現出以下特征:首先,CQDs 的熒光發射峰位置以及強度隨激發波長改變。其次,CQDs具備上轉換發光優勢,更適合應用于生物體內的成像及檢測。另外,CQDs可通過單波長激發后產生兩次以上的熒光發射,從而實現利用兩個以上熒光峰的信號變化進行物質的比率檢測。CQDs制備方法簡單、原料廉價易得,成本較低,易應用于生物醫學領域。通常CQDs的制備方式可分為“自上而下法”和“自下而上法”兩類。一般情況下CQDs的合成需經歷脫水、聚合、碳化及鈍化等過程。“自上而下法”是通過化學或物理法將大尺寸的碳材料制備為小尺寸的CQDs,例如通過應用電弧放電法、電化學法以及激光燒蝕法等。“自下而上法”則是以更小尺寸的碳材料為前驅體制備CQDs,采用的方法有微波法、模板法以及水熱溶劑法等。制備方法的差異使得CQDs的熒光性質不盡相同,由于CQDs具有原料來源廣泛、生物相容性較好、易于制備等優勢使得其可作為熒光納米探針而在生物醫學領域具有廣泛應用。CQDs的單發射熒光探針可通過與目標物質發生相互作用引起熒光猝滅或重新恢復熒光從而實現對目標物質的定量檢測。比率型熒光探針則可通過兩個或兩個以上的不同發射波長下的熒光強度從而降低測定誤差。比率型CQDs 熒光納米探針主要分為納米復合探針以及雙發射熒光探針。納米復合探針可通過引入其他熒光材料(如有機熒光染料、MOFs 等材料)與CQDs 通過物理或化學方式結合構建比率型熒光納米探針。雙發射熒光探針則通過合成具有雙波長熒光峰的雙發射CQDs 進行比率熒光檢測,其在單一激發波長的作用下產生兩個不同發射波長峰,相比納米復合探針,其操作過程更簡便[161]。然而,CQDs 仍存在缺陷,例如其熒光量子產率低于QDs,發射光譜寬,發射波長接近于藍光區從而易受到生物體自發熒光干擾。
5 總結與展望
本文主要介紹了目前研究較多的QDs、MNCs、MOFs 及其他熒光納米探針,闡述其基本組成、主要合成方法以及應用(不同種類熒光納米探針的性質比較見表1)。QDs較為常用的合成方法可分為有機相合成法及水相合成法,MNCs 的合成策略可分為自下而上法以及自上而下法,MOFs熒光納米探針的合成策略為單獨的MOFs或負載其他物質。QDs的熒光強度及光穩定性等優于傳統有機染料,隨著其與不同分子連接技術的成熟,QDs 可作為有機熒光染料的有效補充替代,將在當前熱門的生物醫學領域(如基因組學、蛋白質組學以及體內目標物質的檢測等方面)具有廣闊的應用前景。而與傳統有機染料及QDs相比,MNCs 具有粒徑小、尺寸依賴及可調控熒光、生物相容性較好等優勢。MNCs已發展成為一類新興的超小型、具有優異生物相容性的熒光納米材料,其在生物標記以及光電發射器等領域均有發展前景。MOFs材料具有高度可定制、豐富的化學功能性等特點,近年來逐漸成為研究熱點,其在化學傳感、物質吸附及分離、化學催化等領域均有應用,在小分子及生物大分子檢測、細胞成像、活體診斷等領域具有廣闊的應用前景。

表1 不同種類熒光納米探針的基本性能及其優缺點Table 1 The properties,advantages and disadvantages of different types of fluorescent nanoprobes
近年來納米科學的研究及應用為納米生物光子學的發展帶來新機遇,尤其是熒光納米探針對于重大疾病的診斷及特定物質的識別和分析。通過借助納米材料獨特的物理化學性質,利用熒光納米探針可實現對細胞以及特定分子的定位、標記及檢測,逐漸成為化學傳感、生物醫學研究中的有力工具。為了進一步發展熒光納米探針以將其從實驗室推廣至大規模應用,需要開發簡單、低成本的合成方法以及設計具備高量子產率、優異穩定性和生物相容性的熒光納米探針。此外,熒光納米探針的生物安全性問題仍需重點關注,開發不依賴于重金屬離子的高質量熒光納米探針仍是研究熱點之一。熒光納米探針的物理化學性質與眾多因素有關,例如粒徑、組成成分、合成條件等,因此需要更好地理解熒光納米探針的化學組成、表面性質、納米結構,從而更好地推動熒光納米探針的發展。在合成性能優良的熒光納米探針的基礎上,利用熒光納米探針建立靈敏度高、選擇性好的分析測試方法是研究人員的關注點之一。展望未來,雖然熒光納米探針與大規模生產及應用仍有一定距離,但隨著新穎納米材料的研發及相關光子學技術的進步,更多具備優異性能的熒光納米探針將被合成,同時,借助設計熒光納米探針的獨特性質從而促進檢測手段不斷豐富和多元化。

