身體質量指數聯合三酰甘油與高密度脂蛋白膽固醇比值預測2型糖尿病風險
雷慶華,李軍華,霍燕飛,郭子靜,李霞,李宗虎
作者單位:邯鄲市中心醫院體檢中心,河北 邯鄲056000
近年來,2 型糖尿病(type 2 diabetes mellitus,T2DM)的發病率在全球范圍內穩步上升,中國人口眾多,是T2DM的大國,2017年的糖尿病患病達到了11.2%,并且90%是T2DM[1]。與非T2DM 病人相比,T2DM 病人發生心腦血管事件、眼底疾病、糖尿病腎病和外周血管疾病的風險及病死率更高[2]。先前的臨床試驗已經證明,個體化干預可有效減少或延緩高危人群中T2DM 的發病[3]。因此,識別T2DM 風險較高的人群,給予早期干預,可以降低醫療成本,提高生活質量。因此,需要一種新穎、準確且簡單的預測指標來識別T2DM的高危人群。
機體的β 細胞功能障礙和胰島素抵抗(insulin resistance,IR)均與T2DM 的發病有直接關系。此外,已有研究表明,血脂異常,例如三酰甘油(triglyceride,TG)升高或高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)水平低都能導致血糖異常[4]。高甘油三酯血癥可導致IR 和隨后的惡性循環后果,其中代償性高胰島素血癥和IR 可進一步加劇高甘油三酯血癥[5]。另一方面,一些臨床觀察表明,HDL-C 與糖尿病風險呈負相關[6]。目前有研究使用三酰甘油與高密度脂蛋白膽固醇(TG∕HDLC)的比值來預測T2DM 的發生,我們在臨床工作中發現,身體質量指數(body mass index,BMI)會影響TG∕HDL-C 與T2DM 的關系。所以本研究分析BMI聯合TG∕HDL-C對T2DM的預測作用。
1 資料與方法
1.1 一般資料選取瑞慈醫療集團2010—2016 年體檢人群的體檢數據庫[7],所有納入研究的人群至少兩次隨訪,且隨訪間隔大于2 年。排除基線時有缺失值、基線時診斷為糖尿病、隨訪時未確定是否患有糖尿病的參與者。最后,共納入研究對象13 685 例。糖尿病診斷標準參見《中國2 型糖尿病防治指南(2020年版)》[1]。根據該診斷標準,隨訪結束時共有315 例診斷為T2DM。病人或其近親屬知情同意,本研究符合《世界醫學協會赫爾辛基宣言》相關要求。。
1.2 方法我們記錄如下信息:年齡、性別、BMI、TG、HDL-C、血壓、天冬氨酸轉氨酶(AST)、丙氨酸轉氨酶(ALT)、血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine, Cr)、總膽固醇(total cholesterol,TC)、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)、空 腹 血 糖(fasting blood glucose,FPG)、吸煙史、飲酒史、T2DM家族史和隨訪結果(是否患T2DM)。以BMI=24 kg∕m2作為分界點,將所有納入研究的人群分為兩個亞組:BMI<24 kg∕m2亞組和BMI≥24 kg∕m2亞組。其中BMI<24 kg∕m2亞組共有8 238例,96例研究對象在隨訪結束時患T2DM;BMI≥24 kg∕m2亞組共有5 447 例,219 例研究對象隨訪結束時患T2DM。根據TG∕HDL-C 的五分位數將研究人群分為五組,即Q1、Q2、Q3、Q4 和Q5 組。研究的終點定義如下:在隨訪期間,研究對象診斷為T2DM或截至隨訪結束時未出現終點事件。T2DM 事件的診斷標準參見《中國2型糖尿病防治指南》[1]。
1.3 統計學方法應用R 軟件(4.1.0 版本)進行統計分析。數據分為定量數據和定性數據,正態分布的定量數據用±s來表示,非正態分布計量資料采用中位數(第25、75百分位數)即M(P25,P75)表示,定性數據用例(%)表示。分別用單因素方差分析、Kruskal-Wallis 秩和檢驗、Pearsonχ2檢驗來分析每組間的差異是否有統計學意義。Cox 比例風險模型用于研究不同亞組間TG∕HDL-C 對T2DM 發生風險的影響,TG∕HDL-C 分別以連續變量和分組變量兩種形式代入模型。所有模型都分為不調整任何因素(原始模型),調整性別、年齡(模型Ⅰ)和調整性別、年齡、收縮壓、谷丙轉氨酶和肌酐(模型Ⅱ)共計3 個模型。繪制Kaplan-Meier 生存曲線以計算不同亞組間累積T2DM 發病率,并且通過限制性立方樣條模型評估不同亞組間TG∕HDL-C 與T2DM 發病率之間非線性關系。
2 結果
2.1 一般資料比較在最終納入研究的13 685 例受試者中,至隨訪結束共有315 例(2.3%)診斷為T2DM。如表1 所示,在這13 685 例受試者中,男性7 396 例(54.0%),女性6 289 例(46.0%),年齡44.06 歲,TG∕HDL-C 為1.06。根據TG∕HDL-C 的 五分位數,將研究人群分為五組:Q1 組,TG∕HDL-C為0.37±0.07(n=2 737),Q2 組,TG∕HDL-C 為0.58±0.06(n=2 735),Q3 組 的TG∕HDL-C 為0.82±0.08(n=2 736),Q4 組 的TG∕HDL-C 為1.20±0.15(n=2 740),Q5 組 的TG∕HDL-C 為2.35±1.01(n=2 737)。見表1。

表1 糖尿病13 685例一般資料比較
2.2 BMI<24 kg/m2 亞 組中TG 與HDL-C 比 值 與T2DM 發病率之間的關系在BMI<24 kg∕m2的人群中,TG 與HDL-C 比值,與T2DM 發病率之間的關系見表2。在未調整任何變量的模型中,T2DM 發病率隨著TG 與HDL-C 比值的升高而顯著增加[HR=1.67;95%CI:(1.48,1.89);P<0.01]。將TG∕HDL-C分成五組,以第一組為參照,隨著組別的升高,T2DM 發生的風險呈上升趨勢(趨勢P<0.01)。原始模型未調整任何混雜因素,模型Ⅰ調整了性別和年齡,模型Ⅱ在模型Ⅰ的基礎上調整了收縮壓、谷丙轉氨酶和肌酐,3個模型的結果類似。見表2。
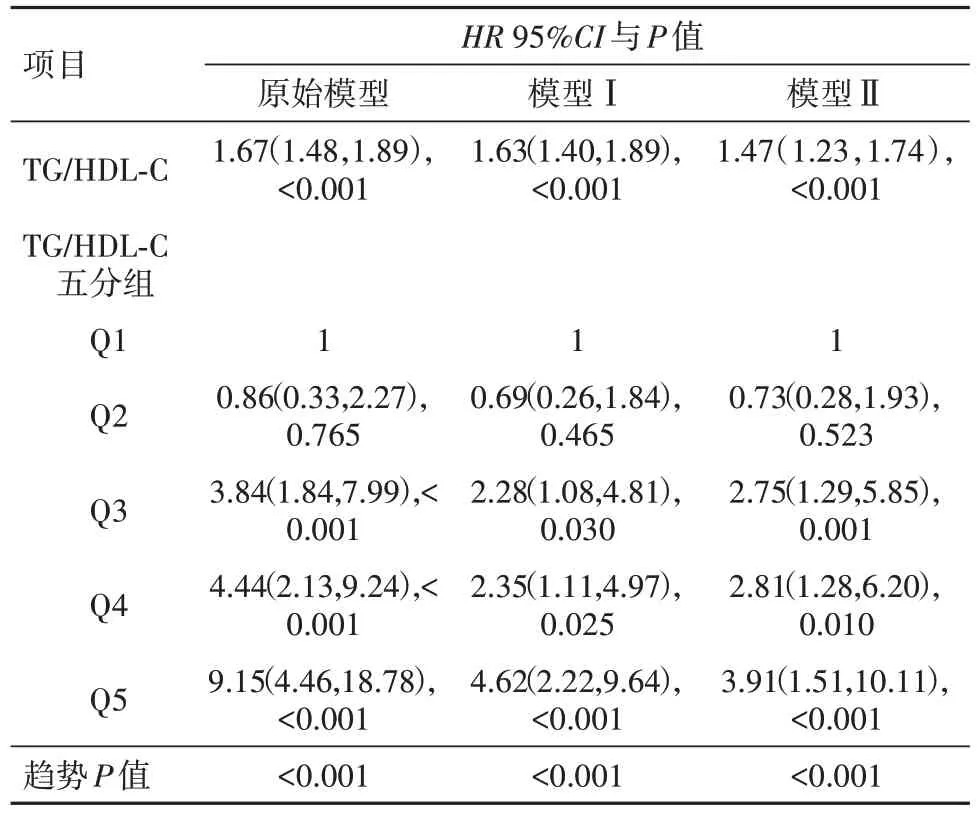
表2 BMI<24 kg∕m2亞組8 238例TG∕HDL-C與T2DM發病風險的關系
2.3 BMI≥24 kg/m2 亞 組中TG 與HDL-C 比值 與T2DM 發病率之間的關系在BMI≥24 kg∕m2的人群中,TG 與HDL-C 比值,與T2DM 發病率之間的關系見表3。在未調整任何變量的模型中,T2DM 發病率隨著TG 與HDL-C 比值的升高而顯著增加[HR=1.84;95%CI:(1.07,1.31);P<0.01]。將TG∕HDL-C分成五組,以第一組為參照,隨著組別的升高,T2DM 發生的風險呈上升趨勢(趨勢P<0.01)。原始模型未調整任何混雜因素,模型Ⅰ調整了性別和年齡,模型Ⅱ在模型Ⅰ的基礎上調整了收縮壓、谷丙轉氨酶和肌酐,在后兩個模型中,隨著TG∕HDL-C 的增加,T2DM發病率差異無統計學意義。見表3。

表3 BMI≥24 kg∕m2亞組5 447例TG∕HDL-C與T2DM發病風險的關系
2.4 兩亞組的交互作用根據BMI=24 kg∕m2的切點值,將BMI 分為兩個亞組,TG∕HDL-C 與BMI 的交互作用P<0.01。
2.5 兩亞組T2DM 患病率比較在隨訪期間共有315 例(2.3%)研究對象患T2DM。Q1、Q2、Q3、Q4 和Q5 的T2DM 分別為0.6%(n=17),1.0%(n=27),2.0%(n=55),3.3%(n=90)和4.6%(n=126)。隨著時間延長,BMI<24 kg∕m2和BMI≥24 kg∕m2的亞組患T2DM的人數均增加,且Q1、Q2、Q3、Q4 和Q5 五組中T2DM的患病人數增加均差異有統計學意義(分別為P<0.001和P=0.013)。見圖1。

圖1 非糖尿病體檢人群患2型糖尿病的風險:1A為BMI<24kg/m2組;1B為BMI≥24kg/m 2組圖2非糖尿病體檢人群TG/HDL-C與T2DM發病率的曲線關系:2A為BMI<24kg/m 2組8238例;2B為BMI≥24 kg/m 2組5 447例
2.6 TG/HDL-C 與T2DM 發病率的曲線關系我們通過使用限制性立方樣條分析評估了TG∕HDL-C與T2DM 發病率之間的非線性特征。在對性別、年齡、收縮壓、谷丙轉氨酶和肌酐進行調整后,我們可以看到:隨著TG∕HDL-C 的升高,T2DM 發病的風險逐漸升高并呈現曲線相關性(BMI<24 kg∕m2亞組增長稍快,BMI≥24 kg∕m2亞組增長較慢)。見圖2。
2.7 兩個亞組中ROC 曲線我們繪制了兩個亞組中,以TG∕HDL-C 分別預測3 年和5 年T2DM 發病的ROC 曲線、截斷值(BMI<24 kg∕m2:3 年為0.72、0.90;5 年為0.77、0.71。BMI≥24 kg∕m2:3 年為0.55、1.08;5年為0.57、1.05)。
3 討論
TG∕HDL-C 在預測T2DM 發病率方面顯示出相當大的敏感性和特異性[8]。本研究將研究人群根據BMI 分為兩組,探討BMI 聯合TG∕HDL-C 預測T2DM發病風險,結果發現:兩組人群中,隨著TG∕HDL-C的增加,T2DM 發病風險均呈非線性增加,這一變化在BMI<24 kg∕m2的人群中更顯著。
血脂異常對T2DM 發展的影響已在之前的研究中得到充分證實。已經發現 TG∕HDL-C 比值是胰島素抵抗和β 細胞功能障礙的潛在預測標志物[9]。最新研究表明,葡萄糖穩態與脂質代謝密切相關。較高的TG∕HDL-C、TG 和較低的HDL-C 可加速T2DM的發展和進展[10]。在沒有診斷出T2DM 的健康個體中,胰腺脂質含量沉積增加可能導致β 細胞功能障礙增強[11]。胰腺三酰甘油儲存的減少可能有助于T2DM 中β 細胞功能和胰島素敏感性的正常化。高脂血癥通過誘導胰腺β 細胞凋亡、下調胰島素的生物合成和分泌以及糖代謝異常來促進T2DM 的發展。這些結果與脂肪酸代謝異常有關,包括脂質沉積、內質網應激、炎癥反應、氧化應激和胰島素信號傳導缺陷,最終導致β 細胞損傷和凋亡[12]。相反,HDL-C 已被證明是一種潛在的抗糖尿病因子,可改善胰島素抵抗和β 細胞功能障礙[13]。另一方面,在胰島素抵抗或高胰島素血癥的T2DM 病人中,過量的胰島素分泌可以調節脂蛋白脂肪酶和載脂蛋白的產生以及膽固醇酯轉移蛋白的功能,從而進一步促進糖尿病血脂異常的進展[14]。因此,IR、β 細胞功能障礙、TG 和HDL-C 的惡性循環可顯著增加T2DM發病和進展的風險。
高的BMI 是眾所周知的IR 風險因素[15],而IR是T2DM 發生發展過程中關鍵的一環[16]。不同BMI的人脂肪的含量是不同的,脂肪組織的特點是乳糜微粒的清除減少和胰島素介導的脂解抑制受損,這可能導致IR[17]。因此,身體脂肪的含量和IR之間存在直接聯系,而IR 則直接影響了T2DM 的發生和疾病進程。本研究就是探討不同的BMI 狀態下,TG∕HDL-C 和T2DM 的關系。結果顯示在BMI<24 kg∕m2的亞組中,隨著TG∕HDL-C 增加或組別的升高,T2DM 的發病風險均增加,在BMI≥24 kg∕m2的亞組中,在未調整任何混雜因素的情況下,TG∕HDL-C 每升高一個單位,T2DM 的發病風險變為原來的1.84倍。但在調整潛在的混雜因素后,隨著TG∕HDL-C的升高,T2DM 的發病風險的增加無統計學意義。既往文獻也報道了不同的BMI 人群中,TG∕HDL-C與T2DM 發病風險的不同[8,18]。但是對其中的機制并未進行更多的探討,我們分析可能在高BMI 的人群中,IR較嚴重,故血脂水平的變化對T2DM的發病風險影響相對較小。
我們進一步使用非限制性立方樣條模型探討了不同的BMI 分組下TG∕HDL-C 與T2DM 發病風險的非線性相關性。我們發現在兩個亞組中,隨著TG∕HDL-C 的增加,T2DM 發病風險均升高,并且升高的速度是非線性的,先快后慢。在BMI<24 kg∕m2的亞組中,T2DM 發病風險增加得較快,在BMI≥24 kg∕m2亞組中,增加得較慢。先前的研究表明,一些預測因子的異常,包括血壓、體重指數、三酰甘油、高密度脂蛋白膽固醇、低密度脂蛋白膽固醇和空腹血糖,不僅與T2DM 獨立相關,還與其他疾病如心血管疾病、腦血管疾病、心力衰竭和與這些疾病相關的病死率增加有關[19]。我們繪制了在BMI<24 kg∕m2和BMI≥24 kg∕m2兩個亞組中,以TG∕HDL-C 分別預測3 年和5 年T2DM 發病的ROC 曲線,結果發現在BMI<24 kg∕m2亞組中,ROC 曲線下面積均高于0.70,尤其在5年的ROC曲線中,曲線下面積達到了0.77,提示在該亞組中TG∕HDL-C 對T2DM 的發病有很強的預測作用。但是在BMI≥24 kg∕m2的亞組中,ROC曲線下面積均低于0.60,提示在該亞組中TG∕HDL-C與T2DM 的發病風險關聯較弱。我們在臨床工作中很容易獲得病人的血脂,在BMI<24 kg∕m2的人群中,要關注這些病人的TG∕HDL-C,因為這部分人群有較高的患T2DM的風險。
總之,TG∕HDL-C 的升高對T2DM 患病具有一定的預測價值,尤其在BMI<24 kg∕m2的人群中。本研究是回顧性研究,病人沒有口服葡萄糖耐量試驗,所以可能會造成T2DM 的漏診此外,隨訪期間,TG和HDL-C 缺失比較嚴重,所以我們沒有分析TG∕HDL-C 的動態變化與T2DM 的關系。我們使用的是公共數據庫,里面沒有腰圍、臀圍等數據,所以我們分析的指標有一定局限性,下一步我們將進一步完善相關數據,加強前瞻性隨訪,以驗證結果。
(本文圖1,2見插圖1-1)

