專用擴張器在耐高壓注射型經外周靜脈置入中心靜脈導管置管穿刺術中的應用研究*
項小燕,欽曉英,朱 薇,黃培培,盧 琪,張 燁,崔智萍
浙江省人民醫院·杭州醫學院附屬人民醫院,浙江 杭州 310014
耐高壓注射型經外周置入中心靜脈導管(Power PICC)采用強化聚氨酯材料制成,能夠提高導管可耐受壓強程度,除了能夠滿足臨床靜脈輸液治療的需求,還兼具中心靜脈壓監測或造影劑高壓團注的功能[1]。因此,近年來,該類型導管被廣泛運用于臨床中。隨著醫學技術的發展,超聲引導技術被用于靜脈置管操作中[2-4],PICC導管穿刺技術也從傳統的盲穿技術發展至采用B超引導,行改良塞丁格穿刺技術(MST)進行導管穿刺,此技術除了能夠準確定位預穿刺靜脈的位置,還能夠根據血管直徑、血管與周邊組織關系等情況,制定最佳超聲引導方法(包括橫軸、縱軸或斜軸平面),避免誤穿動脈、損傷神經等情況的發生,提高穿刺成功率,減少穿刺并發癥[5-7]。但該技術中的擴皮送鞘操作,尤其是傳統的擴皮刀擴皮技術,容易損傷穿刺點周圍的組織或毛細血管,增加置管后24 h穿刺點出血量和帶管期間穿刺點滲液的發生率[8]。穿刺點出血、滲液會增加計劃外維護次數、術后并發感染及導管滑脫的發生風險,加重患者經濟成本及時間成本,給患者帶來困擾[9]。在臨床實踐中,醫護人員應積極探索更加安全的擴皮操作技術,其中采用微插管鞘組件的內鞘擴張穿刺點的鈍性分離法得到廣泛應用[10-15],但此技術在置管過程中也存在鈍性分離失敗等問題。基于此,本研究旨在探討專用擴張器在Power PICC置管穿刺術中的應用效果,現報告如下。
1 資料與方法
1.1 一般資料
選擇2020 年1 月—12 月浙江省人民醫院收治的B 超引導下結合MST 行Power PICC 置管穿刺術的100 例肺癌患者作為研究對象,按隨機數表分為實驗組和對照組,每組各50 例。實驗組:男40 例,女10 例,平均年齡(56.54±10.02)歲;貴要靜脈置管30 例,肱脈置管17 例,頭靜脈置管3 例;左上肢置管29 例,右上肢置管21 例。對照組:男35 例,女15 例,平均年齡(56.86±10.17)歲;貴要靜脈置管34 例,肱脈置管16 例;左上肢置管26 例,右上肢置管24例。兩組患者一般資料具有可比性(P>0.05)。本研究經醫院醫學倫理委員會批準通過。(1)納入標準:①符合PICC 置管指征,愿意參加本研究并簽署知情同意書。②年齡在18周歲以上。③選擇上臂B超引導下MST置管。④凝血功能正常。⑤置管后7 d 內均在樣本醫院進行維護。(2)排除標準:①意識不清,精神失常,無法進行語言溝通或失語。②凝血功能異常。③置管后7 d 內拔除PICC 導管。④PICC 導管異位,包括胸部X 片定位異位及置管過程中反復異位。
1.2 方法
由科室取得PICC置管資質的1名靜療專科護士進行超聲引導下行MST 置入PICC,并嚴格按照樣本醫院PICC 置管操作規程進行。入組患者均選擇上臂中段部位進行置管,并選用相同廠家生產的前端開口式單腔Power PICC。按常規評估上臂血管及相關檢查,測量導管體外長度,消毒上臂皮膚,鋪巾,建立最大化無菌屏障。在超聲引導下于穿刺點處用2%利多卡因0.2 mL 進行局部麻醉后,使用穿刺針穿刺,穿刺成功后放入導絲。(1)對照組:成功放入導絲后,將微插管鞘組件的內外鞘分離,先將導絲穿入內鞘,非慣用手繃緊穿刺點下方皮膚,慣用手順著導絲方向推進內鞘,使其前端錐形部分全部進入皮下后再退出,同時,非慣用手使用紗布按壓穿刺點,并固定導絲。慣用手將微插管鞘組件的外鞘與內鞘重新組合并穿過導絲,將組件全部送入血管后(若一次送鞘失敗,則改用手術刀縱向擴皮送鞘),修剪導管至預測量長度,再將內鞘及導絲安全撤出,保留外鞘在血管中,緩慢送入導管,確認導管功能,在超聲下排除導管異位。隨后采用腔內心電定位儀定位導管尖端位置(若心電圖P 波無明顯變化,則在置管結束后行胸部正位片定位導管尖端位置)。置管成功后穿刺點上方使用1 塊5 cm×5 cm 對折2 次(8 層)的無菌紗布覆蓋,以無菌透明貼膜(10 cm×10 cm)及思樂扣固定導管,穿刺點局部使用食指、中指、無名指共同按壓穿刺點上方近心端5 min。(2)實驗組:成功放入導絲后,采用7F 專用擴皮器(見圖1),將導絲穿入擴皮器,擴皮器前端3/4錐形部分進入皮下后,等待3 s退出,再將微插管鞘組件穿過導絲,并使其全部送入血管(若一次送鞘失敗,則改用手術刀縱向擴皮送鞘)。其余步驟同對照組。

圖1 7F專用擴皮器
1.3 評價指標
(1)安全性指標包括Power PICC置管中一次性送鞘成功率和置管后24 h出血量。一次性送鞘成功率是指一次鈍性分離后,一次性將微插管鞘組件送入血管即為成功,退出再次推送微插管鞘或需二次擴皮均視為不成功。術后24 h 穿刺點出血量以浸濕覆蓋于穿刺點上方的無菌紗布程度來判斷,滲血量(測量血液浸濕紗布的面積)評價標準具體如下。①0 級為無滲血。②I 級為紗布表面可見滲血,面積為<0.5 cm2。③Ⅱ級為紗布可見滲血,面積為0.5~1.0 cm2。④III級紗布可見滲血,面積>1.0 cm2。(2)經濟性指標包括Power PICC置管后7 d內換藥次數。置管后7 d內換藥次數是指統計置管7 d 內穿刺部位因出血、滲液過多引起的換藥次數。
1.4 統計學方法
采用SPSS 19.0 軟件進行統計分析。計量資料以均數±標準差(±s)表示,組間比較采用t 檢驗。計數資料用例數和百分比(%)表示,組間比較采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者一次送鞘成功率情況
實驗組一次性送鞘成功率顯著高于對照組,差異有統計學意義(P<0.05),見表1。

表1 兩組患者一次送鞘成功率情況
2.2 兩組患者置管后24 h 出血量及PICC 置管后7 d 內換藥次數情況
實驗組置管后24 h出血量情況優于對照組,差異有統計學意義(P<0.05)。兩組患者置管后7 d 內換藥次數比較,差異無統計學意義(P>0.05),見表2。
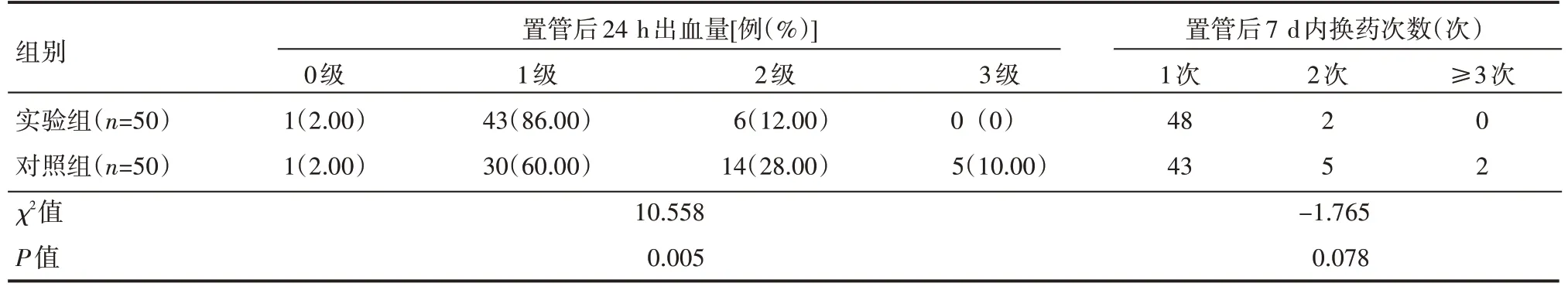
表2 兩組患者置管后24 h出血量及PICC置管后7 d內換藥次數情況
3 討論
Power PICC 具備多種臨床應用功能,真正體現了“一針式”導管的優勢。擴皮是其置管過程中必不可少的一個程序,雖然擴皮送鞘技術得到了不斷改進,但仍存在一次送鞘成功率不高、需要多次擴皮以及適用范圍局限等問題。因此,如何提高一次送鞘成功率、降低置管后相關并發癥的發生率、提高患者帶管舒適度是近年來臨床上不斷探索的問題。
3.1 采用7F專用擴皮器進行鈍性分離技術,可提高Power PICC微插管鞘組件一次置入成功率
Power PICC 置管操作過程中的送鞘是整個置管操作的重要步驟。微插管鞘組件的順利置入一般需要擴皮操作,擴皮的目的是在皮膚打開通道,以便管鞘順利穿過皮膚,進入血管。皮膚由表皮、真皮、皮下三層組織構成,有一定的強度,也有毛細淋巴管盲端位于其中[7]。為了順利穿過皮膚,成功送鞘,早期采用擴皮刀進行銳性擴皮,容易導致真皮層中的血管、淋巴管及神經損傷,引起穿刺點滲血或滲液。鈍性分離是一種外科手術操作,該方法重在擴展,避免了手術刀對皮膚和血管組織的切割性損傷[16],具有創傷小、愈合快的優點。因此,近年來有研究[17-20]將該技術應用于PICC 穿刺過程中。本研究結果顯示,實驗組一次性送鞘成功率顯著高于對照組,這主要與7F 專用擴皮器前端錐形部分和擴皮器主體部分為一體式設計、擴皮器前端3/4 錐形部位外徑和微插管鞘組件外徑接近等因素有關,在推進過程中可減小皮膚阻力,有效擴張穿刺點處皮膚。失敗的3 例患者均因其肌肉過度緊張,使擴皮器推進阻力增大,導致一次送鞘失敗,經放松療法及再次擴皮后,微插管鞘組件順利穿過皮膚,進入血管。因此,操作者在穿刺前或穿刺過程中需要預估送鞘阻力,對于肌張力過高或肌肉緊張的患者,可通過擺放舒適體位或分散注意力等方式,使患者肌肉松弛,避免多次擴皮或暴力擴皮,對患者皮膚、肌肉或血管造成更大的傷害。此外,在7F專用擴皮器推進過程中,操作者應使用主力手手持擴皮器,采取分段推進方式[18],即先手持擴皮器錐形部分后端,使擴皮器錐形尖端破入皮膚,再將手移至擴皮器中段,使擴皮器前端3/4 錐形部分緩慢推進皮下。在臨床操作中發現,采用微插管鞘組件直接鈍性分離難度較大,需用很大力氣進行推進,容易導致微插管鞘組件或導絲變形,甚至微插管鞘外鞘卷曲破損。這主要由于微插管鞘組件的內鞘外徑明顯小于外鞘的外徑,使部分患者無法有效擴皮。對于首次鈍性分離失敗者,需退出鞘管重新送鞘,或用擴皮刀擴皮后再次送鞘,但此操作對患者皮下組織的損傷較大,易形成皮下淤血或纖維黏連。因此,采用微插管鞘組件進行鈍性分離操作時,除了以分段推進方式進行微插管鞘組件推進外,預估推進阻力、及時采用其他擴皮方式干預也顯得尤為重要。
3.2 采用7F 專用擴皮器進行鈍性分離技術,可減輕PICC穿刺點出血量
PICC置管術后常常會出現穿刺點出血現象,主要與人的皮下組織內有豐富的血管網以及在PICC 置管術中置入微插管鞘組件前需要擴皮等因素有關[21-22]。本研究結果顯示,實驗組置管后24 h出血量少于對照組,分析其原因在于,7F專用擴皮器鈍性分離技術一次送鞘成功率高,避免了皮膚及皮下組織損傷,局部血管的離斷減少,周圍皮膚出血量減少。由于本研究實驗組鈍性分離時只推進了7F擴皮器前端錐形部分3/4 長度,該處外徑跟微插管鞘外徑接近,從而減少了血管及周圍皮下組織的損傷。該技術彌補了微插管鞘組件鈍性分離技術的不足,使穿刺點的出血量減少。
綜上所述,7F專用擴皮器鈍性分離技術可顯著提高一次性送鞘成功率,減少置管后24 h穿刺點出血量,但在降低置管后7 d 內維護次數方面無明顯優勢。另外,本研究僅將該技術運用于Power PICC穿刺術,至于該技術在其他類型導管中是否具有優勢,需要后期更多相關研究進行支持。
——導絲概述及導絲通過病變技巧

