藍蓮清瘟敗毒飲方藥抗艾滋病病毒作用機制的網絡藥理學分析及實驗驗證
秦明珍,陳路,劉鈺,藍鳴生,呂建楠,吳無畏*
(1.廣西壯族自治區藥用植物園,廣西 南寧 530010;2.右江民族醫學院附屬醫院,廣西 百色 533099)
艾滋病是由人類免疫缺陷病毒(human immunodeficiency virus,HIV)感染機體而產生的疾病。據聯合國發布的最新數據統計,2020年全球共有3 770萬艾滋病患者,其中新發150萬人,68萬人死于艾滋病相關疾病[1]。研究表明,應用抗反轉錄病毒藥物治療艾滋病具有良好的效果,但是隨著藥物使用規模增加以及治療時間延長,HIV的耐藥性也逐漸提高[2]。此外,抗反轉錄病毒藥物與其他藥物的聯合使用可能會引起療效降低以及不良反應,導致藥物相互作用升高[3]。因此,開發具有抗HIV良好療效同時副作用低的新藥在治療艾滋病難題上尤為重要。中藥因其廣譜藥效以及低副作用,廣泛應用于多種疾病的治療,研究表明中藥在治療艾滋病及其并發癥上顯示出獨特的優勢。中藥復方聯合西藥使用可以有效緩解艾滋病患者癥狀,提高免疫功能、改善焦慮情況等[4-5]。陳梅等[6]發現中藥制劑唐草片聯合西藥抗病毒治療,可以顯著提高患者CD4+T細胞水平,減少副作用發生。此外,穿心蓮、夏枯草、絞股藍等中藥也具有良好的抗HIV和治療艾滋病的效果[7-10]。
藍蓮清瘟敗毒飲方藥(簡稱藍蓮方藥)是根據收集的廣西壯瑤藥抗病毒民間驗方改進而來的復方,包括穿心蓮、桔梗、南板藍根、黨參、夏枯草、絞股藍、黃芩、梔子和羅漢果。艾滋病屬于中醫之疫毒范疇[11]。表現為正氣不足,感染濕熱疫毒所致,且邪毒迅速傳內惡化,損傷臟腑氣血,以致濕熱膠結,變證叢生。治宜清熱解毒,涼血散結,益氣扶正。根據中醫理論,藍蓮方藥重用南板藍根清熱解毒,涼血散結,善解瘟疫時毒。穿心蓮清熱解毒,燥濕涼血。藍蓮合用為君藥,清瘟辟疫,涼血敗毒以治病因。黃芩清熱燥濕,涼血解毒,亦善清濕熱疫毒。梔子瀉火除煩,清熱利濕,涼血解毒,消腫止痛。二者既增涼血解毒之效,又引三焦濕熱火毒從下而去,使邪有出路,共為臣藥。佐以夏枯草清熱瀉火,消散郁結。黨參益氣扶正,既可扶助正氣,鼓邪外出,又能散中有補,不致耗傷正氣;絞股藍既清熱解毒以助祛邪,又益氣健脾以助固本。諸藥合用,共奏清熱解毒,涼血散結,益氣扶正之功。本方的配伍特點是:祛邪扶正兼顧,祛邪為主。以君藥辟疫解毒,臣藥清熱除濕,配小量補氣藥,祛邪不傷正,扶正不留邪。本文從藍蓮方藥的中藥成分出發,依托網絡藥理學方法開展了藥理分析,并結合體外細胞學實驗,驗證方藥抗HIV病毒的潛在活性并分析其分子機制,為后續的研究和臨床應用提供理論和科學依據。
1 材料
1.1 藥品與試劑藍蓮方藥中藥成分的來源及批號見表1;唐草片購自上海百歲行藥業有限公司(批號:201112);TZM-bl細胞、293T細胞及假病毒包裝質粒(pNL4-3.Luc.R-E-,pVSVG)由本實驗室保存;轉染試劑盒GenJet DNA In Vitro Transfection Reagent(美國SignaGen公司);熒光檢測試劑盒ONE-Glo Luciferase Assay System(美國Promega公司)。

表1 藍蓮方藥各中藥成分來源及批號
1.2 儀器CI-191C二氧化碳細胞培養箱(美國Crystal公司);Infinite M200 Pro酶標儀(瑞士Tecan公司)等。
2 方法
2.1 藥材制備分別稱取藍蓮方藥中藥粉末:南板藍根115 g、穿心蓮94 g、黃芩58 g、夏枯草115 g、絞股藍58 g、黨參115 g、桔梗58 g、梔子58 g、羅漢果180 g。混勻后加70%乙醇回流提取兩次,將提取液抽濾后水浴蒸發除去乙醇以及多余水分,收集浸膏A。將藥渣再次提取后收集提取液并過濾,濾液蒸發濃縮到接近藥材重量1.5倍時測定相對密度和濃縮液溫度,當相對密度=1.10時,邊攪拌邊緩慢加入95%乙醇,使溶液含醇量達到70%。靜置24 h后,將上清液與抽濾后的下層混懸液合并。水浴蒸發去除乙醇和多余水分,收集浸膏B。合并浸膏A和B,混勻后4 ℃保存。
唐草片處理:稱取適量唐草片,研磨均勻后用去離子水充分溶解,過濾,4 ℃保存。
2.2 中藥有效成分和潛在靶點篩選通過TCMSP數據庫(https://old.tcmsp-e.com)查詢各中藥的化學成分,根據口服生物利用度(oral bioavailability,OB)≥30%且化合物類藥性(drug like,DL)≥0.18的屬性值篩選活性組分并獲得相關的蛋白質靶點。根據已發表文獻補充查找南板藍根的化學結構組分,再將組分輸入TCMSP平臺獲取化合物作用的蛋白質靶點。篩選結束后,將所有蛋白質靶點統一在Uniprot(http://beta.uniprot.org/)蛋白質數據庫進行規范化。
2.3 疾病的相關靶點篩選以“HIV”為關鍵詞在GeneCards數據庫(https://www.genecards.org)、OMIM數據庫(http://www.omim.org)、TTD數據庫(http://db.idrblab.net)以及DrugBank數據庫(https://go.drugbank.com)分別獲取疾病的相關作用靶點,并將靶點進行合并。
2.4 生物學功能和通路富集分析將HIV和藍蓮方藥的相關靶點利用R語言繪制成韋恩圖,獲取兩者的交集基因。為進一步分析藥物對HIV的分子作用機制,將交集基因導入Metascape數據庫(http://metascape.org/gp/index.html),物種選擇人類(H.sapiens),進行基因本體(gene ontology,GO)分析和京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析。保存數據結果,利用微生信平臺(http://www.bioinformatics.com.cn)分別繪制前20條通路的生物學過程(biological prpcess,BP)、細胞組分(cellular component,CC)和分子功能 (molecular function,MF)氣泡圖。采用Origin 8.0構建KEGG富集結果柱狀圖。
2.5 成分-靶點-通路網絡圖構建運用CytoScape 3.8.0構建HIV與藍蓮方藥的成分-靶點-通路網絡圖,根據CytoScape內置分析工具“network analyze”計算網絡圖的拓撲參數,由參數中位數大小篩選關鍵成分與靶點,并分析主要的分子通路。
2.6 蛋白相互作用網絡構建蛋白相互作用網絡(protein-protein interaction network,PPI)是通過數據庫將已知蛋白和預測蛋白的相互作用關系以網絡圖呈現出來,對研究疾病分子機制和關鍵靶點有重要作用。將藍蓮方藥抗HIV的潛在靶點導入STRING數據庫(https://cn.string-db.org),得到PPI相互作用網絡。通過CytoScape 3.8.0對PPI網絡進一步分析。
2.7 分子對接驗證分子對接主要用于將小分子與蛋白質進行結構對接,預測分子結合位點并評估其互補分值[12]。本文通過分子對接分析主要活性成分與關鍵靶點的結合潛力。通過PDB數據庫(https://www.rcsb.org/)獲取蛋白結構,PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/)獲取配體小分子結構,采用AutoDock Tools 1.5.6軟件對蛋白和配體結構文件進行去水、加氫、加電荷等預處理。利用AutoDock Vina 1.2.3將蛋白和配體分子進行對接,結果通過Pymol軟件可視化分析。
2.8 HIV假病毒構建采用文獻[13]的方法,將實驗室保存的HIV假病毒包裝質粒共轉染293T細胞制備HIV假病毒。使用6孔細胞培養板,細胞濃度為5×105/孔,于 37 ℃、5% CO2的培養箱中培養細胞。24 h后進行質粒共轉染,48 h后收集含假病毒的細胞上清,離心后置于-80 ℃冰箱凍存。
2.9 藍蓮方藥細胞毒性試驗實驗分為藍蓮方藥組、抗HIV中藥唐草片組、無藥物細胞對照組和無細胞對照組(只加培養基)。將藥物溶解于DMEM完全培養基,配制成一定濃度梯度的培養液。使用96孔細胞培養板孵育TZM-bl細胞,每孔7 000個細胞,于37 ℃、5% CO2的培養箱中培養。24 h后換含藥物的培養液繼續培養。采用MTT染色法在酶標儀上檢測細胞的化學發光值,即相對光單位(relative light unit,RLU),計算細胞活力(%)=RLU(藥物組-無細胞對照組)/RLU(細胞對照組-無細胞對照組)×100%,Graphpad Prism 7軟件得出藥物對細胞的半數毒性濃度CC50。
2.10 藍蓮方藥抗HIV假病毒實驗實驗分為藍蓮方藥組(加藍蓮方藥與HIV假病毒),藍蓮方藥濃度分為65.625、13.125、2.625 μg·mL-1;唐草片組(加唐草片與HIV假病毒),唐草片濃度分為100、50、25 μg·mL-1;HIV假病毒對照組(只加HIV假病毒)和細胞對照組(不含HIV假病毒和藥物)。以每孔10 μL HIV假病毒液感染TZM-bl細胞,添加DMEM完全培養基至100 μL,培養48 h后酶標儀檢測細胞熒光發光值,得到5×106RLU·mL-1的HIV假病毒感染力。將HIV與不同濃度的藥物共培養細胞,HIV假病毒每孔添加10 μL。TZM-bl細胞采用96孔黑色細胞培養板孵育,于37 ℃、5% CO2的培養箱中培養。各組細胞培養48 h后采用ONE-Glo Luciferase Assay System試劑盒對細胞進行熒光染色,酶標儀檢測RLU值,Graphpad Prism 7軟件計算藥物對HIV假病毒的細胞半數抑制濃度IC50以及選擇指數SI,SI=CC50/IC50。Origin 8.0繪制藥物濃度與HIV假病毒感染率關系曲線圖,HIV假病毒感染率(%)=RLU(藥物組-細胞對照組)/RLU(HIV假病毒對照組-細胞對照組)×100%。
2.11 實時熒光定量PCR使用6孔板培養TZM-bl細胞,每孔2.5×105個細胞,于37 ℃、5% CO2的培養箱中培養24 h后更換含HIV或者藥物的新鮮DMEM完全培養基。設置細胞對照組(無處理組)、HIV假病毒組(添加HIV假病毒液)、HIV+藍蓮方藥組(添加HIV假病毒液與藍蓮方藥)。培養24 h后收集各組細胞,根據試劑盒方法提取總RNA,反轉錄為cDNA,實時熒光定量PCR(quantitative Real-time PCR,qRT-PCR)檢測各組細胞內基因的相對表達量,數據以2-△△Ct表示。篩選KEGG富集分析的主要信號通路分子AKT1、TNF-α以及IL-17為檢測基因,內參基因為Actin,基因引物由擎科生物公司合成,引物序列見表2。qRT-PCR反應體系 20 μL,程序為:預熱(95 ℃、30 s),擴增 (95 ℃、10 s, 58 ℃、15 s,72 ℃、15 s,共40個循環),冷卻 (37 ℃、30 s)。
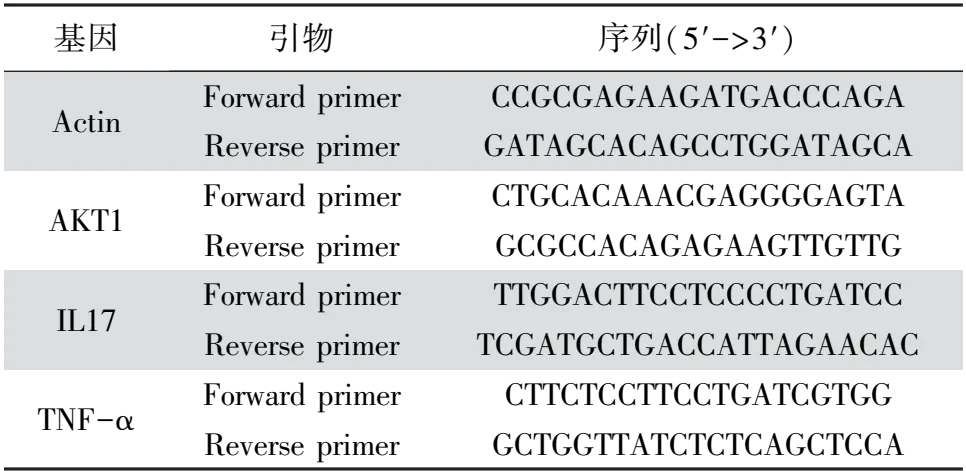
表2 qRT-PCR基因引物
3 結果
3.1 藍蓮方藥和HIV的靶點獲取經ADME篩選并去除重復項之后獲得藍蓮方藥的有效成分110種。各成分對應的靶點數目合計并去除重復靶點后獲得藍蓮方藥的有效靶點280個。
分別從各數據庫獲得HIV的相關靶點數為Drugbank 54個、GenCards 1 315個、OMIM 21個點、TTD 7個,去除重復項后獲得靶點1 357個。
3.2 生物學功能和通路富集分析HIV和藍蓮方藥的共同靶點有135個(見圖1)。GO富集分析可闡明關鍵網絡靶點發揮的主要生物學功能,結果見圖2。由圖2可知,關鍵網絡靶點的BP主要包括response to inorganic substance、response to bacterium、response to lipopolysaccharide等。CC主要有membrane raft、membrane microdomain、side of membrane等。MF以protein kinase binding、kinase binding、phosphotransferase activity、alcohol group as acceptor等功能較明顯。KEGG分析顯示了主要通路參與的關鍵網絡靶點數目以及P值大小,結果見圖3。由圖3可知,藍蓮方藥抗HIV的基因主要富集在Hepatitis B、PI3K-Akt signaling pathway、TNF signaling pathway、IL-17 signaling pathway等信號通路。
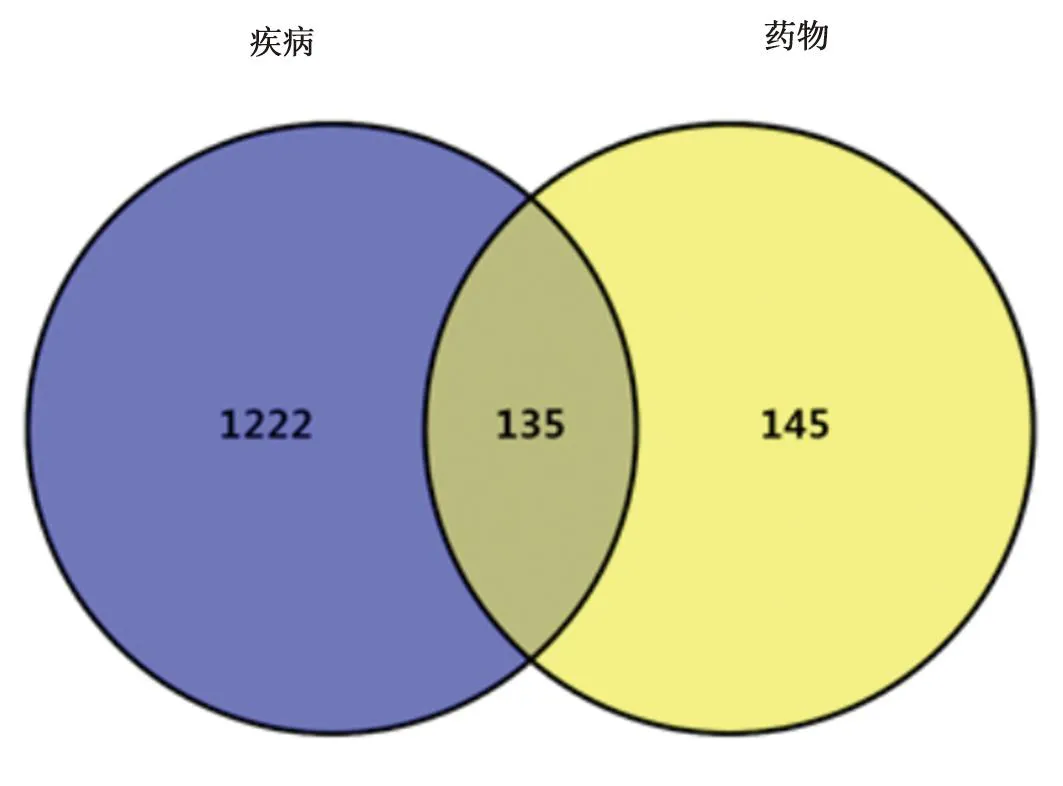
圖1 藍蓮方藥與HIV的靶點韋恩圖

圖2 關鍵網絡靶點的GO富集分析氣泡圖
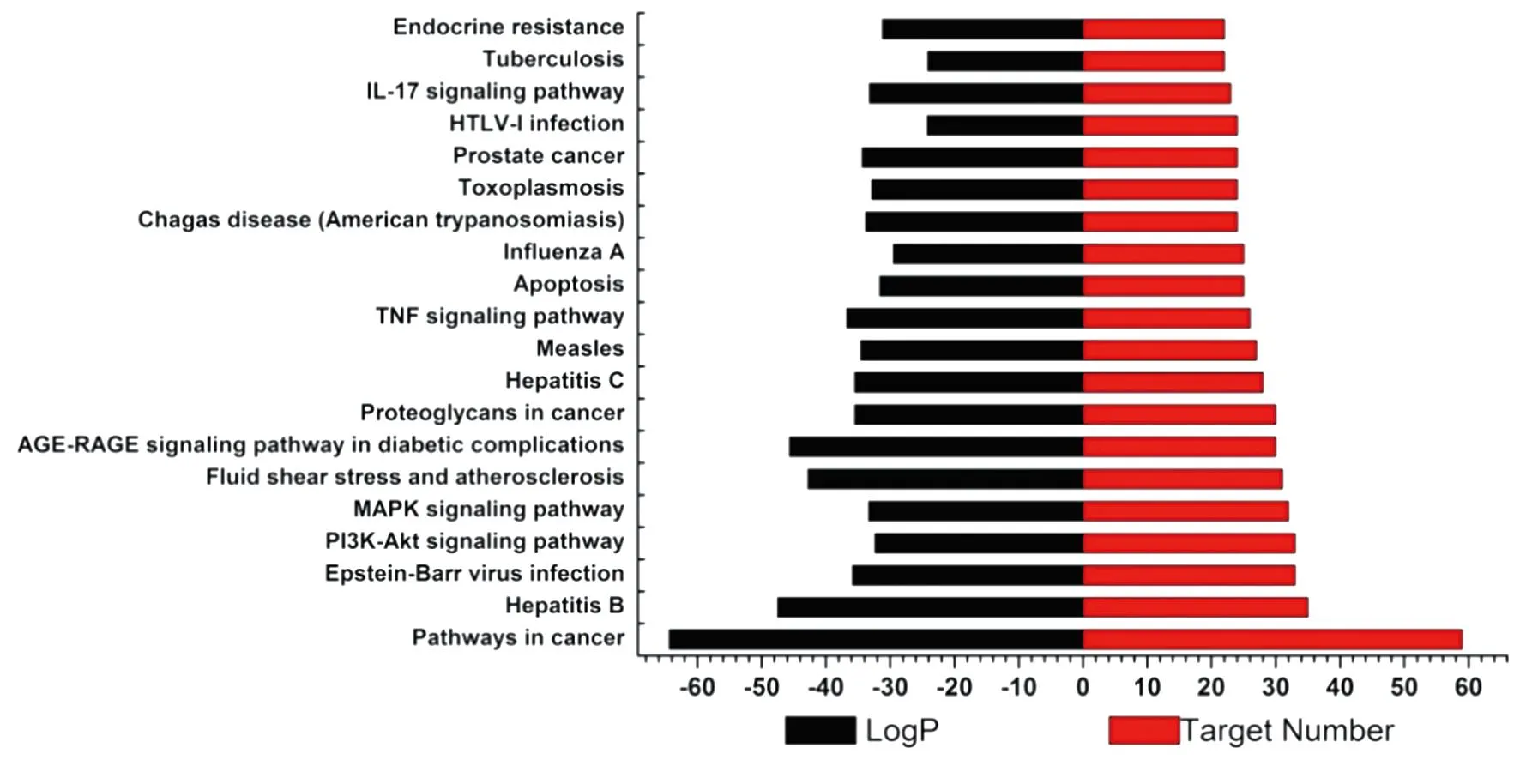
圖3 關鍵網絡靶點的KEGG通路富集分析柱狀圖
3.3 成分-靶點-通路網絡圖構建藍蓮方藥與HIV的共同靶點所包含的藍蓮方藥有效成分為104個。將104個有效成分與KEGG分析獲取的前20條通路,通過CytoScape 3.8.0構建藍蓮抗HIV的成分-靶點-通路網絡圖(見圖4)。
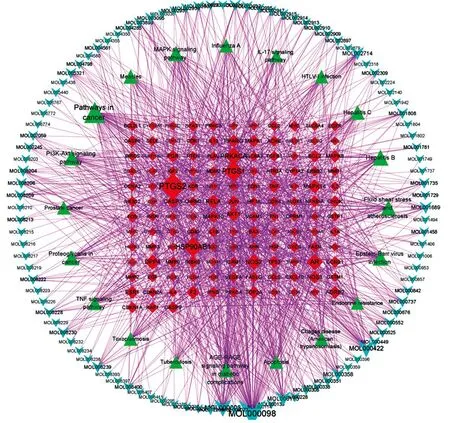
圖4 藍蓮方藥抗HIV的成分-靶點-通路網絡圖 注:藍色的倒三角形為不同藥物的活性成分,綠色三角形為通路,紅色四邊形為HIV和藍蓮方藥的共同靶點。
根據CytoScape計算的度(degree)篩選關鍵成分和靶點。Degree值越大則圖中的節點(node)面積越大,表示該節點在網絡中可能發揮越關鍵的作用。成分的degree中位數為4,篩選degree≥8(2倍中位數),得到36種主要活性成分,包括槲皮素(quercetin)、木犀草素(luteolin)、山柰酚(kaempferol)、黃芩素(baicalein)等,具體見表3。靶點degree中位數為6,篩選degree≥12(2倍中位數),得到37個關鍵網絡靶點。由成分-靶點-通路網絡圖可知,一種成分可與多種靶點相連,一種靶點也可能與多種成分相關,而靶點與通路也是多線連接的方式,提示提示藍蓮方藥抗HIV的機制可能是多成分、多靶點、多通路的特點。

表3 藍蓮方藥的關鍵活性成分
3.4 蛋白PPI網絡構建將藍蓮方藥與HIV的共同靶點導入STRING數據庫,獲得蛋白PPI網絡,用
CytoScape對PPI網絡進一步分析,并篩選核心網絡靶點(見圖5)。該網絡由135個節點,2 837條邊組成,節點連接的邊越多表示該節點的重要性越強,節點間連接線越密集,表示節點間的關聯越密切。PPI網絡計算的degree值為40,篩選degree≥80(2倍中位數),得到14個節點,91條邊的網絡,即主要靶點14個。將這14個靶點與成分-靶點-通路網絡篩選的37個靶點取交集,獲得7個節點,21條邊的網絡,即核心網絡靶點7個,為AKT1、TNF、CASP3、TP53、JUN、ESR1和PTGS2。
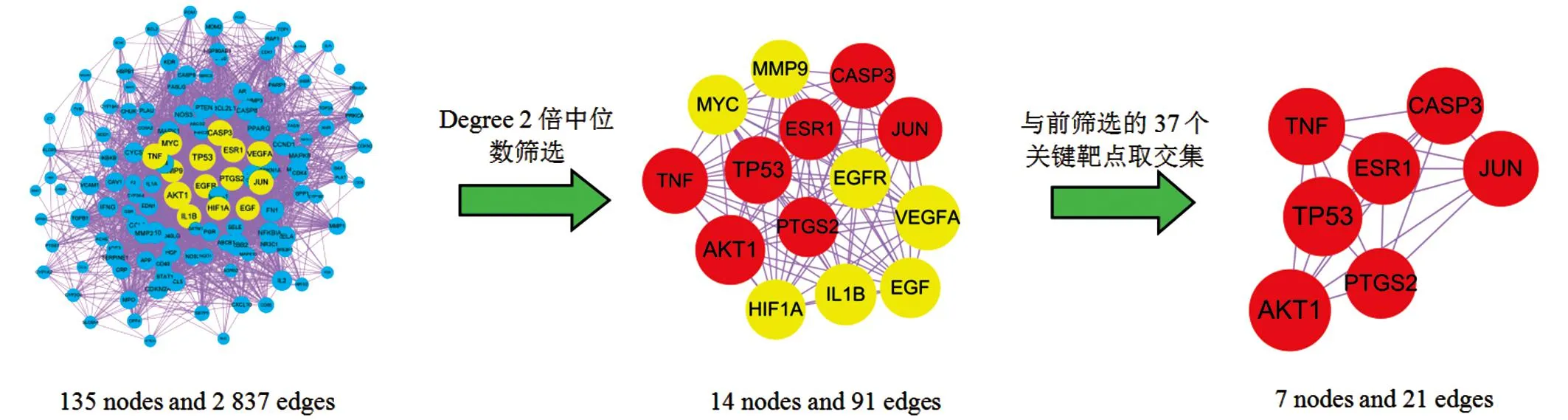
圖5 PPI網絡拓撲篩選核心靶點
3.5 分子對接驗證將核心網絡靶點AKT1、TNF、CASP3 、TP53、JUN、ESR1和PTGS2分別與主要活性成分槲皮素、木犀草素、山柰酚、黃芩素進行分子對接,對接結果見表4。AutoDock Vina 通過計算小分子與蛋白的結合能從而評估其相互作用強度,結合能<-7.0 kcal·mol-1被視為結合活性較強[12],結合能越小表示其結合越穩定,相互作用越強。對接結果顯示,AKT1、TNF、CASP3、ESR1和PTGS2這5種主要成分與蛋白靶點的結合能均小于-7 kcal·mol-1,結合活性較強。將AKT1與黃芩素、TNF與槲皮素、CASP3與木犀草素的對接結果進行可視化,如圖6。
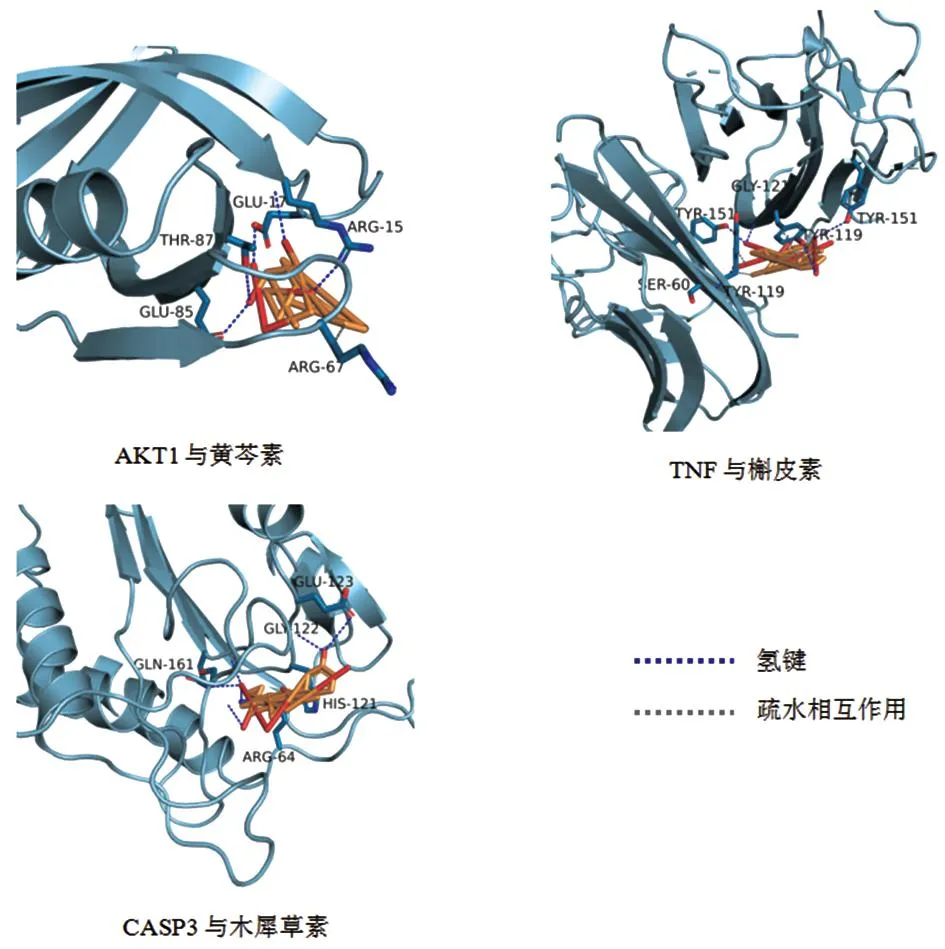
圖6 部分成分與靶點分子對接3D效果圖

表4 成分-靶點分子對接結合能
3.6 藍蓮方藥的細胞毒性以及對HIV的抑制作用細胞毒性實驗結果見圖7,細胞活力與藥物濃度有明顯劑量依賴性,藥物濃度越高細胞活力越低。計算得出,藍蓮方藥與唐草片對TZM-bl細胞的CC50分別為(3.16±0.18)、(2.01±0.02)mg·mL-1。且藍蓮方藥與唐草片對TZM-bl細胞的無毒濃度分別為0.21、0.38 mg·mL-1,后續實驗均在無毒濃度范圍內進行。
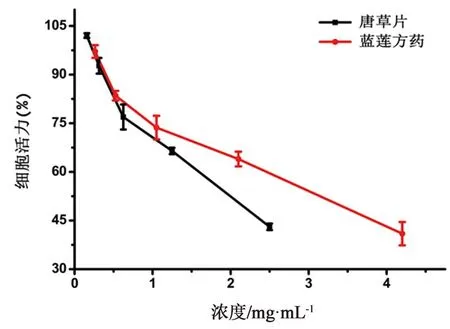
圖7 藍蓮方藥對細胞活力的影響曲線
藥物與HIV假病毒共培養細胞48 h后檢測熒光發光值,得到藥物濃度與病毒感染產生的熒光信號抑制曲線(見圖8),可見假病毒感染率隨著藍蓮方藥或唐草片的濃度增加而降低。經計算得出藍蓮方藥與唐草片對HIV假病毒的IC50分別為17.10、94.42 μg·mL-1;其SI分別為184.80和21.29。
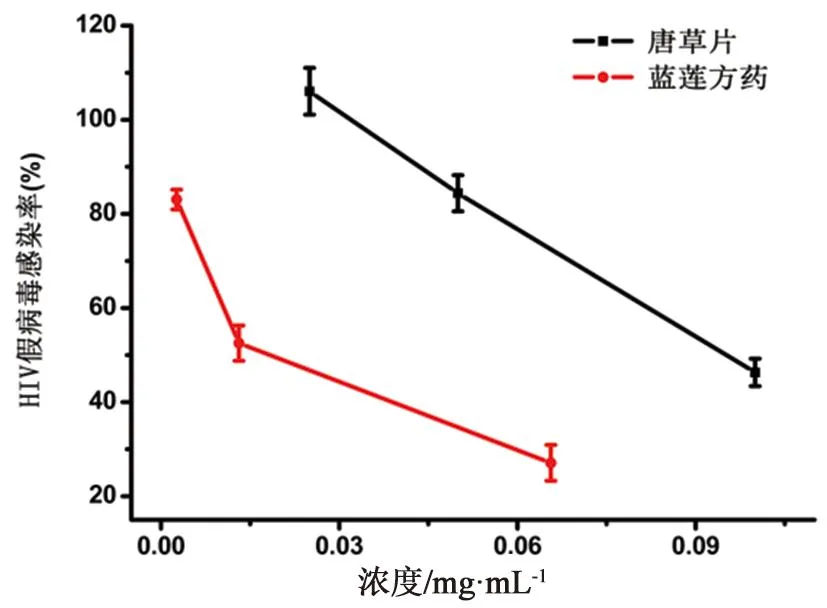
圖8 藍蓮方藥對HIV假病毒的抑制曲線
3.7 qRT-PCR檢測HIV假病毒組每組以假病毒液250 μL感染細胞,藍蓮方藥終濃度為26.25 μg·mL-1,添加DMEM完全培養基至2.5 mL。細胞培養24 h后獲取各組基因qRT-PCR的Ct值,根據2-△△Ct公式,計算其他各組相對于細胞對照組的表達量。由圖9可知,與細胞對照組相比,HIV假病毒組的IL-17基因的相對表達量顯著降低,而AKT1以及TNF-α基因的相對表達量顯著升高。與HIV假病毒組對比,HIV+藍蓮方藥組的IL-17表達量明顯升高,且具有統計學差異(P<0.01)。
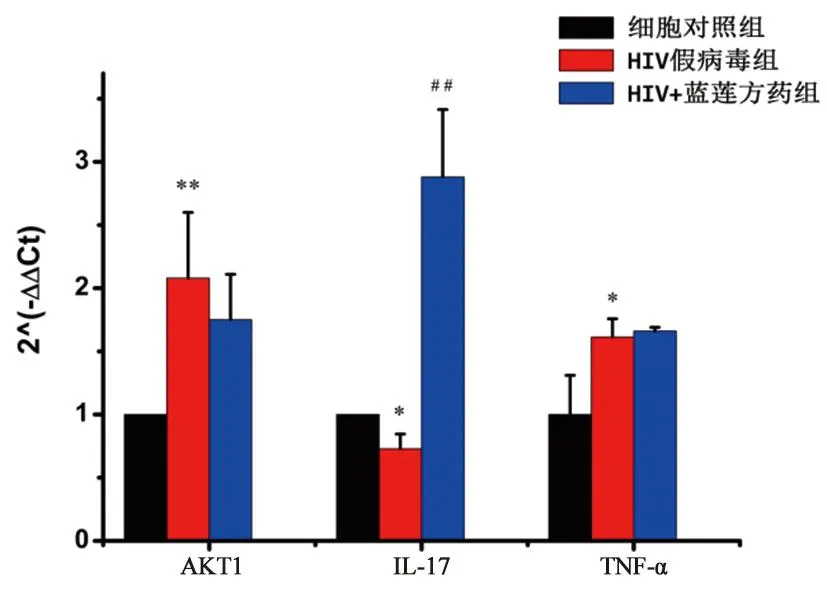
圖9 qRT-PCR檢測基因的相對表達量 注:*表示細胞對照組與HIV假病毒組比較,#表示HIV假病毒組與HIV+藍蓮方藥組比較,n=3;其中*P<0.05,**P<0.01,##P<0.01。
4 討論
本研究通過網絡藥理學方法分析藍蓮方藥具有抗HIV潛在作用的化學組分,包括槲皮素、木犀草素、山柰酚、黃芩素等。研究發現,槲皮素具有良好的抗HIV-1作用[14-15]。Ahn等[16]從大戟分離出的3種槲皮素和山柰酚均能抑制HIV-1整合酶活性,其中槲皮素IC50為15.7~22.7 μmol·L-1,山柰酚IC50為16.7 μmol·L-1。山柰酚-7-O-葡萄糖苷的抗HIV活性高于山柰酚,糖苷衍生物能夠利用較好的水溶性進入組織,在HIV感染早期抑制病毒反轉錄[17]。從大翅薊提取的木犀草素對HIV-1逆轉錄酶RNase H具有較強的抑制作用,IC50為12.8 μmol·L-1,純化的木犀草素還能抑制HIV-1整合酶活性[18]。Schonhofer等[19]發現木犀草素能夠下調細胞周期素依賴性激酶9和HIV反式轉錄激活因子蛋白的表達,通過持續增強HIV潛伏期,使隱藏在CD4+T細胞中具有自發誘導和復制能力的病毒失活。黃芩素是一種黃酮類化合物,能與HIV-1整合酶的核心結構域結合,改變酶構象影響酶活從而抑制HIV病毒的復制[20]。
本文分析顯示,藍蓮方藥調控HIV感染的潛在核心網絡靶點為AKT1、TNF、CASP3、TP53、JUN、ESR1和PTGS2等。AKT1在巨噬細胞的凋亡中發揮重要作用,過表達的AKT1促進了轉錄因子FOXO3a的磷酸化,磷酸化FOXO3a可以增加人單核巨噬細胞DNA片段化,調節HIV-1誘導的人巨噬細胞凋亡[21]。艾滋病患者血清中腫瘤壞死因子TNF-α表達水平普遍增強,陸宇紅等[22]發現TNF-α基因多態性與HIV感染密切相關,患者的TNF-α位點rs1800629基因型為GA以及等位基因為A的分布頻率顯著高于正常組,其基因多態性也影響抗逆轉錄病毒治療后CD4+T細胞水平的恢復。CASP3可以誘導細胞凋亡,由HIV-1編碼的天冬氨酸激酶能激活突變型 CASP3*,通過消除HIV-1感染的細胞從而抑制病毒在SUP-T1細胞中的復制和傳播[23]。分子對接驗證結果也表明,槲皮素、木犀草素、山柰酚、黃芩素與靶點AKT1、TNF和CASP3的結合活性較強,提示藍蓮方藥可能主要通過這幾種成分參與調控AKT1、TNF和CASP3等關鍵基因的表達,從而抑制HIV-1病毒感染細胞。
通過基因富集分析發現,藍蓮方藥抑制HIV感染細胞的信號通路主要有PI3K-Akt 信號通路、TNF信號通路和IL-17信號通路等。PI3K-Akt 信號通路在HIV-1的主要靶細胞中發揮關鍵作用,包括對巨噬細胞凋亡的調節以及壽命延長、影響干擾素IRF-7向漿細胞樣樹突狀細胞核內轉運、介導神經膠質細胞的炎癥反應等[24]。PI3K/Akt抑制劑能夠引起感染HIV-1病毒的巨噬細胞死亡,抑制病毒復制,而不影響正常細胞[25]。白細胞介素IL-17與艾滋病的發生密切相關,艾滋病患者血清IL-17水平以及Th17/Treg細胞比例偏低,經高效抗反轉錄病毒治療后患者的IL-17水平明顯升高,Th17/Treg比例也得以恢復,可見Th17和Treg細胞的失衡可能在艾滋病的發病機制中起著關鍵作用[26]。qRT-PCR結果顯示,經HIV假病毒處理后的細胞IL-17表達量明顯降低,而TNF-α和AKT1表達量明顯升高,表明這幾種基因與HIV病毒的感染密切相關。添加藍蓮方藥處理后的細胞,IL-17表達量與單獨HIV處理組相比顯著上升,說明藍蓮方藥可能主要通過調節IL-17信號通路來抑制HIV病毒對細胞的感染。
假病毒是一類經過基因工程改造的,只能進行單輪復制感染的病毒。由于HIV病毒的特殊性,直接應用HIV病毒進行細胞及動物實驗需要生物安全3級實驗室,因此很多抗HIV藥物篩選和藥物機理研究應用了HIV假病毒來模擬真病毒的感染[27]。唐草片是目前中國唯一批準用于艾滋病治療的中成藥,具有清熱解毒、活血益氣的作用[28]。因此本文應用HIV假病毒感染細胞模型對比了藍蓮方藥和唐草片的抗病毒效果。結果顯示,與唐草片相比,藍蓮方藥抑制病毒感染的半抑制濃度IC50更小,選擇指數SI更大,且二者具有顯著性差異(P<0.5),表明藍蓮方藥抗HIV活性比唐草片更好。本文采用網絡藥理學方法結合體外實驗驗證,從整體角度出發分析藥物與疾病之間的關聯,得出藍蓮方藥抗HIV感染為多成分,多靶點,多通路的網絡作用機制,其中藍蓮方藥對IL-17信號通路的調控可能起關鍵作用。

