分子改良提高甘露聚糖酶的耐熱性
王亞偉 薛強 熊海容
摘要:以來源于嗜熱放線菌(Thermobifida fusca)的甘露聚糖酶基因(KJ806638)為研究對象,利用易錯PCR方法對其進行改造,獲得了耐熱性進一步提高的甘露聚糖酶。篩選獲得的N16I突變株,其最適反應溫度從72.5 ℃提升到77.5 ℃。差示掃描熒光定量(DSF)檢測結果顯示,酶蛋白質的表觀解鏈溫度Tm從61.9 ℃提升到 63.2 ℃。
關鍵詞:甘露聚糖酶;易錯PCR;熱穩定性
中圖分類號:Q55? ? ? ? ?文獻標識碼:A
文章編號:0439-8114(2023)12-0151-03
DOI:10.14088/j.cnki.issn0439-8114.2023.12.027 開放科學(資源服務)標識碼(OSID):
Improving the thermotolerance of mannanase through molecular improvement
WANG Ya-wei1,XUE Qiang2,XIONG Hai-rong2
(1.School of Life Science and Technology,Wuhan Polytechnic University,Wuhan? 430048,China;
2. College of Life Sciences, South-Central Minzu University, Wuhan? 430074,China)
Abstract:The mannanase gene (KJ806638) from Thermobifida fusca was used as the research object, and it was modified by the error-prone PCR method, and the heat resistance of mannanase was further improved. The optimum reaction temperature of N16I mutant was increased from 72.5 ℃ to 77.5 ℃. Differential scanning fluorometry (DSF) testing results showed that the apparent decomposition temperature Tm of the enzyme protein increased from 61.9 ℃ to 63.2 ℃.
Key words: mannanase; error-prone PCR; thermostabilty
甘露聚糖酶是一種半纖維素酶類[1],現已被廣泛應用于飼料、造紙、洗滌劑、食品和石油開采及生物質能源等領域,尤其在功能性低聚糖制備和添加劑等方面應用前景十分廣闊。在飼料行業,甘露聚糖是飼料中主要抗營養因子之一,會增加食糜在畜禽消化道內的黏度,導致畜禽對飼料中營養物質的消化吸收受到影響,致使飼料的消化利用率降低[2]。在石油方面,甘露聚糖酶常被用作壓裂液的破膠劑,可以增強壓裂液的導流能力,減少破壞性物質的殘留,從而提高產油量[3]。在造紙過程中,甘露聚糖酶可用作處理紙漿的漂白劑,可以有效促進木質素的降解而保留纖維素[4]。
工業生產過程中,往往存在高溫等極端環境,高溫環境能加快酶促反應速度,提高液體物料的流動性能,防止有害微生物在過程中的生長繁殖等[5,6]。普通中溫甘露聚糖酶在高溫下會發生結構變化,從而大幅度地喪失活性。來源于嗜熱放線菌(Thermobifida fusca)的耐熱甘露聚糖酶[7]進行水解,能從根本上解決高溫環境使加入的酶很快失活的問題。
易錯PCR技術[8]是在正常PCR技術上演變而來的,它是一種使DNA在復制擴增過程中更容易出現錯誤配對的PCR技術,因此又稱為錯配PCR或傾向錯誤PCR。易錯PCR通常是利用低保真度的Taq DNA聚合酶和改變一些PCR反應體系等手段,來降低PCR過程中DNA復制的保真度,使錯配率升高,從而得到與原來不同的DNA序列或基因。將該酶基因序列通過易錯PCR突變后,通過表達和酶特性鑒定后篩選,獲得的更高耐熱性的甘露聚糖酶突變體4號,在飼料添加劑、保健食品、造紙、洗滌、釀造、紡織和醫藥等領域具有廣闊的應用前景。
1 材料與方法
1.1 菌株質粒和試劑
大腸桿菌(Escherichia coli)BL21(DE3)、質粒pET-22b(+)均為實驗室保藏,質粒pAOhr-ManB來源于武漢擎科生物科技有限公司合成。限制性內切酶、Taq酶、Pyrobest DNA聚合酶、T4 DNA連接酶等工具酶購自TaKaRa公司;DNA純化試劑盒購自愛思進生物技術有限公司。IPTG、X-Gal、SDS及角豆膠購自Sigma公司,TEMED、過硫酸銨、丙烯酰胺、甲叉雙丙烯酰胺為國藥試劑。
50 mmol/L磷酸氫二鈉-檸檬酸緩沖液:取7.10 g磷酸氫二鈉溶解于800 mL去離子水中,用檸檬酸調節pH為4.0~7.5范圍內任一值后,定容至1 L。50 mmol/L Tris-HCl緩沖液:取6.06 g Tris溶解于800 mL去離子水中,用1 mol/L HCl調節pH至7.5~9.0,定容至1 L。50 mmol/L 甘氨酸-氫氧化鈉緩沖液:取7.50 g甘氨酸溶解于800 mL去離子水中,用1 mol/L氫氧化鈉溶液調節pH至9.0~11.0,定容至1 L。
1.2 易錯PCR突變和表達
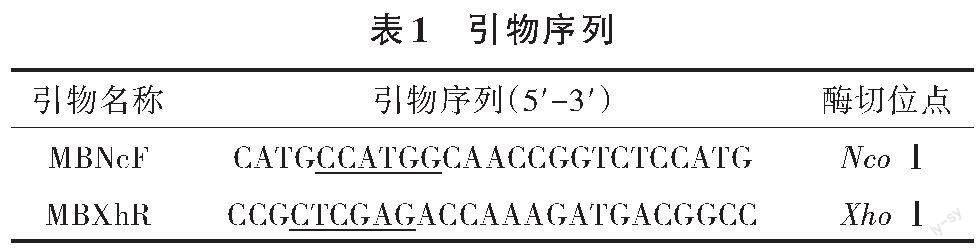
將實驗室保藏的菌株Escherichia coli DH5α-pAOhr-ManB擴大化培養,使用試劑盒提取質粒pAOhr-ManB作為模板,擴增甘露聚糖酶的基因,以回收的片段為模板,進行易錯PCR。所用的引物序列見表1。
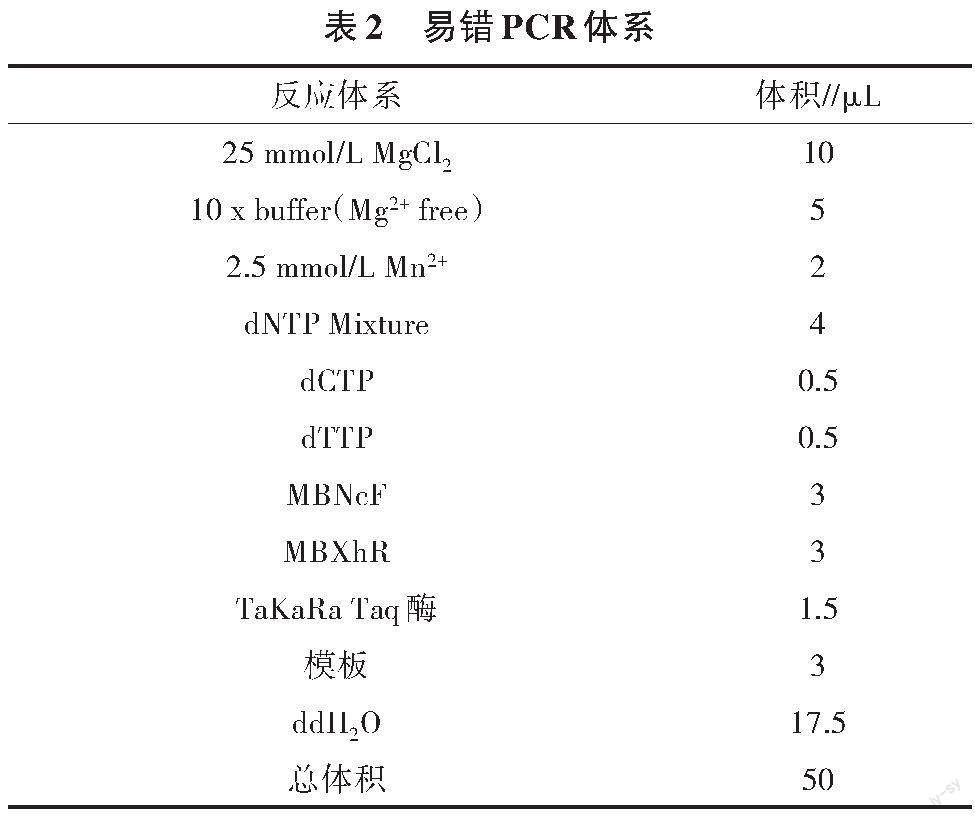
易錯PCR通過改變體系中錳離子濃度和4種脫氧核糖核苷酸的濃度比例,使甘露聚糖酶的堿基序列發生隨機突變,從而得到多個甘露聚糖酶ManB的突變基因序列。易錯PCR的操作體系見表2。基因擴增、大腸桿菌表達和蛋白質提純方法見參考文獻[9,10]。
1.3 酶學性質檢測
原酶及突變酶最適溫度測定[11]:采用3,5-二硝基水楊酸方法(簡稱DNS法)對原酶及突變酶的最適溫度進行測定,以0.5%角豆膠為底物,在pH 7.0反應條件下,分別測定不同溫度梯度(50~85 ℃)下的酶活力,酶活力最高點為最適反應溫度,以測得的最大酶活值為100%,計算不同溫度下的相對酶活力,每個反應設置3個平行。
差示掃描熒光定量(Differential scanning fluorometry, DSF)測定[12]:檢測不同重組酶蛋白的表觀解鏈溫度即Tm。DSF試驗只需要少量純化的蛋白質(10~25 μL),其最低蛋白質濃度為0.1~0.3 mg/mL,將蛋白質和熒光染料均勻混合加入96孔板中,再放入實時熒光定量PCR儀中,可以在較短時間內完成測量過程,這些特點使DSF方法可以快速測量蛋白質的熱穩定性。將20 μL純化后的不同酶蛋白質與5 μL的100×SYPRO Orange染料混合離心,設置實時熒光定量PCR系統中以0.1 ℃的增幅從30 ℃到99 ℃加熱樣品,并同時測得其熒光值,根據熒光值的變化來測定重組酶的Tm。
2 結果與分析
2.1 甘露聚糖酶突變株基因的獲得和表達
本實驗室保藏的甘露聚糖酶(PDB:1BQC)基因來源于Thermobifida fusca,在不改變氨基酸序列的情況下,對該酶基因序列進行序列重排與密碼子優化。為了便于對該基因進行分子操作,消除了基因序列中的限制性內切酶位點,合成了一個新基因ManB(KJ806638)。同時在甘露聚糖酶ManB基因的兩端分別設計添加酶切位點Nco I和Xho I,交由武漢擎科生物科技有限公司完成全基因合成,獲得重組載體pAOhr-ManB。以pAOhr-ManB質粒作為模板,設計引物,通過使用Taq酶和改變PCR體系中的Mn2+濃度和4種脫氧核糖核苷酸的濃度比例,使甘露聚糖酶的堿基序列發生隨機突變,從而得到多個甘露聚糖酶ManB的突變基因序列。本研究篩選獲得的突變酶氨基酸序列信息如下(突變位點為N16I):
MATGLHVKNGRLYEAIGQEFIIRGVSHPHNWYPQHTQAFADIKSHGANTVRVVLSNGVRWSKNGPSDVANVISLCKQNRLICMLEVHDTTGYGEQSGASTLDQAVDYWIELKSVLQGEEDYVLINIGNEPYGNDSATVAAWATDTSAAIQRLRAAGFEHTLVVDAPNWGQDWTNTMRNNADQVYASDPTGNTVFSIHMYGVYSQASTITSYLEHFVNAGLPLIIGEFGHDHSDGNPDEDTIMAEAERLKLGYIGWSWSGNGGGVEYLDMVYNFDGDNLSPWGERIFYGPNGIASTAKEAVIFGLEHHHH
HH
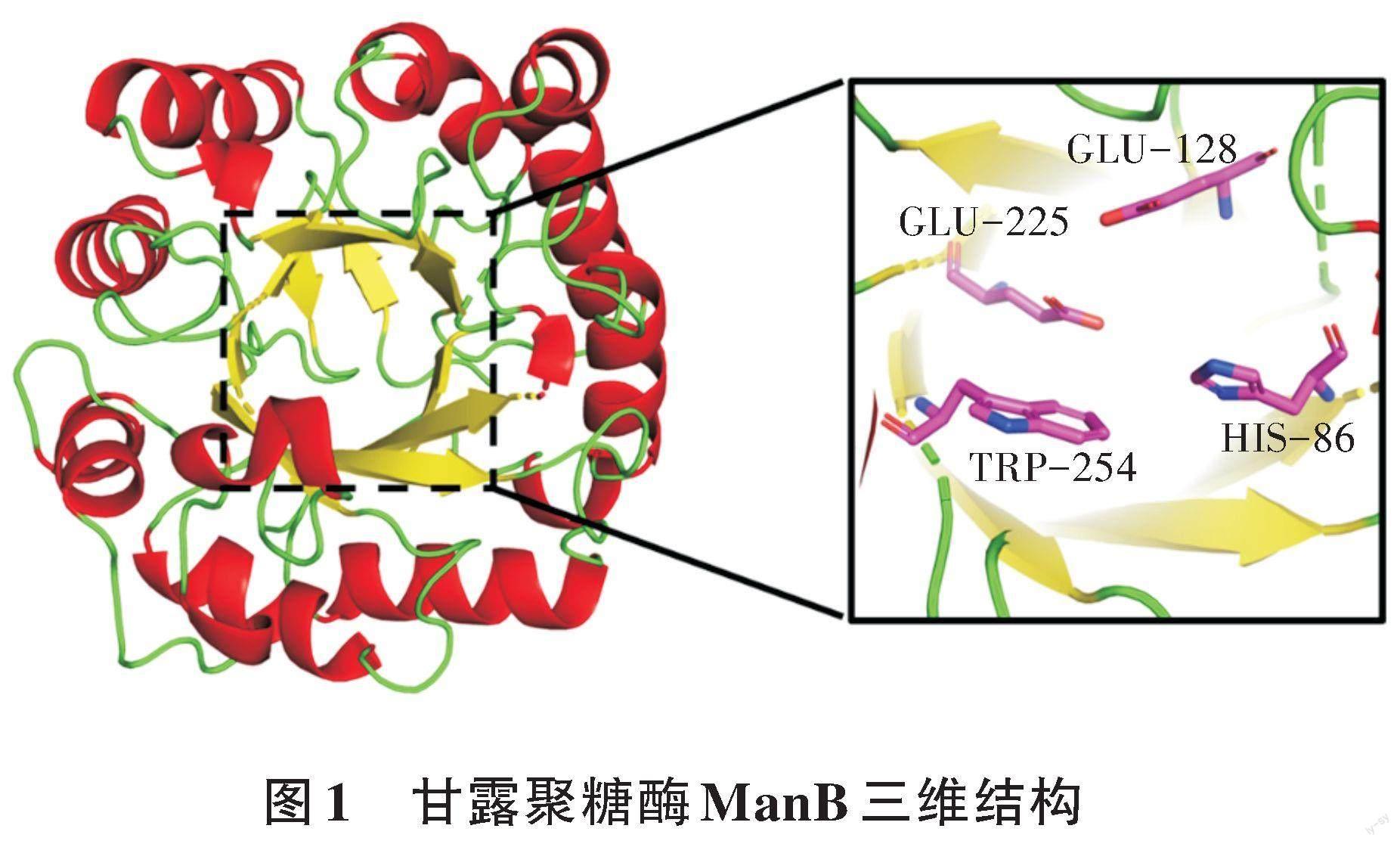
采用限制性內切酶EcoR I和Not I完成甘露聚糖酶突變株N16I的基因和分泌型表達載體pET-22b(+)雙酶切,再使用T4連接酶將兩者連接,構建重組表達質粒。將該重組表達質粒轉化大腸桿菌BL21感受態細胞,以PCR驗證法篩選出陽性克隆菌株,并測序驗證。驗證正確后發酵產酶,純化得到酶蛋白。目標甘露聚糖酶ManB的三維結構如圖1所示。
2.2 甘露聚糖酶的性質分析
2.2.1 甘露聚糖酶最適溫度的測定 由圖2可知,以0.5%角豆膠為底物,在pH 7.0和反應時間10 min的條件下,原甘露聚糖酶ManB的最適反應溫度在72.5 ℃左右,而同樣條件下突變體酶的最適反應溫度為77.5 ℃,顯示出突變酶的最適反應溫度明顯提高。
2.2.2 甘露聚糖酶的熱穩定性分析 由圖3可知,甘露聚糖酶ManB和其突變體均具有較好的耐熱性,在65 ℃處理30 min后仍無滅活現象。突變酶在70 ℃條件下處理后的殘余酶活力高于原酶,顯示出突變酶的耐熱性能明顯提高。
2.2.3 甘露聚糖酶Tm的測定 根據熒光值的變化來測定原酶和突變酶的Tm如圖4所示。由圖4可知,酶蛋白質的表觀解鏈溫度Tm從原酶的61.9 ℃提升到突變酶的 63.2 ℃。測定結果進一步證實了突變酶的耐熱性提高。
3 小結
本研究將Thermobifida fusca來源的β-甘露聚糖酶ManB在大腸桿菌BL21中進行了異源表達,并通過易錯PCR技術對該酶的基因序列進行了兩輪易錯PCR,得到突變體文庫。通過篩選獲得了一株性能較好的突變甘露聚糖酶N16I,并對其酶學性質進行了分析,其耐熱性得到了提升[13-15]。本研究為甘露聚糖酶的分子改造和生產提供了一定的依據和基礎。
參考文獻:
[1] 張建新,宋宜樂,馮軍廠,等. 微生物β-甘露聚糖酶的研究進展[J]. 中國釀造, 2019, 38(4): 7-10.
[2] 殷運菊,閆昭明,陳清華,等. β-甘露聚糖酶的結構、特性及其在畜禽生產中的應用[J]. 動物營養學報,2021,33(5):2535-2543.
[3] 陳曉飛,李珊珊,刁文濤,等. 高產β-甘露聚糖酶菌株的分離鑒定及酶學性質研究[J]. 中國釀造, 2021, 40(9): 92-97.
[4] WANG Y W, SHI P J, LUO H Y, et al. Cloning, over-expression and characterization of an alkali-tolerant endo-β-1,4-mannanase from Penicillium freii F63[J]. Journal of bioscience and bioengineering, 2012,113(6):710-714.
[5] 莊瀅潭,劉芮存,陳雨露,等. 極端微生物及其應用研究進展[J]. 中國科學:生命科學, 2022, 52(2): 204-222.
[6] 翁彩紅,韓業君. 極端微生物與生物制造[J]. 科學,2019,71(4):45-48.
[7] HILGE M., GLOOR S M, RYPNIEWSKI W, et al. High-resolution native and complex structures of thermostable β-mannanase from Thermomonospora fusca - substrate specificity in glycosyl hydrolase family 5[J]. Structure, 1998, 6: 1433-1444.
[8] ZENG J, HE C, GUO J, et al. Improvement of the catalytic activity of thermoacidophilic pullulan hydrolase type III by error-prone PCR technology[J]. Applied biochemistry and microbiology, 2022, 58(3): 277-285.
[9] WANG X C, YOU S P, ZHANG J X, et al. Rational design of a thermophilic β-mannanase from Bacillus subtilis TJ-102 to improve its thermostability[J]. Enzyme and microbial technology, 2018, 118: 50-56.
[10] WANG Y W, SHU T, FAN P, et al. Characterization of a recombinant alkaline thermostable β-mannanase and its application in eco-friendly ramie degumming[J]. Process biochemistry, 2017, 61: 73-79.
[11] 付 巧,林啟蘭,薛 強,等. N端截短CBM41對枯草芽孢桿菌來源普魯蘭酶酶學性質的影響[J]. 生物技術通報,2022,38(6):245-251.
[12] WANG Y W, WANG J, ZHANG Z Q, et al. High-temperature behavior of hyperthermostable Thermotoga maritima xylanase XYN10B after designed and evolved mutations[J]. Applied microbiology and biotechnology, 2022, 106:2017-2027.
[13] 羅長財,繆 靜,李國瑩,等. N-糖基化對一種新型重組耐高溫β-甘露聚糖酶(ReTMan26)穩定性的影響[J]. 微生物學通報, 2019, 46(1): 11-19.
[14] 張 蕊,朱 虹,周峻沛,等. β-甘露聚糖酶分子生物學研究進展[J]. 中國農業科技導報, 2018, 20(5): 34-46.
[15] 汪 斌, 張華山, 熊海容. 一株全基因合成的高溫嗜堿甘露聚糖酶的酶學性質分析[J]. 湖北農業科學,2017,56(12): 2356-2358.

