高溫響應基因MdMYB308 抑制蘋果花青苷合成
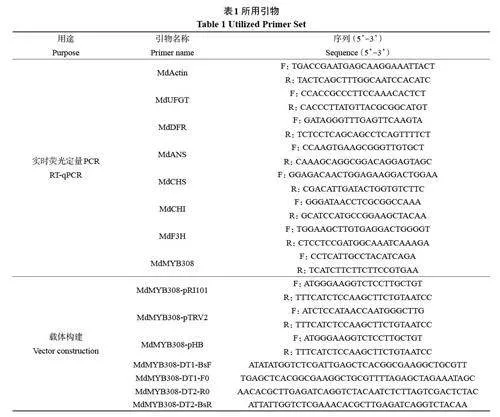
摘 要: 高溫抑制蘋果花青苷合成,從而影響果實的著色。本研究發(fā)現(xiàn)高溫條件下,MdMYB308 基因的表達被強烈誘導。通過亞細胞定位實驗,發(fā)現(xiàn)MdMYB308 定位在細胞核中。為了研究MdMYB308 的功能,我們利用過表達和CRISPR/Cas9 基因編輯技術(shù)對其進行了探究。結(jié)果顯示,MdMYB308 抑制了蘋果花青苷結(jié)構(gòu)基因的表達和花青苷合成,MdMYB308 在高溫抑制蘋果花青苷合成中起到了重要的作用,在耐高溫紅色蘋果育種中具有重要的應用潛力。
關(guān)鍵詞: 蘋果;高溫;花青苷;MdMYB308
中圖法分類號: S661.1 文獻標識碼: A 文章編號: 1000-2324(2024)06-0867-07色澤是蘋果的重要感官品質(zhì),尤其是那些鮮艷的紅色果實,一直以來都深受消費者的喜愛。然而,全球變暖,持續(xù)的高溫對紅色蘋果著色造成了很大影響[1]。因此,提升高溫環(huán)境下紅色蘋果品種的著色能力,對于應對全球變暖背景下蘋果著色難題具有至關(guān)重要的意義。
花青苷是蘋果果實呈現(xiàn)紅色的主要色素成分,其生物合成涉及到多個調(diào)控基因的復雜互作[2]。研究發(fā)現(xiàn),MYB、bHLH、WD40 家族轉(zhuǎn)錄因子通過形成一個保守的M-B-W 三元復合體,共同參與調(diào)控植物體內(nèi)花青苷的合成[3]。R2R3-MYB家族基因被認為是目前研究最為深入的花青苷調(diào)控基因[4]。在蘋果中,MdMYB1 負責調(diào)控蘋果果皮中花青苷的合成[5],而MdMYB10 基因控制紅肉蘋果花青苷生物合成[6]。
最近研究發(fā)現(xiàn),高溫環(huán)境可以通過調(diào)控R2R3-MYB家族基因的表達抑制花青苷的合成。例如,在菊花中,高溫誘導了CmMYB012 基因的表達,進而抑制了CmCHS、CmDFR、CmANS 和CmUFGT 基因的表達,減少了花青苷的合成[7]。在馬鈴薯中,高溫通過激活StMYB44基因的表達,降低了DFR 啟動子的活性,減少了花青苷的積累[8]。同樣,在蘋果中,高溫抑制了MdMYB10 的表達,導致花青苷積累減少[9]。此外,高溫還能激活MdCOL4 的表達,進而抑制MdMYB1 的表達,減少了蘋果果皮花青苷的積累[1]。盡管如此,高溫對蘋果花青苷合成的抑制作用中,負調(diào)控R2R3-MYB家族基因的具體角色尚不十分明確。
前期轉(zhuǎn)錄組分析研究發(fā)現(xiàn),R2R3-MYB基因MdMYB308 受高溫信號誘導,可能參與了高溫抑制蘋果花青苷合成[10]。因此,本研究旨在分析MdMYB308 在不同溫度條件下的表達模式,并通過構(gòu)建MdMYB308 過表達和敲除的轉(zhuǎn)基因蘋果,探究其在調(diào)控花青苷合成中的功能,旨在為高溫條件下培育易著色的蘋果新品種提供寶貴的基因資源。
1 材料與方法
1.1 試驗材料
采摘花后120 d‘Otome’蘋果,30 個果實為1 份,分為4 份,分別置于25 ℃、28 ℃、30 ℃、35 ℃,2×104 lx 光強的光照培養(yǎng)箱中處理9 d,隨后進行拍照并收獲果皮,液氮速凍,?80 ℃儲存。
‘王林’蘋果愈傷組織在含有0.8 mg L?1 6-BA和1.5 mg L?1 2,4-D 的Murashige-Skoog(MS)培養(yǎng)基上,25 ℃黑暗培養(yǎng),‘紫3’紅肉蘋果愈傷組織在含有0.3 mg L?1 NAA和1 mg L?1 6-BA 的Murashige-Skoog(MS)培養(yǎng)基上,25 ℃光照培養(yǎng)。并且每隔15 d 繼代1 次愈傷組織,用來進行遺傳轉(zhuǎn)化。
1.2 實驗方法
1.2.1 花青苷含量測定 稱取0.5 g 蘋果果皮或愈傷組織磨成粉末(液氮中),參照Bai 等[11]的方法對花青苷提取和測定。
1.2.2 亞細胞定位 將MdMYB308 CDS 連接到pHB-GFP 載體上,將重組載體轉(zhuǎn)化到根癌農(nóng)桿菌GV3101 細胞中。陽性菌OD600培養(yǎng)到1.0~1.5時,8 000 r/min 離心10 min,收集菌體。MdMYB308-pHB 菌株重懸(OD600=0.6~0.8)于含有10 mM MES、10 mM MgCl2和150 μM乙酰丁香酮的侵染緩沖液中,黑暗靜置2.5 h,注入本氏煙草葉片。以空載體為對照。引物參見表1。
1.2.3 RNA 提取和RT-qPCR 使用Total RNARapid Extraction Kit (Zomanbio,北京,中國)從樣品中提取總RNA,然后使用PrimeScript RTReagent Kit (Takara,大連,中國)反轉(zhuǎn)錄生成第一鏈cDNA。我們使用SYBR Premix Ex Taq Ⅱ(Takara,大連,中國)進行RT-qPCR 分析。以蘋果Actin(AB638619.1)為內(nèi)參。采用2?ΔΔCT 法進行定量數(shù)據(jù)分析。引物參見表1。
1.2.4 瞬時轉(zhuǎn)化蘋果果實 將MdMYB308 CDS插入到pRI101 載體,從MdMYB308 CDS 的3'端選取300 bp CDS片段插入pTRV2 載體。將重組質(zhì)粒轉(zhuǎn)化到根癌農(nóng)桿菌GV3101 細胞中[12]。將含有MdMYB308-TRV和MdMYB308-pRI 的農(nóng)桿菌菌液分別注射到花后100 d 和140 d 的‘Otome’果皮。黑暗放置過夜,轉(zhuǎn)移到2×104 lx光照條件下,5 d 后進行表型觀察并取樣,測定花青苷含量并進行qRT-PCR分析。引物參見表1。
1.2.5 CRISPR/Cas9 基因敲除載體構(gòu)建 利用在線網(wǎng)站(http://www.crisprscan.org/?page=sequence)設計MdMYB308 CRISPR/Cas9 靶標及引物,將目標序列插入到pHSE401 載體中,具體操作步驟參照Ko等人[13]所述。
1.2.6 蘋果愈傷組織遺傳轉(zhuǎn)化與鑒定 將MdMYB308 過表達和CRISPR/Cas9 基因敲除載體轉(zhuǎn)化到根癌農(nóng)桿菌GV3101 細胞中,將陽性菌株與繼代15 d 的‘紫3’紅肉和‘王林’蘋果愈傷組織室溫孵育20 min,置于繼代培養(yǎng)基中,過夜培養(yǎng),第2 d 將愈傷組織平鋪于抗性培養(yǎng)基中進行篩選。進一步利用PCR、RT-qPCR、westernblotting 和二代測序鑒定陽性轉(zhuǎn)基因蘋果愈傷株系。引物參見表1。
1.2.7 數(shù)據(jù)統(tǒng)計分析 每個試驗設置包含三個生物學重復,并使用t檢驗進行統(tǒng)計分析。
2 結(jié)果與分析
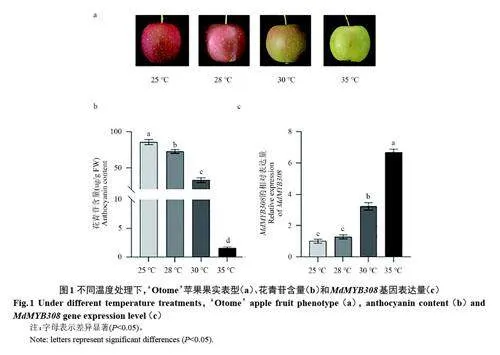
2.1 高溫誘導‘Otome’果實MdMYB308 的表達水平,抑制花青苷積累
如圖1 所示,隨著處理溫度的升高,蘋果花青苷積累量降低。MdMYB308 表達量變化趨勢與之相反。其中,35 ℃處理組MdMYB308 表達量最高。說明高溫促進了MdMYB308 的表達,進而影響了花青苷合成。
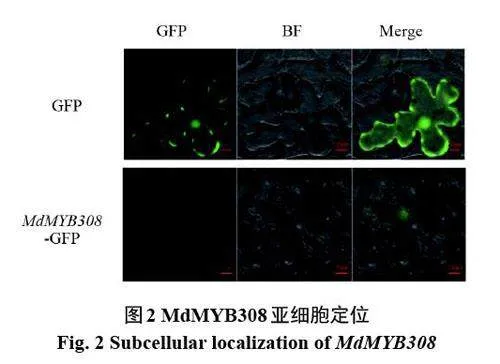
2.2 MdMYB308亞細胞定位
如圖2 所示,構(gòu)建35S::MdMYB308-GFP 亞細胞定位載體,以空載體為對照,將重組質(zhì)粒轉(zhuǎn)化到根癌農(nóng)桿菌GV3101 細胞中,轉(zhuǎn)染煙草葉片。通過煙草瞬時轉(zhuǎn)染實驗在細胞核中發(fā)現(xiàn)了GFP 熒光信號,表明MdMYB308 在細胞核中表達。
2.3 MdMYB308抑制蘋果花青苷合成
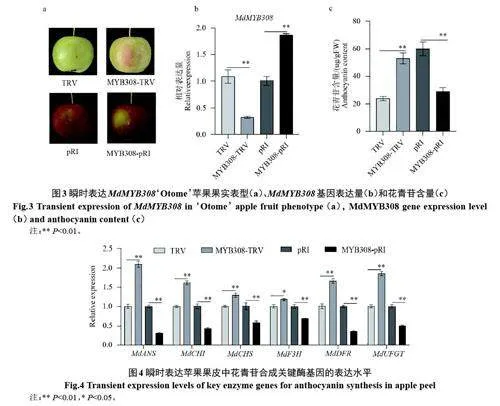
2.3.1 MdMYB308 抑制蘋果果皮花青苷積累和關(guān)鍵酶基因表達 與對照(TRV)相比,瞬時沉默MdMYB308 的‘Otome’蘋果果皮花青苷積累增加,促進果實著色;相反,瞬時過表達MdMYB308的‘Otome’蘋果果皮花青苷積累明顯低于對照(pRI),抑制著色(圖3)。
如圖4 所示,qRT-PCR 分析表明,沉默表達MdMYB308 后,蘋果果皮中花青苷合成關(guān)鍵酶基因的表達明顯被促進。相反,過表達MdMYB308明顯抑制蘋果果皮中花青苷合成關(guān)鍵酶基因的表達。
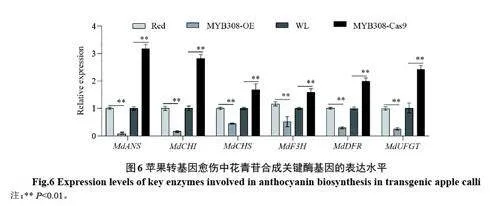
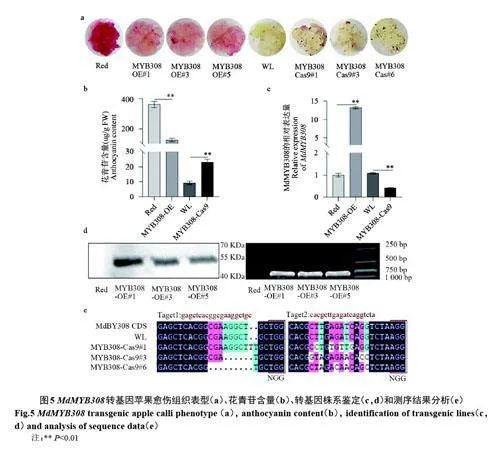
2.3.2 MdMYB308 抑制蘋果愈傷組織中花青苷積累和關(guān)鍵酶基因表達 如圖5 所示,獲得3 個MdMYB308 超表達‘紫3’紅肉蘋果愈傷愈傷株系(MdMYB308-OE#1/3/5)和3 個敲除MdMYB308‘王林’蘋果愈傷株系(MdMYB308-Cas9#1/3/6)。結(jié)果顯示,MdMYB308-OE#1/3/5 蘋果愈傷組織中花青苷含量明顯低于野生型(Red);而與野生型(WL)相比,敲除MdMYB308-Cas9#1/3/6 蘋果愈傷組織中花青苷的積累顯著增加。
如圖6 所示,qRT-PCR 分析表明,過表達MdMYB308 蘋果愈傷組織中,花青苷合成關(guān)鍵酶基因的表達明顯收到抑制。相反,敲除MdMYB308 基因明顯促進蘋果愈傷組織中花青苷合成關(guān)鍵酶基因的表達(圖6)。以上結(jié)果說明MdMYB308 從轉(zhuǎn)錄水平抑制了蘋果花青苷合成。
3 討論
高溫是影響蘋果著色的重要環(huán)境因素。前人研究發(fā)現(xiàn),高溫可以通過抑制蘋果花青苷正調(diào)控R2R3-MYB基因的表達,抑制花青苷的合成。高溫可以抑制蘋果花青苷正調(diào)控基因MdMYB10的表達,抑制果實花青苷合成和著色[9]。高溫還可以通過誘導MdCOL4 的表達,抑制花青苷正調(diào)控基因MdMYB1 的表達,進而降低蘋果果皮中花青苷的積累[1]。本研究中,我們發(fā)現(xiàn)高溫誘導R2R3-MYB 負調(diào)控基因MdMYB308 表達,抑制蘋果花青苷合成。可見,高溫抑制蘋果著色涉及多個正負調(diào)控基因信號途徑。這些結(jié)果為培育高溫條件下易著色蘋果新品種提供了多個潛在基因靶點。
大量研究表明,HSFA 在植物高溫響應中起關(guān)鍵作用[14]。HSFA1a、HSFA1b、HSFA1d 和HSFA1e 被認為是植物熱應激反應中不可或缺的主調(diào)節(jié)因子[15,16]。在擬南芥中,HsfA6a 能夠與MYB102 啟動子序列結(jié)合,調(diào)控MYB102 的表達[17]。在轉(zhuǎn)錄組數(shù)據(jù)組,我們發(fā)現(xiàn)高溫誘導MdHSFA 和MdMYB308 基因表達。但是至目前為止,尚不清楚MdHSFA與MdMYB308 之間是否存在調(diào)控關(guān)系,今后進一步揭示MdMYB308 的上游高溫響應途徑,將對我們深入認識高溫抑制蘋果花青苷合成機制具有重要意義。
除轉(zhuǎn)錄調(diào)控外,高溫還通過蛋白水平調(diào)控植物生理反應。葡萄中,高溫可以提升過氧化物酶活性,降解花青苷[18]。鑒于葡萄的結(jié)果,我們有理由推測高溫也可能引起蘋果過氧化物酶等活性升高導致了花青苷降解。未來的研究可以進一步探究高溫引起的蛋白水平調(diào)控機制,以全面了解高溫對蘋果著色的影響。
參考文獻
[1] Fang H, Dong Y, Yue X, et al. MdCOL4 interaction
mediates crosstalk between UV-B and high
temperature to control fruit coloration in apple [J].
Plant, Cell amp; Physiology, 2019, 60(5): 1055-1066.
[2] Outchkourov NS, Karlova R, H?lscher M, et al.
Transcription factor-mediated control of anthocyanin
biosynthesis in vegetative tissues [J]. Plant
Physiology, 2018, 176(2): 1862-1878.
[3] Nesi N, Jond C, Debeaujon I, et al. The Arabidopsis
TT2 gene encodes an R2R3 MYB domain protein
that acts as a key determinant for proanthocyanidin
accumulation in developing seed [J]. Plant Cell,
2001, 13(9): 2099-2114.
[4] Wu Y, Wen J, Xia Y, et al. Evolution and functional
diversification of R2R3-MYB transcription factors in
plants [J]. Horticulture Research, 2022, 9: uhac058.
[5] Takos AM, Jaffé FW, Jacob SR, et al. Light-induced
expression of a MYB gene regulates anthocyanin
biosynthesis in red apples [J]. Plant Physiology,
2006, 142(3): 1216-1232.
[6] Espley RV, Hellens RP, Putterill J, et al. Red
colouration in apple fruit is due to the activity of the
MYB transcription factor, MdMYB10 [J]. The Plant
Journal, 2007, 49(3): 414-427.
[7] Zhou LJ, Geng Z, Wang Y, et al. A novel
transcription factor CmMYB012 inhibits flavone and
anthocyanin biosynthesis in response to high
temperatures in chrysanthemum [J]. Horticulture
Research, 2021, 8(1): 248.
[8] Liu Y, Lin-Wang K, Espley RV, et al. StMYB44
negatively regulates anthocyanin biosynthesis at high
temperatures in tuber flesh of potato [J]. Journal of
Experimental Botany, 2019, 70(15): 3809-3824.
[9] Lin-Wang K, Micheletti D, Palmer J, et al. High
temperature reduces apple fruit colour via modulation
of the anthocyanin regulatory complex [J]. Plant, Cell
amp; Environment, 2011, 34(7): 1176-1190.
[10] Bu YF, Wang S, Li CZ, et al. Transcriptome Analysis
of Apples in High-Temperature Treatments Reveals a
Role of MdLBD37 in the Inhibition of Anthocyanin
Accumulation [J]. International Journal of Molecular
Sciences, 2022, 23(7): 3766.
[11] Bai S, Saito T, Honda C, et al. An apple B-box
protein, MdCOL11, is involved in UV-B- and
temperature-induced anthocyanin biosynthesis [J].
Planta, 2014, 240(5): 1051-1062.
[12] Jiang S, Chen M, He N, et al. MdGSTF6, activated
by MdMYB1, plays an essential role in anthocyanin
accumulation in apple [J]. Horticulture Research,
2019, 6: 40.
[13] Ko HY, Ho LH, Neuhaus HE, et al. Transporter
SlSWEET15 unloads sucrose from phloem and seed
coat for fruit and seed development in tomato [J].
Plant Physiology, 2021, 187(4): 2230-2245.
[14] Friedrich T, Oberkofler V, Trindade I, et al.
Heteromeric HSFA2/HSFA3 complexes drive
transcriptional memory after heat stress in Arabidopsis
[J]. Nature Communications, 2021, 12(1): 3426.
[15] Scharf KD, Berberich T, Ebersberger I, et al. The
plant heat stress transcription factor(Hsf) family:
structure, function and evolution [J]. Biochimica Et
Biophysica Acta-Biomembranes, 2012, 1819(2):
104-119.
[16] Ohama N, Sato H, Shinozaki K, et al. Transcriptional
Regulatory Network of Plant Heat Stress Response [J].
Trends in Plant Science, 2017, 22(1): 53-65.
[17] Zhao PX, Zhang J, Chen SY, et al. Arabidopsis
MADS-box factor AGL16 is a negative regulator of
plant response to salt stress by downregulating saltresponsive
genes [J]. The New phytologist, 2021,
232(6): 2418–2439.
[18] Movahed N, Pastore C, Cellini A, et al. The
grapevine VviPrx31 peroxidase as a candidate gene
involved in anthocyanin degradation in ripening
berries under high temperature [J]. Journal of Plant
Research, 2016, 129(3): 513-526.

