腸外營養支持中添加結構脂肪乳對胃癌患者術后胃腸功能恢復、免疫功能及肝功能的影響
丁曉平,侯艷,姜如月
(青島市市立醫院東院營養科,山東 青島 266071)
近年來,我國胃腸道腫瘤發病率升高,臨床主要通過手術治療[1]。胃癌患者因為腫瘤消耗嚴重,普遍存在營養攝入不足的情況,患者往往伴有進行性體重下降,免疫功能下降,并在經歷術前禁食、手術創傷后,營養和免疫狀態進一步惡化,不利于患者術后恢復[2]。腸外營養支持干預有利于患者術后營養維持,促進創傷愈合,降低并發癥風險,因此被廣泛用于胃腸道腫瘤手術患者中[3]。作為腸外營養重要組成部分,脂肪乳可減少葡萄糖用量,加強脂肪乳供能,提高氨基酸利用水平,改善氮平衡。隨著研究深入,不同配方脂肪乳劑產品相繼被應用于腸外營養支持中,結構脂肪乳將中鏈、長鏈脂肪酸混合并降解,在酶的催化下形成新型脂肪乳劑,克服二者獨立代謝缺點[4]。本研究將結構脂肪乳應用于胃癌術后腸外營養中,并通過與物理混合的中/長鏈脂肪乳劑比較,試闡述結構脂肪乳應用價值。
1 資料與方法
1.1 一般資料
回顧性分析2019年5月至2022年11月青島市市立醫院收治的186例胃癌行手術治療患者的臨床資料。根據腸外營養支持脂肪乳劑配方,將給予結構脂肪乳的患者納入A組(n=95);給予物理混合的中/長鏈脂肪乳者納入B組(n=91)。兩組患者一般資料比較,差異無統計學意義(P>0.05)。見表1。
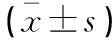
表1 兩組患者一般資料比較
1.2 納入標準
(1)符合《胃癌規范化診療指南》胃癌診斷[5],經病理活檢確診,并于本院接受腹腔鏡根治手術;(2)影像學顯示未發生腫瘤遠處轉移;(3)術前無肺部與其他臟器感染;(4)入組前未接受放療和化療等;(5)預計生存期在3個月以上;(6)醫院倫理委員會批準,患者及家屬同意并簽字。
1.3 排除標準
(1)入組前接受放化療治療;(2)合并其他類型腫瘤;(3)合并其他嚴重器質疾病;(4)合并嚴重腸道感染、腸梗阻等;(5)合并急性胰腺炎、膽囊炎等;(6)合并免疫或血液系統疾病;(7)合并糖脂代謝異常等代謝性疾病。
1.4 方法
兩組患者術后均給予等氮、等熱量腸外營養,腸外營養總非蛋白質由葡萄糖、脂肪乳提供,總熱量83.68 kJ·kg-1·d-1,葡萄糖和脂肪熱量比為1∶1,脂肪1.0 g·kg-1·d-1。B組采用20%物理混合中/長鏈脂肪乳(中鏈、長鏈脂肪乳各占50%,貝朗制藥有限公司);A組給予20%結構脂肪乳注射液(中鏈脂肪乳36%,長鏈脂肪乳64%,華瑞制藥有限公司)。所有氮源均由復方氨基酸注射液提供(8.5%樂凡命,華瑞制藥有限公司),氮量(g):非蛋白質熱量(kcal) 為1∶133。“全合一”營養液中心(周圍)靜脈輸注,第1d輸注營養需要量的1/2,2~6 d全量輸注,每日持續輸注18~20 h,連續6 d。
1.5 觀察指標
患者腸外營養支持前(營養輸注前)、腸外營養支持6 d后采集外周靜脈血5 mL,儀器為日本日立公司7600型全自動生化分析儀及美國BECTON公司 FACS流式細胞儀。(1)營養指標:采用速率散射免疫比濁法檢測血清總蛋白(Total protein,TP)、轉鐵蛋白(transfer-rin,Trf)、前白蛋白(prealbumin,Palb)、白蛋白(albumin,Alb)水平。(2)胃腸激素指標:通過放射免疫法檢測胃動素(MOT)、促胃液素(GAS)、胃蛋白酶原Ⅰ/Ⅱ(PGⅠ/Ⅱ)水平,計算PGⅠ/ PGⅡ比值。(3)免疫功能:采用流式細胞儀檢測患者血液樣本CD3+,CD4+,CD8+水平,計算CD4+/CD8+水平。(4)炎性指標:酶聯免疫吸附法檢測血清白細胞介素6 (interleukin-6,IL-6)、腫瘤壞死因子α (tumor necrosis factor-α,TNF-α)、C反應蛋白(C-reactive protein,CRP)水平。(5)肝功能指標:丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、天冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、總膽紅素(total bilirubin,TBIL)和直接膽紅素(direcrt bilirubin,DBIL)含量檢測采用酶偶聯法。(6)不良反應:比較兩組患者患者不良反應發生情況。
1.6 統計學分析
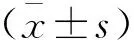
2 結果
2.1 兩組患者營養指標比較
兩組患者支持前血TP、ALB、TFN、Hb水平比較,差異均無統計學意義(P>0.05)。腸外營養支持6 d后,A組TP、ALB、TFN、Hb水平均高于B組(P<0.05)。見表2。

表2 兩組患者營養指標比較
2.2 兩組患者胃腸激素水平比較
兩組患者支持前血漿胃腸激素水平比較,差異均無統計學意義(P>0.05)。兩組患者腸外營養支持6 d后,血漿MOT、GAS、PGⅠ、PGⅠ/PGⅡ水平較支持前均升高(P<0.05),且A組高于B組(P<0.05)。見表3。
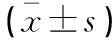
表3 兩組患者血漿胃腸激素水平比較
2.3 兩組患者免疫功能比較
兩組患者支持前細胞免疫功能比較,差異均無統計學意義(P>0.05)。腸外營養支持6 d后,A組血CD3+、CD4+及CD4+/CD8+水平均高于B組(P<0.05)。見表4。
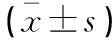
表4 兩組患者免疫功能比較
2.4 兩組患者炎性指標水平比較
兩組患者支持前炎性指標水平比較,差異均無統計學意義(P>0.05)。腸外營養支持6 d后,兩組患者炎性指標TNF-α、IL-6、CRP水平均降低,且A組低于B組(P<0.05)。見表5。
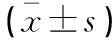
表5 兩組患者炎性指標水平比較
2.5 兩組患者肝功能指標水平比較
兩組患者支持前肝功能指標水平無統計學差異(P>0.05)。腸外營養支持6 d后,A組ALT、AST、TBiL、DBiL水平均低于B組(P<0.05)。見表6。
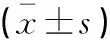
表6 兩組患者肝功能指標比較
2.6 兩組患者不良反應發生情況比較
B組中6例患者出現腹瀉,經治療后好轉,3例患者出現腹脹,自行緩解;A組中5例患者出現腹瀉,1例出現腹脹,經治療后好轉。兩組患者不良反應發生率比較,差異無統計學意義(χ2=0.801,P=0.371)。
3 討論
據調查[6]顯示,胃癌在全球的分布主要集中在東亞地區,中國是胃癌的高發區,據調查統計顯示我國新增胃癌人數以及由于胃癌導致死亡的人數占全球40%以上。目前胃癌治療臨床主要通過根治性手術切除和胃周淋巴結清掃,然而胃癌手術范圍較大,術后患者恢復較為困難。胃癌患者食量、消化功能均較差,腫瘤促進免疫抑制因子分泌,手術也在一定程度上損害機體免疫,患者均發生不同程度的營養不良,影響其術后恢復[7]。
營養支持是治療創傷、感染、中毒等一系列危重癥的重要舉措,脂肪乳劑屬于較為理想的供能物質之一[8]。目前,臨床應用的中/長鏈混合的脂肪乳劑包括兩種,一種為中/長鏈脂肪乳劑,另一種則是結構脂肪乳,二者理化性質、代謝均存在明顯差異[9]。長鏈肪乳劑可為機體提供能量以及必需的脂肪酸;中鏈脂肪乳劑在人體內具有水解氧化速度快、代謝過程不需肉毒堿參與、對免疫系統影響較小等一系列優點[10]。中/長鏈脂肪乳劑在人體是中鏈、長鏈脂肪乳的分別代謝,二者在體內的代謝可能彼此干擾,中鏈水解后會搶占水解酶,使長鏈水解過程變慢[11]。結構脂肪乳屬于新型脂肪乳,即將中鏈、長鏈脂肪乳經高溫、催化劑作用,水解后再酯化,形成6種結構的甘油三酯,其中4種同時包含中鏈、長鏈脂肪酸,其均一性明顯優于中/長鏈脂肪乳劑[12]。
本研究中兩種腸外營養支持均能促進機體營養狀況改善,但結構脂肪乳患者在支持后TP、ALB、TFN、Hb水平均高于中/長鏈脂肪乳劑營養支持患者,與李玉芹等[13]研究結果一致,這可能是由于結構脂肪乳水解速度快且氧化較為完全,供能迅速,提示在蛋白質代謝方面結構脂肪乳更優。本研究中兩組患者術后A組支持后6 d時血漿胃腸激素指標MOT、GAS、PGⅠ、PGⅠ/PGⅡ水平高于B組,表明結構脂肪乳相較于物理混合的中/長鏈脂肪乳更有利于,促進胃腸蠕動,促進患者胃腸功能恢復,改善患者營養狀態。一項Meta分析[14]證實,與中長鏈脂肪乳比較,結構脂肪乳的應用更為安全有效,且對肝功能有益。本研究把結構脂肪乳應用于胃癌術后營養支持患者,發現A組支持后ALT、AST、TBiL、DBiL水平低于B組,這可能是因為中長鏈脂肪乳不均衡代謝使得甘油三酯等蓄積,加重肝臟以及腎臟負擔;結構脂肪乳水解勻速,對肝功能影響較小。
相關臨床研究[15]表明,與中長鏈脂肪乳劑相比,結構脂肪乳可糾正胃腸道腫瘤患者術后免疫抑制,對提高細胞免疫功能具有重要意義。CD3+、CD4+、CD8+是最常見的 T 淋巴細胞亞群,CD4+與CD8+二者相互誘導、制約,CD4+下降、CD8+水平增加或CD4+/CD8+降低時,機體淋巴細胞活化輔助、 B 淋巴細胞抗體生成協助功能下降、抑制性T淋巴細胞增多,致使機體免疫下降[16]。本研究結果顯示,A組支持后血CD3+、CD4+以及CD4+/CD8+水平均高于B組,也提示結構脂肪乳劑更有利于術后患者機體細胞免疫功能恢復,與上述研究結果一致。機體炎癥不利于患者術后康復,胃癌術后,機體炎癥主要與手術創傷有關。CRP是機體敏感的炎癥指標;IL-6參與炎癥反應的發生和進展;TNF-α是一種由活化的單核細胞分化出來的細胞因子,具多種免疫功能,可介導炎癥反應過程。本研究中A組支持后TNF-α、IL-6、CRP水平低于B組,這一結果提示,胃癌根治術后,采用結構性脂肪乳作為腸外營養支持物質能更好地減輕術后機體炎癥狀態,這與結構性脂肪乳免疫改善、術后營養水平提升,同時不引起炎癥反應有關。
綜上,結構脂肪乳用于胃癌術后腸外營養相較于物理混合的中/長鏈脂肪乳可改善患者營養狀態,加快胃腸功能恢復,減輕患者炎性反應,提高免疫功能,患者術后肝功能異常風險降低。

