腸道菌群水平與早產極低出生體重新生兒壞死性小腸結腸炎預后的相關性
賈益,應海燕,李少芳
(漢中三二〇一醫院新生兒科,陜西 漢中 723000)
壞死性小腸結腸炎(necrotizing enterocolitis,NEC)是一種好發于早產兒的胃腸道危重癥,在活產兒中,NEC發病率僅為1‰~3‰,但早產兒NEC發病率增至6%~10%,且低出生體重、胎齡過小、呼吸機輔助通氣時間過長均可導致NEC發生風險上升[1]。數據[2]顯示,極低出生體重兒NEC發病率高達3%~14%,同時,合并NEC的早產兒死亡率高達46.5%~48.0%。隨著產科和新生兒管理技術的提高,早產極低出生體重兒的存活率升至93.6%,但新生兒NEC發病率仍居高不下,且短腸綜合征、腸梗阻等并發癥不僅導致患兒長期依賴腸外營養,也使其神經系統發育受阻、生長發育面臨嚴重威脅[3]。有學者[4]認為,腸道菌群定植直接影響著NEC的發生發展,早產兒、極低出生體重兒腸道菌群定植延遲、腸道微生態失調均與NEC有關。本研究擬進一步明確腸道菌群水平與早產極低出生體重新生兒合并NEC患兒預后的關聯。
1 資料與方法
1.1 一般資料
選取2020年1月至2022年12月漢中三二〇一醫院收治的105例早產極低出生體重合并NEC患兒為研究對象并設為NEC組。納入標準:(1)胎齡<35周;(2)符合極低出生體重兒標準[5]:出生體重<1 500 g;(3)出生后24 h內入住新生兒重癥監護病房(NICU);(4)明確NEC診斷[6]:存在體溫不穩、呼吸暫停、心動過緩、嗜睡等全身表現,伴胃潴留、腹脹、嘔吐、糞便潛血等胃腸道表現,影像學檢查示腸擴張、腸梗阻、腸壁積氣。排除標準:(1)合并先天性消化道畸形;(2)合并腹瀉或染色體異常;(3)合并非NEC相關性腸穿孔;(4)入院后12 h內死亡或1周內自動出院;(5)接受口服益生菌干預。選取同期30例早產極低出生體重新生兒納入對照組,篩選標準與NEC組(1)~(3)一致,排除標準與NEC組(1)~(5)一致且排除合并NEC或繼發NEC患兒。兩組新生兒一般資料比較,差異無統計學意義(P>0.05)。見表1。
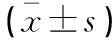
表1 NEC組與對照組新生兒臨床資料比較
1.2 治療方法
NEC組、對照組新生兒均接受常規治療及新生兒管理、喂養。根據NEC組患兒并發癥發生情況給予對應治療策略[7]:保守治療包括腸道休息、禁食等,腹脹、發熱、便血活動期禁食水;待患兒嘔吐癥狀消失、便血好轉、腹脹消除后給予低滲透壓流質飲食,并逐漸增加攝入量。禁食期間持續給予高營養液靜脈輸注,包括10%葡萄糖、復方氨基酸、水解蛋白等。若患兒出現嚴重腹脹,給予M膽堿受體阻斷藥;病情嚴重者酌情給予糖皮質激素、抗生素干預,以抑制炎癥反應、免疫反應、預防或治療感染。若患兒合并門靜脈積氣、穿孔、腹膜刺激癥等嚴重并發癥且保守治療未見好轉,則及時予以手術治療,手術方案包括壞死部分腸管切除聯合腸吻合、造瘺,或腸外置管后切除壞死腸管聯合腸造瘺等,患兒手術均由同組醫師完成。NEC組105例患兒中,71例接受保守治療,34例在保守治療的基礎上接受手術治療。
1.3 觀察指標

此外,按照NEC組患兒預后,將其分別納入存活組、死亡組,計算患兒死亡率并比較存活組、死亡組治療前炎性因子及腸道菌群水平差別,探究不同預后患兒腸道菌群水平差異特點。
1.4 統計學分析
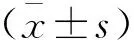
2 結果
2.1 NEC組與對照組新生兒實驗室指標比較
NEC組大便潛血陽性、HCO3-<21 mmol/L、血培養陽性、C-反應蛋白>10 mg/L、血小板計數>100×109/L、白細胞計數<5×109/L、白細胞計數>20×109/L比例均高于對照組,差異有統計學意義(P<0.05)。見表2。

表2 NEC組與對照組新生兒實驗室指標比較[n(%)]
2.2 NEC組與對照組炎性因子比較
NEC組IL-1β、IL-6、IL-10、TNF-α均高于對照組,差異有統計學意義(P<0.05)。見表3。

表3 NEC組與對照組新生兒炎性因子指標比較
2.3 NEC組與對照組腸道菌群水平比較
NEC組厚壁菌門、梭菌綱豐度及Shannon指數均高于對照組;變形菌門豐度、γ-變形菌綱豐度低于對照組,差異有統計學意義(P<0.05)。見表4。
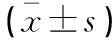
表4 NEC組與對照組新生兒腸道菌群水平比較
2.4 預后情況比較
NEC組105例患兒中,存活74例,死亡31例,死亡率29.52%。存活組大便潛血陽性、HCO3-<21 mmol/L、血培養陽性、C-反應蛋白>10 mg/L、白細胞計數<5×109/L、白細胞計數>20×109/L比例均低于死亡組,其IL-1β、IL-6、IL-10、TNF-α均低于死亡組,且厚壁菌門、梭菌綱豐度及Shannon指數均低于死亡組;存活組變形菌門豐度、γ-變形菌綱豐度高于死亡組,差異有統計學意義(P<0.05)。見表5-表7。

表5 存活組與死亡組新生兒實驗室指標比較[n(%)]

表6 存活組與死亡組新生兒炎性因子指標比較
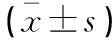
表7 存活組與死亡組新生兒腸道菌群水平比較
3 討論
近年來,越來越多的研究[9]顯示,早產極低出生體重新生兒細菌定植模式改變,與腸道微生態失衡及NEC的發生密切相關。
既往研究[10]顯示,低體重、喂養不當、早產等因素均可導致腸道外源性病原體局部富集能力增強,此時B毒素Welchiii桿菌殘氣莢膜桿菌以及產毒性自身菌群平衡嚴重失調,與小腸壁缺血壞死有關。隨著缺血壞死腸段的增多,病變逐漸累及結腸、回腸、空腸等解剖結構,進而引發廣泛性病變,是導致常規解痙、抗炎、免疫抑制等保守治療效果受限的主要原因[11]。雖然本研究34例患兒接受手術治療,但105例NEC患兒的死亡率仍高達29.52%,與過往報道[12]數據接近,表明,合并NEC的早產極低出生體重新生兒死亡率較高,且即便行手術治療亦難以提升患兒生存質量。因此,進一步明確NEC的發病機制及影響患兒預后的相關因素尤為重要。
本研究就NEC患兒與未合并NEC的早產極低出生體重新生兒實驗室指標、炎性因子指標進行了對比,發現NEC患兒普遍存在實驗室指標異常,并以白細胞、血小板數量改變為主,同時,患兒往往合并顯著機體炎癥反應。有學者[13]認為,IL-6、TNF-α等炎性因子不僅參與了NEC的發生發展,也與患兒預后密切相關:例如,IL-1β、TNF-α直接參與T淋巴細胞的誘導分化,與腸道黏膜損傷及保護性因子修復抑制有關。
除實驗室指標、炎性因子外,NEC患兒亦存在明顯腸道菌群水平變化,并以厚壁菌門、梭菌綱豐度上升,及變形菌門、γ-變形菌綱豐度下降為主要變化,同時伴隨著Shannon的上升。這一變化一方面意味著NEC患兒腸道菌群定植模式存在明顯異常,另一方面,腸道菌群失調也直接導致一氧化氮、超氧自由基生成增多,進而造成腸黏膜損傷加劇[14]。腸黏膜損傷導致硝酸鹽生成減少、專性厭氧菌利用物質不足,進一步加劇炎性反應進展[15]。本研究結果示,死亡組患兒腸道菌群水平變化更為明顯,印證了上述結論。
綜上,合并NEC的早產極低出生體重兒普遍存在腸道功能、血常規相關指標異常及炎癥反應、腸道菌群失調,且上述變化越顯著,患兒預后越差。

