新疆克孜勒河4種裂腹魚形態差異比較




收稿日期:2022-03-21""""" 修回日期:2023-05-12
基金項目:國家自然科學基金(31560721,31860729);國家級大學生創新創業訓練計劃項目(202010757007);新疆生產建設兵團中青年科技創新領軍人才計劃項目(2018CB033);塔里木大學校長基金創新研究團隊項目(TDZKCX202204);中國海洋大學-塔里木大學聯合基金項目(ZHYLH201902)。
作者簡介:張瑞,1998年生,女,本科生,專業方向為水產養殖。E-mail: 2465228559@qq.com
趙賀,1996年生,男,碩士研究生,專業方向為水生生物資源保護與利用。E-mail: 1742961937@qq.com
通信作者:聶竹蘭,女,教授。E-mail:niezhl2004@126.com
DOI:10.15928/j.1674-3075.202203210083
摘要:對新疆克孜勒河(Kizil River)流域4種裂腹魚形態差異和生長特性進行比較分析,從形態特征上為群體的劃分提供科學數據,為裂腹魚的培育和種質資源保護提供理論依據。以2020 年7 月-2021 年8 月采自克孜勒河塔里木裂腹魚(Schizothorax biddulphi)、寬口裂腹魚(Schizothorax eurystomus)、厚唇裂腹魚(Schizothorax irregularis)和斑重唇魚(Diptychus maculates)共126尾個體為研究對象,通過傳統形態測量學和基于地標點的幾何形態測量學分析方法比較克孜勒河4種裂腹魚的生長特性與形態差異。結果顯示:4種裂腹魚共有13個形態特征的平均值存在顯著差異,且主要集中于頭部、軀干部和尾部;利用tpsRegr軟件的網格變形分析,4種裂腹魚的形態差異主要體現在頭部和尾部,其中斑重唇魚魚體較為纖細,頭部偏小;通過主成分分析發現厚唇裂腹魚、塔里木裂腹魚和寬口裂腹魚形態較為相近,而斑重唇魚明顯獨立成一組群;聚類分析結果顯示塔里木裂腹魚群體和厚唇裂腹魚群體首先聚為一支,再與寬口裂腹魚聚為一支,最后與斑重唇魚聚類。研究結果顯示4種裂腹魚群體存在形態差異,且與其地理分布密切相關。
關鍵詞:裂腹魚;形態特征;地標點法;多變量形態測量學;克孜勒河
中圖分類號:S917.4"""""" 文獻標志碼:A""""""" 文章編號:1674-3075(2024)04-0099-09
克孜勒河(Kizil River)發源于塔吉克斯坦境內海拔6 048 m的特拉普齊亞峰,屬于喀什噶爾河水系,自西向東匯入塔里木河流域,在我國境內流經水域面積達15 100 km2(李文江等,2016)。克孜勒河資源豐富,棲息有多種珍稀保護魚類,如塔里木裂腹魚(Schizothorax biddulphi)、寬口裂腹魚(Schizothorax eurystomus)、厚唇裂腹魚(Schizothorax irregularis)和斑重唇魚(Diptychus maculates),是魚類重要的攝食、繁殖和越冬場所(樂佩琦和陳宜瑜,1998;郭焱,2012)。近年來,由于人類的過度捕撈、水利設施的興建,加之裂腹魚生長緩慢、性成熟晚和繁殖力低,導致野外種群數量逐年下降(任慕蓮等,1996;趙年樺等,2021)。其中大壩、水庫和水電站的迅速擴張正威脅著生物多樣性,極大影響了魚類的洄游和繁殖活動,阻斷了魚類種群間的基因交流,長期可導致同種個體出現形態表型的顯著性差異或產生種間分化,甚至可導致物種滅絕(賈建輝等,2019;陳超等,2020;劉洪蕊等,2021;周岐兵等,2022),如2022年7月21日世界自然保護聯盟(IUCN)發布的最新物種紅色名錄中,白鱘(Psephurus gladius)被正式宣告滅絕。因此,探究魚類的形態表型差異,有助于揭示魚類種群分化和形成的進化過程(Weiss,1999)。
魚類的外部形態和結構差異是對適應不同環境的直接表現(Frédérich et al,2012;Whitney et al,2018),已有研究表明不同地理環境下水生動物形態差異大小與河流的水質、水流、溫度、底質和餌料生物組成等棲息環境有一定關系(Gibson et al,1984;Drinan et al,2012;Senay et al,2017)。劉璐等(2023)研究不同海域的褐菖鲉(Sebastiscus marmoratus)外部形態特征時發現,4個樣點海域環境差別較大,受不同樣點水流速度和攝食難易程度差別的影響,不同群體褐菖鲉頭部和尾部存在顯著差異,受生境選擇的影響,廈門群體的褐菖鲉逐漸發展出相較于舟山、汕頭和北海更小的頭部和更靈活健壯的尾柄,加快在水中游動的速度,從而能迅速逃避被捕食。張賽賽等(2020)運用多變量形態度量學分析方法研究不同群體刀鱭的形態差異時,發現不同地區水生態環境的不同和刀鱭群體攝食行為的不同,造成了3個刀鱭群體形態差異集中在頭部和尾部。
由于傳統形態學測量分析方法不能反映生物形態變化的空間格局,對一些形態差異較小的群體無法進行有效判別(Ergüden amp; Turan,2005),如潘瑛子等(2019)在比較尼洋河和日喀則拉孜江段的黑斑原鮡(Glyptosternum maculatum)表型形態時發現,僅根據所測性狀數據難以將兩者完全區分。近些年來,地標點法在生物形態研究中得到廣泛應用,通過在生物體表面選取合適坐標點,并量化坐標點的變形,對生物形態結構的特征進行詳細描述,從而直接反映出生物的多維形態差異(Cadrin,2000;Mitteroecker et al,2004)。肖瑾等(2020)運用地標點法對嘉陵江不同江段蛇鮈(Saurogobio dabryi)進行分析發現,不同江段蛇鮈群體差異集中在頭、尾和鰭。姜曉東等(2021)隨機采集不同地理范圍的野生絨螯蟹(Eriocheir sinensis)種群的雌、雄樣本各15只,運用地標點法比較不同群體的形態特征差異,發現各群體頭胸甲的形態差異主要為額刺和側刺長度。田燦等(2020)為探究不同產地克氏原螯蝦(Procambarus clarkii)的形態差異,運用地標點法選取5個地區規格相近的克氏原螯蝦雌雄各10尾進行形態學研究,發現其形態差異主要體現在頭胸甲及腹部部位。這些結果表明地標點法區分生物群體差異性效果顯著。
本研究將多變量形態度量學和地標點法相結合,通過多變量分析、幾何形態聚類分析和相對扭曲主成分分析等方法,對采自新疆克孜勒河流域的塔里木裂腹魚、寬口裂腹魚、厚唇裂腹魚和斑重唇魚群體形態差異和生長特性進行分析比較,為克孜勒河流域裂腹魚類的生長、繁殖等保護策略的制定提供基礎數據。
1"" 材料與方法
1.1"" 試驗材料
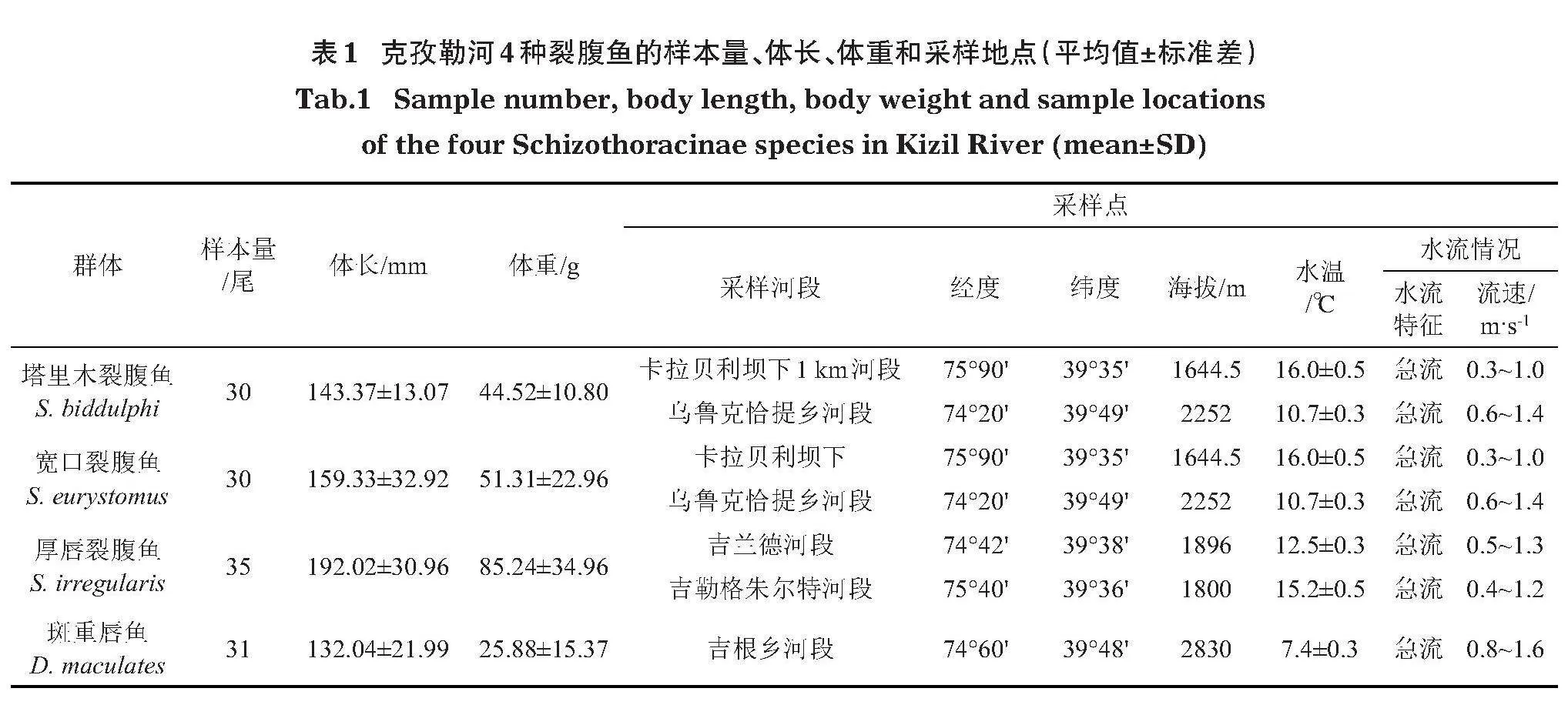
126尾裂腹魚樣本于2020年7月-2021年8月分別采自克孜勒河流域內不同河段,各群體樣本信息見表1。收集魚類樣本后使用MS-222進行麻醉,現場進行拍照和形態測量。所有試驗標本存放于塔里木大學動物科學學院魚類標本室,進行形態學種類鑒定。
1.2"" 數據獲取
使用游標卡尺測量4種裂腹魚15個傳統可量性狀(圖1),使用佳能200 DII相機對魚類標本進行拍照,拍攝時將相機固定,保持焦距和拍攝角度不變,每種魚各挑選10張清晰、魚體無損傷的標準化圖像進行地標點分析。
1.3"" 數據處理
裂腹魚體長-體重關系采用冪指數函數關系擬合(Ricker,1975):
W=a×Lb""""""""""""""""""""""""""""""""""""""""""""nbsp;" ①
式中:W為魚類體重,單位g;L為魚類體長,單位mm;a、b為模型參數,其中參數a為條件因子,參數b為異速生長因子(Froese et al,2014)。
傳統的形態測量法為消除樣品大小差異對形態參數的影響,全部可量性狀用Microsoft Excel 2021通過體長比值法[將長度參數除以體長(BL)]進行數據轉換(García -Berthou,2001;Ghosh,2007),然后使用Origin 2021對4種裂腹魚體重進行正態分布檢驗,用SPSS 26.0軟件進行單因素方差分析(one-way ANOVA)和多重比較(Pgt;0.05時用LSD法,Plt;0.05時用Dunnett法)。
本試驗利用tps系列軟件進行處理,建立地標點(Zelditch et al,2004)(圖1)。用tpsRelw軟件進行相對扭曲(relative warps)和局部扭曲(partial warps)主成分分析,然后使用tpsRegr軟件繪制網格變形圖。利用各樣本的相對扭曲得分,采用歐氏距離進行系統聚類分析。
2"" 結果與分析
2.1"" 體重正態分布檢驗
根據正態性檢驗的結果(圖2),4組顯著值均大于0.05,說明4種裂腹魚的體重服從正態分布。
2.2"" 生長特性
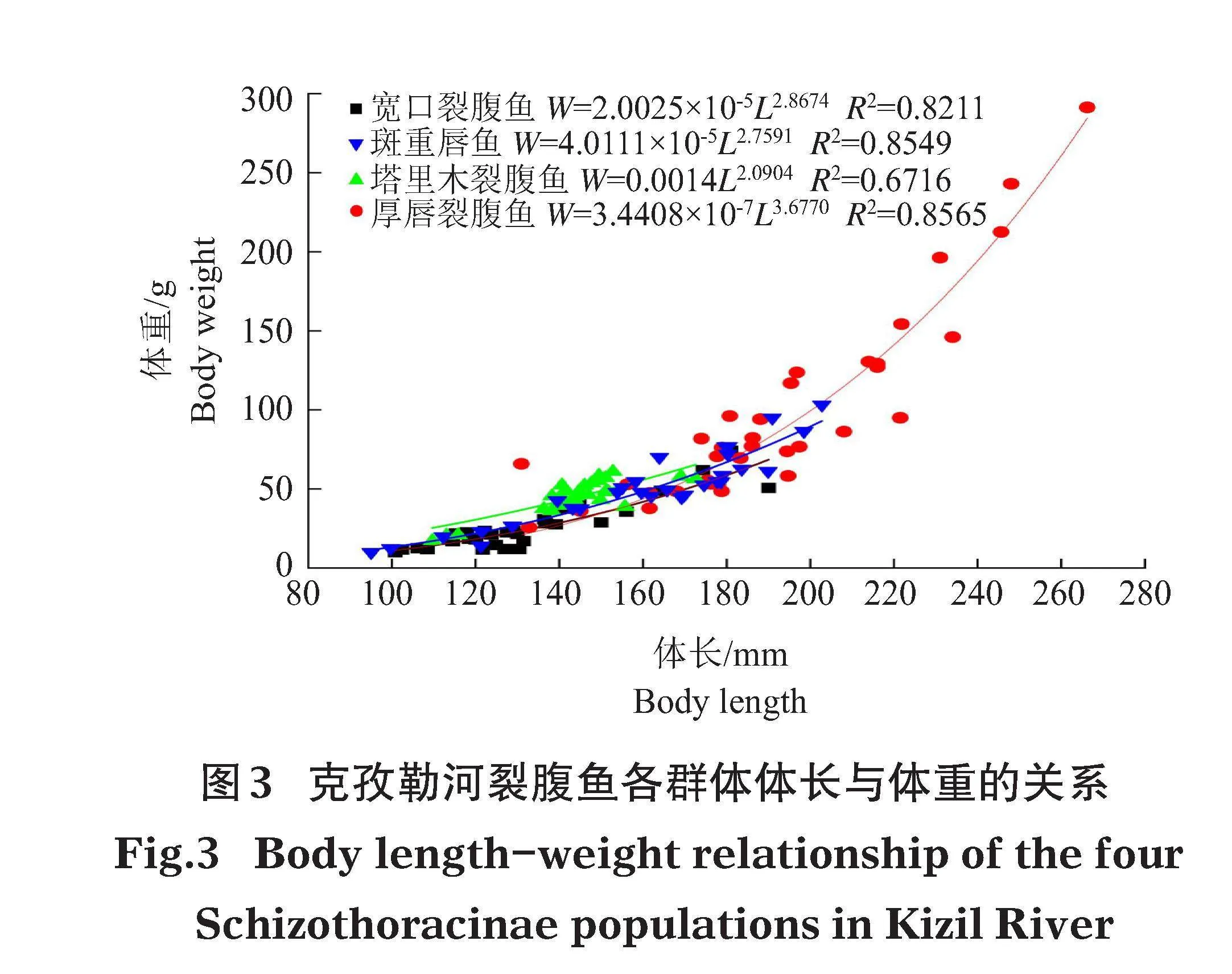
塔里木裂腹魚群體平均體長(143.37±13.07)mm,平均體重(44.53±10.80)g;寬口裂腹魚群體平均體長(159.33±32.92)mm,平均體重(51.31±22.96)g;厚唇裂腹魚群體平均體長(192.02±30.96)mm,平均體重(98.10±59.85)g;斑重唇魚群體平均體長(132.04±21.99)mm,平均體重(25.88±15.37)g。克孜勒河4種裂腹魚體長與體重關系經線性回歸(圖3),其體長-體重分布呈冪函數關系。厚唇裂腹魚平均體長和體重最大,寬口裂腹魚次之,斑重唇魚和塔里木裂腹魚規格相近。
2.3"" 不同種群裂腹魚形態表型差異分析
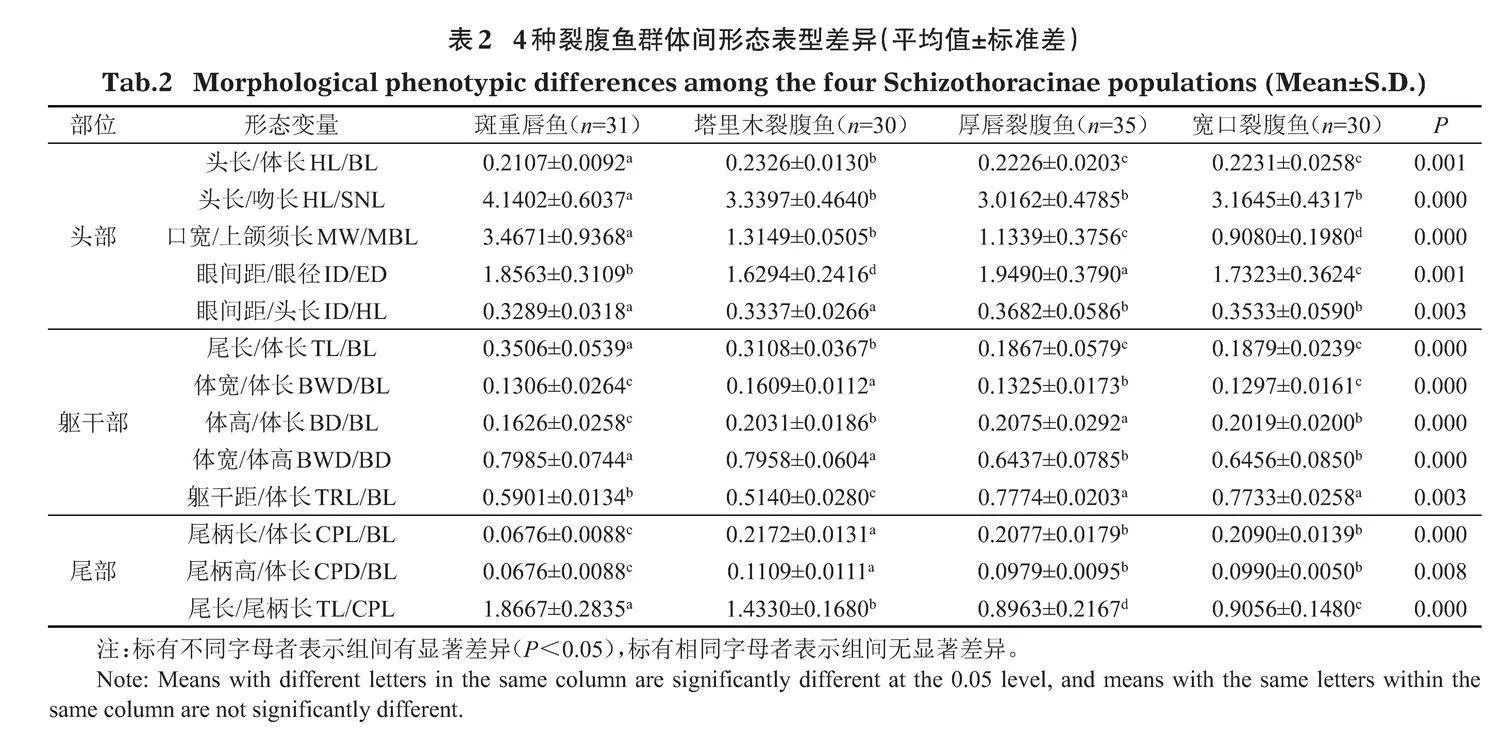
表2顯示有13個形態特征的平均值在不同裂腹魚群體間存在顯著差異(Plt;0.05)(HL/BL、HL/SNL、MW/MBL、ID/ED、ID/HL、TL/BL、BWD/BL、BD/BL、BWD/BD、TRL/BL、TRL/TL、CPL/BL、TL/CPL),且主要集中于口寬、上頜須長、眼間距、眼徑、尾長和尾柄長上,其中HL/BL、CPL/BL、CPD/BL等3個形態特征表現為塔里木裂腹魚gt;寬口裂腹魚gt;厚唇裂腹魚gt;斑重唇魚;HL/SNL、TL/BL、BWD/BD、TL/CPL為斑重唇魚gt;塔里木裂腹魚gt;寬口裂腹魚gt;厚唇裂腹魚;TRL/BL、TRL/TL為厚唇裂腹魚gt;寬口裂腹魚gt;斑重唇魚gt;塔里木裂腹魚;MW/MBL為斑重唇魚gt;塔里木裂腹魚gt;厚唇裂腹魚gt;寬口裂腹魚;ID/ED為厚唇裂腹魚gt;斑重唇魚gt;寬口裂腹魚gt;塔里木裂腹魚;ID/HL為厚唇裂腹魚gt;寬口裂腹魚gt;塔里木裂腹魚gt;斑重唇魚;BWD/BL為塔里木裂腹魚gt;厚唇裂腹魚gt;斑重唇魚gt;寬口裂腹魚;BD/BL為厚唇裂腹魚gt;塔里木裂腹魚gt;寬口裂腹魚gt;斑重唇魚。
2.4"" 不同種群裂腹魚地標點變形分析
在基于地標點的幾何形態分析中,其回歸系數均大于0.99,表明所選取的所有地標點均有效。利用tpsRelw軟件計算獲得裂腹魚不同種群平均形圖和所有地標點矢量化之后的重疊效果圖(圖4)。基于tpsRegr軟件的網格變形分析結果可知(圖5),裂腹魚不同群體的形態差異主要體現在頭部(地標點1、2、3、13)和尾鰭(地標點6、7、8),形態表型差異分析結果與傳統分析方法結果相似。
2.5"" 主成分分析
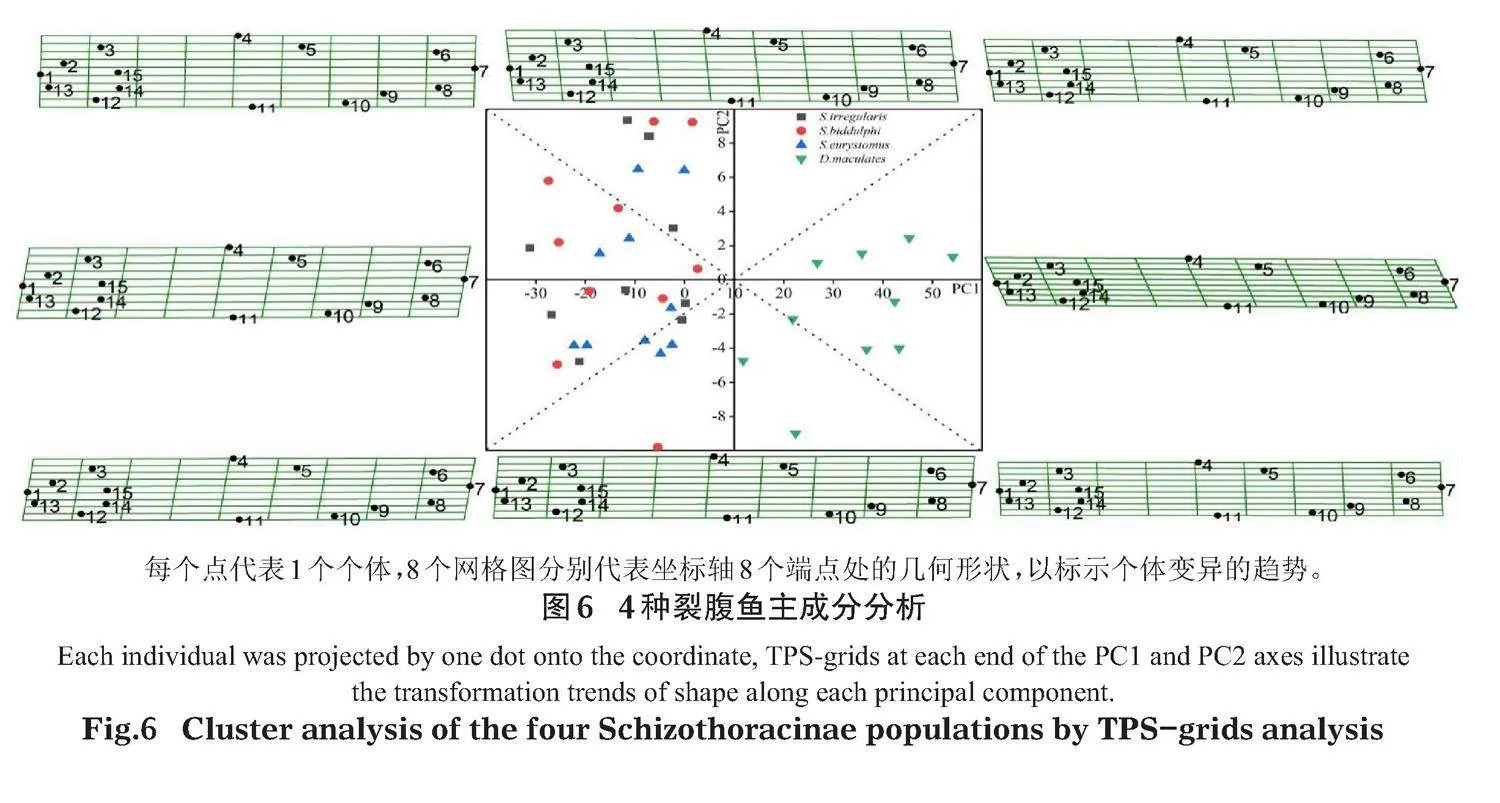
相對扭曲主成分分析總共提取到2個特征值大于0.1的主成分,其特征值分別為0.20567和0.11789,貢獻率分別為48.83%和16.05%。以PC1和PC2建立X-Y坐標軸,得到主成分分析散點圖(圖6),發現厚唇裂腹魚、塔里木裂腹魚和寬口裂腹魚個體互相重疊,并未獨立分支,說明這3種裂腹魚形態較為相近;而斑重唇魚個體主要分布在第一象限和第二象限,獨立成組,說明其形態與其他3種裂腹魚存在較大差異;沿著X軸正方向,斑重唇魚多集中于此,頭部形態變化較大,整體魚身更為細長;沿著X負方向、Y軸正、負方向,魚身更為粗壯,尾部變化較為明顯,這與根據得分系數(圖7)所得出的裂腹魚主要在頭部和尾部存在較大差異的這一結論相一致。
2.6"" 聚類分析
從克孜勒河裂腹魚4個群體間的歐式距離(表3)和系統聚類圖(圖8)可以看出:塔里木裂腹魚群體和厚唇裂腹魚群體首先聚為一支,形態最為相近,兩者之間的歐式距離為0.002;斑重唇魚與寬口裂腹魚、塔里木裂腹魚、厚唇裂腹魚群體形態差異較大,歐式距離分別為0.14866、0.13596和0.13416。
3"" 討論
3.1"" 不同種群裂腹魚形態表型差異
進行魚類保護和資源開發過程中,需要了解該區域魚類種群結構組成和特征,以維持種群的穩定(楊天燕等,2018)。從正態分布檢驗的結果看,這4種裂腹魚的體重顯著值均大于0.05,服從正態分布。且厚唇裂腹魚、寬口裂腹魚和塔里木裂腹魚體重和體長的關系均呈指數增長,厚唇裂腹魚增長趨勢最大,寬口裂腹魚和塔里木裂腹魚增長呈比較穩定的趨勢,而斑重唇魚體重和體長的關系呈直線,斜率較低,說明厚唇裂腹魚種群個體的體型大小組成和群體數量較穩定。在公莉等(2022)的研究中也進一步證實了這一結論,西太公魚和太湖新銀魚存在食物競爭關系,結合生長特性,發現西太公魚的個體較大,對食物需求較多,更具有競爭優勢和種群優勢。
本研究通過傳統的形態學測量分析方法對克孜勒河4種裂腹魚形態表型差異進行分析,發現4種裂腹魚的形態差異主要集中于口寬、上頜須長、眼間距、眼徑、尾長和尾柄長上。楊天燕等(2018)在研究塔里木裂腹魚和厚唇裂腹魚時發現,這2種裂腹魚在頭部和尾部存在極顯著差異,盡管這2個群體間存在交叉散布現象,但仍能在整體上形成相對獨立的組群;孟立霞等(2007)運用多變量形態度量學方法,對雅礱江5(亞)種裂腹魚類群體間的形態學差異進行了研究,其中起較大作用的是背鰭長、眼間距和體高等特征,這些與本研究的結果部分一致。
3.2"" 不同種群裂腹魚地標點變形分析
基于地標點的幾何形態學現已廣泛應用于識別生物表型、分析物種形態差異和劃分物種地理類群等方面(肖瑾等,2020)。程起群和李思發(2004)利用形態學方法對刀鱭(Coilia nasus)和湖鱭(Coilia nasus taihuensis)種群進行差異判別分析,認為二者為同種內的不同地理種群,尚未達到亞種分化水平;Lostrom等(2015)準確區分出屬于同一流域內3個不同地理群體的紅尾美人魚(Melanotaenia australis),描述了體厚和尾柄長度的變異,并量化了不同地理群體間的形態變異水平;王超等(2023)使用幾何形態測量學方法,對劍尖槍烏賊(Uroteuthis edulis)角質顎的生長變化規律進行分析,結果顯示,劍尖槍烏賊的角質顎大小和形態與其不同發育階段有極大關聯,表明上、下顎在不同發育階段具有明顯的異速生長現象。
Nie等(2014)對木扎提河流域內塔里木裂腹魚、寬口裂腹魚、重唇裂腹魚(Schizothorax barbatus)、厚唇裂腹魚(Schizothorax irregularis)、扁吻魚(Aspiorhynchus laticeps)和斑重唇魚共72個形態比例性狀進行聚類分析,發現形態最相似的物種是塔里木裂腹魚和寬口裂腹魚,且與重唇裂腹魚、厚唇裂腹魚、扁吻魚的形態相似性逐漸降低,與斑重唇魚形態差異最大。這與本文研究結果存在一定差異,本研究中塔里木裂腹魚群體和厚唇裂腹魚群體最先聚為一支,形態最為相近,兩者之間的歐式距離為0.002,再與寬口裂腹魚聚為一支;斑重唇魚則與寬口裂腹魚、塔里木裂腹魚、厚唇裂腹魚形態相似度較低。推測造成這種差異的原因可能與魚類處于不同流域、及生境的不同造成不同的攝食習慣有關。
在實地調查中發現塔里木裂腹魚和厚唇裂腹魚體型較為強壯且豐滿,有發達的尾柄,推斷可能與其主要攝食水生昆蟲和底棲動物,及少量浮游藻類的生活習性有極大關系,發達的尾柄能更好的追逐獵物進行攝食(郭焱,2012)。寬口裂腹魚具有較銳利的唇部角質,喜刮食附生在沙礫、巖石上的藻類,且寬口裂腹魚軀干較為纖細,能在湍急的水流中保持較好的穩定性,以便其在同一區域攝取更多的食物,來維持自身生長發育需要(馮興無等,2021)。本課題組在野外采集過程中發現斑重唇魚僅分布在上游吉根鄉河段,海拔高達2 830 m,平均水溫僅7.4 ℃,其棲息地水體具有透明度高和流速較快等特點,與中下游其他裂腹魚棲息地環境存在較大差異,這也是造成斑重唇魚相較于其他3種裂腹魚體型更為細長、尾部更為發達,且與其他裂腹魚形態差異較大的重要因素之一(郭焱等,2009)。
形態和表型差異不僅是水生動物適應不同地理環境的直接體現,也是物種分類和物種識別的重要依據,其不僅受到環境因子的影響,還受到遺傳因子的輔助調控(Swain et al,1991;Kinsey et al,1994;Cadrin,2000;Pakkasmaa amp; Piironen,2001)。海薩·艾也力汗等(2021)對采自塔里木河和伊犁河流域的6種裂腹魚屬魚類的COI基因序列進行了分析,發現塔里木河流域主要支流群體是塔里木裂腹魚,寬口裂腹魚、重唇裂腹魚和厚唇裂腹魚未能形成獨立的分支,得出塔里木河主要支流分布的4種裂腹魚可能存在種間雜交或尚未達到物種分化程度,仍屬同一物種的不同亞種。與本研究形態聚類結果的裂腹魚親緣關系保持一致。
近年來,由于克孜勒河修建的各種水利工程設施對該流域內水生生態系統的完整性和生物多樣性產生了綜合性影響,造成該流域裂腹魚類的自然種群數量顯著下降,魚類個體趨于小型化、低齡化(顏于川,2016;趙賀等,2021)。因此,有關部門應進一步加強漁業管理和魚類資源保護方面的工作,如建立魚類增養殖站、控制捕撈強度和設置攔魚設施等,以期恢復被破壞的種群結構。
4"" 結論
傳統分析方法對魚體形態特征差異分析結果顯示4種裂腹魚的區別主要集中在頭部、軀干部和尾部,而地標點的幾何形態學對魚形態特征差異分析結果顯示4種裂腹魚的區別主要集中在頭部和尾鰭。地標點法雖然以圖形的方式能更直觀、更有效地呈現形態差異及其變化趨勢,但從分析結果來看,傳統分析方法卻是對地標點法的補充和完善。因此,在形態學研究中運用基于地標點的幾何形態學方法的同時,也不能忽略傳統形態測量分析方法的輔助作用。本研究后續還需結合分子生物學方法進一步研究,為新疆地區裂腹魚類保護、分類研究及資源利用提供更準確、有效的數據。
參考文獻
陳超, 余理睿, 馮志政, 等, 2020. 曹娥江流域魚類資源調查[J]. 水生態學雜志,41(6):113-121.
程起群, 李思發, 2004. 刀鱭和湖鱭種群的形態判別[J]. 海洋科學,28(11):39-43.
馮興無, 蔡瑞鈺, 靳天志, 等, 2021. 云南盤鮈仔稚魚口吸盤發育[J]. 漁業科學進展,42(6):69-76.
公莉, 過龍根, 尹成杰等, 2022. 洱海西太公魚和太湖新銀魚生長特性及種群調控效果研究[J]. 水生態學雜志,43(1):117-123.
郭焱, 2012. 新疆魚類志[M]. 烏魯木齊:新疆科學技術出版社.
郭焱, 孟瑋, 劉建, 等, 2009. 新疆不同河流斑重唇魚(Diptychus maculates)形態特征比較研究[J]. 水產學雜志,22(3):1-5.
海薩·艾也力汗, 張人銘, 牛建功, 等, 2021. 基于COI基因探討塔里木河流域裂腹魚屬魚類的親緣關系[J]. 中國水產科學,28(11):1417-1425.
胡月, 曾燏, 蔣朝明, 等, 2017. 嘉陵江下游蛇鮈的兩性異形與雌性個體生殖力[J]. 應用生態學報,28(2):658-664.
賈建輝, 陳建耀, 龍曉君, 2019. 水電開發對河流生態環境影響及對策的研究進展[J]. 華北水利水電大學學報(自然科學版),40(2):62-69.
姜曉東, 成永旭, 楊雨虹, 等, 2021. 基于地標點法的綏芬河絨螯蟹種群鑒定[J]. 水產科學,40(4):501-507.
樂佩琦, 陳宜瑜, 1998. 中國瀕危動物紅皮書:魚類[M]. 北京:科學出版社.
李文江, 王文科, 段磊, 等, 2016. 新疆克孜勒河流域喀什段水化學特征及成因[J]. 南水北調與水利科技,14(6):159-164.
劉洪蕊, 劉玉芳, 王結良, 等, 2021. 水庫運行對漢江流域草魚洄游影響評價研究[J]. 水生態學雜志,42(5):69-77.
劉璐, 周永東, 高天翔, 2023. 褐菖鲉不同地理群體的形態學比較研究[J]. 水生態學雜志,44(2):81-88.
孟立霞, 2007. 5種(亞種)裂腹魚類的形態學差異研究[J]. 凱里學院學報,25(3):25-29.
潘瑛子, 劉海平, 朱挺兵, 2019. 西藏黑斑原鮡兩個野生群體的形態差異[J]. 中國水產科學,26(5):823-833.
任慕蓮, 任波, 楊植林, 等, 1996. 瀕危物種: 新疆大頭魚的生態和資源調查與保護對策的研究[J]. 水產學雜志,9(2):1-19.
田燦, 李飛, 蘇勝彥, 等, 2020. 基于圖像識別的5個不同產地克氏原螯蝦(Procambarus clarkii)形態差異分析[J]. 海洋與湖沼,51(6):1483-1492.
王超, 方舟, 陳新軍, 2023. 基于幾何形態測量法的劍尖槍烏賊角質顎形態變化研究[J]. 漁業科學進展,44(1):58-69.
肖瑾, 曾燏, 張富斌, 等, 2020. 嘉陵江不同江段蛇鮈的形態差異比較[J]. 水產學報,44(11):1832-1840.
顏于川, 2016. 淺談大壩建設與生態保護的關系[J]. 珠江水運,(9):86-87.
楊天燕, 孟瑋, 郭焱, 等, 2018. 塔里木裂腹魚和厚唇裂腹魚多變量形態學分析[J]. 浙江海洋大學學報(自然科學版),37(3):221-227.
張賽賽, 羅珺, 陳博錦, 等, 2020. 不同群體刀鱭形態差異研究[J]. 淡水漁業,50(3):26-33.
趙賀, 洪繼彪, 趙年樺, 等, 2021. 新疆克孜勒河厚唇裂腹魚人工繁殖及胚胎、早期仔魚發育研究[J]. 大連海洋大學學報,36(3):414-422.
趙年樺, 趙賀, 強壯, 等, 2021. 水溫、光周期和光照強度對塔里木裂腹魚幼魚存活、攝食和生長的影響及其鹽堿耐受能力研究[J]. 南方水產科學,17(5):54-63.
周岐兵, 程飛, 王震, 等, 2022. 長江上游合江江段魚類早期資源與向家壩水庫生態調度效果初步研究[J]. 中國環境監測,38(1):95-103.
Cadrin S X, 2000. Advances in morphometric identification of fishery stocks[J]. Reviews in Fish Biology and Fisheries,10(1):91-112.
Drinan T J, McGinnity P, Coughlan J P, et al, 2012. Morphological variability of Atlantic salmon Salmo salar and brown trout Salmo trutta in different river environments[J]. Ecology of Freshwater Fish,21(3):420-432.
Ergüden D, Turan C, 2005. Examination of genetic and morphologic structure of sea-bass (Dicentrarchus labrax L.,1758) populations in Turkish coastal waters[J]. Turkish Journal of Veterinary and Animal Sciences,29(3):727-733.
Frédérich B, Liu S V, Dai C F, 2012. Morphological and genetic divergences in a coral reef damselfish, Pomacentrus coelestis[J]. Evolutionary Biology,39(3):359-370.
Froese R, Thorson J T, Reyes R B Jr, 2014. A Bayesian approach for estimating length-weight relationships in fishes[J]. Journal of Applied Ichthyology,30(1): 78-85.
García-Berthou E, 2001. On the misuse of residuals in ecology: testing regression residuals vs. the analysis of covariance[J]. Journal of Animal Ecology,70(4):708-711.
Ghosh A K, 2007. Applied MANOVA and discriminant analysis[J]. Journal of the American Statistical Association,102(479):1075-1076.
Gibson A R, Baker A J, Moeed A, 1984. Morphometric variation in introduced populations of the common myna (Acridothers tristis): an application of the jackknife to principal component analysis[J]. Systematic Biology,33(4):408-421.
Kinsey S T, Orsoy T, Bert T M, et al, 1994. Population structure of the Spanish sardine Sardinella auriia: natural morphological variation in a genetically homogenous population[J]. Marine biology,118(2):309-317.
Lostrom S, Evans J P, Grierson P F, et al, 2015. Linking stream ecology with morphological variability in a native freshwater fish from semi-arid Australia[J]. Ecology and Evolution,5(16):3272-3287.
Mitteroecker P, Gunz P, Bernhard M, et al, 2004. Comparison of cranial ontogenetic trajectories among great apes and humans [J]. Journal of Human Evolution,46(6):679-697.
Nie Z L, Wei J, Ma Z H, et al, 2014. Morphological variations of Schizothoracinae species in the Muzhati River[J]. Journal of Applied Ichthyology,30:359-365.
Pakkasmaa S, Piironen J, 2001. Morphological differentiation among local trout (Salmo trutta) populations[J]. Biological Journal of the Linnean Society,72(2):231-239.
Ricker W E, 1975. Computation and interpretation of biological statistics of fish populations[M]. Ottowa: The Blackburn Press.
Senay C, Harvey-Lavoie S, MacNaughton C J, et al, 2017. Morphological differentiation in northern pike (Esox lucius): The influence of environmental conditions and sex on body shape[J]. Canadian Journal of Zoology,95(6):383-391.
Swain D P, Riddell B E, Murray C B, 1991. Morphological differences between hatchery and wild populations of Coho salmon (Oncorhynchus kisutch): environmental versus genetic origin[J]. Canadian Journal of Fisheries and Aquatic Sciences,48(9):1783-1791.
Weiss K M, 1999. Phenotypic evolution: a reaction norm perspective[J]. American Journal of Physical Anthropology,109(1):144-146.
Whitney J L, Donahue M J, Karl S A, 2018. Niche divergence along a fine-scale ecological gradient in sympatric color morphs of a coral reef fish[J]. Ecosphere,9(1):1-18.
Zelditch M L, Swiderski D L, Sheets H D, et al, 2004. Geometric morphometrics for biologists: a primer[M]. Amsterdam: Elsevier Academic Press.
(責任編輯"" 熊美華)
Morphological Differences Among Four Schizothoracinae Species
in the Kizil River Basin of Xinjiang
ZHANG Rui1,2, ZHAO He1,2,3, NIE Zhu‐lan1,2,3, WANG Jun‐hui1,2, LIN Hui‐li1,2,
QIN Kai‐rui1,2, CAI Ru‐ming1,2
(1. College of Animal Science and Technology, Tarim University, Alaer 843300, P.R. China;
2. Key Laboratory of Tarim Animal Husbandry Science and Technology,
Xinjiang Production amp; Construction, Alaer 843300, P. R. China;
3. State Kay Laboratory Breeding Base for The Protection and Utilization of Biological Resources
in Tarim Basin Co-funded by Xinjiang Corps and The Ministry of Science and Technology,
Tarim University, Alaer 843300, P. R. China)
Abstract:The Kizil River in Xinjiang Province is an important feeding, breeding, and overwintering site for fish due to abundant resources. In recent years, various water conservancy projects constructed in the Kizil River Basin have had far reaching impacts on the integrity and biodiversity of aquatic ecosystems, resulting in a significant decline in wild populations of Schizothoracinae species. Differences in the external morphology and structure of fish are direct manifestations of adaptation to differing environmental conditions. In this study, we investigated the growth and morphological differences of four Schizothoracinae species (Schizothorax biddulphi, Schizothorax eurystomus, Schizothorax irregularis, Diptychus maculates) in the Kizil River Basin. We aimed to provide scientific data for classifying Schizothoracinae groups based on morphology, and provide a theoretical basis for cultivating and protecting germplasm resources of Schizothoracinae. Schizothoracinae specimens were collected from different river sections of Kizil River from July 2020 to August 2021, and a total of 126 individuals were obtained. Morphological measurements and species identification of all specimens were conducted, and morphological differences and growth characteristics of the four populations were analyzed using multivariate morphometric analysis and landmark-based analysis. There were significant differences in the mean values of 13 morphological metrics among the four Schizothoracinae species, and these differences were in the head, trunk, and tail. Grid deformation analysis using tpsRegr software showed that the morphological differences among the four species were primarily in the head and tail, consistent with the results obtained with traditional morphometric analysis, such as the more slender body and smaller head of D. maculates. Principal component analysis showed that the morphological characteristics of S. biddulphi, S. eurystomus and S. irregularis were similar, with Schizothoracinae in a separate group. Cluster analysis showed that S. biddulphi and S. irregularis first clustered into a group that then clustered with S. eurystomus, and finally clustered with D. maculates. In conclusion, the four Schizothoracinae groups in Kizil River have obvious morphological differences closely related to their geographical distribution.
Key words:Schizothoracinae; morphological characteristics; landmark-based analysis; multivariate morphometric analysis; Kizil River

