低溫對紅耳龜血液指標及植物血凝素反應的影響
DOI:10.15928/j.1674-3075.202206130225
收稿日期:2022-06-13"""" 修回日期:2023-11-21
基金項目:2021年安徽省舒城縣“三區”科技人才項目;安徽農業大學2020年度省級重點教學研究項目(2020jyxm0531)和2021年省級線下課程項目(2021xxkc039);安徽農業大學2021年國家級大學生創新創業訓練計劃項目(202110364013)和2023年度動物學教學創新團隊項目(2023aujxtd004)。
作者簡介:張一帆,2001年生,女,本科在讀,研究方向為動物科學。E-mail: zhangyifan_326@126.com
通信簡介:張志強,教授。E-mail: zzq-003@163.com
摘要:探究低溫對紅耳龜(Trachemys scripta elegans)免疫功能和應激反應能力的影響,揭示紅耳龜適應低溫環境的生理學和免疫學基礎,為深入了解其入侵生物學提供基礎資料。采用活體背甲下靜脈竇采血技術,測定了6℃、17℃和26℃條件下處理1、5和10 d時血液中各型白細胞百分比及嗜異性粒細胞與淋巴細胞的比值(ratio of heterophils to lymphocytes,H/L),以及第10天采血后植物血凝素(phytohemagglutinin-P,PHA-P)反應的變化。結果顯示:(1)隨著溫度下降,第1天只有嗜堿性粒細胞的百分比顯著升高(Plt;0.05),此差異在第5天和第10天消失(Pgt;0.05);第5天,嗜酸性粒細胞的百分比和H/L先升后降,淋巴細胞的百分比先降后升,單核細胞的百分比下降(Plt;0.05);第10天,嗜酸性粒細胞的百分比上升,淋巴細胞、嗜異性粒細胞和單核細胞的百分比,以及H/L下降(Plt;0.05);(2)隨著處理天數延長,除嗜堿性粒細胞的百分比無組內差異外(Pgt;0.05),其他類型白細胞的百分比及H/L都有組內差異(Plt;0.05);(3)6℃組、17℃組和26℃組對PHA-P的反應分別在注射后48 h、24 h和48 h達到峰值,但組間差異不顯著(Pgt;0.05)。紅耳龜通過調整血液中嗜酸性粒細胞等不同類型白細胞的百分比、下降的應激反應能力和提前發生反應的免疫應答來適應低溫的短期脅迫。
關鍵詞:紅耳龜;低溫;淋巴細胞;嗜酸性粒細胞;植物血凝素;應激
中圖分類號:S917.4""""""" 文獻標志碼:A""""""" 文章編號:1674-3075(2024)04-0148-07
免疫學參數和應激反應能力可指示動物體的健康狀態,這些指標的適應性改變是生態免疫學(ecological immunology)關注的主要研究內容之一(Boughton et al,2011;Brock et al,2014;張志強,2015)。相對于其他脊椎動物類群,對爬行動物免疫能力與環境異質性的關系研究起步較晚(Palackdharry et al,2017;Zimmerman et al,2017;Ferguson et al,2018;Goessling et al,2019)。目前,背甲下靜脈竇采血技術和外源植物血凝素(phytohemagglutinin-P,PHA-P)抗原注射技術,較多地被應用于龜鱉類研究,前者具有微量、無損傷、可以連續多次采集血液的優點,但也存在后續工作量較大、白細胞分型鑒定耗時較長等缺點(Davis et al,2008;張志強,2015;吳海燕等,2021;Campbell amp; Ellis,2022),后者可刺激被注射部位的皮膚發生腫脹反應,其反應峰值與淋巴細胞等多種白細胞的數量動態有關,反應機制復雜(Zimmerman et al,2010a;Finger et al,2013;吳文欣等,2020),但具有操作簡便、重復性好的優點(Brock et al,2014;張志強,2015)。此外,爬行動物和鳥類中,嗜異性粒細胞與淋巴細胞的比值(ratio of heterophils to lymphocytes,H/L)可反映其應激水平,短期內可保持相對穩定,之后趨向于增加(Davis et al,2008;Davis amp; Maney,2018)。其中,嗜異性粒細胞類似于哺乳動物血液中的嗜中性粒細胞,主要執行吞噬異物和殺滅病原體的功能(Davis et al,2008)。
紅耳龜(Trachemys scripta elegans),又名巴西龜等,是世界上危害最嚴重的入侵物種之一,分布于我國大部分淡水水域(龔世平等,2018),對半咸水的生態環境也有高度的適應性(洪美玲等,2019)。季節性環境條件下,紅耳龜的多個亞種對PHA-P的反應、體液免疫能力和天然免疫能力變化趨勢不同(Zimmerman et al,2010b;Hernandez et al,2017;Novovesky amp; Halán,2019);在適宜紅耳龜生存的溫度范圍內,其稚龜對PHA-P的反應快于烏龜(Mauremys reevesii),且數值較高(周贊等,2016),亞成體的反應峰值隨溫度升高有前移傾向(吳文欣等,2020)。本研究模擬紅耳龜冬眠時、入眠和出眠前后及最適存活溫度,采用背甲下靜脈竇活體采血技術,測定與免疫功能相關的血液指標和PHA-P反應值及應激反應能力,旨在驗證背甲下靜脈竇連續采血技術的可行性,揭示紅耳龜適應低溫環境的生理學和免疫學基礎,為深入了解其入侵生物學提供基礎資料。
1"" 材料與方法
1.1"" 試驗動物飼養和分組
試驗用亞成體紅耳龜均購于合肥市裕豐花市。選取背甲完整、大小相似、健康活潑的紅耳龜30只,不區分性別,每箱10只,共3箱,暫養于安徽農業大學動物生理生態學實驗室內的水族箱(長×寬×高= 60 cm × 36 cm × 36 cm)內,水深10 cm。箱內置露出水面的石塊若干,供紅耳龜曬背使用;每日12:00喂食萬事利龜糧(粗蛋白質含量gt;41%,粗脂肪含量≥4.5%,粗纖維含量≤6%),每隔2 d換曝氣24 h以上的自來水1次;加熱棒控制水溫為(26±1)℃。
室內飼養15 d后,1箱仍飼養于水溫為(26±1)℃的水族箱內,作為26℃組,即對照組;1箱移至(17±1)℃的水族箱內,作為17℃組;1箱移入(6±1)℃的冰箱內,作為6℃組。
1.2"" 背甲下靜脈竇采血、血涂片制作及各型白細胞百分比的測定
26℃組、17℃組和6℃組處理至第1、5和10天時,每組各10只紅耳龜,稱量體重,測量背甲長和背甲寬后,均從其背甲下靜脈竇處用預先經過肝素鈉處理過的1 mL一次性無菌注射器采集其血液,每次采集約100 μL。采血后,均用上海運佳黃浦制藥有限公司生產的濃度為2%的碘酊消毒采血部位,脫脂棉止血。
將采集后的血液迅速移至1.5 mL離心管中,用20 μL量程的移液器從離心管中取血液約20 μL,每只龜制作血涂片2張。參照吳海燕等(2021)的描述,使用快速瑞氏吉姆薩染液(南京建成生物工程有限公司,產品編號:D010)處理第1、5和10天時烘干后的血涂片,計數血液中嗜異性粒細胞、嗜酸性粒細胞、嗜堿性粒細胞、單核細胞和淋巴細胞的數量,并計算H/L。
以嗜異性粒細胞的百分比計算方法為例,其計算公式為:
H =(H1 + H2)/2"""" """"""nbsp;"""""""""""①
式中:H為嗜異性粒細胞的百分比(%),H1、H2分別為任1張血涂片中每100個白細胞中嗜異性粒細胞的數量。
H/L的計算公式如下:
R = H/L""""""""""""""""""""""""""""""" ②
式中:R為H/L,H為嗜異性粒細胞的百分比,L為淋巴細胞的百分比。
1.3"" 對PHA-P反應的測定
第10天采血后在紅耳龜后足足墊部位一側注射PHA-P溶液,對側足同一部位注射等量滅菌后的0.7%生理鹽水,注射前后均用碘酊消毒。PHA-P的注射濃度為2.5 g/L,劑量為100 μL,測量時間點為注射前(0 h)和注射后6、12、24、48、72 h(吳文欣等,2020)。用瑞士產Tesa數顯卡尺(±0.01 mm)連續測定注射前后足墊部位皮膚組織的增厚程度。每只龜每個測量時間點由同一人重復測定3次。通過左、右足皮膚組織增厚的百分率來表示對PHA-P的反應。
以注射后6 h為例,該時間點PHA-P反應的計算公式為:
P =(A-B)/B × 100""""""""""""""" ③
式中:P為注射后6 h由PHA-P抗原所誘導的被注射部位皮膚組織的腫脹程度(%),A為注射PHA-P抗原溶液6 h后被注射足墊部位的厚度(mm),B為該時間點對側足足墊部位的厚度(mm)。
1.4"" 數據處理與統計分析
用統計分析軟件SPSS軟件包(SPSS 19.0 for windows)進行數據處理。用雙因素方差分析(two-way ANOVA)比較6℃組、17℃組和26℃組實驗開始時和實驗結束時體重、背甲長和背甲寬的差異。因第1、5和10天采血的均為同一只龜,第10天進行PHA-P反應測定的也都為同一只龜,故都采用重復測量方差分析(repeated measurement ANOVA)進行數據處理和統計分析,比較采血個體6℃組、17℃組或26℃組組內不同取樣天數間各型白細胞百分比和H/L的差異,以及同一溫度組內不同測量時間點PHA-P反應的差異。用單因素方差分析(one-way ANOVA)比較6℃組、17℃組和26℃組第1、5或10天各型白細胞百分比和H/L的差異,以及第10天PHA-P最大反應值的組間差異。文中數值均以平均值±標準誤(Mean±SE)表示,Plt;0.05為差異顯著。
2"" 結果與分析
2.1"" 溫度和取樣時間點對紅耳龜體重、背甲長和背甲寬的影響
溫度對紅耳龜的體重(F2,54=0.034,Pgt;0.05)、背甲長(F2,54=0.029,Pgt;0.05)和背甲寬(F2,54=0.278,Pgt;0.05)均無明顯影響,取樣時間點也不影響其體重(F1,54=0.001,Pgt;0.05)、背甲長(F1,54=0.285,Pgt;0.05)和背甲寬(F1,54=0.013,Pgt;0.05),溫度和取樣時間點對其體重(F2,54=0.004,Pgt;0.05)、背甲長(F2,54=0.029,Pgt;0.05)和背甲寬(F2,54=0.051,Pgt;0.05)都無明顯的交互作用(圖1)。
2.2"" 同一溫度組內不同取樣時間點間各型白細胞百分比和H/L的變化
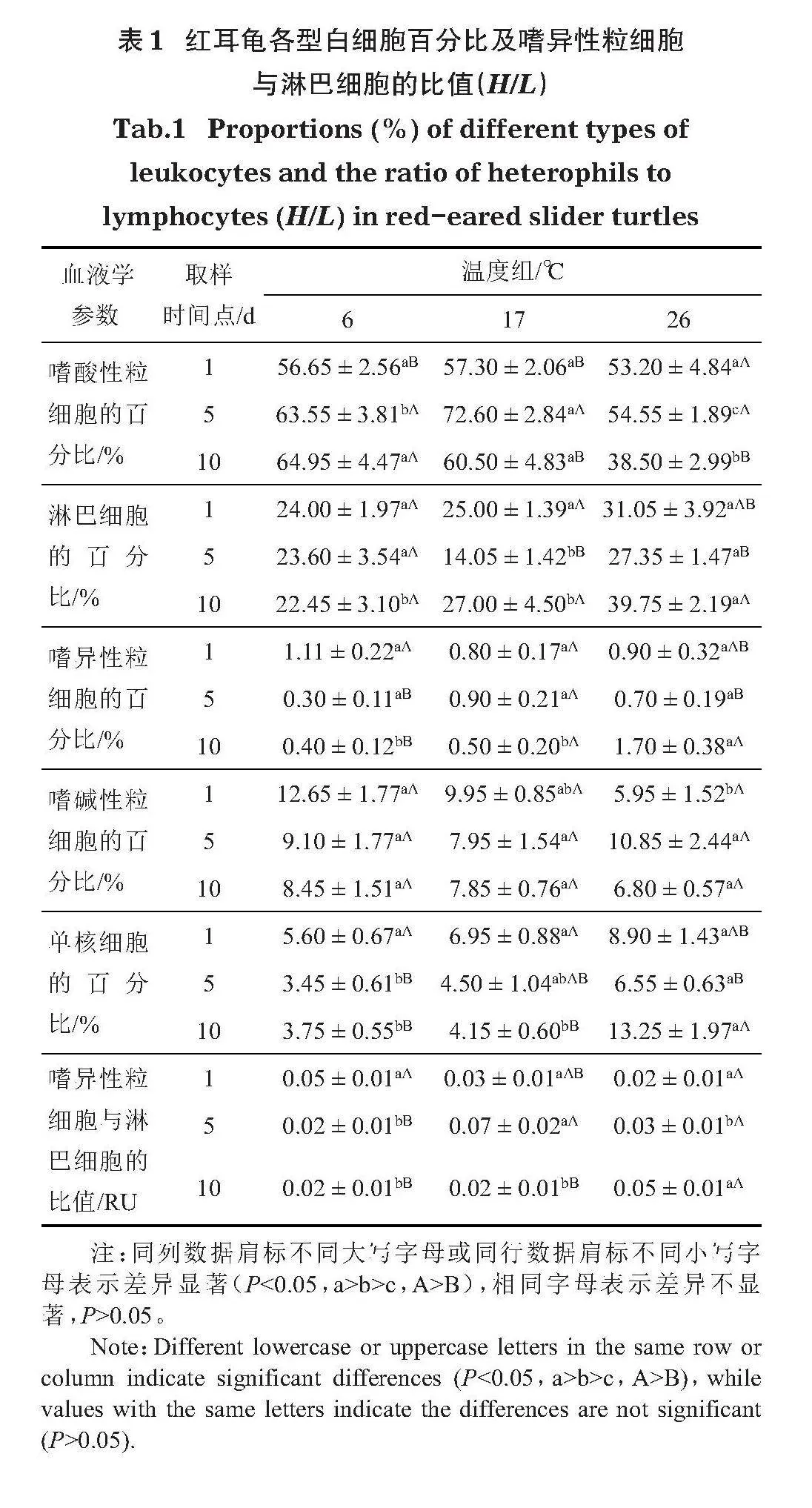
重復測量方差分析結果表明,第1天6℃組嗜酸性粒細胞(F2,18=4.650,Plt;0.05)的百分比顯著低于第5天和第10天,但第1天單核細胞(F2,18=8.912,Plt;0.05)和嗜異性粒細胞(F2,18=7.277,Plt;0.05)的百分比以及H/L(F2,81=5.481,Plt;0.05)顯著高于第5天和第10天,淋巴細胞(F2,18=0.196,Pgt;0.05)和嗜堿性粒細胞(F2,18=2.424,Pgt;0.05)的百分比無變化。第5天17℃組嗜酸性粒細胞(F2,18=7.962,Plt;0.05)的百分比顯著高于第1天和第10天,第1天單核細胞的百分比(F2,18=3.917,Plt;0.05)顯著高于第10天,第1天和第10天淋巴細胞的百分比(F2,18=8.025,Plt;0.05)都顯著高于第5天,嗜異性粒細胞(F2,18=1.307,Pgt;0.05)和嗜堿性粒細胞(F2,18=0.968,Pgt;0.05)的百分比無變化,第5天H/L(F2,81=4.197,Plt;0.05)顯著高于第10天。第10天26℃組嗜酸性粒細胞(F2,18=6.391,Plt;0.05)的百分比顯著低于第1天和第5天,第10天單核細胞(F2,18=5.867,Plt;0.05)、淋巴細胞(F2,18=5.052,Plt;0.05)和嗜異性粒細胞(F2,18=3.761,Plt;0.05)的百分比顯著高于第5天,嗜堿性粒細胞(F2,18=2.114,Pgt;0.05)的百分比和H/L(F2,81=2.581,Pgt;0.05)無變化(表1)。
2.3"" 同一取樣時間點不同溫度組間各型白細胞百分比和H/L的變化
單因素方差分析結果表明,第1 天嗜堿性粒細胞的百分比6℃組顯著高于26℃組(F2,29=5.513,Plt;0.05),單核細胞(F2,29=2.532,Pgt;0.05)、淋巴細胞(F2,29=2.060,Pgt;0.05)、嗜異性粒細胞(F2,29=0.384,Pgt;0.05)、嗜酸性粒細胞(F2,29=0.426,Pgt;0.05)的百分比和H/L(F2,29=2.511,Pgt;0.05)均無顯著的組間差異。第5天,嗜酸性粒細胞(F2,29=9.341,Plt;0.05)的百分比17℃組最高,6℃組居中,26℃組最低;淋巴細胞的百分比(F2,29=8.453,Plt;0.05)6℃組和26℃組都顯著高于17℃組;單核細胞的百分比(F2,29=4.069,Plt;0.05)6℃組顯著低于26℃組;H/L(F2,29=4.530,Plt;0.05)17℃組顯著高于6℃組和26℃組;嗜異性粒細胞(F2,29=3.111,Pgt;0.05)和嗜堿性粒細胞的百分比(F2,29=0.560,Pgt;0.05)均無顯著的組間差異。第10天,嗜酸性粒細胞的百分比(F2,29=11.529,Plt;0.05)6℃組和17℃組顯著高于26℃組;單核細胞(F2,29=19.116,Plt;0.05)、淋巴細胞(F2,29=6.954,Plt;0.05)、嗜異性粒細胞(F2,29=7.850,Plt;0.05)的百分比和H/L(F2,29=3.532,Plt;0.05)26℃組顯著高于6℃組和17℃組;嗜堿性粒細胞的百分比(F2,29=0.655,Pgt;0.05)無明顯的組間差異(表1)。
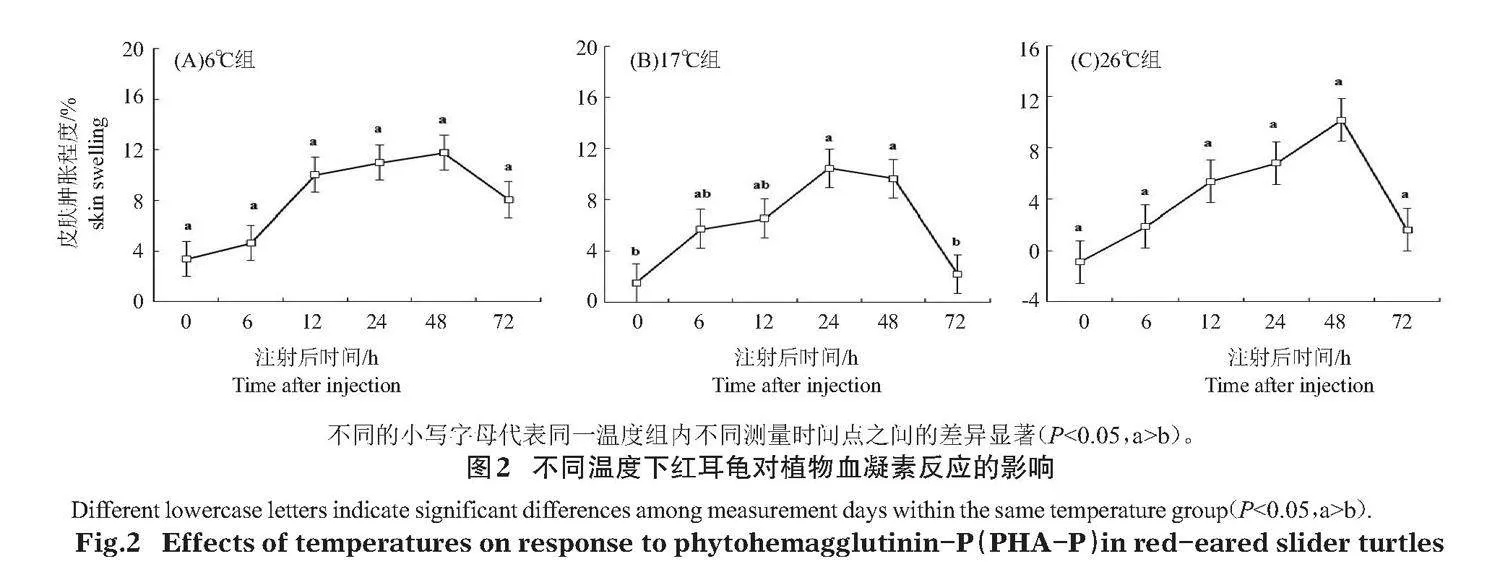
2.4"" 溫度對PHA-P反應的影響
溫度顯著影響紅耳龜對PHA-P的反應值(F2,15=89.374,Plt;0.05),但6℃組、17℃組和26℃組的PHA-P最大反應值未見顯著的組間差異(F2,15=0.065,Pgt;0.05,圖2)。6℃組(F5,35=2.375,Pgt;0.05,圖2-A)和26℃組(F5,35=2.053,Pgt;0.05,圖2-C)都在注射后48 h最高,24 h其次,0 h最低,但不同測量時間點均無顯著的組間差異;17℃組注射后24 h最高,48 h與24 h接近,顯著高于0 h和72 h(F5,35=2.559,Plt;0.05,圖2-B)。
3"" 討論
3.1"" 關于背甲下靜脈竇連續采血技術的普適性
活體背甲下靜脈竇采血技術曾被用于龜類(Barrows et al,2004)、海龜類(夏中榮,2018)和最適溫度處理條件下活體紅耳龜的單次采血(吳海燕等,2021);本研究發現,26℃組、17℃組和6℃分別處理紅耳龜1、5和10天均可快速采到約0.1 mL血液,不但能滿足制作血涂片的要求,也為連續監測同一溫度不同時間段對紅耳龜生理狀態的影響提供了可能性。背甲下靜脈竇采血技術不影響紅耳龜的正常生命活動、無損傷且操作簡單,建議推廣應用于其他龜類研究。
3.2"" 溫度和時間對紅耳龜各型白細胞百分比的影響
在20℃至28℃的溫度范圍內,經6周處理后,紅耳龜血液中嗜堿性粒細胞的百分比28℃和20℃組都高于24℃組,但嗜異性粒細胞和單核細胞的百分比未見明顯變化(吳海燕等,2021)。本研究中,隨溫度下降,第1天紅耳龜只有嗜堿性粒細胞顯著增高,26℃組、17℃組和6℃組均不隨處理天數延長而變化,說明1 d的溫度刺激即可有效激發嗜堿性粒細胞增殖(Davis et al,2008);季節性環境條件下,黃腹彩龜(Trachemys scripta scripta)(Hernandez et al,2017)和某種彩龜屬動物(Trachemys spp.)(Novovesky amp; Halán,2019)冬季嗜堿性粒細胞的百分比顯著高于夏季。各溫度組嗜異性粒細胞占比均不足2%,隨溫度下降,只在第10天下降明顯,這與黃腹彩龜等(Hernandez et al,2017;Novovesky amp; Halán,2019)嗜異性粒細胞的百分比夏季顯著高于冬季相似,但17℃組組內無明顯變化,26℃組隨處理時間延長而增加,6℃組下降,說明低溫會抑制嗜異性粒細胞的增殖。單核細胞的百分比第1、5和10天總體上隨溫度降低都呈下降趨勢,尤其是在第5和10天,隨處理天數延長26℃組先降后升,17℃組和6℃組下降明顯,可能與低溫抑制感染有關(成令忠等,2003)。
隨溫度下降,嗜酸性粒細胞和淋巴細胞的百分比第1天均無顯著變化,第5天前者先升后降,后者先降后升,第10天前者增高,后者降低。隨處理時間延長,26℃組和17℃組嗜酸性粒細胞與淋巴細胞的百分比變化趨勢相反,但6℃組嗜酸性粒細胞的百分比第5和10天顯著高于第1天,淋巴細胞的百分比未見明顯變化。嗜酸性粒細胞具有殺傷細菌、寄生蟲的功能,也是免疫反應和過敏反應過程中極為重要的細胞,主要執行天然免疫功能(成令忠等,2003),而淋巴細胞可分為T細胞、B細胞和自然殺傷細胞3類,T細胞受抗原刺激激活后參與細胞免疫,B細胞激活后與體液免疫有關(Davis et al,2008),兩者間潛在的權衡關系可能有利于維持適應性免疫與天然免疫處于動態平衡狀態。沙漠地鼠龜(Gopherus agassizii)淋巴細胞的百分比在秋、冬季升高而嗜酸性粒細胞的百分比卻在夏季最高(Sandmeier et al,2016);進一步的體外實驗證明,在偏離最適溫度范圍后,沙漠地鼠龜淋巴細胞的吞噬活性隨溫度下降而增強,這可能與呼吸類病原體增多有關(Slama et al,2022)。
3.3"" 溫度和時間對紅耳龜H/L及PHA-P反應的影響
與血漿皮質酮含量等激素類指標可快速指示脊椎動物的應激反應狀態不同,H/L變化更穩定、需時更長(Davis amp; Maney,2018;Flower et al,2018)。隨溫度下降,第1天紅耳龜H/L無明顯變化,第5天和第10天分別在17℃組和26℃組最高;隨處理時間延長,26℃組H/L無明顯變化,17℃組第5天顯著高于第10天,6℃組第1天最高,說明紅耳龜H/L變化受低溫影響波動較大,尤其在入眠或出眠前后,這有助于紅耳龜快速適應多變的溫度。研究表明,分布于我國南北兩地的黃喉擬水龜(Mauremys mutica)1齡幼龜,在其冬眠期間分別進行急性高溫脅迫處理,發現南方種群更易受到冬眠期間溫度波動的影響,表現出了更強的氧化應激反應(陳威等,2019);模擬熱浪侵襲1周后再恢復至初始水平,黃喉擬水龜幼龜肝、脾臟指數下降,血漿溶菌酶活性和血清補體C4水平升高,恢復至常溫后這些指標可恢復至初始水平,但抗氧化能力、熱休克蛋白含量和免疫力變化不大,可在一定程度上緩沖熱浪的威脅(Li et al,2021)。24℃組和28℃組紅耳龜H/L低于20℃組和32℃組,但同時表現出較高的血漿殺菌能力(吳海燕等,2021)。
本研究發現,與26℃組相比,10 d的17℃低溫刺激使紅耳龜對PHA-P的反應提前至注射后24 h,但更低的6℃卻無前移或后延效應。普通麝香龜(Sternotherus odoratus)的天然免疫能力對低溫較為敏感,暴露于5℃或10℃條件下48 h后殺菌能力和吞噬能力均有所增強(Goessling et al,2019),而溫度驟變可使中華鱉(Pelodiscus sinensis)機體血漿的皮質酮水平增加,抑菌能力降低(申思仙等,2018)。紅耳龜亞成體20℃組對PHA-P的反應在48 h、24℃組和28℃組在24 h和48 h、32℃組在24 h時最高,隨溫度升高反應峰值前移但無明顯的組間差異,PHA-P的最大反應值與血液中淋巴細胞的百分比升高有關(吳文欣等,2020)。灣鱷(Crocodylus porosus)在注射PHA-P后12 h趾蹼部位皮膚組織中粒細胞、巨噬細胞和淋巴細胞的數量均高于對照組(Finger et al,2013)。對分布于北美地區的紅耳龜,從4月底至9月初逐月監測其PHA-P反應,發現其對PHA-P的反應峰值出現于5月底(Zimmerman et al,2010b)。17℃處理促使紅耳龜對PHA-P的反應提前至注射后24 h,可能有助于提高其細胞免疫和體液免疫能力,來應對多變的環境溫度。
4"" 結論
活體背甲下靜脈竇采血技術和外源注射PHA-P抗原的方法對紅耳龜傷害較小或無損傷,建議推廣應用于其他龜類研究。低溫導致紅耳龜應激反應能力下降、嗜酸性粒細胞和淋巴細胞的百分比等多種免疫指標之間存在權衡關系,這些變化是其適應低溫脅迫的生理學基礎之一。
參考文獻
陳威, 胡小瑜, 蔣柳陽, 等, 2019. 黃喉擬水龜對冬眠期間急性高溫脅迫的氧化應激響應[J]. 生態學報,39(18):6916-6922.
成令忠, 鐘翠平, 蔡文琴, 2003. 現代組織學[M]. 上海:上海科學技術文獻出版社.
龔世平, 楊江波, 葛研, 等, 2018. 外來物種紅耳龜在中國野外分布現狀及擴散路徑研究[J]. 野生動物學報,39(2):373-378.
洪美玲, 史海濤, 丁利, 2019. 外來物種紅耳龜入侵半咸水的生理生態機制[M]. 北京:科學出版社.
申思仙, 史燕, 李偉, 等, 2018. 溫度對中華鱉血漿皮質酮水平、免疫生化指標及抑菌效果的影響[J]. 生態學雜志,37(9):2754-2760.
吳海燕, 馮文紅, 吳文欣, 等, 2021. 溫度對紅耳滑龜白細胞數量和殺菌能力的影響[J]. 動物醫學進展,42(9):91-95.
吳文欣, 吳海燕, 楊雨晴, 等, 2020. 紅耳龜植物血凝素反應峰值與血液指標的關系及溫度對其反應模式的影響[J]. 四川動物,39(6):639-645.
夏中榮, 2018. 一種用于海龜類的無損傷采血技術[J]. 科學養魚,34(10):84-85.
張志強, 2015. 動物生態學研究中免疫學參數的選擇及其優缺點分析[J]. 四川動物,34(1):145-148.
周贊, 蔡夢思, 劉虞, 等, 2016. 紅耳龜和中華草龜幼體體溫與運動的熱依賴性、補償生長及免疫力[J]. 生態學報,36(21):7014-7022.
Barrows M S, McArthur S, Wilkinson R, 2004. Diagnosis[M]//McArthur S, Wilkinson R, Meyer J. Medicine and Surgery of Tortoises and Turtles. Oxford: Blackwell Publishing Ltd.
Boughton R K, Joop G, Armitage S A O, 2011. Outdoor immunology: methodological considerations for ecologists[J]. Functional Ecology,25(1):81-100.
Brock P M, Murdock C C, Martin L B, 2014. The history of eco-immunology and its integration with disease ecology[J]. Integrative and Comparative Biology,54(3):353-362.
Campbell T W, Ellis C K, 2022. Exotic Animal Hematology and Cytology[M]. 3rd edition. Oxford: Wiley-Blackwell.
Davis A K, Maney D L, 2018. The use of glucocorticoid hormones or leucocyte profiles to measure stress in vertebrates: What's the difference?[J]. Methods in Ecology and Evolution,9(6):1556-1568.
Davis A K, Maney D L, Maerz J C, 2008. The use of leukocyte profiles to measure stress in vertebrates: a review for ecologists[J]. Functional Ecology,22(5):760-772.
Ferguson L V, Kortet R, Sinclair B J, 2018. Eco-immunology in the cold: the role of immunity in shaping the overwintering survival of ectotherms[J]. Journal of Experimental Biology,221(13):163873.
Finger J W, Amanda A L, Thomson P C, et al, 2013. Using phytohaemagglutinin to determine immune responsiveness in saltwater crocodiles (Crocodylus porosus)[J]. Australia Journal of Zoology,61(4):301-311.
Flower J E, Norton T M, Andrews K M, et al, 2018. Baseline corticosterone, hematology, and biochemistry results and correlations to reproductive success in nesting loggerhead sea turtles (Caretta caretta)[J]. Journal of Zoo and Wildlife Medicine,49(1):9-17.
Goessling J M, Ward C, Mendon?a M T, 2019. Rapid thermal immune acclimation in common musk turtles (Sternotherus odoratus)[J]. Journal of Experimental Zoology A:Ecological and Integrative Physiology,331(3):185-191.
Hernandez J D, Castro P, Saavedra P, et al, 2017. Seasonal variations in haematological parameters in yellow-bellied slider turtles (Trachemys scripta scripta)[J]. Veterinární Medicína,62(7):394-400.
Li S R, Li J H, Chen W, et al, 2021. Effects of simulated heat wave on oxidative physiology and immunity in Asian yellow pond turtle (Mauremys mutica)[J]. Frontiers in Ecology and Evolution,9:704105.
Novovesky E, Halán M, 2019. Observation of seasonal changes of selected hematological parameters in Trachemys spp.[J]. Folia Veterinaria,63(4):46-53.
Palackdharry S, Sadd B M, Vogel L A, et al, 2017. The effect of environmental temperature on reptilian peripheral blood B cell functions[J]. Hormones amp; Behavior,88:87-94.
Sandmeier F C, Tracy C R, Horn K R, 2016. Temperature-independent, seasonal fluctuations in immune function of the Mojave desert tortoise (Gopherus agassizii)[J]. Canadian Journal of Zoology,94(8):583-590.
Slama S L, Williams G S, Painter M N, et al, 2022. Temperature and season influence phagocytosis by B1 lymphocytes in the Mojave desert tortoise[J]. Integrative and Comparative Biology,62(6):1683-1692.
Zimmerman L M, Carter A W, Bowden R M, et al, 2017. Immunocompetence in a long-lived ectothermic vertebrate is temperature dependent but shows no decline in older adults[J]. Functional Ecology,31(7):1383-1389.
Zimmerman L M, Paitz R T, Vogel L A, et al, 2010b. Variation in the seasonal patterns of innate and adaptive immunity in the red-eared slider (Trachemys scripta)[J]. Journal of Experimental Biology,213(9):1477-1483.
Zimmerman L M, Vogel L A, Bowden R M, 2010a. Understanding the vertebrate immune system: insights from the reptilian perspective[J]. Journal of Experimental Biology,213(5):661-671.
(責任編輯"" 熊美華)
Effects of Low Temperature on Hematological Indices and Response to
Phytohemagglutinin in the Red-eared Slider Turtle, Trachemys scripta elegans
ZHANG Yi‐fan, LIN Han‐yu, LI Song‐ming, WU Liang, DIAO Ying‐zhu, ZHANG Zhi‐qiang
(College of Animal Science and Technology, Anhui Agricultural University," Hefei" 230036, P.R. China)
Abstract:In this study, we explored the effects of low temperatures on immune function and stress response in the red-eared slider turtle, Trachemys scripta elegans. Our aim was to reveal the physiological and immunological mechanisms of their adaptation to low-temperature environments, and provide basic data on their biological behavior as an invasive species. Healthy red-eared slider turtles purchased at the flower fair were exposed to three water temperatures (6℃, 17℃, and 26℃) for 10 days, with 10 turtles in each group. On day 1, 5 and 10, blood samples were collected from the dorsal cervical sinus and body mass, carapace length and width were measured. The percentage of different leukocytes and the ratio of heterophils to lymphocytes (H/L) were determined, and their response to the antigen, phytohemagglutinin-P (PHA-P), was measured on day 10 after collecting blood samples. Results were as follows: (1) Temperature and time had no significant effects on or interaction with body mass, carapace length and width. On day 1, the percentage of basophils significantly increased at 6℃ and 17℃ (Plt;0.05), but this effect was not observed on day 5 and day 10 (Pgt;0.05). On day 5, the percentage of eosinophils and H/L increased and then decreased, the percentage of lymphocytes initially decreased and then increased, while the percentage of monocytes tended to decrease (Plt;0.05). On day 10, the percentage of eosinophils increased, but the percentage of lymphocytes, heterophils and monocytes, and H/L decreased (Plt;0.05). (2) After 10 days, the percentage of leukocytes, except for the basophils and H/L, showed significant differences within temperature groups (Plt;0.05). (3) The response of the red-eared slider turtles to the PHA-P antigen peaked at 48 h, 24 h, and 48 h after injection in the 6℃, 17℃, and 26℃ groups, respectively, with no significant differences among the temperature groups (Pgt;0.05). Red-eared slider turtles adapt to short-term low temperature stress by adjusting the proportions of different types of leukocytes, reducing stress response capacity, and altering immune response timing.
Key words:Trachemys scripta elegans; low temperature; lymphocytes; eosinophils; phytohemagglutinin; stress response

