穩定表達VP5蛋白BGC823細胞系的構建

[摘 要] 溶瘤Ⅱ型單純皰疹病毒oHSV2是對Ⅱ型單純皰疹病毒HSV-2進行基因改造后得到的新型溶瘤病毒。UL19基因編碼的VP5蛋白為oHSV2主要衣殼蛋白之一。在前期已經通過GST pull-down與質譜檢測分析確定了oHSV2的VP5蛋白為人類白細胞抗原E(HLA-E)的相互作用蛋白的基礎上,將HLA-E作為NK與CTL等免疫細胞表面CD94/NKG2A的強效抑制性配體,當它與CD94/NKG2A結合后,NK與CTL細胞的免疫功能會受到一定程度的抑制。前期研究已證實oHSV2會在體外上調部分腫瘤細胞系表面HLA-E表達,為探究oHSV2是否通過VP5蛋白上調腫瘤細胞系表面HLA-E的表達,進而影響HLA-E和CD94/NKG2A的結合,最終改變NK細胞的抗腫瘤能力,通過PiggyBac 轉座系統構建穩定表達VP5蛋白的人胃腺癌細胞BGC823-VP5細胞系。所構建的細胞系經流式檢測單克隆細胞陽性率在99%以上;Western Blot檢測到VP5蛋白在細胞內表達;實時無標記動態細胞分析技術(RTCA Real Time Cell AnaIysis)檢測表明BGC823-VP5細胞系與親本細胞BGC823細胞生長活性一致。穩定表達VP5蛋白的人胃癌細胞BGC823-VP5細胞系的構建,為進一步研究oHSV2上VP5蛋白在人胃癌BGC823細胞內影響HLA-E的表達,進而影響免疫細胞的抗腫瘤能力奠定了基礎。
[關鍵詞] 溶瘤Ⅱ型單純皰疹病毒; VP5蛋白; BGC823細胞
[中圖分類號] R735.2" [文獻標識碼] A
溶瘤Ⅱ型單純皰疹病毒oHSV2是由Ⅱ型單純皰疹病毒(HSV-2)基因改造而來的新型溶瘤病毒,具體改造步驟是在Ⅱ型單純皰疹病毒(HSV-2)標準毒株HG52的基因組上敲除了ICP34.5和ICP47,同時在病毒基因組上插入了編碼人粒細胞巨噬細胞集落刺激因子(human granulocyte macrophage colony stimulating factor,hGM-CSF)的基因序列[1]。溶瘤Ⅱ型單純皰疹病毒oHSV2上VP5蛋白是由UL19基因編碼的病毒主要衣殼蛋白,屬于病毒晚期(leaky-late)表達蛋白[2],在病毒基因組復制開始后表達,在感染復制周期中晚期最高表達[3]。
病毒感染腫瘤細胞引起HLA-E表達上調的現象已有文獻報道[4]。本團隊前期實驗已經證實oHSV2會在體外上調部分腫瘤細胞系表面HLA-E的表達,且已經通過GST pull-down與質譜分析確定了oHSV2上由UL19基因編碼的VP5蛋白為人類白細胞抗原E(HLA-E)的相互作用蛋白。這提示了oHSV2可能通過VP5蛋白上調部分腫瘤細胞系表面HLA-E的表達,而HLA-E作為CTL細胞與NK細胞表面CD94/NKG2A的強效抑制性配體在腫瘤細胞表面表達會影響到CTL細胞與NK細胞介導的細胞毒性[5]。
胃癌作為最常見的消化道癌之一,其死亡率高居消化道癌癥第一位[6]。人胃癌BGC823細胞系作為經典的腫瘤研究細胞模型,在胃癌研究中極具代表性[7]。本研究擬在人胃癌BGC823細胞系基礎上構建穩定表達VP5蛋白的人胃癌細胞系,以利于進一步探究VP5蛋白影響腫瘤細胞表面HLA-E表達進而影響CTL細胞與NK細胞介導的細胞毒性的機制。
目前用于真核蛋白穩定表達細胞系構建的常用載體有轉座子載體與慢病毒載體[8],本研究選擇的是轉座子載體,采用了PiggyBac 轉座質粒系統。作為DNA型轉座系統,PiggyBac轉座質粒系統憑借其轉座效率高、宿主范圍廣等優勢,已廣泛應用于哺乳動物細胞真核蛋白穩定表達細胞系構建中[9]。PiggyBac 轉座質粒系統需要轉座子質粒與轉座酶質粒共同發揮作用。轉座酶質粒可編碼由594個氨基酸組成的PiggyBac轉座酶,轉座酶在細胞內表達后可在轉座子轉座過程中切斷DNA使轉座子從質粒載體中釋放出來,同時也可將宿主細胞內目標染色體的特定位點剪切為粘性末端雙鏈斷口[10]。在DNA連接酶的作用下,載體質粒會重新連接起來,連接宿主細胞染色體粘性末端雙鏈斷口,從而整合到宿主細胞染色體上[11]。本研究使用已插入UL19基因(oHSV2上VP5蛋白的編碼基因)與綠色熒光蛋白(green fluorescent protein ,GFP)基因的轉座子質粒和表達轉座酶的轉座酶質粒轉染BGC823細胞,使GFP與UL19基因整合到BGC823細胞染色體上,從而在BGC823細胞中穩定表達VP5蛋白。其中GFP 作為熒光標簽蛋白,可作為細胞系篩選過程中的重要指標[12]。
1 實驗材料
1.1 實驗材料和試劑
本實驗使用來源于協和醫院(北京)的人胃癌細胞株;細胞培養使用DMEM/F12(南京森貝伽生物科技)、FBS(浙江天杭生物);PiggyBac Dual Promoter-VP5 重組質粒及菌種由本實驗室前期構建并保存;Super PiggyBac Transposase(pSPBT)轉座酶質粒由本實驗室前期改造并保存;質粒提取使用江蘇康為世紀生物科技有限公司無內毒素質粒中提試劑盒;質粒轉染使用Lipofectamine 3000轉染試劑盒(Thermo Fisher Scientific);細胞篩選用嘌呤霉素(Puro)購自白鯊生物;PAGE凝膠快速制備試劑盒(10%)購自上海雅酶生物醫藥科技有限公司;Anti-VP5抗體購自圣克魯斯生物技術有限公司;山羊抗兔二抗購自proteintech。
1.2 主要實驗儀器
二級生物安全柜 (北京東聯哈爾), CO2培養箱 (Panasonic), 體視熒光顯微鏡 (Nikon),細胞計數儀 (Thermo Fisher Scientific), 流式細胞檢測儀 (BD), 多功能實時無標記細胞分析儀 (ACEA Biosciences Inc)。
2 實驗方法
2.1 細胞培養
50 mL FBS加入450 mL DMEM/F12內混勻即為BGC823細胞培養用完全培養基;BGC823細胞于37℃,5%" CO2的培養箱內培養。
2.2 質粒提取
從超低溫保存箱中取出前期保存的pPBDP-VP5與pSPBT質粒菌種,冰上化凍后在超凈工作臺內取15 μL質粒菌種接種于15 mL的LB培養基中,加入 15 μL 抗生素,37℃,200 r/min 搖菌 14 h。質粒提取操作按照試劑盒相應說明書完成。提取完成后及時測定所提質粒DNA濃度,于-20℃冰箱保存。
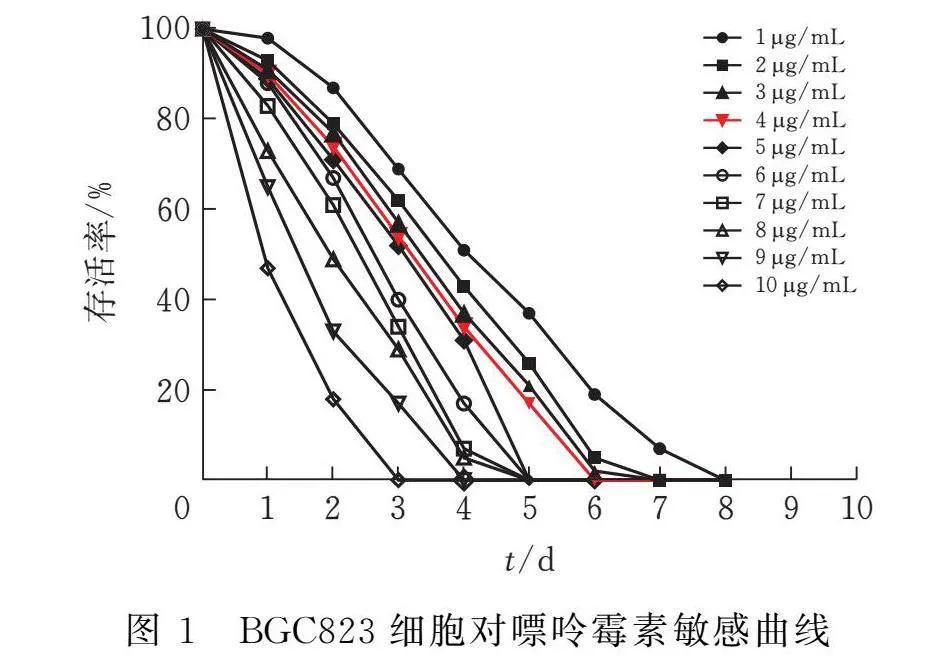
2.3 細胞對嘌呤霉素敏感性實驗
取BGC823細胞,消化并終止后計數,以完全培養基稀釋細胞,稀釋至細胞濃度為3×105 個/mL,以每孔0.5 mL置于24孔板中培養。于培養箱中培養1 d待BGC823細胞匯合度達到80%后,取出24孔板,在生物安全柜內棄掉孔板中舊培養基,各培養孔中各換入1 mL完全培養基,在各孔內分別加入1、2、3、4、5、6、7、8、9 、10 μL嘌呤霉素(1 μg/μL),每個濃度3次重復。輕輕搖晃孔板,將孔板內抗生素與培養基搖晃均勻后放入培養箱中繼續培養,期間每日觀察記錄細胞生長狀態與存活細胞比例,每2日對24孔板中培養基進行更換并加入對應體積嘌呤霉素。最后于加入嘌呤霉素后第6天確定細胞系篩選過程中的嘌呤霉素最合適濃度。
2.4 質粒轉染
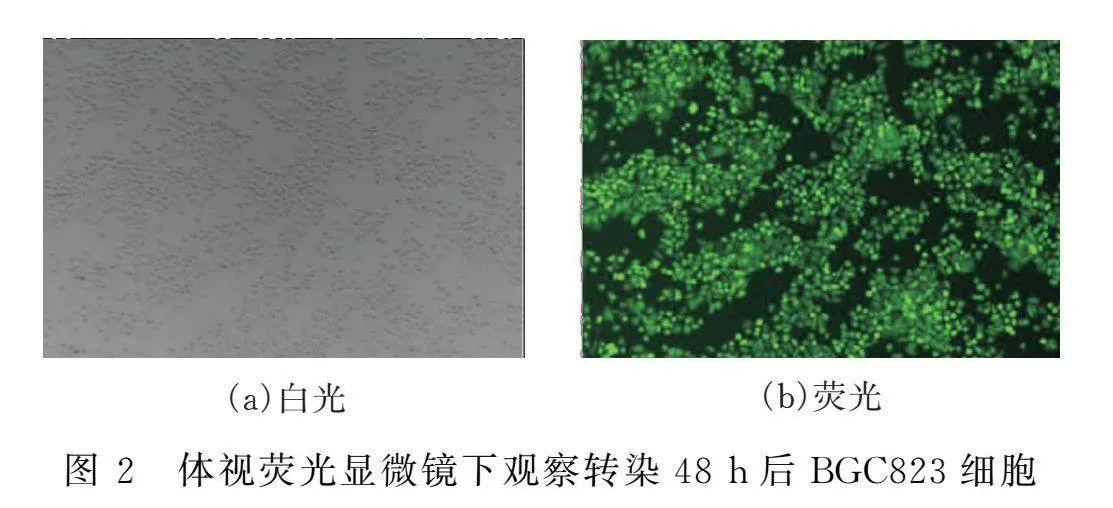
取BGC823細胞,消化終止后計數,將細胞以每孔1.5×105個鋪于24孔板中。細胞放入培養箱內培養24 h待孔板內細胞匯合度達到80%后,取出24孔板,在生物安全柜內棄掉24孔板內舊培養基,每孔換入新培養基。將pPBDP-VP5質粒與pSPBT按質量比為5∶1轉染BGC823細胞。轉染完成后,輕輕晃動孔板使轉染體系與培養基混合均勻,于培養箱內繼續培養細胞。轉染48 h后在體視熒光顯微鏡下觀察細胞發光率。
2.5 嘌呤霉素篩選
轉染48 h后,取出BGC823細胞,在生物安全柜內棄去24孔板內舊培養基,每孔換入1 mL新培養基,并按照BGC823細胞對嘌呤霉素敏感性實驗所確定的最合適嘌呤霉素濃度加入嘌呤霉素。放入培養箱繼續培養,期間每日觀察細胞生長狀態與細胞發光率,每2 日更換24孔板內培養基與嘌呤霉素。嘌呤霉素篩選至24孔板內細胞發光率達到50%后在生物安全柜內消化細胞,終止消化后吹勻細胞,計數,使用完全培養基稀釋至10 個/mL。將稀釋后細胞轉入96孔板中(每孔100 μL),放入培養箱中繼續培養。培養24 h后取出96孔板,在顯微鏡下觀察96孔板內細胞并記錄只生長有單個細胞的培養孔。繼續培養至單個細胞增殖為細胞團后,體視顯微鏡挑選發光單克隆細胞團,并將單克隆細胞轉移至24孔板內,放入培養箱內繼續培養。待24孔板中細胞匯合度達到80%后消化細胞,終止消化后轉移至T25培養瓶內培養。
2.6 流式細胞儀檢測細胞GFP表達
取BGC823-VP5細胞與BGC823細胞消化并終止后離心,用PBS重懸并稀釋細胞至2×105個/mL。以BGC823細胞為對照,使用流式細胞儀檢測BGC823-VP5細胞GFP的表達率。
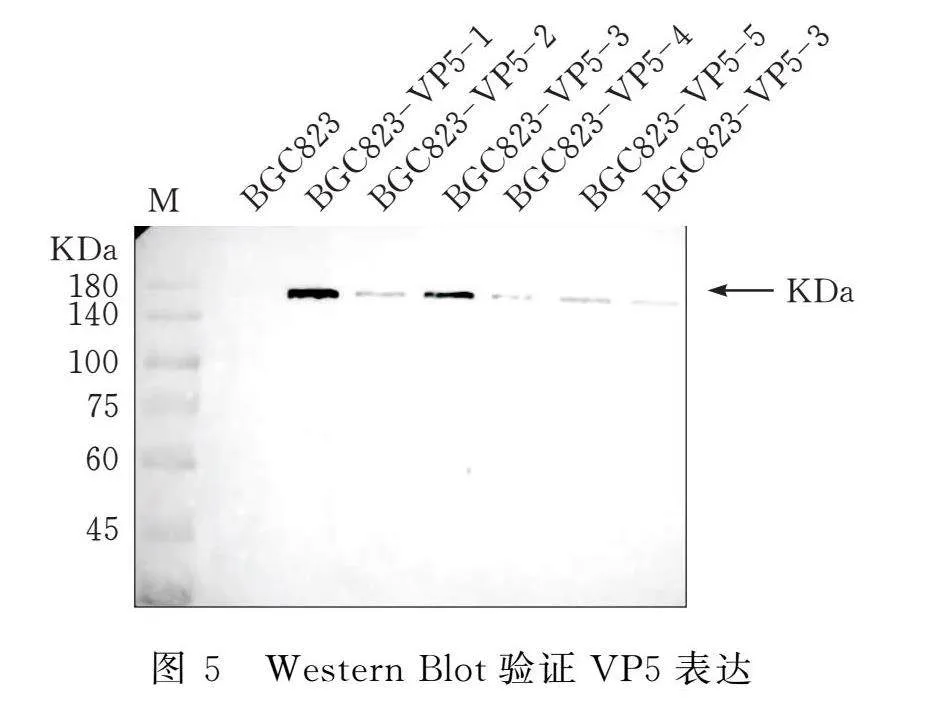
2.7 Western Blot檢測細胞VP5表達
取BGC823-VP5細胞與BGC823細胞分別鋪于6孔板,于培養箱內培養1 d后取出,棄去孔板內培養基,使用RIPA(強)裂解液4℃裂解細胞,4℃離心裂解后細胞收獲總蛋白,使用蛋白上樣緩沖液100℃變性蛋白。變性后蛋白通過蛋白膠電泳分離,使用半干轉印槽將SDS-PAGE內蛋白轉印至NC膜(電壓15 V,20 min)。采用含有5% 脫脂奶粉的TBST室溫封閉1 h,一抗室溫孵育1 h,二抗室溫孵育1 h。使用ECL顯色液顯色。
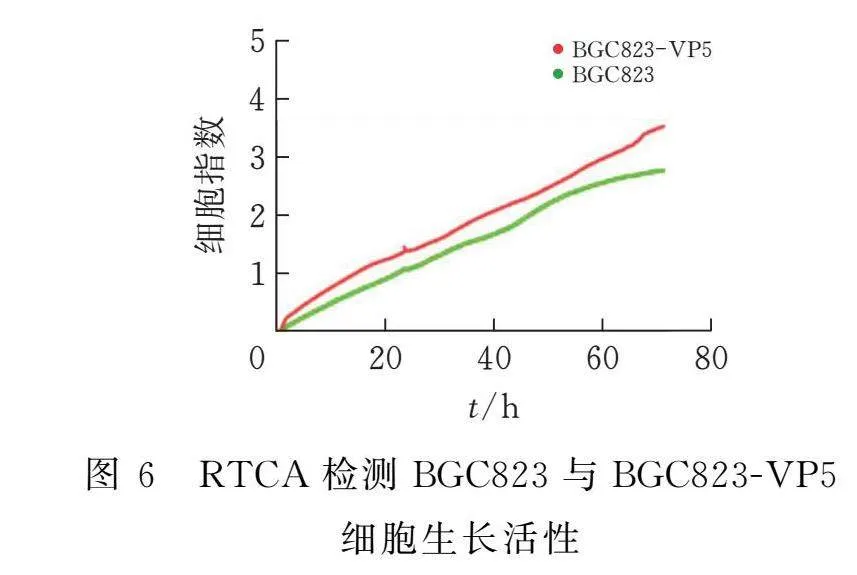
2.8 實時無標記細胞分析儀(RTCA)檢測細胞生長與增殖活性
選擇GFP陽性率在99%以上的BGC823-VP5-3細胞系進行細胞生長活性檢測。分別取BGC823-VP5-3細胞與BGC823細胞消化終止后計數,使用培養基分別稀釋細胞密度至1×105個/mL,以100 μL每孔鋪于RTCA專用16孔板,將RTCA放入培養箱內以每5 min一次的頻率監測細胞生長狀態,共監測72 h[13]。
3 實驗結果
3.1 BGC823細胞對嘌呤霉素敏感性實驗
以1~10 μg/μL為嘌呤霉素濃度范圍刺激BGC823細胞,觀察細胞存活率并制作細胞生存曲線。由圖1可知,嘌呤霉素刺激細胞后6 d內細胞全部死亡的最低嘌呤霉素濃度為5 μg/μL,故采用5 μg/μL的嘌呤霉素濃度作為細胞系篩選濃度。
3.2 質粒轉染
在體視熒光顯微鏡下觀察BGC823細胞轉染pPBDP-VP5質粒與pSPBT質粒48 h后細胞GFP表達水平。如圖2所示,在顯微鏡下可觀察到大量綠色細胞團,表明轉染成功,外源基因在BGC823細胞內表達。
3.3 單克隆細胞挑選擴培
轉染后細胞經濃度為5 μg/μL的嘌呤霉素篩選3 周后,稀釋挑選單克隆細胞于96孔板中培養。細胞在96孔板中培養72 h后在熒光顯微鏡下觀察細胞生長狀態與GFP表達,培養7 d后在熒光顯微鏡下可觀察到明顯單克隆細胞團。圖3為熒光顯微鏡下單克隆細胞及由單克隆細胞生長所得單克隆細胞團。
3.4 流式細胞儀檢測BGC823-VP5細胞GFP表達
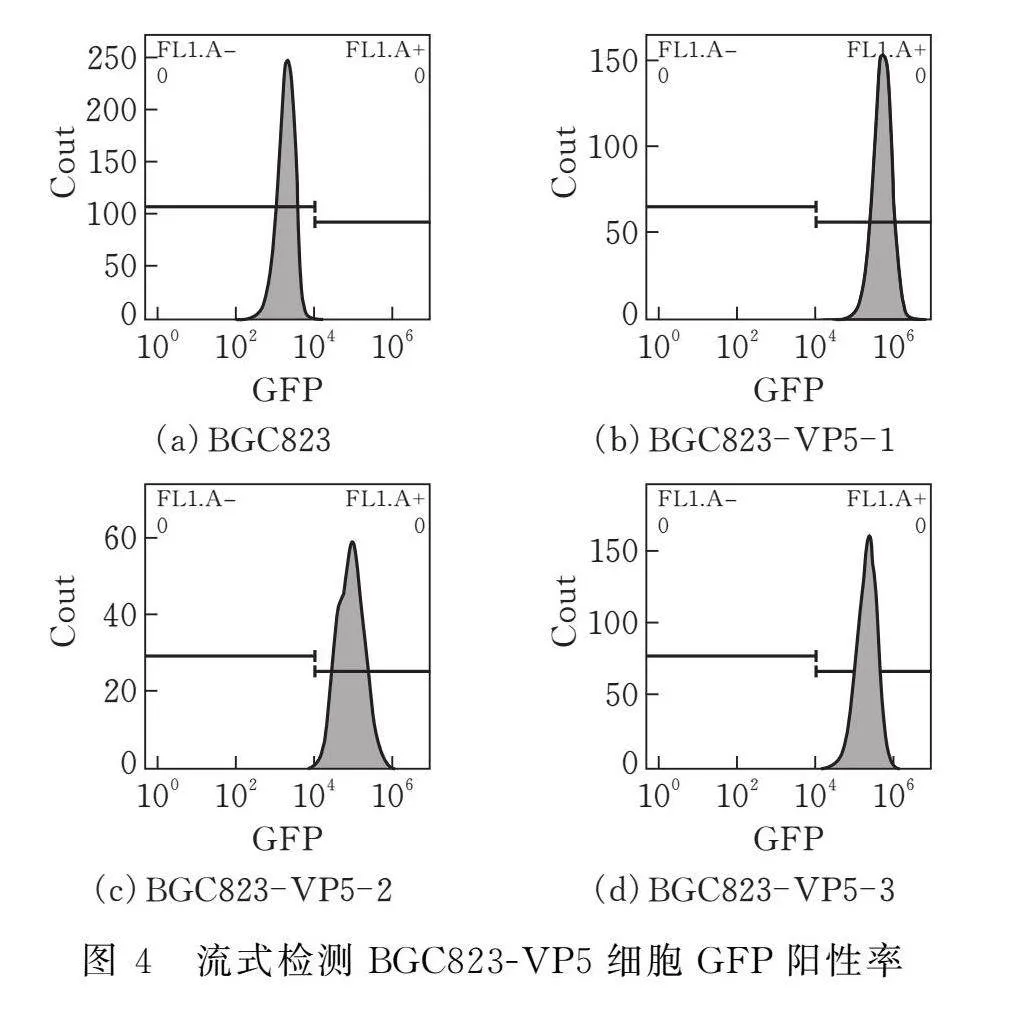
選擇3株BGC823-VP5(BGC823-VP5-1、BGC823-VP5-2、BGC823-VP5-3)單克隆細胞系將細胞以PBS稀釋至2×105個/mL后,以BGC823為對照流式檢測BGC823-VP5單克隆細胞純度與GFP表達。流式結果顯示,3株BGC823-VP5細胞系GFP陽性率均達到99.9%,表明GFP在BGC823-VP5細胞系內穩定表達(圖4)。
3.5 Western Blot檢測BGC823-VP5細胞VP5蛋白表達
BGC823-VP5與BGC823細胞全細胞裂解產物中加入蛋白上樣緩沖液后,經高溫變性,PAGE膠電泳分離蛋白。Western Blot結果顯示:在BGC823-VP5細胞中存在VP5蛋白,在BGC823細胞中未檢到VP5蛋白(圖5)。
3.6 實時無標記動態細胞分析技術(RTCA)檢測BGC823-VP5細胞生長活性
RTCA檢測BGC823-VP5與BGC823細胞的生長活性。結果顯示,在72 h內,BGC823-VP5細胞的細胞指數(cell index)均高于BGC823細胞,表明外源基因的插入并未降低BGC823細胞生長活性(圖6)。
4 結束語
根據抗原性差異,單純皰疹病毒可分為Ⅰ型和Ⅱ型,其中Ⅰ型主要感染口、唇的皮膚粘膜及中樞神經系統,而Ⅱ型主要與外生殖器感染和新生兒感染有關。目前以Ⅰ型單純皰疹病毒為載體的溶瘤病毒產品T-Vec已在2015年上市,而以Ⅱ型單純皰疹病毒為載體的溶瘤病毒產品也已進入臨床試驗階段。
NKG2A作為自然殺傷細胞受體家族2中的抑制性受體,是NK細胞表面優先表達的跨膜蛋白之一,主要表達在NK細胞表面和部分T細胞表面。在免疫細胞表面, NKG2A與CD94分子(NK細胞表面膜蛋白)以二硫鍵連接形式形成的異質二聚體復合物NKG2A/CD94。
人類白細胞抗原E(HLA-E)作為NK細胞表面抑制性受體CD94/NKG2A分子的唯一配體,廣泛表達于各類癌細胞表面,并通過結合CD94/NKG2A受體抑制NK細胞的激活[14]。本團隊前期實驗已經證實oHSV2會在體外上調人胃癌BGC823細胞表面HLA-E的表達,并通過GST pull-down與質譜技術證實了oHSV2上VP5蛋白為HLA-E的相互作用蛋白。
目前已有研究表明,人巨細胞病毒(HCMV)在感染腫瘤細胞后可上調腫瘤細胞表面HLA-E表達,其主要作用機制是通過病毒糖蛋白UL40所產生的肽段與HLA-E結合[15]。oHSV2在體外上調腫瘤細胞表面HLA-E表達的機制尚未明確,為研究oHSV2是否通過VP5蛋白上調人胃癌BGC823細胞表面HLA-E表達,使用PiggyBac 轉座質粒系統與脂質體轉染法將UL19基因插入BGC823細胞染色體上,通過嘌呤霉素篩選獲得成功表達GFP與VP5蛋白的單克隆細胞系。使用Western Blot與流式分別驗證GFP與VP5蛋白在BGC823-VP5中表達。使用RTCA技術證實BGC823-VP5與BGC823細胞生長活性一致。
本研究所構建穩定表達VP5蛋白的BGC823-VP5細胞系為研究oHSV2在體外上調腫瘤細胞表面HLA-E表達的機制提供了合適的細胞模型,同時此細胞系穩定表達綠色熒光蛋白,為后續探究VP5蛋白在小鼠動物模型內影響HLA-E表達及NK細胞抗腫瘤能力奠定了基礎。
[ 參 考 文 獻 ]
[1] ZHANG W, ZENG B, HU X, et al. Oncolytic herpes simplex virus type 2 can effectively inhibit colorectal cancer liver metastasis by modulating the immune status in the tumor microenvironment and inducing specific antitumor immunity [J]. Human gene therapy, 2021, 32(3-4): 203-215.
[2] YUAN S, WANG J, ZHU D, et al. Cryo-EM structure of a herpesvirus capsid at 3.1 [J]. Science (New York, NY), 2018, 360(6384):eaao7283.
[3] LIEU P T, WAGNER E K. Two leaky-late HSV-1 promoters differ significantly in structural architecture [J]. Virology, 2000, 272(01): 191-203.
[4] NATTERMANN J, NISCHALKE H D, HOFMEISTER V, et al. The HLA-A2 restricted T cell epitope HCV core 35-44 stabilizes HLA-E expression and inhibits cytolysis mediated by natural killer cells [J]. The American journal of pathology, 2005, 166(02): 443-453.
[5] PETRIE E J, CLEMENTS C S, LIN J, et al. CD94-NKG2A recognition of human leukocyte antigen (HLA)-E bound to an HLA class I leader sequence [J]. The Journal of experimental medicine, 2008, 205(03): 725-735.
[6] 曹毛毛, 李賀, 孫殿欽, 等. 2000—2019年中國胃癌流行病學趨勢分析[J]. 中華消化外科雜志, 2021, 20(01): 102-109.
[7] FU X, TAO L, ZHANG X. An oncolytic virus derived from type 2 herpes simplex virus has potent therapeutic effect against metastatic ovarian cancer [J]. Cancer gene therapy, 2007, 14(05): 480-487.
[8] 盧加琪, 韋薇, 白玉, 等. 細胞治療產品的基因轉導系統及審評要點 [J]. 中國新藥雜志,2020(01): 27-32.
[9] SAHA S, WOODARD L E, CHARRON E M, et al. Evaluating the potential for undesired genomic effects of the piggyBac transposon system in human cells [J]. Nucleic acids research, 2015, 43(03): 1770-1782.
[10] SARKAR A, SIM C, HONG Y S, et al. Molecular evolutionary analysis of the widespread piggyBac transposon family and related \"domesticated\" sequences [J]. Molecular genetics and genomics : MGG, 2003, 270(02): 173-180.
[11] LOBO N F, FRASER T S, ADAMS J A, et al. Interplasmid transposition demonstrates piggyBac mobility in vertebrate species [J]. Genetica, 2006, 128(1-3): 347-357.
[12] PDELACQ J D, CABANTOUS S, TRAN T, et al. Engineering and characterization of a superfolder green fluorescent protein [J]. Nature biotechnology, 2006, 24(01): 79-88.
[13] MARTINEZ-SERRA J, GUTIERREZ A, MUOZ-CAP S, et al. xCELLigence system for real-time label-free monitoring of growth and viability of cell lines from hematological malignancies [J]. OncoTargets and therapy, 2014, 7: 985-994.
[14] ZHEN Z J, LING J Y, CAI Y, et al. Impact of HLA-E gene polymorphism on HLA-E expression in tumor cells and prognosis in patients with stage Ⅲ colorectal cancer [J]. Medical oncology (Northwood, London, England), 2013, 30(01): 482.
[15] ULBRECHT M, MARTINOZZI S, GRZESCHIK M, et al. Cutting edge: the human cytomegalovirus UL40 gene product contains a ligand for HLA-E and prevents NK cell-mediated lysis [J]. Journal of immunology (Baltimore, Md : 1950), 2000, 164(10): 5019-5022.
Construction of BGC823 Cell Line Stably Expressing VP5Protein of Herpes Simplex Virus Type Ⅱ
XIAO Xiong, ZHAO Xiaotong,LI Le, ZHOU Qin, WANG Yang, HU Han, LIU Binlei
(School of Food and Biological Engin., Hubei Univ. of Tech., Wuhan 430068, China)
Abstract: Oncolytic herpes simplex virus type Ⅱ oHSV2 is a new type of oncolytic virus obtained by genetic modification on the basis of herpes simplex virus type Ⅱ HSV-2. VP5 protein encoded by UL19 gene is one of the main capsid proteins of oHSV2. Our team has determined that VP5 protein of oHSV2 is the interaction protein of human leukocyte antigen E (HLA-E) through GST pull down and mass spectrometry detection and analysis in the early stage. HLA-E is a potent inhibitory ligand of CD94/NKG2A on the surface of CTL cells and NK cells. When it binds with CD94/NKG2A, the immune function of CTL cells and NK cells will be inhibited. On the basis of previous studies that have confirmed that oHSV2 can up regulate the expression of HLA-E on the surface of some tumor cell lines in vitro, in order to explore whether oHSV2 can up regulate the expression of HLA-E on the surface of tumor cell lines through VP5 protein, thereby affecting the binding of HLA-E and CD94/NKG2A, and ultimately changing the anti-tumor ability of NK cells, a human gastric adenocarcinoma cell line BGC823-VP5 stably expressing VP5 was constructed through PiggyBac transposition system. The positive rate of monoclonal cells in the constructed cell line was more than 99% by flow cytometry; Western Blot detected VP5 protein expression in cells; RTCA Real Time Cell AnaIysis showed that the growth activity of BGC823-VP5 cell line was consistent with that of its parent cell BGC823. The construction of a human gastric cancer cell line BGC823-VP5 stably expressing VP5 lays a foundation for exploring the effect of VP5 protein on oHSV2 on the expression of HLA-E in tumor cells and thus on the anti-tumor activity of NK cells.
Keywords: oncolytic herpes simplex virus type Ⅱ; VP5 protein; BGC823 cells
[責任編校: 張 眾]

