槲皮素-3-O-乙酸-(4 -(3H-1,2-二硫雜環戊烯-3-硫酮))-苯酯的合成





[摘 要] 以蘆丁為起始原料,以5-(4-羥基苯基)-3H-1,2-二硫雜環戊烯-3-硫酮作為H2S供體,合成一種具有治療糖尿病且促進傷口愈合功能的藥物槲皮素-3-O-乙酸-(4-(3H-1,2-二硫雜環戊烯-3-硫酮))-苯酯。整個工藝路線包括取代、水解、williamson醚化、水解和酯化等5步反應,總產率為6.4 %。各步產物經MS、1H NMR分析表征。該合成路線具有原料廉價易得、反應條件溫和、操作簡便的優點。
[關鍵詞] 蘆丁; 槲皮素; H2S供體
[中圖分類號] R914.4" [文獻標識碼] A
糖尿病患者創面愈合過程中,由于創面新生血管形成過少,會導致患者創面的愈合緩慢[1],因此單獨給予一種糖尿病藥物往往沒有較好的治療效果。通過聯合給藥可以實現降低血糖、促進傷口愈合的目的[2-3]。槲皮素具有降低血糖水平的活性,對其結構可以進行化學修飾,可用做降血糖藥物[4]。H2S能夠通過調控一些細胞因子和基因表達來影響傷口周圍細胞以及組織的生長,進而促進傷口愈合[5-6]。基于此,本研究的思路是利用藥物拼合原理[7],將槲皮素和H2S供體兩種化合物的基本結構拼合在一個分子中,合成新的分子,以發揮治療糖尿病和促進傷口愈合的雙重作用[8],達到聯合用藥的目的。
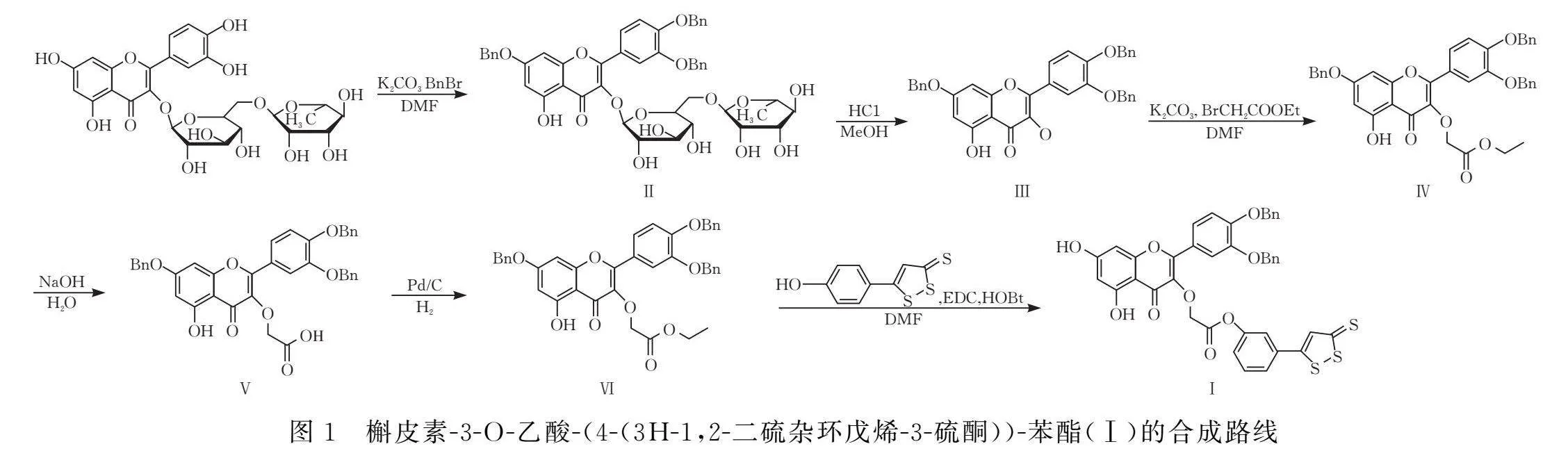
本研究以蘆丁為起始原料,以5-(4-羥基苯基)-3H-1,2-二硫雜環戊烯-3-硫酮作為硫化氫供體,經過取代-水解-williamson醚化水解酯化反應得到目標化合物(Ⅰ)槲皮素-3-O-乙酸-(4-(3H-1,2-二硫雜環戊烯-3-硫酮))-苯酯(合成路線見圖1)。同時,探討了部分工藝參數對產率的影響。
1 實驗部分
1.1 儀器與試劑
JY2301型電子天平,上海天祥儀器儀表廠;DF-236S型磁力攪拌器,鄭州博時電子有限公司;RE-3型旋轉蒸發儀,上海亞榮生化儀器廠;GYH-5698型鼓風干燥箱,廣州機電實業有限公司;D-2型真空干燥箱,上海真空設備有限公司;WQS-3C型熔點儀,廣州儀表有限公司;MH-2型循環水式真空泵,寧波真空器械有限責任公司;400 M超導核磁共振波譜儀,安捷倫科技有限公司。
溴化芐的純度,99%;溴乙酸乙酯的純度,98%;Pd/C的純度,10%;EDC的純度,97%;HOBt的純度,99%;5-(4-羥基苯基)-3H-1,2-二硫雜環戊烯-3-硫酮(ADT-OH)的純度,97%。其它試劑、溶劑均為分析純,購于國藥集團化學試劑有限公司。
1.2 實驗步驟
1.2.1 3’,4’,7-O-三芐基槲皮素(Ⅲ)的合成 將無水蘆丁(4.88 g,8 mmol)溶于40 mL DMF中,加入無水K2CO3(3.86 g,28 mmol),28℃,氮氣保護下攪拌0.5 h后,緩慢滴加溴化芐(3.8 mL,32 mmol),升溫至60℃,反應3 h。反應結束,反應液用冰乙酸調節pH至5,離心并收集固體(II)溶于120 mL乙醇中,再次升溫至70℃,加入18 mL濃HCl,回流反應2 h。反應結束,反應液冷卻至室溫,過濾后烘干,得3.5 g黃色固體(Ⅲ),產率為71.7%。Mp:190~192℃。1H NMR(400 MHz,DMSO-d6)δ:12.40(s,1H);9.67(s,1H);7.88(s,1H);7.81(s,1H);7.49-7.33(m,15H);7.24(s,1H);6.83(s,1H);6.42(s,1H);5.22(s,6H)。
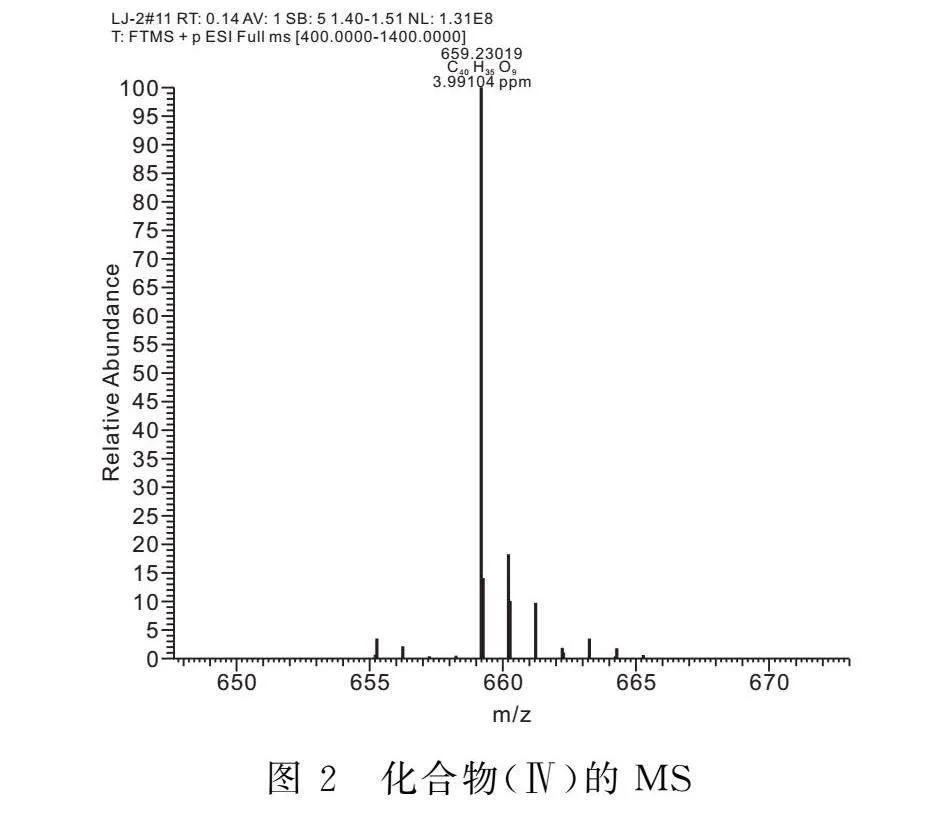
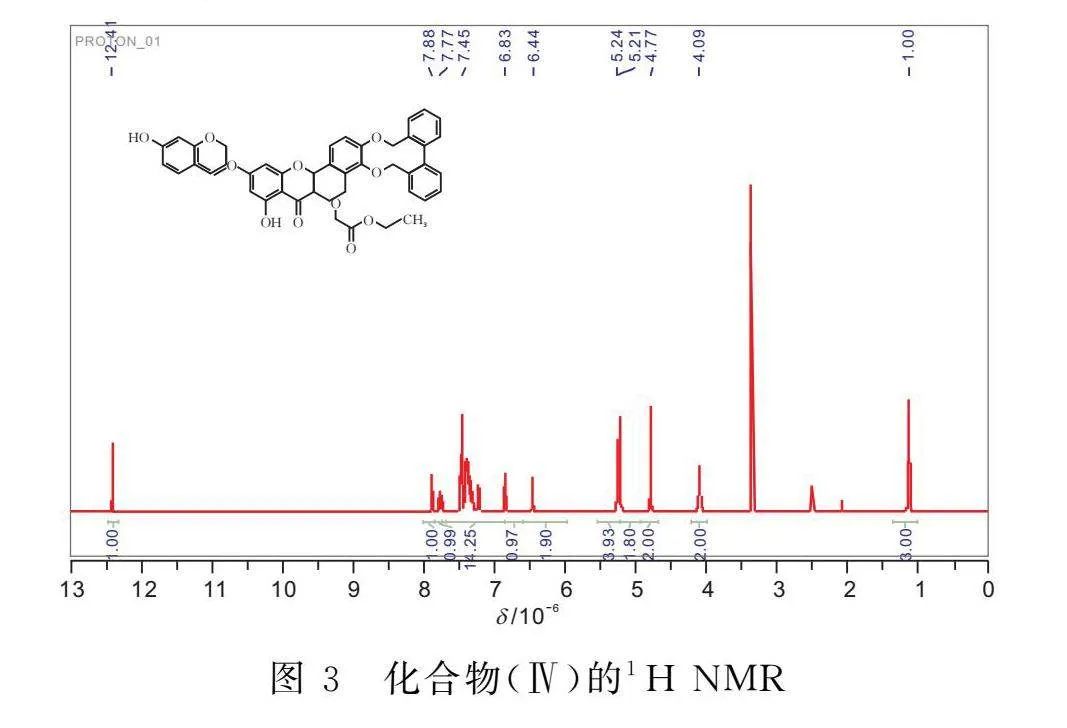
1.2.2 3’,4’,7-O-三芐基槲皮素-3-O-乙酸乙酯(Ⅳ)的合成 將化合物(Ⅲ)(2.3 g,4 mmol)溶于60 mL DMF中,加入無水K2CO3(690 mg,5 mmol),室溫攪拌反應0.5 h后,緩慢滴加溴乙酸乙酯(500 μL,4.4 mmol)的DMF(15 mL)溶液,20℃下反應2 h。反應結束,反應液用冰乙酸調節pH至6,用乙酸乙酯/水萃取后,飽和食鹽水洗滌,有機相用無水硫酸鈉干燥,過濾后濃縮,經硅膠柱純化(V(丙酮)∶V(石油醚)=1∶4),得到0.5 g黃色固體(Ⅳ),產率為21.7%。Mp:121~122℃。1H NMR(400 MHz,DMSO-d6)δ:12.47-12.31(m,1H);7.88(d,J=2.1 Hz,1H);7.84-7.72(m,1H);7.69-6.85(m,14H);6.84-6.59(m,1H);6.57-5.96(m,2H);5.54-5.21(m,4H);5.21-4.93(m,2H);4.79(d,J=16.9 Hz,2H); 4.21-3.97 (m, 2H);1.35-0.99 (m, 3H)。ESI-MS,m/z:659.23019[M+H]+,理論值為658.22。
1.2.3 3’,4’,7-O-三芐基槲皮素-3-O-乙酸(Ⅴ)的合成 將化合物(Ⅳ)(2.63 g,4 mmol)溶于100 mL的NaOH水溶液(2 mmol/mL),回流3 h。反應結束,反應冷卻至室溫,用稀HCl調節pH至2~3,用乙酸乙酯/水萃取后,調節有機相的pH至5~6,過濾后烘干,得2.36 g黃色固體(Ⅴ),產率為90%。Mp:164~165℃。1H NMR(400 MHz,DMSO-d6)δ:13.01(s,1H);12.45(s,1H);7.98(s,1H);7.75(s,1H);7.48-7.33(m,15H);7.18(s,1H);6.80(s,1H);6.42(s,1H);5.21(s,6H);4.74(s,2H)。ESI-MS,m/z:631.19905[M+H]+,理論值為630.19。
1.2.4 槲皮素-3-O-乙酸(Ⅵ)的合成 將化合物(Ⅴ)(600 mg,1 mmol)溶于60 mL混合溶液(V(二氯甲烷)∶V(甲醇)=2∶1)后,加入10% Pd/C(60 mg),在加氫反應釜中,25℃下反應7 h。反應結束,反應液離心、過濾并烘干后,得到314 mg黃色固體(Ⅵ),產率:52%,Mp:283~284℃。1H NMR(400 MHz,DMSO-d6)δ:12.51(s,1H);10.84(s,1H);9.74(s,1H);9.28(s,2H);7.53(s,1H);6.85(d,J=9.1 Hz,1H);6.84(s,1H);6.38(s,1H);6.17(s,1H);4.65(s,2H)。ESI-MS,m/z:361.05522[M+H]+,理論值為360.05。
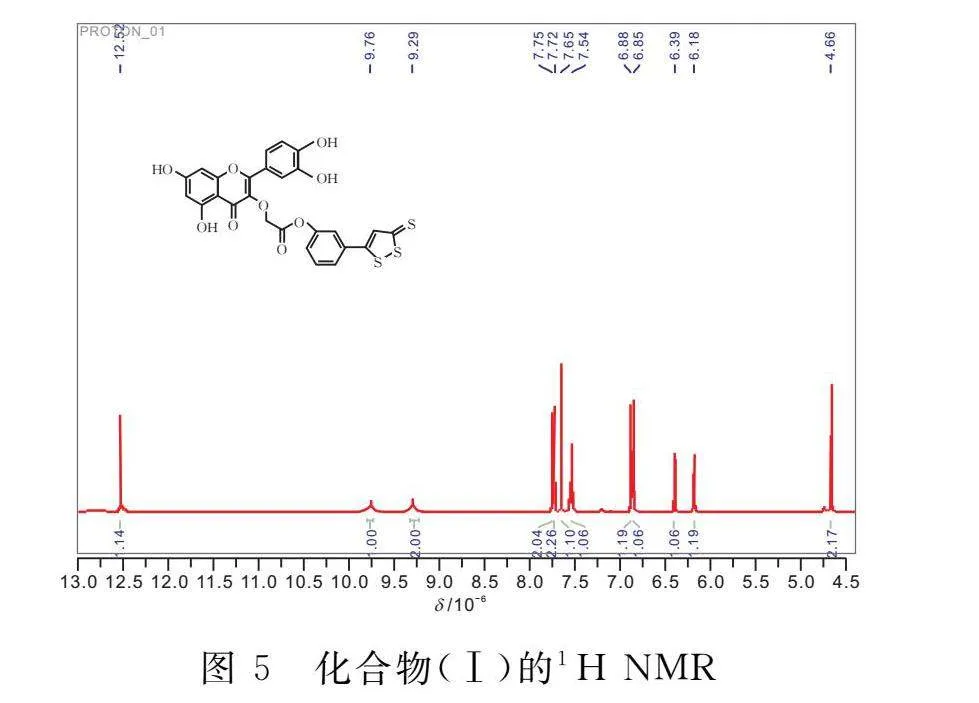
1.2.5 槲皮素-3-O-乙酸-(4-(3H-1,2-二硫雜環戊烯-3-硫酮))-苯酯(Ⅰ)的合成 將化合物(Ⅵ)(100 mg,0.2778 mmol)溶于10 mL DMF,加入EDC(79.59 mg,0.4167 mmol),HOBt(63.76 mg,0.4167 mmol),在0℃下反應1 h。反應結束,再加入ADT-OH(94.3 mg,0.4167 mmol),升溫至25℃反應5 h。反應結束,反應液減壓濃縮后,加水攪拌并離心,固體烘干后,得到140 mg目標產物(Ⅰ),產率為88%,Mp:169~171℃。1H NMR(400 MHz,DMSO-d6)δ:12.52(s,1H);9.76(s,1H);9.29(s,2H);7.75(s,2H);7.72(s,2H);7.65(s,1H);7.54(s,1H);6.88(s,1H);6.85(s,1H);6.40(d,J=1.8 Hz,1H);6.18(s,1H);4.66(s,2H)。ESI-MS,m/z:569.00288[M+H]+,理論值為566.02。
2 結果與討論
在整條合成路線中,化合物(Ⅳ)、化合物(Ⅴ)和化合物(Ⅰ)的合成是關鍵步驟,其反應條件對最終產物的產率和純度影響較大。因此,在研究過程中這三步反應的合成條件需要作進一步討論。
2.1 反應溫度對化合物(Ⅳ)產率的影響
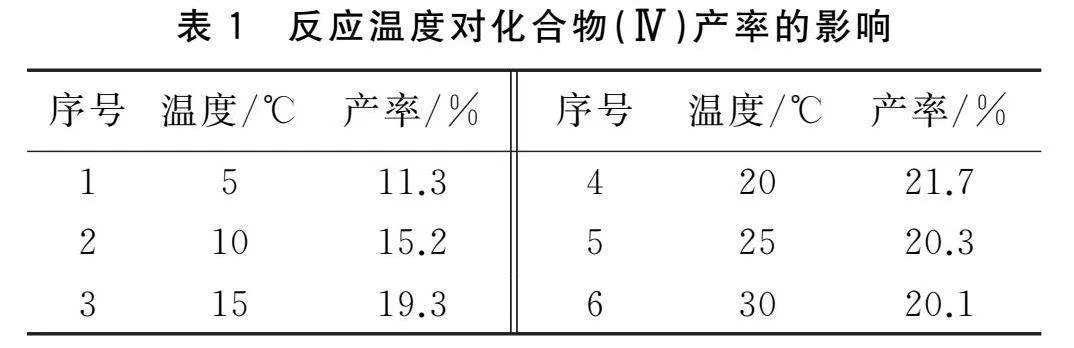
化合物(Ⅳ)是用化合物(Ⅲ)和溴乙酸乙酯通過取代反應得到。在此步反應中,由于后處理涉及柱層析,在實驗過程中發現實驗室溫度對柱層析的產率有很大影響。因此,在其他條件相同的情況下,探討了反應溫度對化合物(Ⅳ)產率的影響,并采用薄層色譜跟蹤反應終點。
由表1分析可知, 當反應溫度為 20℃ 時, 產率最高為 21.7%, 且繼續升高溫度, 產率不再提高, 因此確定將反應溫度為 20℃ 作為該步最佳反應溫度。
2.2 NaOH的用量對化合物(Ⅴ)產率的影響
化合物(Ⅴ)是化合物(Ⅳ)經NaOH水解得到的。實驗過程中,發現NaOH的用量會影響該步反應收率。因此,在其他條件相同的情況下,探討了NaOH的用量對化合物(Ⅴ)產率的影響,并采用薄層色譜跟蹤反應終點。
由表2分析可知,當控制n(化合物Ⅳ)∶n(NaOH)=1∶50時,該步反應的產率最高;再增加NaOH的比例,產率反而有所下降。因此選用n(化合物Ⅳ)∶n(NaOH)=1∶50作為該步反應較優的工藝條件。
2.3 不同因素對化合物(Ⅰ)產率的影響
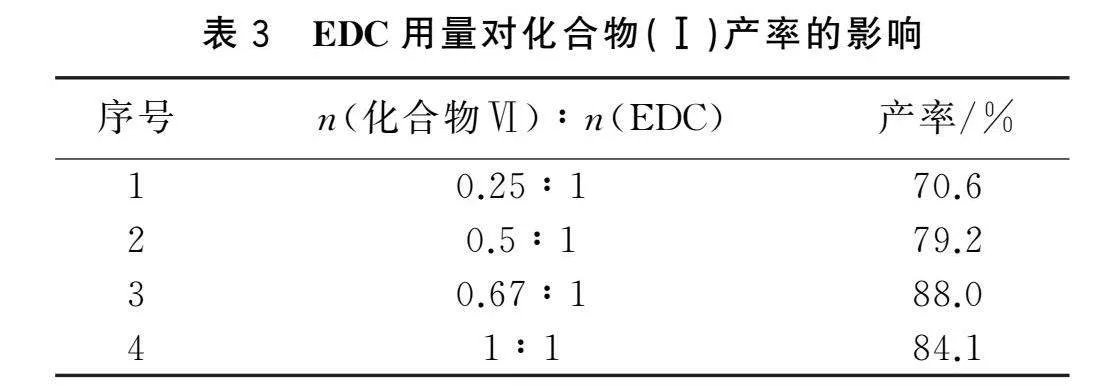
2.3.1 EDC用量對化合物(Ⅰ)產率的影響 化合物(Ⅰ)是化合物(Ⅵ)與ADT-OH通過酯化反應得到,EDC作為酯化反應常用的縮合劑,在使用時通常與催化劑HOBt配合使用,并設置n(EDC)∶n(HOBt)=1∶1。在實驗過程中,發現EDC的用量對化合物(Ⅰ)產率影響較大,因此,在其他條件相同情況下,探討化合物(Ⅵ)與EDC的摩爾比對化合物(Ⅰ)產率的影響,且采用薄層色譜跟蹤反應終點。
由表3分析可知,當n(化合物Ⅵ)∶n(EDC)=0.67∶1時,化合物(Ⅰ)的產率最高為88.0%;繼續提高EDC的用量,化合物(Ⅰ)的產率未提高,反而略有下降。因此,選擇n(化合物Ⅵ)∶n(EDC)=0.6∶1為該步反應EDC的最佳用量。
2.3.2 溫度和時間對化合物(Ⅰ)產率的影響 在0℃時,EDC和HOBt活化化合物(Ⅵ)的羧基后,再加入ADT-OH后發生縮合反應。實驗發現,反應的時間和溫度對化合物(Ⅰ)產率影響較大。因此,在n(化合物Ⅵ)∶n(EDC)=0.67∶1以及其他條件相同的情況下,探討反應的時間和溫度對化合物(Ⅰ)產率的影響,且采用薄層色譜跟蹤反應終點。
由表4分析可知,當設置反應溫度為25℃,反應在5 h達到終點,產率最大到88%;將溫度提升至40℃,盡管反應在4 h就達到終點,但產率卻有所下降。因此,確定25℃和5 h為該步反應的最佳溫度和最佳反應時間。
2.4 化合物(Ⅳ)、化合物(Ⅴ)、化合物(Ⅰ)的結構表征
2.4.1 化合物(Ⅳ)的結構表征 化合物(Ⅳ)的理論分子量為658.22,從圖2中可直接看出陽離子轟擊產生659.23019的峰。由質譜圖可初步判斷該步產物較大可能是化合物(Ⅳ)。
由圖3可知,化合物(Ⅳ)的核磁氫譜解析如下:1H NMR(400 MHz,DMSO-d6)δ:12.47-12.31(m,1H);7.88(d,J=2.1 Hz,1H);7.84-7.72(m,1H);7.69-6.85(m,14H);6.84-6.59(m,1H);6.57-5.96(m,2H);5.54-5.21(m,4H);5.21-4.93(m,2H);4.79(d,J=16.9 Hz,2H);4.21-3.97(m,2H);1.35-0.99(m,3H)。其中化學位移處于1.11的質子積分面積為3,正好對應支鏈鏈端的甲基中處于同一化學環境的三個質子。此外:化學位移處于4.09的質子積分面積為2,對應的是與鏈端甲基相連的亞甲基中處于同一化學環境的2個質子;化學位移處于4.77的質子積分面積為2,對應的是與酯鍵相連的左邊的亞甲基的2個質子;化學位移處于5.21的質子積分面積為1.80,對應的是最左邊苯環相連的亞甲基上的2個質子;化學位移處于5.24的質子積分面積為3.96,對應的是最右邊兩個與苯環相連的處于相同化學環境的兩個亞甲基的4個質子;化學位移處于12.41的質子積分面積為1,對應的是酚羥基中的1個質子。由此可證明合成的分子結構是化合物(Ⅳ)。
2.4.2 化合物(Ⅰ)的結構表征 化合物(Ⅰ)的理論分子量566.02,從圖4中可直接看出陽離子轟擊產生569.00288的峰。由質譜圖可初步判斷該步產物較大可能是化合物(Ⅰ)。
由圖5可知,化合物(Ⅰ)的核磁氫譜解析如下:1H NMR(400 MHz,DMSO-d6)δ:12.52(s,1H);9.76(s,1H);9.29(s,2H);7.75(s,2H);7.72(s,2H);7.65(s,1H);7.54(s,1H);6.88(s,1H);6.85(s,1H);6.40(d,J=1.8 Hz,1H);6.18(s,1H);4.66(s,2H)。化學位移處于4.66的質子積分面積為2.17,對應的是與酯鍵相連的亞甲基上的2個質子;化學位移處于9.29的質子積分面積為2,對應的是右上端與苯基相連的2個酚羥基,兩個酚羥基中的兩個質子處于同樣的化學環境;化學位移處于9.76的質子積分面積為1,對應的是最左端的酚羥基中的1個質子;化學位移處于12.52的質子積分面積為1,對應的是最左端的苯基上下端的酚羥基中的1個質子。由此可證明合成的分子結構是化合物(Ⅰ)。
3 結論
本研究以蘆丁為起始原料,經過取代水解williamson醚化水解,還原得到槲皮素-3-O-乙酸,再利用藥物拼合原理,與H2S供體5-(4-羥基苯基)-3H-1,2-二硫雜環戊烯-3-硫酮通過酯化反應得到目標產物槲皮素-3-O-乙酸-(4-(3H-1,2-二硫雜環戊烯-3-硫酮))-苯酯。通過1H NMR、MS表征來確證相關產物的化學結構,并對相關步驟的合成工藝進行了優化,得到的目標化合物具有潛在治療糖尿病及促進糖尿病患者傷口愈合的功能。該合成路線具有操作步驟簡單、原料易得、條件溫和等優點,可望實現規模化生產。
[ 參 考 文 獻 ]
[1] WANG G,LI W,CHEN Q,et al. Hydrogen sulfide accelerates wound healing in diabetic rats[J]. International Journal of Clinical and Experimental Pathology,2015,8(05):5097-5104.
[2] DAⅥES M J,D'ALESSIO D A,FRADKIN J,et al. Management of Hyperglycemia in type 2 diabetes,2018. a consensus report by the american diabetes association(ADA) and the european association for the study of diabetes(EASD)[J]. Diabetes Care,2018,41(12):2669-2701.
[3] BENNETT W L,MARUTHUR N M,SINGH S,et al. Comparative effectiveness and safety of medications for type 2 diabetes: an update including new drugs and 2-drug combinations[J]. Annals of Internal Medicine,2011,154(09):602-613.
[4] SHI G J,LI Y,CAO Q H,et al. In vitro and in vivo evidence that quercetin protects against diabetes and its complications: a systematic review of the literature[J]. Biomedicine amp;Pharmacotherapy,2019,109:1085-1099.
[5] WANG M J,CAI W J,ZHU Y C. Mechanisms of angiogenesis: role of hydrogen sulphide[J]. Clinical and Experimental Pharmacology and Physiology,2010,37(07):764-771.
[6] VACEK T P,GILLESPIE W,TYAGI N,et al. Hydrogen sulfide protects against vascular remodeling from endothelial damage[J]. Amino Acids,2010,39(05):1161-1169. (下轉第56頁)
[7] 王忠雷,張小華,楊麗燕,等. 拼合原理在降血糖新藥研發中的應用設想[J]. 中國實驗方劑學雜志,2013,19(04):351-354.
[8] CHEVEREAU G, BOLLENBACH T. Systematic discovery of drug interaction mechanisms[J]. Molecular Systems Biology,2015,11(04):807.
Synthesis of quercetin-3-O-acetic acid-(4-(3H-1,2-dithiacyclopentene-3-thione))-phenyl ester
HE Shibo, XIAO Zhixin, LIU Jian, LIU Mingxing
School of Biological Engin. and Food, Hubei Univ. of Tech., Wuhan 430068, China
Abstract: A drug quercetin-3-O-acetic acid-(4-(3H-1,2-dithiacyclopentene-3-thione))-phenyl ester with the function of treating diabetes and promoting wound healing was synthesized by using rutin as the starting material and 5-(4-hydroxyphenyl)-3H-1, 2-dithiacyclopentene-3-thione as the H2S donor. The whole process route included a total of five reaction steps including substitution, hydrolysis, williamson etherification, hydrolysis, and esterification, with a total yield of 6.4 %. The products of each step were characterized by MS and 1H NMR analysis. The synthetic route has the advantages of cheap and easy availability of raw materials, mild reaction conditions and simple operation.
Keywords: rutin;quercetin;H2S donor;synthesis
[責任編校: 張 眾]

